El cáncer pulmonar es actualmente la primera causa de muerte por cáncer en el mundo. Su incidencia en Chile también ha aumentado en forma progresiva, lo que sumado a la alta tasa de tabaquismo en nuestro país hacen prever que se convertirá en un grave problema de salud pública en los próximos años.
El principal factor de riesgo es el cigarrillo, por lo que deben realizarse los máximos esfuerzos para desincentivar su consumo, la exposición a arsénico parece ser un importante factor en el Norte del país. Se han descrito múltiples alteraciones genéticas que interactuarían con los carcinógenos del cigarrillo y cierta predisposición familiar para el desarrollo de cáncer pulmonar.
Este cáncer tiene una alta letalidad con una sobrevida global de 16% a cinco años. Los síntomas son inespecíficos, por lo que el diagnóstico es generalmente tardío. El cáncer pulmonar se divide en Cáncer Pulmonar de Células Pequeñas (CPCP) que representa el 10-15% y el Cáncer Pulmonar de Células no Pequeñas (CPCNP) que representa el 85-90%. El CPCP es agresivo, con metástasis precoces, siendo el tratamiento de elección Quimioterapia. El CPNCP consta de varios tipos histológicos, siendo el más frecuente el Adenocarcinoma, en este sub-tipo se han descrito mutaciones con factor pronóstico (EGFR, KRAS, ALK), lo que ha motivado la revisión de su clasificación y estudio histopatológico incorporando en forma estándar el estudio molecular.
Se han producido avances en el diagnóstico y etapificación con la incorporación del EBUS, EUS y PET/CT y adopción de la 7ª Clasificación TNM de la IASLC (International Association for the Study of Lung Cancer), más exacta y con mejor correlación con el pronóstico por etapas. Se ha mostrado recientemente que el diagnóstico precoz mediante TAC de tórax de baja dosis logra una reducción en la mortalidad por cáncer pulmonar.
Dentro del tratamiento, los avances en cirugía mínimamente invasiva permiten realizar actualmente lobectomías por videotoracoscopía con resultados oncológicos absolutamente equivalentes a la cirugía abierta, pero con menores complicaciones, hospitalizaciones más cortas y reincorporación laboral precoz. Se está evaluando además el uso de resecciones sub-lobares en etapas iniciales.
En radioterapia la incorporación de la intensidad modulada ha permitido lograr mejores resultados en sobrevida y control local. Se están estudiando con promisorios resultados nuevas técnicas como la planificación con PET/CT y el uso de radioterapia estereotáctica del cuerpo (SBRT).
En quimioterapia se han incorporado nuevas drogas con mayor efectividad y menor perfil de toxicidad. Sin embargo el explosivo desarrollo de la biología molecular que ha permitido el desarrollo de la terapia personalizada representa el mayor avance en oncología médica de los últimos años. La identificación de mutaciones con factor pronóstico como EGFR y ALK, y el desarrollo de moléculas que actúan en forma específica sobre los productos de los genes mutados, con excelente respuesta y escasa toxicidad, han revolucionado nuestra visión de la quimioterapia. La terapia personalizada de acuerdo a las mutaciones del tumor de cada paciente representa uno de los mayores avances en el tratamiento del cáncer pulmonar y sin duda será un campo de gran desarrollo en los próximos años.
Pese a la letalidad de esta neoplasia y el aumento de su incidencia a nivel mundial, los avances que se describen en el presente artículo permiten vislumbrar un mejor futuro para los pacientes con cáncer pulmonar.
Lung cancer is the leading cause of cancer death worldwide, and its incidence has increased steadily in Chile. Smoking is the main risk factor for lung cancer, while arsenic exposure appears to be important in the North of Chile. Multiple genetic alterations that interact with cigarette carcinogens have been described as well as a family predisposition for the development of lung cancer. Our country has the highest rate of cigarette smoking in Latin-America. Therefore it is expected that lung cancer will become a serious public health problem in upcoming years.
Lung Cancer has poor outcomes, with an overall five-year survival of only 16%. Symptoms are non-specific and occur late in the course of disease, therefore a diagnosis is usually made in advanced stages. Lung cancer is divided into Small Cell Lung Cancer (SCLC), representing the 10-15% of cases, and Non-Small Cell Lung Cancer (NSCLC) accounting for 85-90%. SCLC is aggressive, with early metastasis, and its treatment of choice is Chemotherapy. NSCLC includes several histologic subtypes, the most frequent being Adenocarcinoma. Activating mutations like EGFR and ALK has been recently described in Lung cancer, most commonly in Adenocarcinomas, leading to the revision of its classification incorporating molecular study as standard of care.
There have been advances in diagnosis and staging of Lung Cancer mainly due to the addition of EBUS and PET / CT and adoption of the 7th TNM classification, which is more accurate and has better correlation with the prognosis by stages. Screening with Chest CT has recently proven to reduce lung cancer mortality and could be included in clinical practice.
Great advances have taken place in treatment of Lung cancer. The development of minimally invasive surgery results in equivalent oncologic outcomes with VATS lobectomy, but with fewer complications, shorter hospital stay and earlier return to work. The use of sub-lobar resection in early stages is under study, allowing the sparing of lung tissue for further treatments.
In Radiotherapy the introduction of Intensity modulated Radiotherapy (IMRT) has obtained better results in survival and local control. Other techniques under study with promising results are PET / CT planning radiotherapy and stereotactic body radiotherapy (SBRT).
New chemotherapeutic agents with higher effectiveness and lower toxicity were introduced in the last years, but the explosive development of molecular biology, which allowed the development of Personalized Therapy, has been the greatest achievement in chemotherapy in the last decade. The discovery of activating mutations in different genes, such as EGFR and ALK, and new drugs which target those mutations with excellent response and low toxicity have renewed our view of chemotherapy. Personalized therapy is the greatest achievement in the treatment of advanced lung cancer, and represents an exciting and promising investigation field for the upcoming years.
Despite the raising incidence and lethality of this tumor, the advances in different fields described in this article allow us to foresee a better future for lung cancer patients.
El número de cánceres ha ido aumentando progresivamente en el mundo. Se estima que la probabilidad de desarrollar un cáncer es actualmente de 1 cada 2 hombres y 1 cada 3 mujeres.
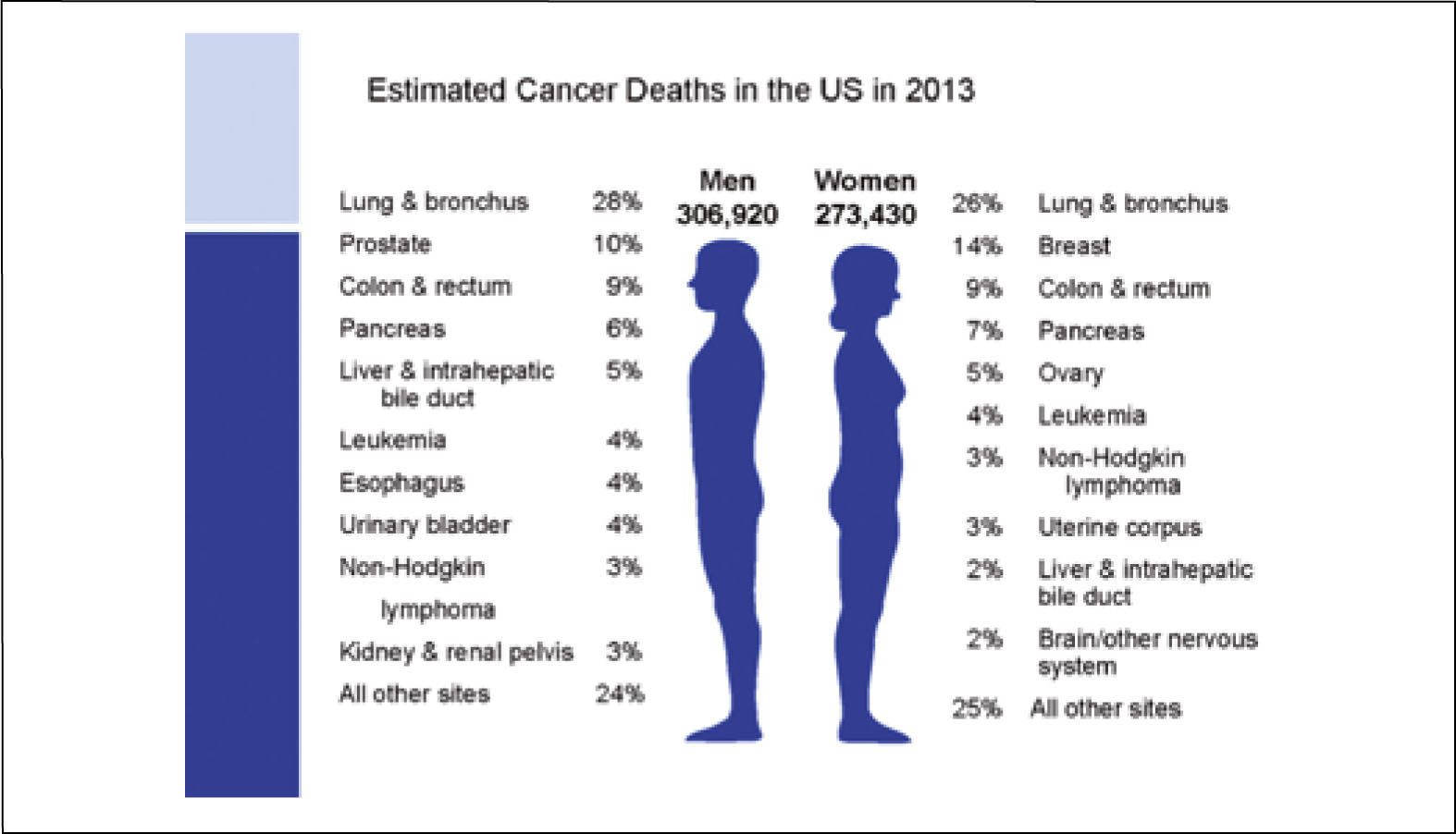
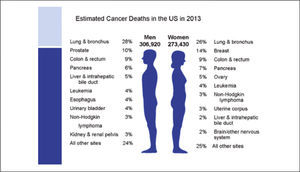
El cáncer pulmonar es la primera causa de muerte por cáncer a nivel mundial, tanto en hombres como mujeres, causando más de 1.3 millones de muertes al año (1). En Estados Unidos se estima que en 2013 habrá 228190 nuevos casos de cáncer pulmonar, correspondiendo al 14% de todos los nuevos cánceres diagnosticados en ese país (Figura 1). La posibilidad de desarrollar un cáncer pulmonar en el transcurso de la vida se estima en 1 cada 13 hombres y 1 cada 16 mujeres (1). En ese país el cáncer pulmonar representa además la primera causa de muerte por cáncer tanto en hombres como mujeres, estimándose para 2013, 159.480 muertes por esta causa, lo que representa el 27% de todas las muertes por cáncer. Esto significa que se producen anualmente más muertes por cáncer pulmonar que las producidas por los cánceres de mama, próstata, colon y recto reunidas (1).
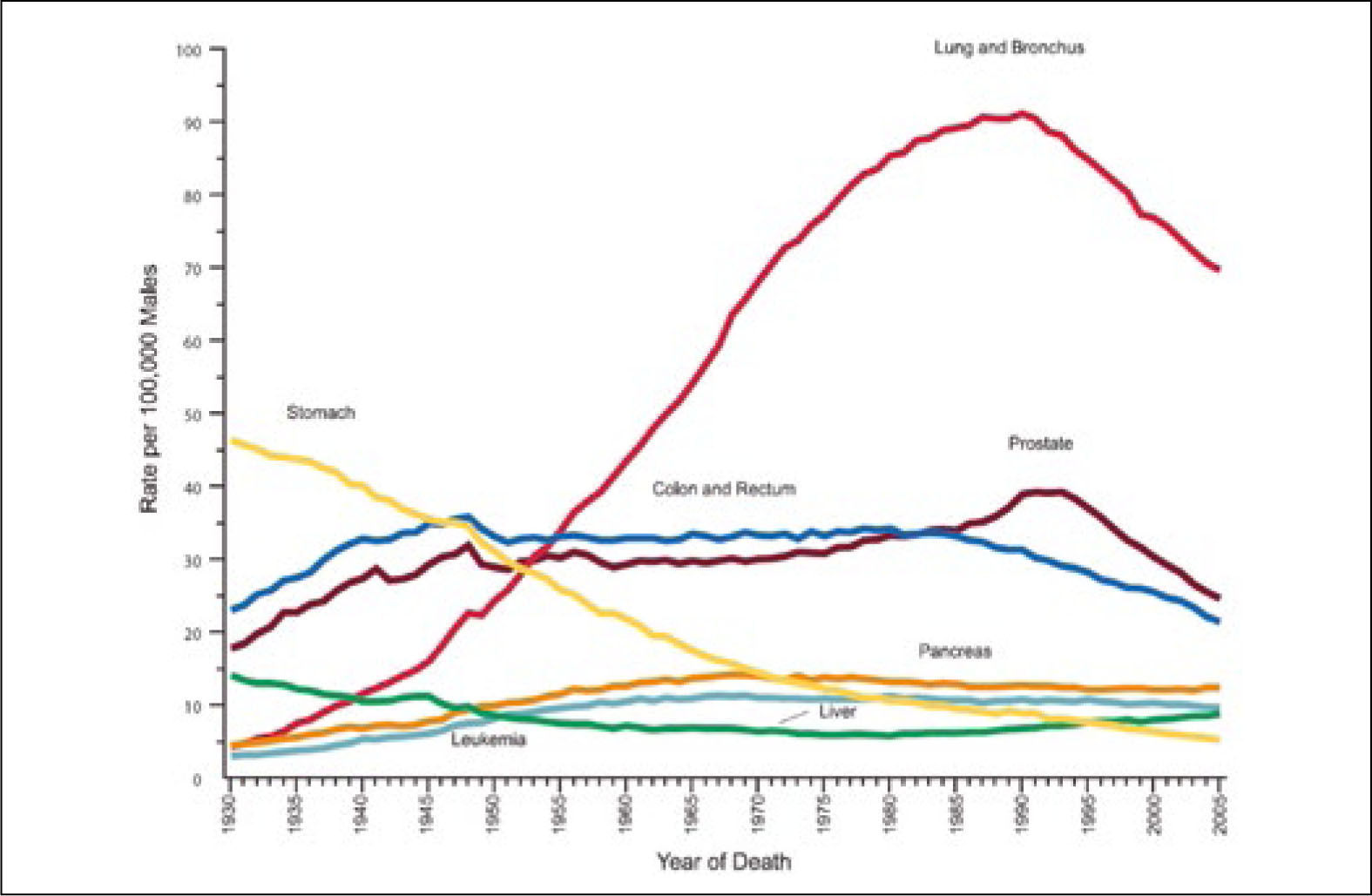
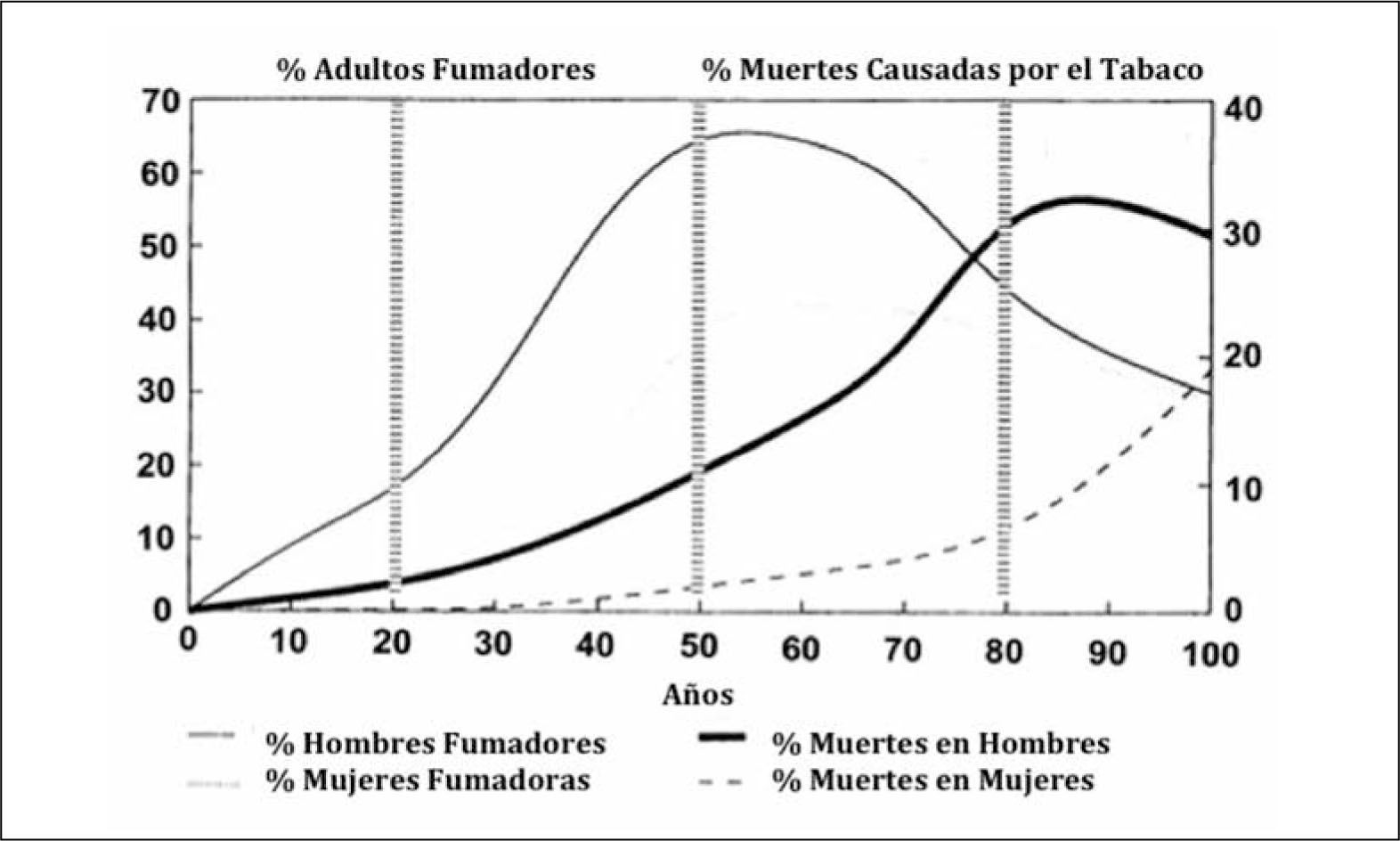
El dramático aumento en la incidencia de cáncer pulmonar de los últimos 100 años, se correlaciona estrechamente con el aumento del consumo y comercialización de tabaco y a la producción masiva de cigarrillos en el mismo período (2). Esta relación es evidente hoy en día, pero recién en 1939 se publicó el primer artículo en que asoció el tabaco con el cáncer pulmonar (3) y sólo en 1964 en el informe del Surgeon General of the Public Health Service, se estableció claramente que el consumo de cigarrillos era la principal causa de desarrollo de cáncer pulmonar (4). Además del mayor consumo de cigarrillos, se ha producido un importante aumento de la expectativa de vida en el último siglo. Los individuos viven más y se ven expuestos por mayor tiempo a carcinógenos como el humo de cigarrillo, lo que también explica el aumento del número de casos de cáncer pulmonar observado en las últimas décadas.
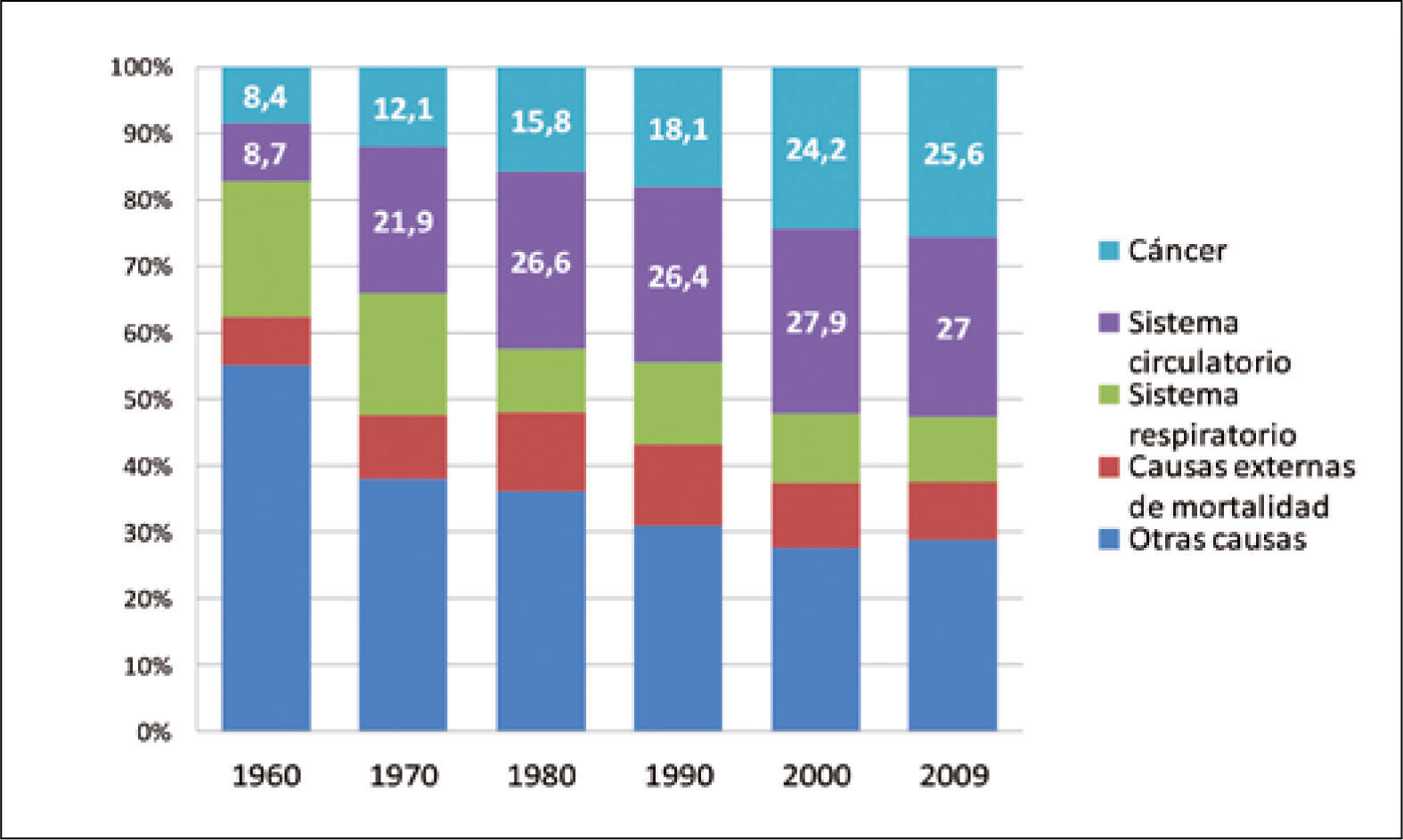
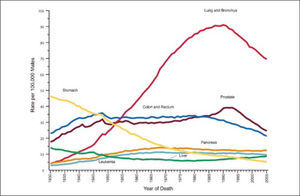
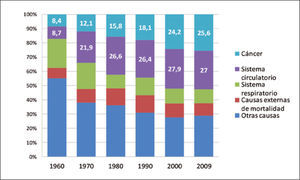
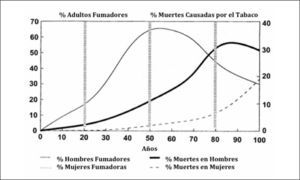
Las muertes por cáncer pulmonar han aumentado en forma progresiva en la mayoría de los países del mundo. Sólo en muy pocos países desarrollados, como por ejemplo Estados Unidos, se alcanzó un plateau en la década de los 90 y posteriormente comenzaron lentamente a disminuir a razón de 1 a 3% al año (1). Esa reducción sólo se logró con la adopción de severas políticas anti-tabaco, que lograron los cambios socioculturales necesarios para disminuir el consumo de cigarrillo (Figura 2). En Chile la esperanza de vida también ha aumentado de manera constante en las últimas décadas, siendo en promedio en 2012 de 79,1 años. Los cánceres también han aumentado progresivamente, representando actualmente la segunda causa de muerte después de las muertes de origen cardiovascular (Figura 3). Y en las regiones de Arica y Parinacota, Iquique, Antofagasta y Aisén el cáncer es la primera causa de muerte (5). Este aumento en la tasa de muerte por cáncer se debe en parte al envejecimiento de la población, pero también a un extraordinario aumento de los factores de riesgo de cáncer. En Chile aproximadamente el 30% de la población es obesa, 70% es sedentaria y 80% tiene una dieta inadecuada (6). El 40.6% de la población general fuma, 47.8% de los jóvenes al terminar el colegio también fuma y un 25.7% de los escolares en 8° Básico también lo hace en forma regular, lo que representa el mayor consumo de cigarrillos de América Latina (6, 7).
Esta altísima tasa de tabaquismo asociada a la mayor expectativa de vida son probablemente los principales responsables del notable incremento de los casos de cáncer pulmonar observado en los últimos años en nuestro país.
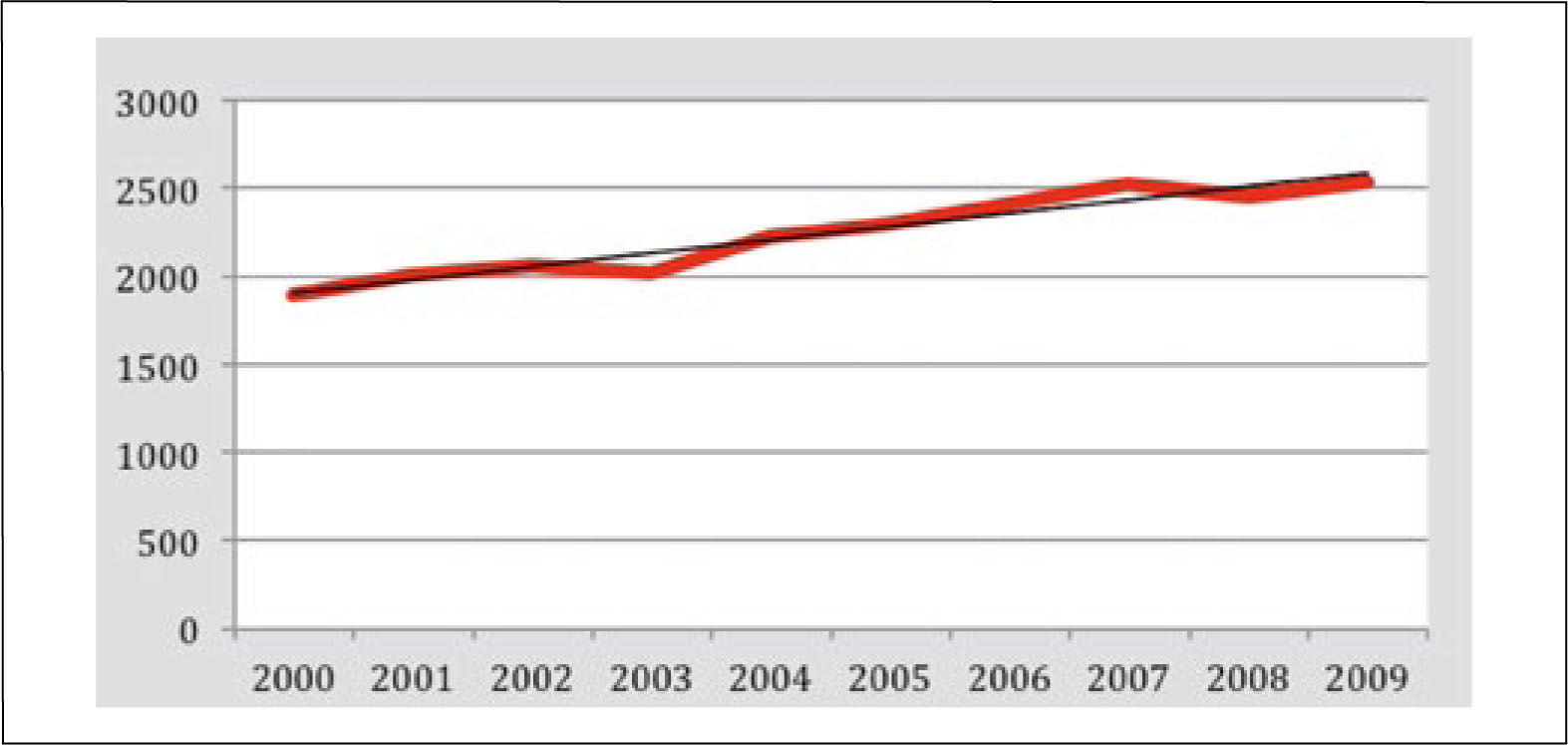
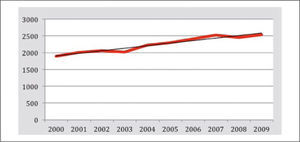
El cáncer pulmonar es el segundo cáncer más frecuente en Chile, luego del cáncer gástrico, su incidencia ha aumentado constantemente en las últimas décadas correspondiendo actualmente a la segunda neoplasia maligna más frecuente en varones y la tercera en mujeres (Figura 4).
La tasa de mortalidad por cáncer de pulmón en 2009 fue de 15,0 / 100.000 habitantes en hombres y 11,1 en las mujeres. Existiendo importantes diferencias entre las regiones del país. Antofagasta tiene la tasa más alta (62,5 / 100.000 habitantes en hombres y 21,6 en mujeres), probablemente debido a la contaminación del agua y suelo especialmente con arsénico (5).
El aumento progresivo de la tasa de mortalidad por cáncer pulmonar y la letalidad de este cáncer significará que en los próximos años sea uno de los cánceres de mayor relevancia del punto de vista de salud pública en Chile. Se estima que en 2013 habrá más de 3000 nuevos casos y 2550 muertes por cáncer pulmonar en Chile. Lo que significará enormes costos en salud y años de vida potencialmente perdidos por esta patología.
Factores de riesgo de cáncer pulmonarEl 85% de los cánceres pulmonares se observa en fumadores, siendo el consumo de cigarrillos el principal factor de riesgo del cáncer pulmonar. El riesgo aumenta con la cantidad y duración del tabaquismo, y tiene una latencia de 15 a 20 años en relación al consumo de cigarrillos (Figura 5). Todos los tipos de consumo de tabaco además del cigarrillo son factores de riesgo, incluyendo puros, pipa, pipas de agua, entre otros (8, 9).
En Europa y Norteamérica la exposición a radón, gas liberado del suelo y materiales de construcción, representaría la segunda causa más importante de desarrollo de cáncer pulmonar (10). Otros factores de riesgo son la exposición a humo de cigarrillo (fumador pasivo), asbestos (especialmente en fumadores), algunos metales como arsénico, cromo y cadmio, algunos productos orgánicos, radiación, contaminación ambiental, humo proveniente de la combustión de diesel, y pinturas (2, 11). Algunas exposiciones ocupacionales también han mostrado aumentar la incidencia de cáncer pulmonar, como: fabricación de caucho, pavimentos, techumbres y limpieza de chimeneas (11) (Tabla 1).
Carcinógenos pulmonares
| Humo de cigarrillo | Gas Mostaza |
| Radón | Insecticidas |
| Arsénico | Humo de escapes diesel |
| Asbestos | Hollín |
| Berilio | Alquitrán |
| Cadmio | Hidrocarburos policíclicos |
| Plomo | aromáticos |
| Níquel | Cloro metil éter |
| Cromo | Fibras cerámicas |
| Polvo de óxido de fierro | Aceites Minerales |
| Radiación Gamma | Vinyl chloride |
| Radiaciones ionizantes (Rayos X) | Aserrín |
Adaptado de. International Agency for Research on Cancer. Carcinogen identification and evaluation. http://www.iarc.fr/ (Nov 21, 2001).
Entre las enfermedades con mayor riesgo de desarrollar cáncer pulmonar están los cánceres de cabeza y cuello, también relacionados con el consumo de tabaco en que el riesgo de desarrollar un cáncer pulmonar es aproximadamente 4 veces mayor que la población general (12). Varias enfermedades pulmonares confieren un mayor riesgo de desarrollar cáncer pulmonar. Especialmente relevante es el EPOC, que tiene un reconocido riesgo de desarrollar cáncer pulmonar, otras enfermedades pulmonares son los pacientes con secuelas de Tuberculosis y los pacientes con Silicosis (10 y 11).
Alteraciones genéticas y cáncer pulmonarA pesar del efecto carcinogenético del tabaco, muchos fumadores no desarrollan cáncer pulmonar y un porcentaje de personas que nunca ha fumado, sí lo hacen.
Esto traduce la existencia de complejas interacciones entre carcinógenos ambientales y factores genéticos, las que se han ido esclareciendo lentamente, evidenciado un efecto sinérgico y no simplemente aditivo, en el desarrollo del cáncer pulmonar.
Algunos de los factores genéticos involucrados en el desarrollo del cáncer pulmonar se relacionan con la capacidad de eliminar o detoxificar en forma eficiente los diferentes carcinógenos y de la capacidad de reparar el ADN. Polimorfismos en las enzimas de Fase I (activantes) y en las de Fase II (detoxificantes) pueden aumentar o disminuir la capacidad carcinogenética de los derivados del tabaco (13, 14). De manera similar, polimorfismos de genes que participan en el control del ciclo celular como CCND1, TP53, P21 y P73, aumentan el riesgo de desarrollar cáncer pulmonar en fumadores. Sin embargo, existe gran variabilidad en el riesgo relativo de estas alteraciones genéticas dependiendo de la carga tabáquica, factores raciales y étnicos (13). Las alteraciones genéticas más estudiadas en los últimos años son las mutaciones en p53, KRAS y EGFR, así como la traslocación EML4-ALK y alteraciones en ROS1 (15, 16). Estas alteraciones genéticas tienen un importante valor como predictores de la respuesta de la terapia personalizada del cáncer pulmonar y serán discutidas con mayor detalle más adelante.
Se ha establecido claramente además, que existe una mayor incidencia de cáncer pulmonar en grupos familiares (clustering). Estudios poblacionales realizados en Estados Unidos, Suecia e Islandia, así como un metanálisis han mostrado mayor riesgo de cáncer pulmonar cuando un familiar ha tenido esta neoplasia, especialmente entre los fumadores. El riesgo era mayor mientras más miembros de una familia habían tenido cáncer pulmonar (17).
Todas las alteraciones moleculares y genéticas descritas, sus interacciones y especialmente su relación con el consumo de cigarrillo son extremadamente complejas.
El mayor conocimiento de ellas permitirá identificar individuos con mayor riesgo de desarrollar cáncer pulmonar, previniendo su exposición a carcinógenos y realizando programas de tamizaje específicos. Sin embargo hasta el momento el consumo de cigarrillo continúa siendo el principal factor de riesgo prevenible.
Clasificación del cáncer pulmonarEl cáncer pulmonar se divide en células pequeñas (CPCP) que representa entre el 10 y el 15% del total y el cáncer pulmonar de células no pequeñas (CPCNP) que representa el 85 a 90% restante (18).
1. El CPCP, o cáncer pulmonar de células de avena, se relaciona también al consumo de cigarrillo. Se presenta generalmente en etapas avanzadas; aproximadamente dos tercios de los pacientes con CPCP tienen metástasis a distancia y el otro tercio compromiso nodal extenso en el hilio pulmonar, mediastino o supraclavicular, lo que determina su mal pronóstico general (19). Dependiendo de su extensión se clasifica generalmente como Enfermedad Extendida o Localizada (20). Aunque la Asociación Internacional para el Estudio del Cáncer Pulmonar (IASLC) recomienda utilizar la clasificación TNM (19).
Este comportamiento agresivo del CPCP con metástasis tempranas determina su escasa sobrevida a largo plazo, que en promedio es de 10% a cinco años (21). Sólo ocasionalmente, en tumores pequeños sin compromiso nodal ni metastásico puede considerarse la Cirugía. En estos pacientes con enfermedad localizada la sobrevida puede alcanzar 14% a cinco años (22, 23). El tratamiento estándar del CPCP es quimioterapia más radioterapia torácica en las zonas comprometidas (24, 25). El esquema de quimioterapia más utilizado es Etopósido – Cisplatino. Con este esquema se obtienen respuestas en el 50-80% de los pacientes. Sin embargo la recurrencia es frecuente y la sobrevida prolongada escasa (21, 28, 29). Dado el compromiso frecuente y precoz del SNC se recomienda la Radiación craneana profiláctica, la que disminuye la recurrencia en el SNC y aumenta la sobrevida en pacientes que han tenido una buena respuesta a la quimioterapia (30, 31).
2. El Cáncer Pulmonar No Células Pequeñas es el tipo más frecuente de cáncer pulmonar. Es también un tumor agresivo con una sobrevida global de aproximadamente 16% a 5 años. La sobrevida depende de la etapa al diagnóstico, siendo en general entre 60 y 80% a cinco años en etapa I, 55-60% en etapa II, 20 a 40% en etapas III y 0 a 5% en etapa IV (32). Lamentablemente cerca del 50% de los pacientes presenta metástasis al momento del diagnóstico, 20-30% tiene una enfermedad localmente avanzada y solo un 25% se presenta en etapas iniciales (32). Los principales tipos histológicos son el Adenocarcinoma (40%), el carcinoma escamoso (25%) y el de células grandes (10%), los que presentan cierta variabilidad en su comportamiento y pronóstico (18). La clasificación completa del cáncer pulmonar se presenta en la Tabla 2.
Clasificación de la oms de los tumores pulmonares
| Tumores Epiteliales Malignos: |
|---|
| -Carcinoma Escamoso |
| -Carcinoma de células pequeñas |
| -Adenocarcinoma |
| -Carcinoma de células grandes |
| -Carcinoma Adenoescamoso |
| -Carcinoma Sarcomatoso |
| -Tumor Carcinoide |
| -Tumor de células de glándulas salivales |
| Tumores Mesenquimáticos |
| Lesiones pre-neoplásicas |
| Tumores benignos: |
| -Papilomas |
| -Adenomas |
| Tumores Linfoproliferativos |
| Tumores Misceláneos |
| Tumores Metastásicos |
Adaptado de Travis WD, Brambilla E, Muller-Hermelink HK, Harris CC (Eds): World Health Organization Classification of Tumors. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. IARC Press: Lyon 2004.
En los últimos años se ha observado un aumento progresivo en la frecuencia de Adenocarcinomas. En este sub grupo histológico se han producido los avances más importantes en el diagnóstico y tratamiento del CPNCP de los últimos años. La identificación de las mutaciones del gen del Receptor del Factor de Crecimiento Epidérmico (EGFR) y la determinación de su valor pronóstico para el tratamiento con inhibidores de Tirosin–kinasa, dio inicio a la terapia personalizada en cáncer pulmonar, produciendo una verdadera revolución en esta área donde se concentra actualmente gran parte de la investigación en oncología torácica (33-36).
La IASLC ha establecido una nueva clasificación para los Adenocarcinomas (37), en que se incluyen los término de carcinoma in situ y mínimamente invasor (antes denominados Bronquioloalveolares), diferenciándolos de los adenocarcinomas invasores dado su mejor pronóstico y nuevas alternativas de tratamiento (38). La IASLC establece además la manera de procesar y analizar las diferentes muestras histológicas y citológicas. Se enfatiza limitar el número de tinciones Inmunnohistoquímicas para poder disponer de la mayor cantidad de tejido para el estudio genético (37). El estudio molecular para determinación de las mutaciones de EGFR y traslocación de ALK-ML4 es considerado hoy en día un componente estándar del estudio anatomo-patológico de estos tumores por sus implicancias pronosticas y terapéuticas, debiendo realizarse en todo paciente con Adenocarcinoma y en tumores mixtos con componente de Adenocarcinoma (39).
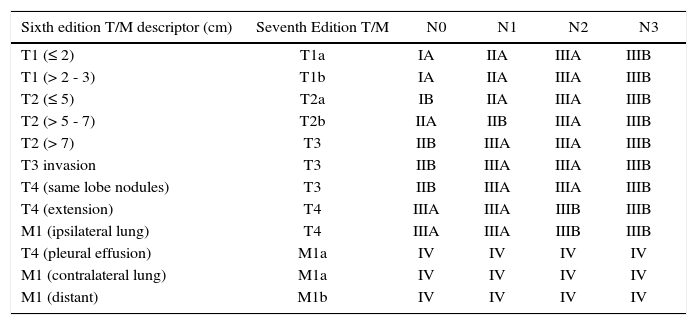
EtapificaciónAl igual que en la mayoría de los tumores, el cáncer pulmonar se etapifica mediante el sistema de TNM. En 2010 se adoptó la 7ª edición de la Clasificación TNM de Cáncer Pulmonar desarrollada por la IASLC (32). A diferencia de la 6ª edición, estudio retrospectivo de 3753 pacientes, principalmente quirúrgicos, con 73% de los pacientes de un sólo centro (40). La 7ª edición incorporó en forma prospectiva pacientes de múltiples centros de Europa, Norteamérica, Australia y Asia; incluyendo casos quirúrgicos, tratados con quimioterapia, radioterapia o manejo médico. Incluyó 67,725 pacientes con CPNCP y 13,290 con CPCP (32, 41-46).
Dentro de los cambios más relevantes de esta clasificación se estableció como factor pronóstico independiente el tamaño del tumor (T) debido a las diferencias en sobrevida entre tumores menores de 2 cms, y los de 2-3, 3-5, 5-7 y mayores de 7 cms. Los nódulos sincrónicos ipsilaterales, fueron clasificados en una etapa menor que en la clasificación anterior. El derrame pleural neoplásico cuya sobrevida era similar a la enfermedad metastásica se incorporó dentro de un nuevo grupo: M1a (44).
No se realizaron cambios a la clasificación de los linfonodos (N) manteniendose N1 para los linfonodos intrapulmonares e hiliares, N2 para linfonodos mediastínicos ipsilaterales y N3 para linfonodos mediastínicos contralaterales. Pese a lo anterior se unificaron los mapas de linfonodos utilizados en Japón, Norteamérica y Europa lo que permitirá unificar criterios para estudios posteriores (43).
En las Tablas 3 y 4 muestran los principales cambios y la 7ª Clasificación TNM del Cáncer Pulmonar.
Principales cambios de la 7ª clasificación tnm del cáncer pulmonar
| T1: ≤ 2 cm | T1a |
| T1: > 2 - ≤ 3 cm | T1b |
| T2: > 3 - ≤ 5 cm | T2a |
| T2: > 5 - ≤ 7 cm | T2b |
| T2: >7 cm | T3 |
| Nódulos mismo lóbulo (T4) | T3 |
| Nódulos otro lóbulo ipsilateral (M1) | T4 |
| Diseminación Pleural (T4) | M1a |
| Metástasis Intratorácicas (M1) | M1a |
| Metástasis Extratorácicas (M1) | M1b |
Goldstraw P, Crowley J, Chansky K, et al.: The IASLC Lung Cancer Staging Project: Proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumours. J. Thorac Oncol 2:706-14, 2007.
7ª Clasificación tnm del cáncer pulmonar
| Sixth edition T/M descriptor (cm) | Seventh Edition T/M | N0 | N1 | N2 | N3 |
|---|---|---|---|---|---|
| T1 (≤ 2) | T1a | IA | IIA | IIIA | IIIB |
| T1 (> 2 - 3) | T1b | IA | IIA | IIIA | IIIB |
| T2 (≤ 5) | T2a | IB | IIA | IIIA | IIIB |
| T2 (> 5 - 7) | T2b | IIA | IIB | IIIA | IIIB |
| T2 (> 7) | T3 | IIB | IIIA | IIIA | IIIB |
| T3 invasion | T3 | IIB | IIIA | IIIA | IIIB |
| T4 (same lobe nodules) | T3 | IIB | IIIA | IIIA | IIIB |
| T4 (extension) | T4 | IIIA | IIIA | IIIB | IIIB |
| M1 (ipsilateral lung) | T4 | IIIA | IIIA | IIIB | IIIB |
| T4 (pleural effusion) | M1a | IV | IV | IV | IV |
| M1 (contralateral lung) | M1a | IV | IV | IV | IV |
| M1 (distant) | M1b | IV | IV | IV | IV |
Goldstraw P, Crowley J, Chansky K, et al.: The IASLC Lung Cancer Staging Project: Proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumours. J. Thorac Oncol 2:706-14, 2007.
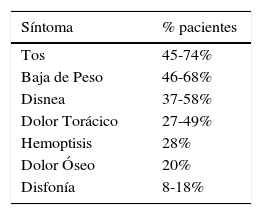
Los síntomas y signos son inespecíficos y traducen generalmente una enfermedad avanzada. Pueden ser ocasionados por el tumor como tos, hemoptisis, sibilancias localizadas, neumonías o bronquitis recurrente (post obstructiva). Por extensión intratorácica del tumor: dolor torácico, disfagia, síndrome de vena cava superior y disnea. Por compromiso metastásico: dolor óseo, baja de peso y síntomas neurológicos. O por compromiso general debido al cáncer: caquexia, fatigabilidad o debilidad muscular. Los síntomas más frecuentes incluyen tos, baja de peso, disnea, dolor torácico, hemoptisis, dolor óseo y disfonía (47-49). Tabla 5.
DiagnósticoEl tratamiento del CPNCP depende de su tipo histológico, etapa y estado funcional del paciente. El estudio de los pacientes con sospecha de cáncer pulmonar está dirigido a confirmar el diagnóstico histológico (incluyendo tejido para estudio molecular), efectuar la etapificación del paciente y evaluar la reserva cardio-respiratoria, este estudio se realiza generalmente en forma paralela (50).
Como se verá a continuación, básicamente el tratamiento del CPNCP en etapas precoces (I y II) es quirúrgico, en etapa III multimodal y en etapa IV quimioterapia (51). Por lo tanto uno de los primeros aspectos a dilucidar es determinar la presencia o ausencia de lesiones a distancia (etapa IV), siendo las metástasis más frecuentes a cerebro, hueso, hígado, glándulas suprarenales y pulmón (47, 48, 50). De no existir metástasis el segundo aspecto más importante es determinar la presencia de compromiso nodal mediastínico, que determina una etapa III (51, 52).
Ante la sospecha de un CPNCP el estudio comienza mediante el diagnóstico por imágenes: Radiografía y especialmente TAC de Tórax. El TAC de tórax permite una buena evaluación inicial del tumor (T), determinar la presencia de nódulos en otros lóbulos (T3, T4 o M1b), la presencia de derrame pleural (M1a) y orientar al compromiso nodal mediastínico (N2-N3), pero no es suficiente para una etapificación completa del paciente (50, 52).
La etapificación se inicia con métodos no invasivos, idealmente con PET/CT y RNM de cerebro, que permiten detectar 10-15% más lesiones a distancia y 3% más lesiones cerebrales que el TAC de tórax y de cerebro (53, 54), representando el gold estándar actual en la etapificación del CPNCP.
En caso de sospecha de metástasis una biopsia quirúrgica o punción biopsia bajo TAC o ECO, permite confirmar histológicamente un CPN-CP, certificar una etapa IV y por lo tanto determinar que el tratamiento apropiado es quimioterapia.
Para la etapificación del mediastino, el rendimiento del TAC es sólo de 75-80%, con 20-40% de falsos negativos y 18-23% falsos positivos (50). En cambio el PET/CT tiene una sensibilidad de 90%, una Especificidad de 81%, un valor predictivo negativo mayor a 95%, pero un valor predictivo positivo menor a 85% (53). Por lo tanto un PET/ CT que no demuestra compromiso del mediastino permite proceder directamente a una cirugía oncológica. Por el contrario un PET/CT que sí demuestra lesiones hipermetabólicas en mediastino requiere confirmación histológica para certificar una etapa III, lo que se puede realizar mediante EBUS (Broncoscopía con Ultrasonido), EUS (Endoscopía con Ultrasonido), Mediastinoscopía, Mediastinotomía o Videotoracoscopía (55, 56).
Especial mención merece la incorporación del EBUS en la etapificación del CPNCP. Este fibrobroncoscopio dispone de un ECO-doppler y permite realizar biopsias por punción transbronquial, bajo visión ecográfica en tiempo real, tanto del tumor como de los linfonodos hiliares y mediastínicos. Permite realizar una etapificación exacta y menos invasiva, especialmente asociado al EUS, con una sensibilidad de 95%, especificidad de 100%, VPP 100% y VPN de 95% (55-57).
Detección precozLa gran mayoría de los CPNCP tiene una etapa pre-clínica prolongada, en que podrían utilizarse exámenes de tamizaje. Hasta el momento ningún bio-marcador ha demostrado utilidad (58). Sin embargo mediante exámenes radiológicos es posible detectar cánceres en etapas tempranas en la forma de nódulos pulmonares. Se han diferenciado en los últimos años diferentes tipos de nódulos que se relacionan con el tipo histológico y grado de invasión: sólidos, en vidrio esmerilado y mixto (59, 60).
El crecimiento de los nódulos pulmonares es lento (tiempo de duplicación de 150 a 900 días), lo que sugería que podría utilizarse la radiografía para la detección precoz de cáncer pulmonar. Sin embargo los estudios de tamizaje mediante radiografía de tórax realizados en la década del 50 y 60 no demostraron una disminución en la mortalidad por cáncer pulmonar (61).
Estudios realizados en la década de los 90 sugirieron que el TAC de tórax sería útil para le detección precoz de cáncer pulmonar. Entre ellos, el Anti-Lung Cancer Association Project en Japón, permitió pesquisar 11.5% cánceres versus 3.4% con radiografía, el 71% de los tumores correspondían a etapas tempranas (62). En Estados Unidos el Early Lung Cancer Action Project, pesquisó 2.7% de cánceres pulmonares, de los cuales 85% correspondía a etapa I (63).
Recientemente el National Lung Screening Trial permitió mostrar claramente que el tamizaje con TAC de tórax de baja dosis es útil para la detección precoz de cáncer pulmonar. Este estudio multicéntrico incluyó a 53454 individuos mayores de 55 años con gran carga tabáquica (más de 30 paquetes/año); obteniendo una reducción en la mortalidad por cáncer pulmonar de 20% en los individuos seguidos con TAC de Tórax en relación a los seguidos con radiografía de tórax (64).
Sin embargo, hay varios aspectos relacionados al costo de estos programas, su implementación, población blanco y protocolos de seguimiento que aún no han sido definidos. No se ha establecido si los resultados del NLST son aplicables a poblaciones menor con exposición a tabaco, ni tampoco los riesgos potenciales como radiación acumulada y los falsos positivos que necesitarán biopsias y/o cirugías potencialmente evitables (65)
La American Cancer Society (ACS), la National Comprehensive Cancer Network (NCCN), el American College of Chest Physicians (ACCP), y la American Society of Clinical Oncology (ASCO), han desarrollado guías para la detección precoz del cáncer pulmonar. Estas guías incluyen diferentes protocolos de manejo y seguimiento dependiendo del tipo de nódulo: sólido, vidrio esmerilado y mixto (66-69).
La ACS, ACCP y ASCO recomiendan que se tome una decisión compartida con el clínico con las personas que cumplen los criterios de ingreso del NLST. La NCCN expande estos criterios para otros pacientes con más factores de riesgo (66-68). Cada país deberá evaluar la posibilidad de implementar programas de tamizaje de este tipo, el tipo de algoritmos de seguimiento utilizar y las poblaciones de riesgo a las que debe dirigirse (69).
Tratamiento del cáncer pulmonar no células pequeñasEn términos muy generales el tratamiento del CPNCP se podría resumir de la siguiente manera. Etapas iniciales tratamiento quirúrgico:
-Etapa I, sólo cirugía.
-Etapas II, tratamiento quirúrgico + terapia adyuvante.
-Etapas IIIa, localmente avanzadas quimio-radioterapia de inducción en pacientes con buena capacidad funcional, en pacientes con respuesta completa, parcial o enfermedad estable, cirugía resectiva posterior.
-Etapas IIIb, quimio-radioterapia.
-Etapa I V, quimioterapia.
Esto sólo representa un resumen muy general, ya que el detalle del manejo del cáncer pulmonar escapa al objetivo de este artículo. Cada paciente debe ser analizado en su totalidad en relación a capacidad funcional, función cardio-pulmonar, edad, comorbilidades, etapa y tipo histológico. Las decisiones terapéuticas deben ser discutidas en comités oncológicos multidisciplinarios con experiencia en el complejo manejo de estos pacientes y teniendo en cuenta la mejor evidencia científica existente y las preferencias del paciente.
Describiremos a continuación alguno aspectos relevantes de los diferentes tipos de tratamientos disponibles.
CirugíaEl tratamiento de elección en las etapas iniciales del cáncer pulmonar es quirúrgico (70, 71). La cirugía oncológica estándar es la lobectomía más una linfadenectomía mediastínica. En el estudio clásico de 1995 del Lung Cancer Study Group, la recidiva fue 20 veces mayor en pacientes sometidos a resecciones sublobares (segmentectomías o resección en cuña) versus lobectomía (72). Únicamente en pacientes con capacidad funcional limitada es aceptada un resección sublobar para preservar mayor cantidad de parénquima pulmonar (73).
Sin embargo siguiendo la experiencia inicial de autores japoneses en cánceres pequeños y de bajo grado como adenocarcinomas mínimamente invasores (74), y considerando que un 10-11% de los pacientes con CPNCP etapa I resecados desarrollarán un nuevo tumor metacrónico antes de 5 años (75, 76); se han comenzado a difundir las resecciones sublobares con intención curativa en pacientes en etapa I. La evidencia acumulada sugiere que las resecciones sublobares serían equivalentes a las lobecomtías en términos de sobrevida en tumores menores de 2 cms y de bajo grado, T1aN0M0 (77, 78). Se ha estudiado extensamente los márgenes necesarios para poder realizar este tipo de resecciones, incluyendo citología del margen y compromiso del linfonodo segmentario (79-81). Existiendo actualmente 2 trabajos randomizados en curso en Japón y Estados Unidos que permitirán esclarecer este punto (82, 83). Otro de los pilares de la cirugía oncológica del cáncer pulmonar es realizar una linfadenectomía mediastínica (71), la que debe cumplir criterios claramente establecidos (84). La linfadenectomía no produce mayor morbi-mortalidad y permite realizar una adecuada etapificación para evaluar la necesidad de un tratamiento adyuvante (71, 85).
Sin duda uno de los mayores avances en la última década es el desarrollo de la cirugía mínimamente invasiva en oncología torácica. Las primeras Lobectomías por videotoracoscopía (VTC) se realizaron hace 20 años (86, 87). Sin embargo recién en la última década se han generalizado (88). Los resultados oncológicos son absolutamente comparables a la cirugía abierta, pero con estadía operatoria más corta, menos complicaciones y mejores resultados en pacientes de edad avanzada (88-90). A modo de ejemplo en la serie de McKenna con 1100 lobectomías por VTC, la mortalidad fue de 0.8%, la morbilidad de 15%, la tasa de conversión de 2.5% y la estadía hospitalaria media de 4.8 días. La sobrevida a 5 años fue de 84.5% en etapas Ia y 70.5% en Ib (91). En nuestro país también se ha ido acumulando experiencia con esta técnica con resultados comparables (92).
Dentro de las ventajas de la lobectomía por videotoracoscopía se encuentran: disminución del dolor post-operatorio, disminución de liberación de citokinas, menor alteración de la función pulmonar, menor duración de los drenajes pleurales, menor duración de hospitalización, menor número de complicaciones, reincorporación laboral precoz y un mayor porcentaje de los pacientes recibe la dosis de quimioterapia adyuvante planificada (93-95). Recientemente además se han realizado segmentectomías regladas en CPNCP etapa I con resultados también equivalentes a los obtenidos por toracotomía (81). Por lo tanto actualmente la cirugía oncológica con técnicas mínimamente invasivas (videotoracoscopía) debe ser considerada el tratamiento estándar del CPNCP en etapas iniciales (88).
RadioterapiaEn pacientes con CPNCP en etapas iniciales, pero con contraindicación quirúrgica por comorbilidades importantes la radioterapia con intención curativa es una adecuada alternativa. La dosis recomendada es de 60-70 Gy con o sin boost al tumor. Se requiere una adecuada planificación en un simulador para definir el volumen a tratar y evitar los efectos adversos sobre los tejidos normales. La sobrevida a 5 años con radioterapia curativa es de 10-27% (96-98). Una revisión reciente mostró una sobrevida global de 34% a 3 años pero con recidiva local de 40% (99). Con las nuevas técnicas de radioterapia como Intensidad Modulada (IMRT), se han logrado mejores resultados: respuestas sobre el 70%, sobrevidas medias de 38 meses y menores complicaciones (100).
Se están estudiando nuevas modalidades de radioterapia con promisorios resultados como la planificación con PET/CT y el uso de radioterapia estereotáctica del cuerpo o SBRT (101, 102). Esta última técnica consiste en entregar altas dosis de radiación (mayor a 100 Gy) a la zona blanco por medio de múltiples haces, lo que permite que la dosis fuera del volumen a tratar se reduzca dramáticamente, disminuyendo la toxicidad a órganos vecinos y especialmente al pulmón (102). Esta técnica es similar al gama-knife usado en Neuro-radiocirugía y necesita un equipamiento y preparación sofisticados. Múltiples estudios han mostrado mejores resultados que la radioterapia convencional en el control local del tumor con sobrevidas globales sobre el 50% (103).
La Radioterapia tiene además un rol fundamental en la terapia neoadyuvante de tumores etapa III en conjunto con quimioterapia, permitiendo mejores respuestas y mayor porcentaje de pacientes resecables y con respuesta patológica completa post resección (104, 105). Tiene por último una invaluable utilidad en el manejo paliativo de los pacientes con CPNCP: tratamiento de metástasis cerebrales y óseas, manejo del tumor primario y linfonodos mediastínicos en etapas avanzadas y prevención o tratamiento de la obstrucción bronquial, compromiso de órganos vecinos y síndrome de vena cava superior (106-108).
QuimioterapiaLa quimioterapia es el tratamiento de elección en etapas avanzadas (IV) y parte fundamental del tratamiento multimodal en etapas II y III.
En pacientes con etapas II en adelante la adición de quimioterapia luego de la cirugía, ofrece un beneficio absoluto en sobrevida de 5% (109, 110).
En pacientes con diagnóstico de etapa III-N2 pre operatorio la quimioterapia de inducción combinada a radioterapia permite disminuir el tamaño tumoral, aumentar la tasa de resecabilidad y tratar precozmente las micrometástasis (111). En los pacientes en etapa III y buena respuesta a la quimioterapia de inducción, especialmente con “down-stage” del compromiso mediastínico de N2 a N0-N1, se han obtenido sobrevidas prolongadas al realizar una cirugía resectiva posterior (111, 112).
Las drogas de quimioterapia y las combinaciones más efectivas han sido extensamente estudiadas en múltiples estudios lo que escapa el objetivo del presente texto. En términos generales la quimioterapia con dos drogas en base a platino es la más efectiva: Cisplatino o Carboplatino más Paclitaxel, Gemcitabina, Docetaxel, Vinorelbina, Irinotecan o Pemetrexed. Los esquemas de quimioterapia a utilizar dependerán de la capacidad funcional de cada paciente, sus comorbilidades, género, tipo histológico y el perfil de toxicidad de cada droga en particular (113). En general los dobletes con platino parecen tener mejor respuesta que los con carboplatino (114). En pacientes con carcinoma escamoso la combinación de Cisplatino/Gemcitabina sería superior (114, 115). En Adenocarcinomas con Cisplatino/Penetrexed se obtienen los mejores resultados y con la adición de bevacizumab, anticuerpo monoclonal para el receptor de crecimiento endotelial vascular (VEGF), se podrían lograr mejores respuestas (116).
Sin embargo, pese a los avances en quimioterapia con el tratamiento en base a dobletes, al mejor cuidado de los pacientes y tratamiento de las complicaciones, se ha alcanzado un “plateau” en los resultados de la quimioterapia estándar con respuestas de 25-35%, tiempo de progresión de 4-6 meses, sobrevida media de 8-10 meses y porcentajes de sobrevida a 2 años de 10-15% (117).
Es en este contexto, en que los grandes avances en biología molecular producidos en los últimos años, han abierto un nuevo y promisorio campo, con enormes proyecciones a futuro en la oncología torácica (118). En la última década se han identificado múltiples oncogenes entre ellos: AKT1, ALK, BRAF, EGFR, HER2, KRAS, MEK1, MET, NRAS, PIK3CA, RET y ROS 1 (33-35, 37, 39, 117-119). La presencia de mutaciones en estos genes conformaría un tipo especial de CPNCP respondedores a nuevas drogas dirigidas a vías moleculares específicas (34, 37, 118-120).
Estas nuevas drogas son medicamentos de uso oral con un perfil de toxicidad mucho menor a la quimioterapia estándar y que han logrado excelentes resultados clínicos, por ejemplo en pacientes con mutaciones sensibles de EGFR la respuesta a los inhibidores de Tirosin Kinasa ha sido de 56 a 84% con sobrevidas media de 19.3 a 30.6 meses, resultados significativamente mejores que la quimioterapia estándar (34).
Las alteraciones genéticas están presentes en todos los tipos histológicos de CPNCP, pero son más frecuentes en adenocarcinomas (34, 39).
La frecuencia de las mutaciones más relevantes del punto de vista clínico en adenocarcinoma son: EGFR (10-35%), KRAS (10-25%), ALK-ML4 (3-7%), HER 2 2-4% y ROS1 1% (39). Otra característica importante es que estas mutaciones son mutuamente excluyentes en el 97% de los casos.
Las mutaciones de EGFR fueron las primeras descritas y han sido las más estudiadas, en Asia están presentes en un 45-50% de los pacientes con adenocarcinomas, 7% de los carcinomas de células grandes y 5% de los escamosos (39). En otras razas el porcentaje de mutaciones del EGFR en adenocarcinomas son menores, en la población caucásica es aproximadamente 24%, en afromericanos un 20% y en la población hispánica un 17% (39). En Latinoamérica las mutaciones del EGFR se han reportado en un 33% de la población con variaciones importantes entre diferentes países; desde 19% en Argentina a 67% en Perú (121). En Chile la frecuencia de mutaciones de EGFR reportada ha sido de 22.2% (122).
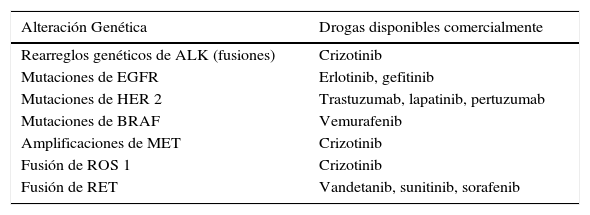
Como se ha mencionado lo más relevante del punto de vista clínico, es que estas alteraciones genéticas son predictoras de la respuesta al tratamiento con las nuevas moléculas disponibles (33-35, 37, 39, 117-119, 123-126). Las mutaciones del gen de EGFR, específicamente la deleción del exón 19 y la mutación L858R del exón 21, permiten predecir la respuesta al tratamiento con inhibidores de Tirosin-Kinasa como erlotinib y gefitinib (34, 35, 119, 120). Al contrario la mutación del exón T790M confiere resistencia al tratamiento con estas drogas (100). La fusión de ALK-ML4 y las alteraciones génicas de ROS 1 son predictoras de respuesta a crizotinib (123-126). La expresión elevada de ERCC1 (127) es predictor de una pobre respuesta a la terapia con platino y la mutación de KRAS, excluye mutaciones de EGFR, ALK y ROS1 y confiere un mal pronóstico a los CPNCP (128). Aparte de las drogas ya mencionadas existen varias moléculas aprobadas por la FDA para uso en CPNCP o para otras indicaciones pero con actividad en las mutaciones identificadas (Tabla 6). Próximamente serán incorporadas nuevos drogas como el afatinib y se están realizando múltiples estudios con nuevas moléculas (36, 120).
Terapia blanco para pacientes con alteraciones genéticas en CPNCP
| Alteración Genética | Drogas disponibles comercialmente |
|---|---|
| Rearreglos genéticos de ALK (fusiones) | Crizotinib |
| Mutaciones de EGFR | Erlotinib, gefitinib |
| Mutaciones de HER 2 | Trastuzumab, lapatinib, pertuzumab |
| Mutaciones de BRAF | Vemurafenib |
| Amplificaciones de MET | Crizotinib |
| Fusión de ROS 1 | Crizotinib |
| Fusión de RET | Vandetanib, sunitinib, sorafenib |
De esta manera, dependiendo del estudio molecular realizado, se podrá elegir la terapia más efectiva de acuerdo a las mutaciones presentes en el tumor. Este tratamiento de acuerdo a las alteraciones genéticas particulares de cada paciente es llamado terapia personalizada y sin duda en esta área se verán importantes cambios en el tratamiento del CPNCP en los próximos años.
SeguimientoComo se mencionó, la posibilidad de desarrollar un segundo primario es de 1-2% al año en pacientes que han tenido un CPNCP (75,76). Por lo tanto es recomendable realizar en todos los pacientes un seguimiento prolongado. Pese a no existir un acuerdo claro al respecto la mayoría de las guías clínicas recomiendan realizar al menos un TAC de tórax de baja dosis anual (117).
ConclusionesEl cáncer pulmonar es actualmente la primera causa de muerte por cáncer en el mundo. Su incidencia en Chile ha aumentado en forma dramática en los últimos años, similar a la ocurrido hace un par de décadas en países desarrollados, siendo esperable que se convierta en un grave problema de salud pública en los próximos años. El cáncer pulmonar tiene una alta letalidad, por lo que disminuir el tabaquismo, principal factor de riesgo debe ser una tarea prioritaria.
Sin embargo pese a su baja sobrevida global, se han producido importantes avances en diferentes áreas en las últimas décadas. Se ha demostrado que la detección precoz mediante TAC de Tórax de baja dosis puede reducir la mortalidad por cáncer pulmonar, por lo que podrían implementarse programas de tamizaje en el futuro, detectando cánceres incipientes y potencialmente curables.
La incorporación de nuevos exámenes diagnósticos como el EBUS y el PET/CT permite una etapificación más precisa y menos invasiva. En el tratamiento quirúrgico el desarrollo de nuevas técnicas quirúrgicas, especialmente de la Videotoracoscopía han permitido obtener mejores resultados y con menos riesgo quirúrgico que la cirugía convencional. Las nuevas modalidades de radioterapia también han logrado mejores resultados con menor toxicidad. En quimioterapia se han incorporado nuevas drogas de mayor efectividad y menor perfil de toxicidad y el explosivo avance en biología molecular ha permitido el desarrollo de la terapia personalizada, que ha logrado excelentes resultados y tiene enormes proyecciones futuras.
Sin duda aún falta mucho para lograr mejorar el pronóstico del cáncer pulmonar, pero los avances descritos permiten ver con mayor optimismo el futuro de esta compleja enfermedad.
El autor declara no tener conflictos de interés, con relación a este artículo.