El cáncer gástrico es la primera causa de muerte por tumores malignos en Chile. A nivel mundial ocupa el segundo lugar en incidencia después del cáncer del pulmón. A pesar de estas cifras, solo en países orientales desarrollados (Japón y Corea) existen programas de detección precoz que han logrado disminuir efectivamente las tasas de mortalidad.
Mucho es lo que se ha avanzado en la compresión de las causas que provocan esta enfermedad, pero aun no ha sido posible trasladar estos adelantos a instaurar medidas que ayuden a prevenir con efectividad la incidencia de esta neoplasia.
Las mayores novedades están en el tratamiento. Clásicamente la cirugía era la alternativa disponible para intentar curar la enfermedad. En los últimos años han emergido la endoscopía y la laparoscopía como alternativas válidas de manejo curativo. En cuanto a terapias adyuvantes, existen alternativas de radioterapia más quimioterapia post-operatorias y quimioterapia peri-operatorias que han demostrado efectividad significativa en mejorar la supervivencia. Todas estas alternativas definen el tratamiento del cáncer gástrico como individualizado, multimodal y multidisciplinario. Es fundamental la evaluación de estos pacientes por un equipo oncológico altamente especializado.
Gastric cancer is the leading cause of death from malignancy in Chile. Worldwide, it is the second neo-plasia in incidence after lung cancer. Only in developed Oriental countries (Japan, South Korea) there are screening programs for early detection, that have shown decreased mortality rates from this disease.
In recent years progress has been made in understanding the causes of this disease, but has not yet been possible to translate these avances, to establish measures that effectively help prevent the inciden-ce of this neoplasm.
The major developments are in the treatment field. Traditionally, surgery was the only option available to cure this disease. In recent years have emerged endoscopy and laparoscopy as valid alternatives to intent curative management. Regarding adjuvant therapy, postoperative radiotherapy plus chemotherapy or perioperative chemotherapy have shown effectiveness in improving survival outcomes. All these alternatives define gastric cancer treatment as individualized, multimodal and multidisciplinary. It is essential that these patients be evaluated by a highly specialized medical team.
El cáncer gástrico ha sido por muchos años una de las principales causas de mortalidad por neoplasias en el mundo entero. A pesar que en países occidentales se ha observado una importante disminución de la incidencia de la enfermedad, aún constituye una causa relevante en cuanto al número de muertes. En Chile, el cáncer gástrico es la primera causa de muerte por tumores malignos. De las enfermedades malignas gástricas, el adenocarcinoma es lejos el más frecuente.
EpidemiologíaEl cáncer gástrico es el segundo cáncer más frecuente del mundo, superado solamente por el cáncer de pulmón (1). Posee una alta mortalidad y una variación geográfica significativa (2). A nivel global la incidencia de esta neoplasia está disminuyendo, hecho más marcado en países occidentales, por razones desconocidas (3).
La variación geográfica es una característica del cáncer gástrico. Los países con más altas tasas ajustadas de mortalidad son: Bulgaria, Colombia, Costa Rica, Chile, China, Islandia, Japón, Portugal y algunos países de la ex URSS. Por el contrario, en países como EE.UU., India, Filipinas y la mayoría de los países africanos esta neoplasia es poco relevante (4).
La tasa de mortalidad reportada en Chile es del 20 por 100.000 habitantes, siendo como ya se mencionó la primera causa de mortalidad por tumores malignos. Dentro de nuestro país también la tasa de mortalidad es variable. Es más frecuente en regiones de Chile central que en los extremos geográficos (5).
EtiopatogeniaNumerosos estudios han demostrado la relación del cáncer gástrico con factores dietéticos (nitratos, grasas animales, sal, baja ingesta de antioxidantes). Sin embargo, no ha podido demostrarse con certeza la asociación directa con el desarrollo de esta neoplasia. La importancia de identificar la relación entre factores y el cáncer radica en las medidas preventivas que se pueden tomar y así evitar la aparición de la enfermedad (6).
En términos anatomo-patológicos existen dos formas microscópicas distinguibles: la forma intestinal, en la cual las células adoptan formas de las glándulas gástricas y con estrecha asociación con factores de riesgos ambientales y dietéticos; y la forma difusa, que es más indiferenciada, con debut a edades más tempranas y asociado a peor pronóstico (7). Actualmente se piensa que el cáncer gástrico variedad intestinal tiene un desarrollo escalonado desde un epitelio normal a adenoma y carcinoma, con cada uno de los peldaños asociado una mutación genética específica. Aparentemente el desencadenante inicial es la inflamación crónica asociada a la infección crónica por Helicobacter pylori (8). Los pasos serían mucosa normal, inflamación crónica y gastritis atrófica, metaplasia intestinal, displasia y finalmente cáncer. En cuanto a la variedad difusa no se conoce hasta ahora que existe una progresión histopatológica similar a la forma intestinal.
Siempre se ha asociado el cáncer gástrico con diversos tipos de factores ambientales, como ingesta excesiva de alimentos ricos en sal, alimentos ahumados y conservados en vinagre, así como el bajo consumo de alimentos ricos en antioxidantes. También en países desarrollados ha existido una clara relación entre el mayor consumo de alimentos refrigerados y la disminución en la incidencia de este tipo de cáncer. El tabaquismo, otro factor relacionado a otros tipos de cáncer, también se asocia a esta neoplasia (9, 10).
Más controversial aún es la asociación que tiene este cáncer con el nivel socioeconómico (11). Se podría pensar que un nivel socioeconómico bajo podría relacionarse a la ingesta de alimentos que predisponen a este tipo de tumor, sin embargo en estudios nacionales no ha sido posible demostrar que un nivel socioeconómico bajo sea indicador de la calidad de la alimentación. Otros factores podrían influir en esta asociación, como son la infección por Helicobacter pylori que sería más frecuente en este grupo socioeconómico, la falta de refrigeración de alimentos y la exposición a carcinógenos ambientales relacionados con la actividad laboral (12).
Los factores hereditarios han sido ampliamente estudiados en el cáncer gástrico. La entidad denominada Cáncer Gástrico Hereditario, se asocia a una mutación del gen de la E-Cadherina, la que codifica proteínas relacionadas a la adhesión y comunicación intercelular. Se presenta en individuos jóvenes, habitualmente la segunda o tercera década de la vida, con la variedad difusa o indiferenciada como el rasgo anatomopatológico más relevantes. Actualmente existe la posibilidad de realizar estudio genético en individuos con sospecha clínica de cáncer gástrico hereditario, con el objetivo de entregar un adecuado consejo genético a los descendientes, que incluye en casos seleccionados, la indicación de gastrectomía total profiláctica (13-15).
También existen condiciones mórbidas predisponentes al desarrollo de cáncer gástrico: esófago de Barrett (16), gastritis atrófica, anemia perniciosa y metaplasia intestinal de la mucosa gástrica. Otros factores son los adenomas gástricos, el antecedente gastrectomía subtotal previa y la enfermedad de Menetrier (17). El esófago de Barrett ha sido la condición más ampliamente estudiada en la literatura anglosajona. El riesgo de desarrollar un cáncer en una mucosa esofágica alteradas (18-21), como en el caso del Barrett, ha sido estimada entre 2 a 57 veces el de la población normal, y con un riesgo acumulativo entre 0.2 al 2% anual. La anemia perniciosa aparece como secuela de la gastritis crónica atrófica autoinmune. El riesgo de cáncer es variable de acuerdo a la duración de la enfermedad y la ubicación geográfica, pero en general entre un 5 a un 10% de los pacientes con anemia perniciosa desarrolla un cáncer gástrico.
En cuanto a los adenomas gástricos, (22) éstos tienen un riesgo de malignización con tamaños mayores a 2cm y por lo tanto tienen indicación de resección. El cáncer gástrico del muñón es una entidad claramente establecida y corresponde la aparición de un cáncer en el remanente gástrico después de una gastrectomía sub total (23, 24), habitualmente reconstruida con una gastroyeyunoanastomosis tipo Bilroth II. Generalmente aparecen entre 15 a 20 años post cirugía inicial y por lo tanto la recomendación es el control endoscópico para todos aquellos pacientes portadores de esta condición.
Cuadro clínicoEl cáncer gástrico tiende a manifestarse con síntomas leves e inespecíficos en sus inicios, por lo cual rara vez son causa de consulta médica. El cáncer gástrico incipiente (aquella lesión que compromete la mucosa o submucosa) es asintomático el 80% de los casos, y en el 20% restante aparecen síntomas inespecíficos similares a un síndrome ulceroso y ocasionalmente náuseas, anorexia o saciedad precoz (25). Síntomas más alarmantes como una hemorragia digestiva alta o pérdida de peso significativa se presenta en menos del 2% de los casos precoces. En el cáncer gástrico avanzado, la sintomatología es más florida siendo frecuentes el dolor abdominal y la baja de peso (60% de lo casos) (26, 27). También suelen presentar anorexia, náuseas, vómitos, anemia, disfagia, hemorragia digestiva y saciedad precoz. La anemia de causa no aparente en un adulto, debe obligara realizar endoscopía digestiva alta y baja para descartar/confirmar tumores digestivos. Este tipo de sintomatología ha determinado que la mayoría de los casos de cáncer gástrico en nuestro país el diagnóstico se realicen en etapas avanzadas de la enfermedad, y el cáncer gástrico incipiente sólo sea detectado en alrededor de un 10% del total. La diseminación del cáncer gástrico ocurre preferentemente al hígado y peritoneo dando síntomas específicos como masa abdominal palpable en hipocondrio derecho o hepatomegalia neoplásica y ascitis.
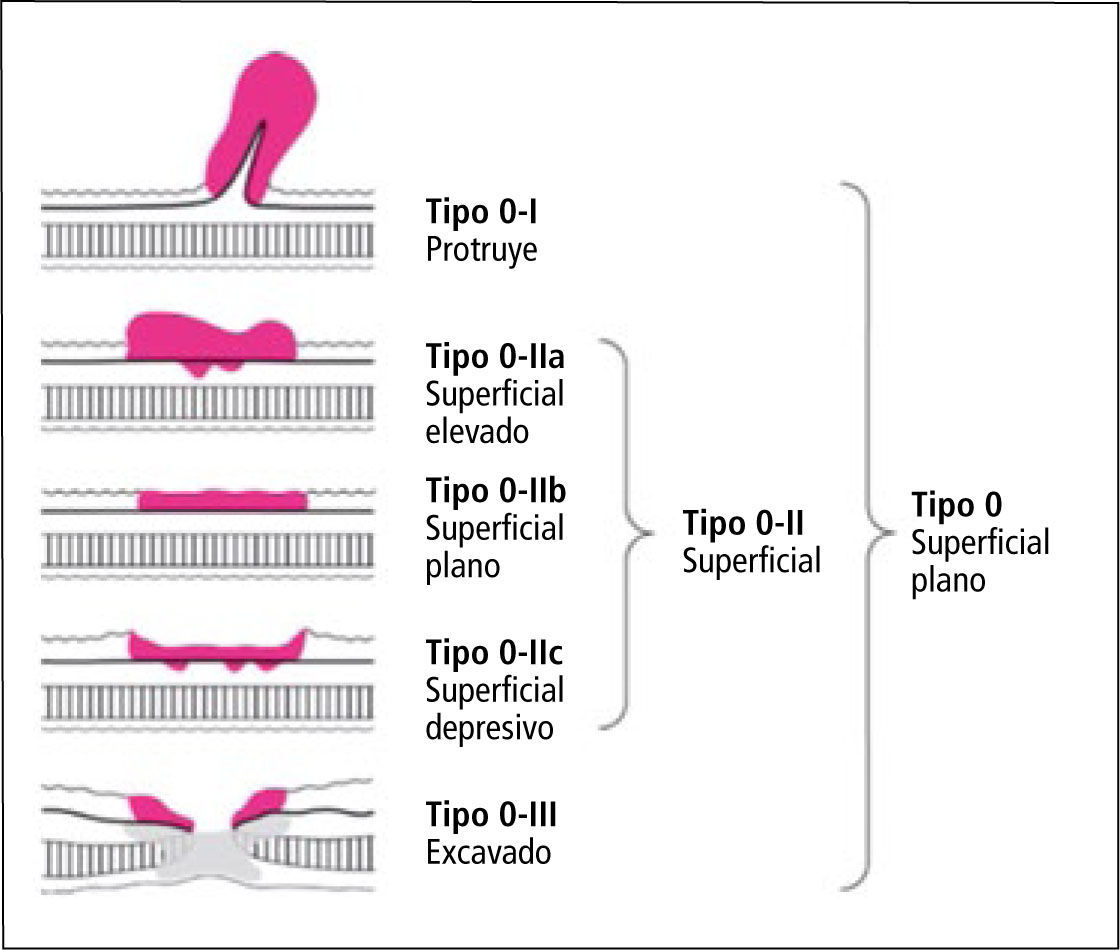
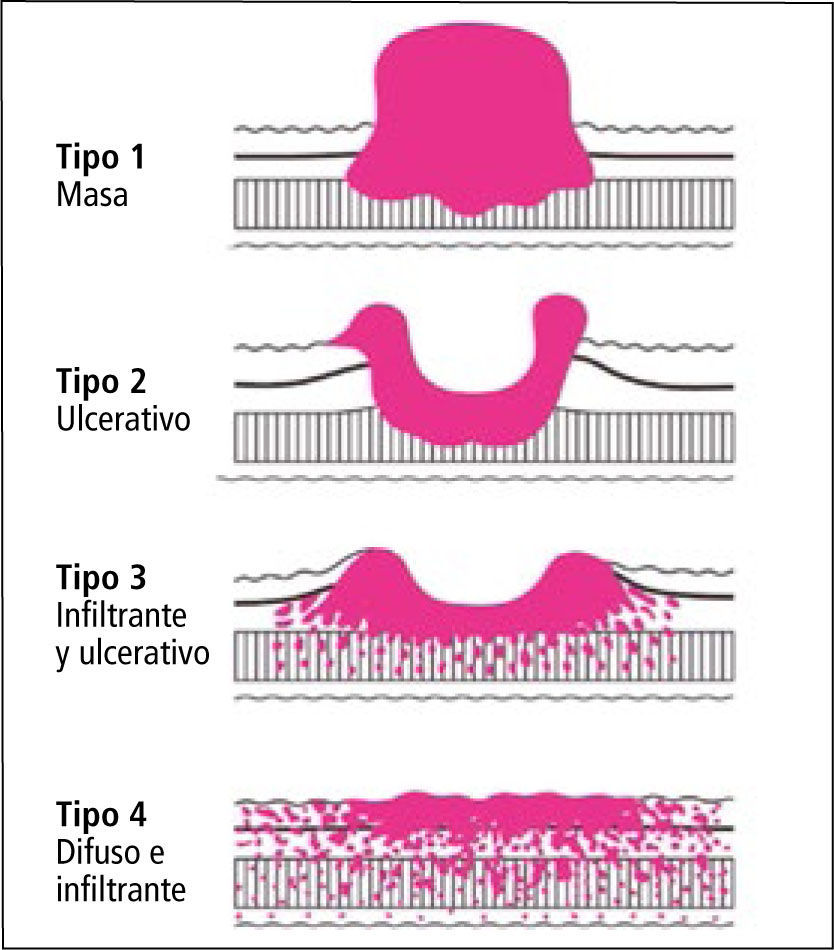
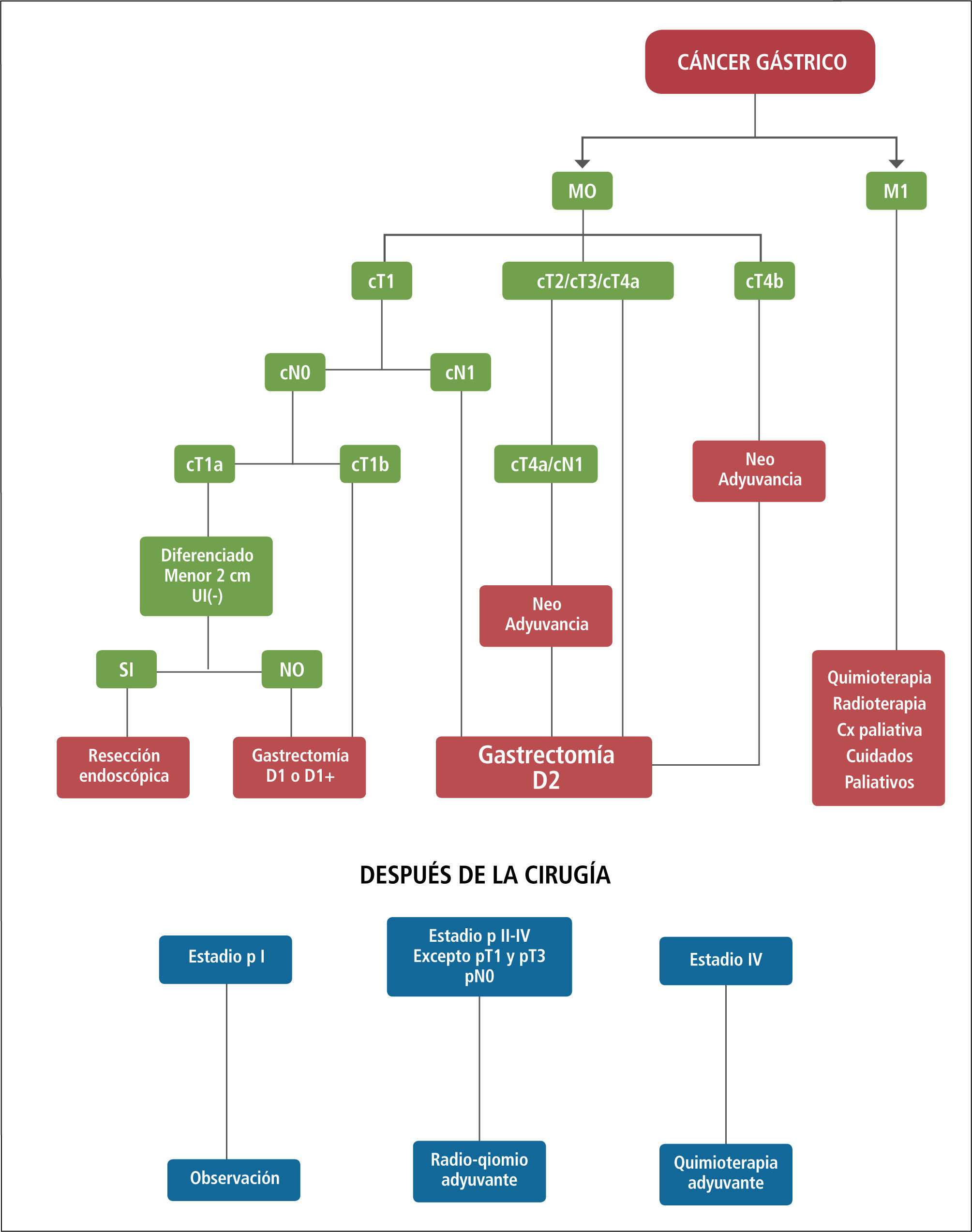
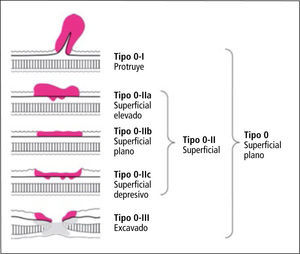
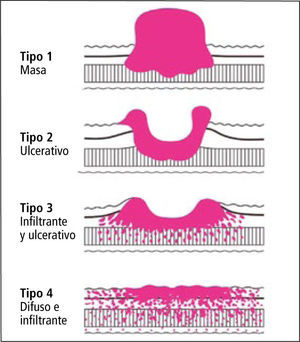
El diagnóstico se realiza mediante una endoscopia digestiva alta y la biopsia (28). La endoscopía además de visualizar la lesión, determina su forma macroscópica, tamaño, localización y en ojos experimentados una estimación de la profundidad. Desde el punto de vista macroscópico el cáncer gástrico se clasifica en lesiones incipientes y avanzadas (Figura 1 y 2). Esta clasificación propuesta en la década del 60 por la asociación japonesa para el estudio del cáncer gástrico, persiste hasta nuestros días y se utiliza en la práctica habitual del manejo de estos pacientes. Tiene un significado pronóstico y determina en la mayoría de los casos la conducta a seguir.
Además de la endoscopía, se cuenta con la radiología con doble contraste (29), que permite, al igual que la endoscopía, determinar la forma macroscópica, el tamaño y localización de la lesión. Es sin lugar a dudas una buena herramienta para el cirujano puesto que agrega una visión más panorámica de la característica de la lesión y de los límites proximal y distal.
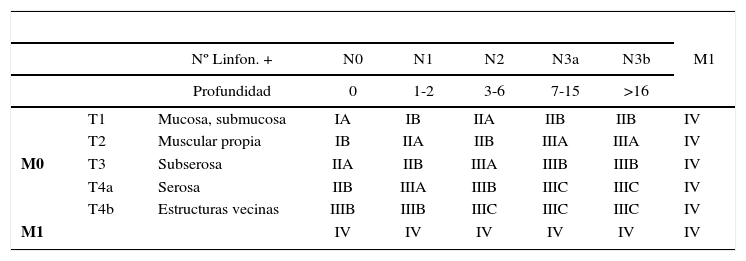
Una vez diagnosticada la lesión, se debe proceder al estudio de diseminación. Se considera como estudio mínimo para este paso la tomografía axial computada de abdomen y pelvis, que básicamente está orientada a precisar la existencia de metástasis linfonodales, hepáticas y peritoneales, esta última con mayor rango de error (30, 31). Con una adecuada preparación del estómago es posible precisar la morfología, extensión, y localización del tumor primario, logrando un acercamiento bastante preciso del factor T, utilizado en la clasificación TNM, de amplia difusión (Tabla 1). En caso de sospecha clínica de carcinomatosis es posible el empleo de la laparoscopia de estadificación (32-34) que en muchos casos evita una laparotomía innecesaria. Otras herramientas disponibles son la endosonografía (35), que determina la profundidad de la lesión con mayor precisión que los exámenes anteriores, con gran valor en la discriminación de lesionen mucosas de las submucosas y por ende de la terapia a realizar (endoscópica versus quirúrgica, ver más adelante). Estudios de diseminación ósea o cerebral no se consideran indispensable para realizar una cirugía resectiva en pacientes asintomáticos al igual que la tomografía axial computada del tórax excepto en lesiones que comprometen la unión gastroesofágica o el esófago propiamente tal.
Clasificación tnm 2010 para cáncer gástrico
| M1 | ||||||||
|---|---|---|---|---|---|---|---|---|
| Nº Linfon. + | N0 | N1 | N2 | N3a | N3b | |||
| Profundidad | 0 | 1-2 | 3-6 | 7-15 | >16 | |||
| T1 | Mucosa, submucosa | IA | IB | IIA | IIB | IIB | IV | |
| T2 | Muscular propia | IB | IIA | IIB | IIIA | IIIA | IV | |
| M0 | T3 | Subserosa | IIA | IIB | IIIA | IIIB | IIIB | IV |
| T4a | Serosa | IIB | IIIA | IIIB | IIIC | IIIC | IV | |
| T4b | Estructuras vecinas | IIIB | IIIB | IIIC | IIIC | IIIC | IV | |
| M1 | IV | IV | IV | IV | IV | IV |
Una vez diagnosticado y estadificado el paciente mediante la clasificación TNM clínica, empleando la letra c como prefijo, (cTNM), permitirá la orientación de la terapia multimodal.
Screening y prevenciónDesde principio de la década del 60 se han realizado estudios masivos de detección radiológica del cáncer gástrico en Japón (36). Esta conducta ha demostrado con los años disminuir radicalmente la mortalidad por cáncer gástrico (37). En países occidentales en que la incidencia de esta neoplasia es mucho menor, la utilidad de estas pesquisas son más discutibles por su baja relación costo beneficio (38). Por otra parte dada la ¿letalidad? del cáncer gástrico y su asociación con la infección crónica por Helicobacter pylori, se han realizado estudios de erradicación masiva a población de alto riesgo, no demostrándose fehacientemente que esta sea una medida significativa en la reducción de la mortalidad. Uno de los pocos estudios prospectivos demostró que pacientes tratados endoscópicamente por un cáncer gástrico incipiente, tenían una menor incidencia de recurrencia cuando se erradicaba el Helicobacter pylori. Mientras esperamos la aparición de estudios aleatorizados o prospectivos y placebo-control para evaluar este problema, parece razonable la prevención con erradicación en grupos de mayor riesgo (39, 40).
Tratamiento del cáncer gástricoEl mejor conocimiento de la biología tumoral del cáncer gástrico ha permitido que el tratamiento actual se haya definido como individualizado, multidisciplinario y multimodal (41). Individualizado significa aplicar la mejor terapia que asegure curación de la enfermedad con la menor invasión posible, destacando en este punto la irrupción de la endoscopía como arma terapéutica y la laparoscopia. Sin embargo, la cirugía radical sigue siendo el pilar fundamental del tratamiento del cáncer gástrico avanzado.
Tratamiento del cáncer gástrico incipienteHasta hace una década el tratamiento del cáncer gástrico incipiente era la cirugía radical (42, 43). Sin embargo, la irrupción de la endoscopía y la laparoscopia ha cambiado el enfoque de manejo. Las lesiones incipientes con compromiso solo de la capa mucosa, de pequeño tamaño y no ulceradas son factibles de resecar por vía endoscópica. Evidentemente que esta técnica avanzada debe ser realizada en centros con alto entrenamiento, de manera de garantizar que los resultados obtenidos sean similares a los de la cirugía clásica.
Existen dos técnicas endoscópicas disponibles: la mucosectomía y la resección endoscópica submucosa (44, 45). La mucosectomía consiste en la elevación de la lesión por medio de la inyección submucosa de una solución líquida y resección por medio de un asa de alambre que permite a su vez electrofulguración para hemostasia. La resección endoscópica submucosa es más compleja que la anterior y consiste en la disección por el plano submucoso, de una placa o estampilla, a veces bastante extensa, de mucosa. La curabilidad de este tipo de tra tamiento, cuando se cumplen los criterios de respetabilidad, alcanza el 100% de los casos. Las lesiones incipientes con compromiso hasta submucosa tienen una posibilidad de metástasis linfáticas locales de 15 a 20% por lo que un tratamiento endoscópico local gástrico no está indicado. Este tipo de lesiones requiere, al igual que las lesiones avanzadas, una cirugía con resección del tumor primario gástrico y una disección linfática. La cirugía para este tipo de tumores tiene una curabilidad cercana al 95% (46).
Por lo tanto para el cáncer gástrico incipiente, el tratamiento endoscópico está claramente indicado en los pacientes en que existe un mínimo riesgo de metástasis linfáticas y las que es posible resecar en block la lesión gástrica. La sociedad japonesa de cáncer gástrico define criterios estándar y criterios extendidos para tratamiento endoscópico (Tabla 2). Los criterios estándar tienen indicación de mucosectomía y los criterios extendidos de disección endoscópica submucosa (47).
Criterios estándar y extendidos para resección endoscópica en cáncer gástrico incipiente
| Criterios estándares | Criterios extendidos |
|---|---|
| 1- Compromiso solo de la mucosa (T1a) | 1- Compromiso solo de la mucosa (T1a) |
| 2- Adenocarcinoma gástrico bien diferenciado | 2- Diferenciado, no ulcerado, > de 2cm. |
| 3- No ulcerados | 3- Diferenciado, ulcerado y < de 3cm. |
| 4- Díametro menor de 2cm. | 4- Indiferenciado, no ulcerado y < de 2cm. |
La definición de procedimiento potencialmente curativo definitivo lo otorga el estudio de anatomía patológica. La pieza extraída debe ser extendida y fijada de inmediato y posteriormente analizada por el patólogo con el fin de establecer los límites radiales y en profundidad. En la Tabla 3 se muestran los criterios de curabilidad de una resección endoscópica. Cuando no se cumplen estos criterios en general se debe recurrir a la cirugía clásica (48).
Criterios de resección endoscópica curativa en cáncer gástrico incipiente
| Resección en bloque - márgenes horizontal y vertical (-) invasión linfo-vascular (-) | ||||
|---|---|---|---|---|
| Tipo histológico | Tamaño | Ulceración | Profundidad | |
| Diferenciado | > 2cm. | (-) | T1a | |
| Diferenciado | < 3cm. | (+) | T1a | |
| Indiferenciado | <2cm. | (-) | T1a | |
| Diferenciado | <3cm. | T1b | Sm1 | |
Como el compromiso linfático del cáncer gástrico incipiente es como máximo 20%, hay un 80% de pacientes en la cual si se sometiesen a cirugía y disección linfática clásica tendrían una cirugía innecesaria. Para evaluar el compromiso linfático en forma exacta durante la cirugía se ha ideado la técnica de linfonodo centinela, (49, 50), con resultados dispares y aun no definitivos, por lo tanto es considerada actualmente con una técnica en investigación, compleja y controvertida.
La irrupción de la laparoscopia es otro avance en la cirugía del cáncer gástrico incipiente. La gastrectomía laparoscópica más disección linfática D1+ ha demostrado en grandes series orientales, resultados similares a la gastrectomía mediante laparotomía (51, 52). Sin embargo, esta es una técnica demandante, que requiere gran entrenamiento y dado el bajo porcentaje de lesiones incipientes en nuestro medio, la experiencia suele ser más bien acotada y anecdótica. De todos modos la gastrectomía laparoscópica D1+ es estándar de tratamiento para el cáncer gástrico incipiente no susceptible a terapia endoscópica (53).
Tratamiento del cáncer gástrico avanzadoEl pilar fundamental del tratamiento del cáncer gástrico avanzado es la cirugía. El objetivo de esta es lograr una resección R0. Los puntos controversiales de la cirugía R0 en cáncer gástrico avanzado son:
1)Márgenes de resecciónLa gastrectomía con intención curativa debe asegurar suficiente márgenes del tumor primario que garanticen su erradicación completa. Se recomienda un margen proximal de 3cms para lesiones tipo Borrmann I y II y de 5 centímetros para lesiones Borrmann III y IV (48).
La biopsia rápida es fundamental para la evaluación del margen proximal en cáncer gastroesofágico.
2)LinfadenectomíaEste es quizás el aspecto más controversial de la cirugía en cáncer gástrico (54, 55). Dos series prospectivas randomizadas europeas han puesto en duda la efectividad de este procedimiento en cuanto a mejoría de la supervivencia. Sin embargo en el análisis de supervivencia a 15 años de la serie holandesa (56, 57), se demostró beneficio a favor de la linfadenectomía extendida tipo D2. Existen también otros reportes tanto nacionales como orientales, que apoyan la superioridad de la linfadenectomía extendida D2, ya que es posible realizarla con cifras de morbimortalidad menores a las reportadas en las series europeas mencionadas (58, 59).
Si para los autores japoneses la superioridad de la cirugía D2 es un hecho indiscutible, se plantearon la necesidad de evaluar el valor de realizar una cirugía aún mas extendida, como la linfadenectomía para-aórtica. La serie que probó dicha postura fue llevada a cabo por Sasako, en un estudio randomizado y prospectivo (60, 61). Los resultados fueron publicados el año 2008, y no se demostró una mejor supervivencia del grupo con disección para-aórtica versus la disección estándar D2. Por estas razones, la disección linfática de la segunda barrera (D2) es aceptada actualmente como la linfadenectomía estándar para el tratamiento quirúrgico del cáncer gástrico avanzado.
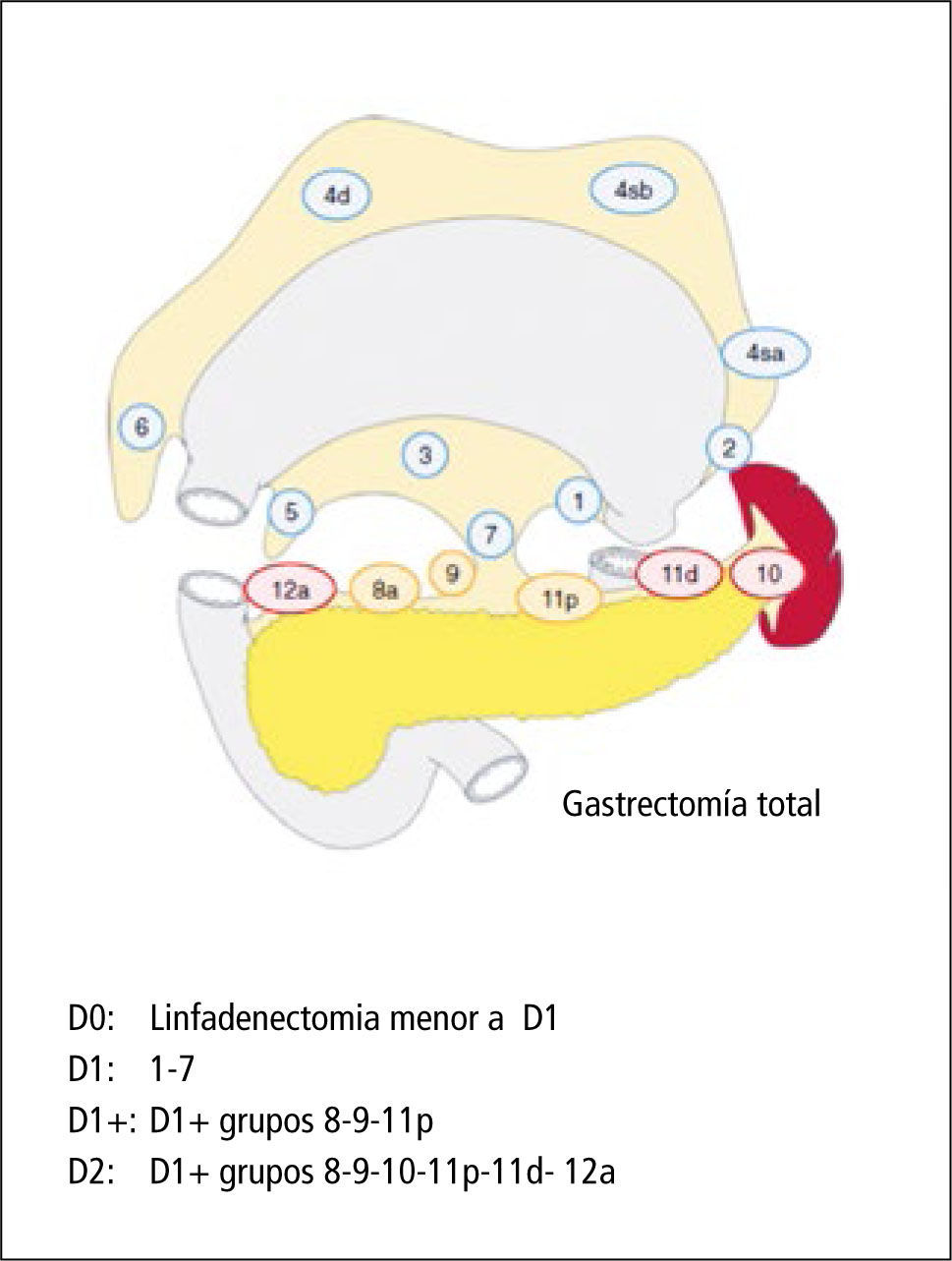
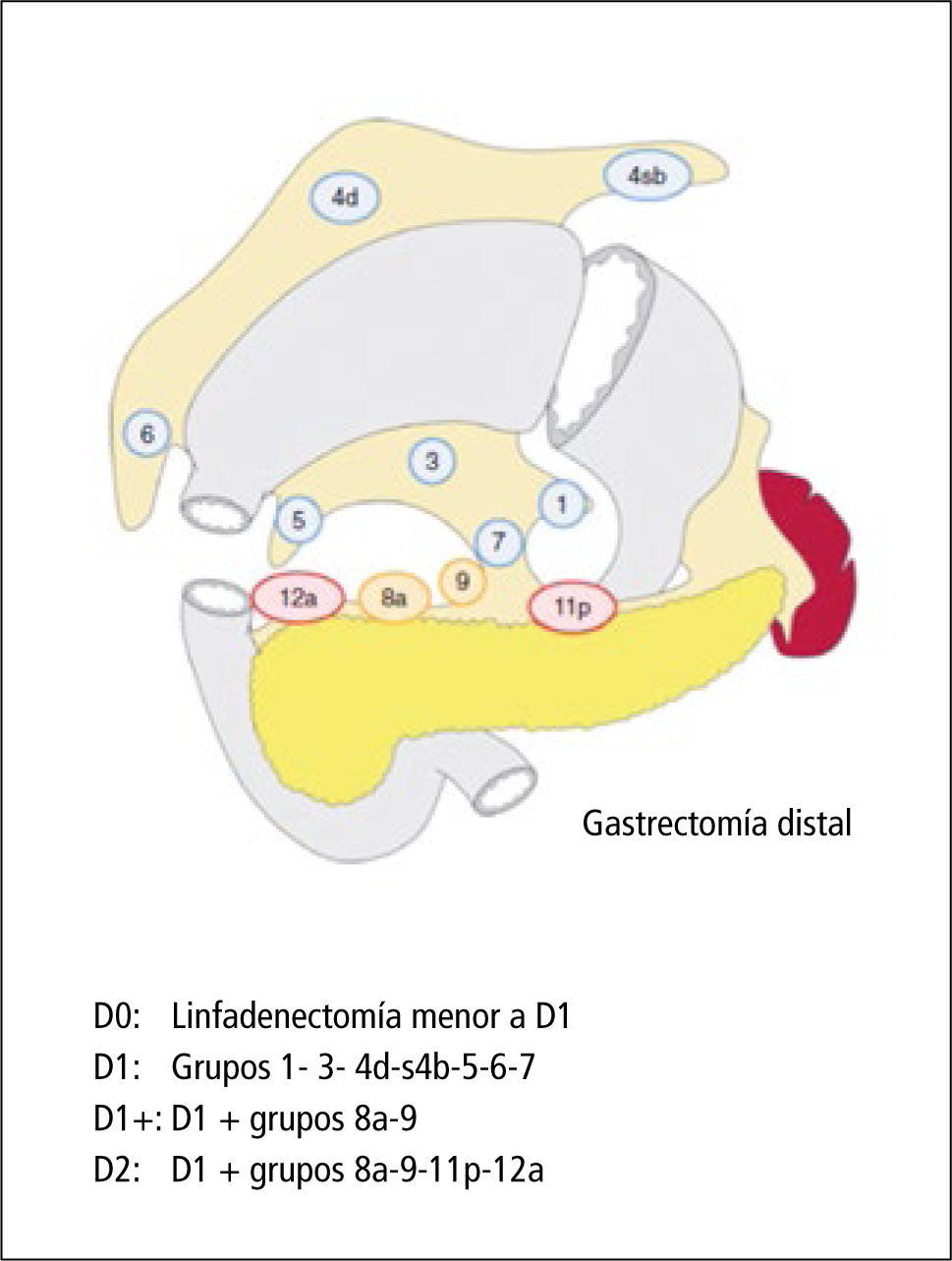
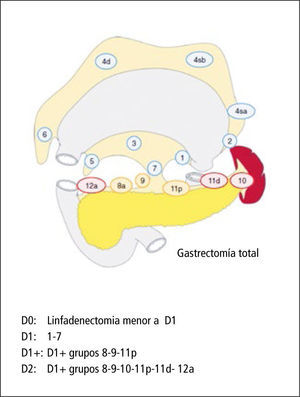
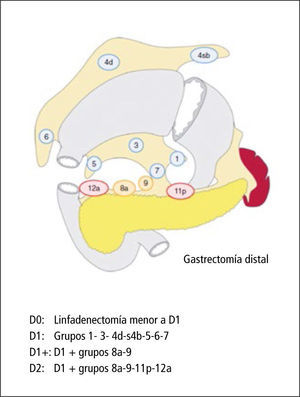
Las distintas clasificaciones existentes evalúan de distinta manera el compromiso linfonodal. La clasificación japonesa del cáncer gástrico (1998) consideraba la localización de las metástasis linfonodales en relación al tumor primario como el método de definir este compromiso. En cambio, la clasificación occidental TNM (1997) consideraba el número de linfonodos comprometidos independiente de la localización. Sin embargo, con la publicación de la edición 7º de TNM y la Clasificación japonesa del 2011, se logró la unificación de criterios de definición del factor N, tomando en consideración el número de linfonodos comprometidos. También en esta última clasificación japonesa se definió que es lo que se considera D2 en cáncer gástrico, de acuerdo al tipo de resección gástrica (Figuras 3 y 4).
El realizar en forma rutinaria la esplenectomía junto a la resección del tumor primario fue una controversia hasta hace algún tiempo. El objetivo de la esplenectomía es realizar un adecuado vaciamiento linfonodal del pedículo esplénico como parte de la disección tipo D2. Sin embargo, diversos autores han mostrado cifras de supervivencia similares para los grupos con y sin esplenectomía, pero con mayor morbilidad para el grupo resectivo. La indicación actual de esplenectomía en cáncer gástrico avanzado son aquellas lesiones de tercio superior y curvatura mayor gástrica o aquellos casos con evidente compromiso linfonodal a este nivel (62).
4)PancreatectomíaLa pancreatectomía distal fue parte la cirugía estándar del cáncer gástrico avanzado hasta hace algún tiempo. El objetivo era la resección en block de los linfonodos de la arteria esplénica por el borde superior del páncreas. Esta resección implicaba de todos modos un aumento de la mortalidad y morbilidad posoperatoria. Maruyama, demostró resultados de supervivencia similares entre grupos con pancreatectomía distal y aquellos con disección linfática de la arteria esplénica sin pancretaectomía, pero con disminución significativa de la morbi-mortalidad. La indicación actual de la pancreatectomía distal es la invasión directa del órgano por el tumor primario o el compromiso linfonodal evidente de la arteria esplénica (43).
5)OmentectomíaLa resección del omento mayor forma parte de la cirugía estándar del cáncer gástrico avanzado. No implica riesgo de la morbo-mortalidad y asegura la resección de una barrera tumoral biológica. En lesiones incipientes es posible la preservación de la mayor parte del epiplón, resecando los vasos gastro-epiploicos y su cadena linfática.
Cirugía laparoscópica en cáncer gástricoLa aparición de la cirugía laparoscópica o mínimamente invasiva ocurrida en los últimos años ha hecho que esta constituya también una alternativa quirúrgica para el tratamiento del cáncer gástrico. Han sido publicadas grandes series de pacientes operados por esta vía, principalmente orientales y abocadas a cáncer gástrico incipiente. La gran experiencia es en gastrectomías distales con disección linfática D2 (53).
Al igual que en otras patologías oncológicas digestivas, la cirugía laparoscópica constituye solo una vía más para el abordaje de esta enfermedad, respetando los principios oncológicos específicos discutidos en los puntos de más arriba. Aún es extremadamente controversial el valor de la cirugía laparoscópica en cáncer gástrico avanzado.
Adyuvancia y neoadyuvancia en cáncer gástricoLa cirugía extendida tipo D2 en cáncer gástrico avanzado logra cifras de supervivencia inferiores al 50% a 5 años, por lo que el valor de la adyuvancia es un tema de actualidad y con grandes perspectivas a futuro.
Existe especial interés sobre los promisorios resultados de la quimioterapia neoadyuvante y la quimio-radioterapia adyuvante. El año 2006 se publicaron los resultados del estudio MAGIC (63), que comparó dos grupos de pacientes con estadios II y III sometidos a quimioterapia peri operatoria (quimioterapia-cirugía-quimioterapia) versus cirugía exclusiva. En el grupo con quimioterapia se observó una disminución del estadio y tamaño tumoral y más importante aún una mejora significativa en el tiempo libre de enfermedad y supervivencia a 5 años. La conclusión final es que este es el primer estudio prospectivo y randomizado que demostró beneficios de la quimioterapia peri operatoria en cáncer gástrico avanzado. Estos resultados han sido confirmados en distintas series con esquemas similares, aunque no iguales, de quimioterapia.
La quimioterapia adyuvante (indicada posterior a cirugía) ha sido investigada desde hace bastante tiempo para tratar de disminuir las recurrencias y mejorar la supervivencia en cáncer gástrico avanzado (64). Los resultados iniciales fueron desalentadores. Sin embargo el año 2007 se publicaron los resultados de un estudio cooperativo y randomizado japonés (65) que comparó la supervivencia a 5 años entre pacientes que recibieron quimioterapia postoperatoria en base a S1 (fuoropiridimina oral) versus cirugía exclusiva. El grupo que recibió S1 presentó una supervivencia a 3 años superior en 10% con el grupo de cirugía exclusiva. Con estos resultados, en oriente, la adyuvancia estándar para el cáncer gástrico es la quimioterapia en base a S1.
Los resultados publicados por McDonald (66) empleando quimio y radioterapia posoperatoria en cáncer gástrico avanzado también son interesantes y alentadores, aunque controversiales. El tratamiento adyuvante consistió en cinco ciclos post-operatorios de 5-fluoruracilo y Leucovorina más 45Gy de radioterapia externa. Esta serie demostró una supervivencia a tres años significativamente mayor para pacientes sometidos a quimio-radioterapia post operatoria. Las críticas fundamentales a este trabajo se refieren a la calidad de la cirugía, ya que en el 90% de los casos fue una resección gástrica D1. Además se critica la tolerancia limitada del tratamiento ya que sólo el 64% del grupo total completo el tratamiento planeado. Todos estos elementos han hecho que la quimio y radioterapia posoperatoria no sean aceptadas ampliamente en Japón y en Europa. Existe además publicada una serie coreana (67, 68) con quimio radioterapia posoperatoria más cirugía D2, con resultados favorable a la adyuvancia, sin embargo este es un estudio no aleatorio.
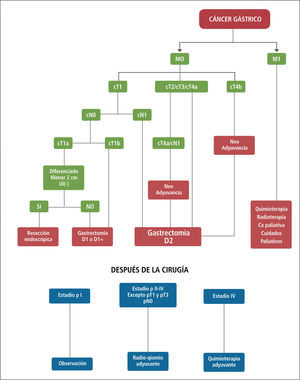
Paliación en cáncer gástricoEn Chile, existe un porcentaje significativo de pacientes que se presentan con tumores localmente avanzados o diseminados al momento del diagnóstico, y que el objetivo del tratamiento es la paliación de síntomas. La paliación cáncer gástrico está indicada para obstrucción, en tumores proximales y distales o el sangrado manifestado por hemorragia digestiva. Las alternativas disponibles van desde la paliación endoscópica, la cirugía derivativa y la resección gástrica paliativa (69). La elección de alguna de estas alternativas depende del contexto clínico y del buen criterio del equipo tratante (70). El esquema general de manejo del cáncer gástrico se muestra en la Figura 5.
El autor declara no tener conflictos de interés, con relación a este artículo.