EL ECMO u oxigenación por membrana extracorpórea, tiene una larga historia de desarrollo. Partiendo con el estudio del aparato circulatorio, transfusiones sanguíneas y circulación extracorpórea en el quirófano. Hay casos aislados reportados en la segunda mitad de la década de 1960, el primer paciente vivo se publicó en el NEJM en 1972. Existe suficiente evidencia para pensar que tiene un impacto positivo en la falla respiratoria neonatal y en la misma condición en adultos, si estos son transferidos a un centro ECMO. Más estudios están siendo llevados a cabo, para clarificar el impacto del ECMO en la falla respiratoria, cardiaca y en el paro cardiaco refractario.
ECMO (Extracorporeal Membrane Oxygenation) has a long history of development. Starting with circulation, blood management and extracorporeal circulation in the operating room. ECMO, began its development in late 1960s, with some few cases, being the first reported alive patient, published in 1972 in the NETM. There is enough evidence to think it has a positive impact in catastrophic neonatal respiratory failure and in adults in the same condition, transferred to an ECMO center. More trials are ongoing to settle ECMO impact in respiratory, cardiac failure and cardiac arrest outcomes.
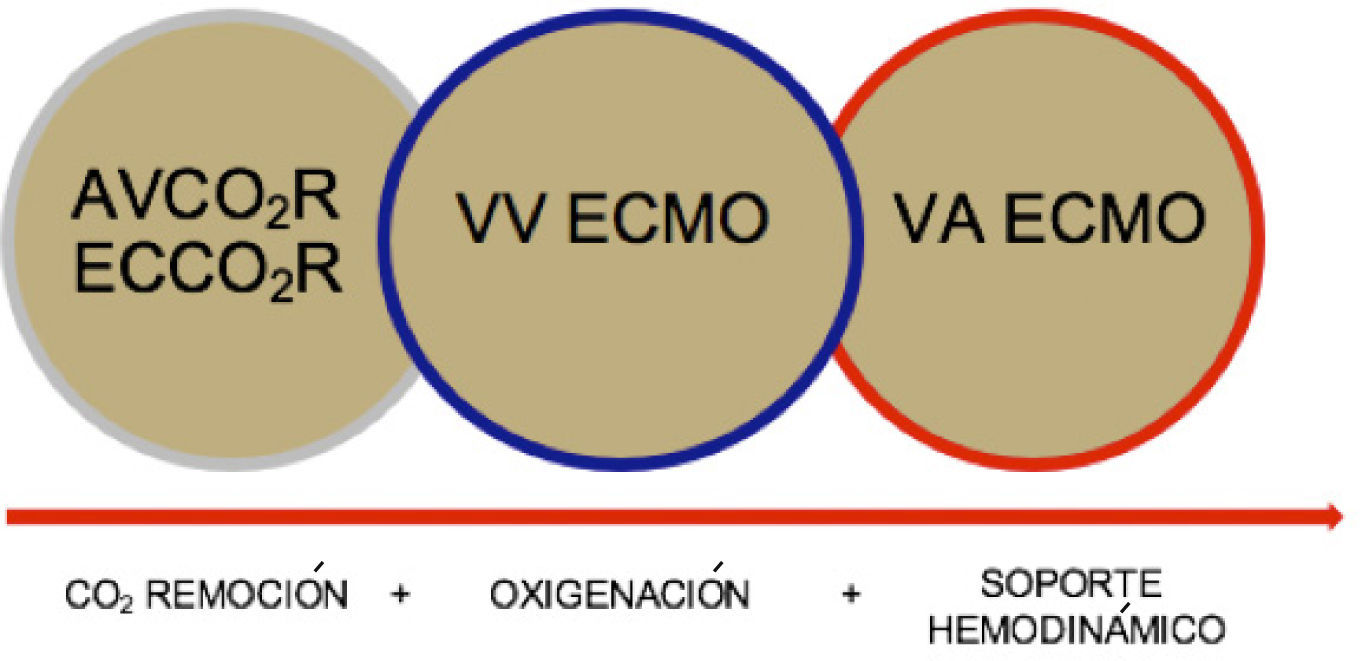
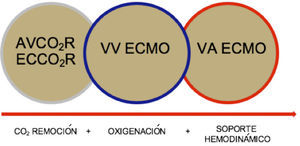
El intercambio de gases transmembrana extracorpórea o ECMO (Extracorporeal Membrane Oxygenation), utiliza una bomba y un oxigenador (intercambiador de gases) para proveer soporte hemodinámico y/o respiratorio prolongado. Dependiendo del tipo de paciente es el tipo de ECMO que se elige: veno venoso para la falla respiratoria y/o venoarterial cuando existe compromiso hemodinámico. (Figura 1).
GRADO DE APOYO EXTRACORPÓREO
AVCOR2R: Extracción de CO2 con membrana arteriovenosa sin bomba. ECCO2R: ECMO de bajo flujo (<30% débito cardiaco). VV ECMO: Conectado al lado derecho de la circulación sistémica, con al menos un 60% del gasto cardiaco del paciente. ECMO VA: Conectado en paralelo a la circulación nativa, se caracteriza por dar apoyo hemodinámico e intercambio de gases.
El ECMO es una evolución de la máquina de perfusión utilizada en cirugía cardiaca. Dependiendo de su configuración es veno venoso o veno arterial, para soportar la función cardiaca o respiratoria o ambas. Este soporte provee un puente a recuperación, trasplante o a asistencia mecánicas de larga duración.
Las técnicas de apoyo extracorpóreo cuentan en sus bases históricas el uso de hemoderivados, anticoagulación, perfusión de órganos aislados, y circulación extracorpórea en el quirófano de cirugía cardiaca entre otras.
ANTECEDENTES HISTÓRICOS QUE DIERON LUGAR AL ECMOEn la segunda mitad del siglo XVII, el médico Jean Baptiste Denis hizo la primera transfusión con fines terapéuticos (ya había sido utilizada con fines experimentales) a un ser humano. Esto inició un largo periodo de experimentación en transfusiones de animales a humanos, cuyos malos resultados llevaron a la prescripción de esta práctica por más de un siglo, hasta 1818, en que James Blandwell realizó la primera transfusión de humano a humano 1. En 1860 el británico Sir Benjamin Ward Richardson reportó experimentos en que logró oxigenar sangre en un modelo animal y en 1895 el doctor Johann Jacobi, logró diseñar un aparato para perfusión renal, que oxigenaba sangre mediante infusión directa de aire 2.
El descubrimiento de la heparina, el primer anticoagulante de uso clínico, está asignado universalmente a Jay McLean (1916) siendo estudiante de medicina, en la Universidad Johns Hopkins, mientras investigaba con extractos de hígado y corazón de perros para purificar sustancias procoagulantes. Después de que McLean dejara Johns Hopkins, su profesor, William Howell, se dedicó a estudiar este fenómeno, y en 1918 con otro alumno llamado Emmett Holt Jr (que posteriormente fuera un eminente pediatra) extrajo otra sustancia, también liposoluble, del hígado del perro, pero diferente a la de McLean, y que Howell denominó heparina, y que en sus primeros años se utilizó solo como un reactivo de laboratorio para prevenir la coagulación de las muestras de sangre. Chargaff y Olsson en 1937 descubrieron la protamina, convirtiendo así a la heparina en el único anticoagulante con antídoto. En 1935, tras los estudios moleculares de Erik Jorpes del Karolinska Institute en Estocolmo, la compañía sueca VitrumAB logra fabricar heparina para uso intravenoso. Posteriormente al resolver problemas con la extracción a gran escala y purificación de la materia activa, su uso terapéutico se extendió. Así, cada año, se producen unas 100 toneladas de heparina, que son extraídas del intestino de unos 300 millones de cerdos 3.
El científico ruso Sergei Brukhonenko logró en 1929 la perfusión de órganos, partes o cuerpos enteros de animales manteniéndolos vivos por horas. Famosas son sus imágenes de cabezas caninas que se mantienen con vitalidad conectadas a perfusión extracorpórea.
A comienzo de los años treinta un joven médico, John Gibbon vió morir a una joven por una embolia pulmonar y nace la idea de que si hubiese tenido algún artefacto que pudiera bombear y oxigenar sangre, posiblemente habría tenido tiempo para solucionar el problema a la paciente. Los siguientes 23 años los dedicó al desarrollo de la máquina corazón pulmón con el soporte técnico de IBM y la ayuda de su esposa Mary, enfermera y de hecho la primigenia perfusionista. Así el 6 de mayo de 1953, el doctor Gibbon realiza la primera cirugía a corazón abierto con circulación extracorpórea en el Jefferson Medical School de Philadelphia.
Varios son los pioneros de la cirugía cardiaca que en los 50's lograron consolidar la circulación extracorpórea, William Mustard (pulmón de mono aislado como oxigenador) en University of Toronto Medical School, Forest Dodrill (junto a General Motors investiga en Maquina Corazón) en Wayne State Medical School Detroit, Clarence Dennis (Oxigenador de Disco Rotatorio) en University of Minnesota Medical School, Walton Lillehei (Circulación Cruzada) también en Minnesota (recomendable ver la película que relata la experiencia de una paciente que fue sometida a circulación cruzada: Kardia del director Su Rynard), John Kirklin (Mayo-Gibbon Máquina Corazón-Pulmón) en la Mayo Clinic de Rochester. Richard DeWall inventó el primer oxigenador de burbujas desechable en 1955, pronto llegó a ser el principal modelo utilizado en circulación extracorpórea para cirugía cardiaca 4,5. Este fue utilizado en Chile hasta bien avanzados los 80s.
A pesar de lo revolucionario para la medicina, el oxigenador de burbujas tiene desventajas. De hecho las micro embolias aéreas y la hemólisis son algunas de ellas, por lo que es muy útil para sala de operaciones en cirugías de pocas horas, pero no para ECMO o apoyo de larga duración. Kammermeyer en 1957 desarrolló el polímero dimetilpolisiloxano hoy llamado silicona, material que resulta ser altamente resistente a la presión hidrostática (no permite el paso de agua), pero es muy eficiente en la difusión de gases. Sentando la base para que el doctor Theodor Kolobow y cols. desarrollaran el primer pulmón artificial (oxigenador) de membrana en los 60s. Desde los últimos años de esa década empezaron a aparecer reportes de casos de pacientes sometidos a oxigenación extracorpórea prolongada, pero sin éxito.
En 1971 el doctor JD Hill realizó el primer uso de un circuito extracorpóreo para uso prolongado con sobrevida del paciente. Conectó a ECMO a un joven de 24 años con un distrés respiratorio por politrauma y en 1972 Bartlett reportó el primer ECMO cardiaco en un niño post cirugía cardiaca 6–8. “One of the satisfying things about physiology is that it makes sense. With enough data we can always figure out the problem. One of the satisfying things about ECMO is that it allows time to think about the data”
Robert H. Bartlett, considerado en el mundo, el Padre del ECMO, realizó con éxito por primera vez un ECMO neonatal en 1975: apoyó con esta técnica una recién nacida en falla respiratoria e hipertensión pulmonar secundarios a una aspiración meconial. Bartlett fue un pionero, modificando la circulación extracorpórea para llevarla desde la sala de operaciones a las unidades de cuidados intensivos. Esta recién nacida, llamada Esperanza, es hoy un ícono del ECMO 5 (Foto 1).
FOTO 1.
Esperanza, con el Dr. Javier Kattan, neonatólogo del Hospital Clínico de la U. Católica y EU. Christian Fajardo, perfusionista de Clínica Las Condes. Año 2014.
El Dr. Bartlett es un médico, científico, aficionado a la música y emprendedor. Fundador de ELSO (Extracorporeal Life Support Organization), hasta el día de hoy viaja por el mundo aportando al desarrollo del ECMO. El doctor Bartlett nos visitó en Chile el año 2016 (Foto 2).
FOTO 2.
Robert H. Bartlett, MD
ECMO EN NEONATOLOGÍAEl primer estudio clínico sobre ECMO en falla respiratoria aguda de neonatos liderado por el doctor Bartlett y cols., se publicó en 1985. Un ensayo diferente dirigido por O¿Rourke en el Boston Children¿s Hospital, obtuvo resultados promisorios y fueron comunicados en 1989 (94% de supervivencia en el grupo tratado con ECMO) 5. A partir de ahí se multiplicaron los pacientes y los centros con programas de ECMO, convirtiendo este tipo de apoyo, en una alternativa viable. En 1996 se publicó el resultado del trabajo aleatorizado en falla respiratoria neonatal, del UK Collaborative ECMO Trial Group. Este estudio mostró una diferencia significativa, con un 60% sobrevida en el grupo de ECMO vs. 40% con terapia estándar (NNT 3-4). Es así que el ECMO en este grupo etario llegó a ser un estándar de cuidado 8.
ECMO EN ADULTOSLa historia en adultos es algo distinta, en 1975 tras varios casos reportados, el National Institute of Health, encargó a Warren Zapol, el estudio multicéntrico de ECMO en insuficiencia respiratoria del adulto. Publicado en 1979, mostró sobrevidas cercanas al 10%, sin diferencias en el grupo ECMO vs convencional 10. Debido a estos resultados, prácticamente se detuvo el desarrollo del ECMO en adultos, salvo contadas excepciones, como los grupos de Bartlett y Luciano Gattinoni. Varios años después, en 1994 Morris reportó en un trabajo aleatorizado monocentro, que no había beneficios con ECCO2R (remoción de CO2 extracorpórea) en adultos. La experiencia en este centro con ECMO era limitada, tuvieron alta cantidad de complicaciones hemorrágicas y el promedio de Ventilación Mecánica era de 8 días previo al ECMO 11.
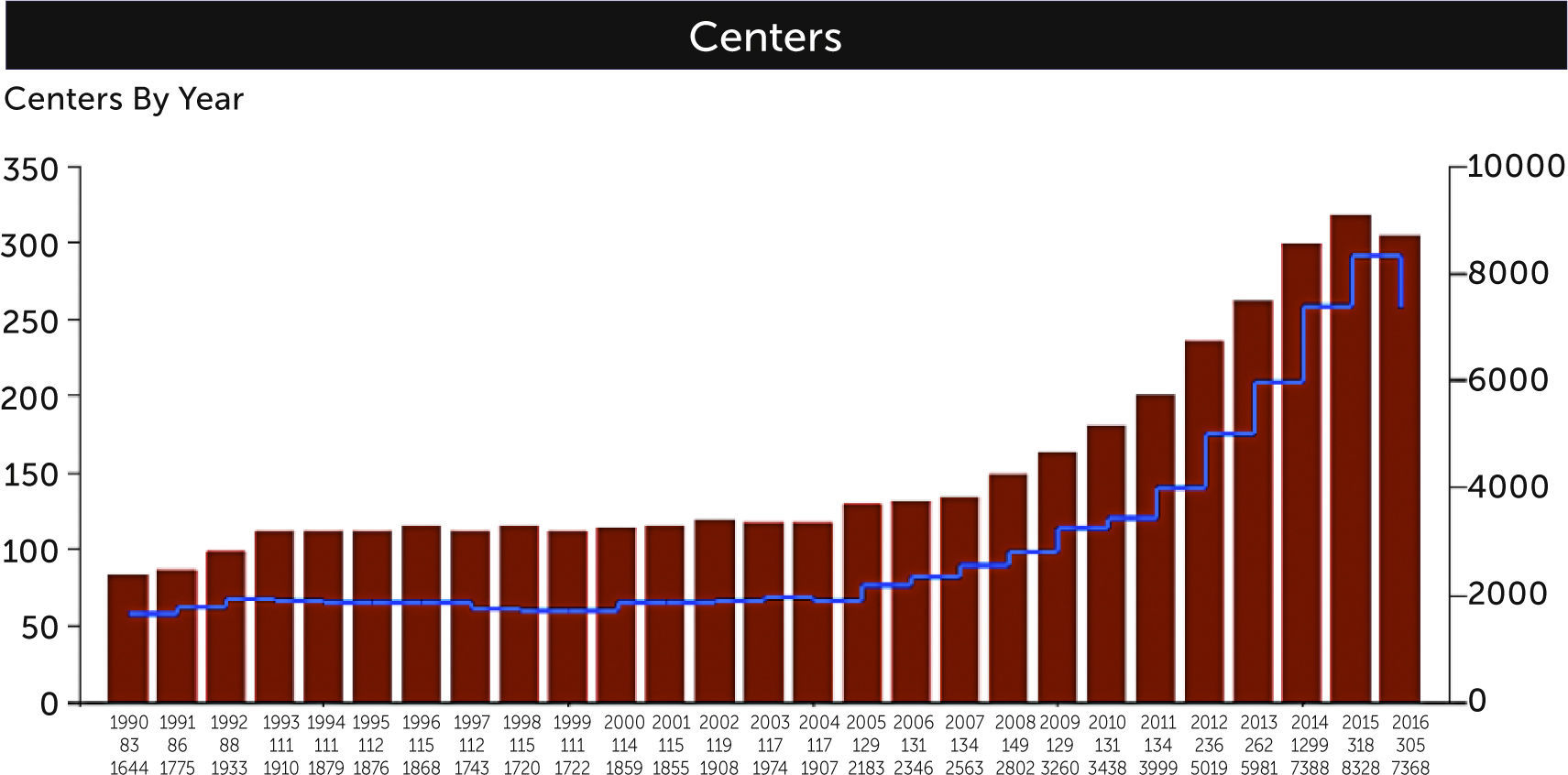
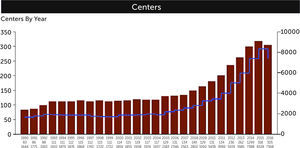
En el año 2009 se publicó el estudio CESAR (Conventional ventilatory support versus Extracorporeal membrane oxygenation for Severe Adult Respiratory failure) dirigido por Giles Peek en Reino Unido, que incluyó 180 pacientes aleatorizados a manejo convencional y a ECMO, con algo más de 40% de sobrevida o incapacidad severa para el grupo de convencional y 63% de sobrevida o incapacidad severa para el grupo ECMO 12. Si bien no todos los pacientes en la rama “ECMO” fueron conectados, responde la pregunta a que es mejor trasladar un paciente en falla respiratoria catastrófica a un centro ECMO que manejarlo convencionalmente. El año de publicación de esto, coincidió con la pandemia H1N1. Así, a partir del 2009 hubo un marcado aumento en el uso de ECMO en adultos, tanto en falla respiratoria como en falla cardiaca y se observó en el reporte internacional un aumento de alrededor de 500 casos el 2006 a casi 3000 el 2014 y en la cantidad de centros ECMO registrados de 130 el 2006 a 305 el 2016 5 (Figura 2).
CHILEEl soporte extracorpóreo, en Chile, está íntimamente ligado a la anestesia, en parte al menos, por el hecho de que los Doctores Waldemar Badía y Dr. Jorge Urzúa, Anestesiólogos, Profesores Titulares de la Pontificia Universidad Católica y Maestros de la Anestesiología Chilena, hicieron escuela a nivel nacional, donde anestesia y perfusión eran una sola unidad, modelo que se replicó en otros centros del país 13 (Foto 3).
En Chile, Bugedo, Castillo y cols. en 1996 reportaron los primeros resultados (18% de sobrevida) con ECMO en adultos 14. En el Congreso Chileno de Cardiología, el año 1994, Pedemonte et al presentaron 7 pacientes: 3 con el uso de asistencia ventricular con bomba centrífuga y 4 casos de ECMO Veno Arterial, esto con una sobrevida del 57% 15. Frente a la evidencia que existía en neonatología, y a la ausencia de un programa formal de ECMO, se organizó en 1999 el programa neonatal pediátrico en el Hospital Clínico de la Universidad Católica de Chile, en mayo de 2003 se realizó el primer ECMO neonatal en Chile, y se consolidó el primer centro ELSO de Latino América, liderado por Javier Kattan 16.
Actualmente existen en Chile al menos 21 centros con “máquinas de ECMO”, con números desde 0 hasta 55 pacientes por año, con 32% de los casos acumulados de indicación cardíaca. En el país se hicieron aproximadamente 180 casos de ECMO en el período octubre 2015 a octubre 2016 (87 el año 2014), y al menos 20 de ellos fueron de transporte (Encuesta Nacional de ECMO: datos presentados en Congreso SOCHIMI, Coquimbo, noviembre 2016) 17. Actualmente existe un grupo de trabajo de la SOCHIMI y el MINSAL que está organizando los criterios de indicación, requerimientos de centros ECMO, coordinación y una base de datos nacional con los resultados 18. Lo mismo para el ECMO como asistencia mecánica de corta duración con un grupo de expertos convocados por el MINSAL.
FOTO 3.
Profesor Dr. Jorge Urzúa U.
ELSODesde el punto de vista organizacional la historia se remonta a 1975, al realizarse el Primer Simposio de Pulmón Artificial en Copenhage. En 1984 se inició el primer registro de casos realizado por un grupo colaborativo de estudio con el objetivo de compartir los datos y experiencias, este grupo publicó su registro en 1988, con algo más de 700 casos. Esta iniciativa concluiría en la fundación de ELSO (Extracorporeal Life Support Organization) en 1989, en la Universidad de Michigan, Ann Arbor, Michigan EE.UU., entidad liderada por un grupo de clínicos e investigadores empeñados en el desarrollo, difusión e investigación en ECMO. ELSO es hoy una organización internacional, sin fines de lucro, con la base de datos más grande del mundo en ECMO, que agrupa a todos los centros que voluntariamente desean aportar al registro con sus casos (Figura 2). En 2011 se formalizó el capítulo EURO-ELSO, encabezado por Roberto Larusso (este capítulo reemplazó a EESO: Organización Europea de Soporte Vital Extracorpóreo que funcionaba desde 1994). El primer semestre del 2012 se creó el capítulo ASIA-PACÍFICO. En noviembre del 2012 en una reunión realizada en Santiago de Chile, con participación de representantes de centros latinoamericanos y la visita de miembros del comité ejecutivo de ELSO, se creó el Capítulo LATINO AMERICANO de ELSO. Para 2014 también había nacido el capítulo Medio Oriente – Asia que incluye a África 5.
ELSO entrega datos para poder evaluar programas de ECMO, ha desarrollado y desarrolla Guías Clínicas para el manejo de pacientes en ECMO tanto neonatos como niños y adultos, desarrolla guías para el manejo de áreas particulares del ECMO como por ejemplo la anticoagulación e infecciones a través de grupos de trabajo. Promueve y provee el Estado del Arte de los Programas de Educación en ECMO alrededor del mundo (FOTO 4). Provee la evaluación de los Programas de ECMO de cada institución a través del “ELSO Award of Excellence in ECMO”.
El avance y desarrollo tecnológico han permitido ofrecer a los pacientes soporte extracorpóreo prolongado más seguro. Nuevos pulmones artificiales (oxigenadores), nuevas bombas, nuevos productos menos trombogénicos han ayudado a una mayor efectividad y seguridad. Sin duda el conocimiento, mejor entendimiento de las patologías, pero en especial el aprender a trabajar en equipo, han sido clave en esto.
FOTO 4. CURSO ELSO. ECMO EN ADULTOS. SAO PAULO. AGOSTO 2017
Alumnos de todo Brasil. Instructores Brasileros, EE.UU., Canadá y Chile (CLC).
Los autores declaran no tener conflictos de interés, en relación a este artículo.