La tuberculosis sigue siendo una epidemia mundial. En Chile en los últimos años se ha mantenido la tasa de enfermos con tuberculosis. En niños el diagnóstico es un desafio, ya que los elementos considerados como gold estándar como la baciloscopía y cultivos suelen ser falsos negativos. La prueba de tuberculina (PPD) e IGRAS son pruebas complementarias con una sensibilidad y especificidad variable. La imágenes son un elemento fundamental en el contexto de un paciente sospechoso. En esta revisión se abarca la epidemiología, proceso diagnóstico (historia clínica, metodos diagnósticos), tratamiento y prevención en el niño.
Tuberculosis continues to be a worldwide epidemic. The rate of sick patients with tuberculosis in Chile has stayed the same in recent years.
Diagnosis in children is challenging due to the fact that gold standard elements such as bacilloscopy and cultures often produce false negative results. The PPD and IGRAS tests are complimentary tests with variable sensitivity and specificity. Imaging is a fundamental element when tuberculosis is suspected in a patient. This study includes the epidemiology, diagnostic process (clinical history, diagnostic methods), treatment and prevention in children. Keywords: tuberculosis, bacilloscopy, PPD skin test.
La TBC sigue siendo una epidemia a nivel mundial, con especial impacto en los países más pobres especialmente de África y Asia. También la tendencia mundial a la eliminación, que ocurría en los países de mayores recursos se vio interrumpida por la aparición de la coinfección por VIH y las enormes migraciones desde países con TBC endémica. En Chile la tasa actual es de 14.2/100000, lo que nos aleja como país de lograr la tasa de eliminación que es menor a 5/100000. 1
Según estimaciones de la Organización Mundial de la Salud (OMS), durante el año 2015 hubo un aumento de casos nuevos a 10.4 millones en el mundo, siendo los casos infantiles (menores de 15 años), 1 millón y de estos murieron alrededor de 170000 2. En forma global el 12% de los casos nuevos eran VIH positivo. En Chile pesar de los esfuerzo por intentar erradicar la TBC para el 2020 la tasa no se ha disminuido, manteniéndose 50 casos infantiles nuevos al año, incluyendo muertes, formas diseminadas y Tuberculosis mutirresistente (MDR).
A pesar de los esfuerzos de la OMS y múltiples organizaciones dedicadas a mejorar la prevención, diagnóstico, tratamiento oportuno y tratar de acercar las nuevas tecnologías a los lugares de mayor incidencia y mortalidad, aún no se logran dichos objetivos.
Alrededor del 90% de los niños infectados no enferma. Dentro de los niños que no enferma, un grupo importante puede quedar como infección latente, quedando como reservorio para futura transmisión de la enfermedad al reactivarse Tuberculosis (TBC) post primaria. Un 10% de los niños enferma y esto ocurre durante los primeros 5 años después de la infección. Dentro de los factores de riesgo principales están: la edad, siendo los lactantes el grupo etario de mayor riesgo de enfermedad grave (30-40% TBC pulmonar y 10-20% TBC diseminada) e inmunodeficiencias, especialmente en pacientes portadores de VIH. Esta progresión a enfermedad puede ser muy poco sintomática 3,4.
Cuando un niño enferma, casi siempre es sinónimo de infección reciente, por lo tanto, es perentorio tratar de encontrar al caso índice que lo contagió, siendo éste, generalmente un contacto cercano intradomiciliario o en su entorno escolar.
El diagnóstico de la TBC en el niño es difícil, considerando que en general las lesiones son paucibacilares y cerradas, por lo tanto de gold standard que es la bacteriología positiva no se logra en más del 30% de los casos.
En la actualidad, todas la estrategias a nivel mundial para intentar terminar la epidemia TBC se han focalizado en mejorar el diagnóstico precoz, en el tratamiento oportuno y más aceptable (fácil de administrar) de la TBC infantil.
Un elemento a considerar también en el control y mejoría de la enfermedad, es la creciente aparición de Bácilo de Koch MDR (resistentes a dos drogas de primera línea isoniacida más rifampicina) o XMDR (MDR asociado a resistencia a fluoroquinolonas y al menos 1 de los tres fármacos inyectable capreomicina, amikacina o kanamicina). Esto dificulta y alarga el tratamiento, aumentando la mortalidad de los pacientes e infectando a otros con estos gérmenes resistentes.
¿EN QUIÉNES SOSPECHAR LA TBC ?Si no se sospecha la posibilidad de que un paciente esté enfermo de tuberculosis o con infección latente, difícilmente se podrá llegar al diagnóstico.
Se debe sospechar TBC pulmonar en las siguientes situaciones:
- 1.
Niños con antecedentes de contacto con un adulto con: TBC pulmonar o miliar, con Baciloscopí (BK) y/o cultivo positivo y en los contactos de cualquier tipo de TBC Pediátrico. Estos pueden ser contactos intradomiciliarios o escolares 3.
- 2.
En neumonías resistentes a tratamientos que cubren gérmenes más habituales y también en neumonías o pleuroneumonias extensas con discordancia clínico- radiológica, donde el compromiso clínico es menor a la extensión de las imágenes.
- 3.
En imágenes pulmonares o mediastínicas persistentes.
- 4.
Pacientes con tos crónica productiva en que se ha descartado otras causas más habituales.
- 5.
Escolares con hemoptisis, neumonías extensas febriles y baja de peso.
- 6.
Pacientes VIH +, con síndromes febriles y aparición de nuevas imágenes pulmonares.
Y se debe sospechar TBC extrapulmonar en las siguientes situaciones:
- 1.
Pleuroneumonías de predominio linfocitario o resistente a tratamiento de gérmenes adquiridos en la comunidad.
- 2.
Meningitis a líquido claro asociado a encefalitis de causa no evidente.
- 3.
Adenopatías persistentes que requieren de biopsia (diagnóstico diferencial con adenitis BCG, tumores y otras infecciones).
- 4.
Hallazgo de granulomas en biopsias de diferentes órganos (ósea, peritoneal, pleural, entre otros).
Sin duda, lo primero es sospechar el diagnóstico de TBC y luego realizar una exhaustiva historia clínica buscando síntomas sugerentes, contacto epidemiológico (adulto TBC/BK+) o familiar con tos crónica y examen físico detallado (Tabla 1) 5.
ASPECTOS CLÍNICOS Y DE EXAMEN FÍSICO FRENTE A LA SOSPECHA DE TBC
| HISTORIA CLÍNICA |
| -Compromiso del estado general |
| -Baja de peso |
| -Fiebre prolongada o sin foco |
| -Síntomas respiratorios: tos crónica, expectoración, hemoptisis |
| -Antecedentes de vacunación con BCG |
| EXAMEN FÍSICO |
| -Presencia de cicatriz BCG |
| -Adenopatías cervicales |
| -Examen pulmonar normal o semiología de condensación o sibilancias fijas |
- 1.
Radiografía de torax: El uso de las imágenes, particularmente la radiografía de tórax, constituyen hoy en día herramientas fundamentales en el apoyo diagnóstico y en el seguimiento de los pacientes con tuberculosis, así como también para la evaluación de sus contactos.
Una radiografía de tórax (Rx Tórax) aparentemente normal, no descarta la presencia de enfermedad pulmonar. Se debe ser muy acucioso en la interpretación radiológica, considerando cualquier hallazgo como sospechoso, ya que aún cuando no sea específicos, en el contexto clínico sugerente de enfermedad tuberculosa, las imágenes pueden permitir acercarse al diagnóstico.
- 2.
La tomografía computada de tórax se usa como complemento a la Rx de tórax en caso de: duda diagnóstica o en las presentaciones diseminadas de la enfermedad. Esta debe ser realizada con uso de medio de contraste endovenoso con el fin de detectar de mejor forma la presencia de adenopatías hiliares y utilizando protocolos de bajas dosis adaptados a niños 6.
- 3.
La ecografía toráxica: tiene utilidad particularmente, en la caracterización del derrame pleural o pericárdico, así como servir de guía para punciones diagnósticas. Sin embargo, el derrame TBC, no se distingue ecográficamente de los causados por gérmenes habituales.
Las adenopatías están presentes hasta en un 95% de los niños, pero la Rx Tórax puede no evidenciarla.
- 4.
La Tomografía Computada con medio de contraste endovenoso, juega un rol importante en identificar la presencia de adenopatías.
La rotura de una adenopatía hacia un bronquio, puede producir una diseminación broncógena de la enfermedad, con compromiso de más de un lóbulo y que en la Tomografía Computada se manifestara por la presencia de múltiples opacidades de distribución centro lobulillar, con la característica apariencia de “árbol en brote” 7.
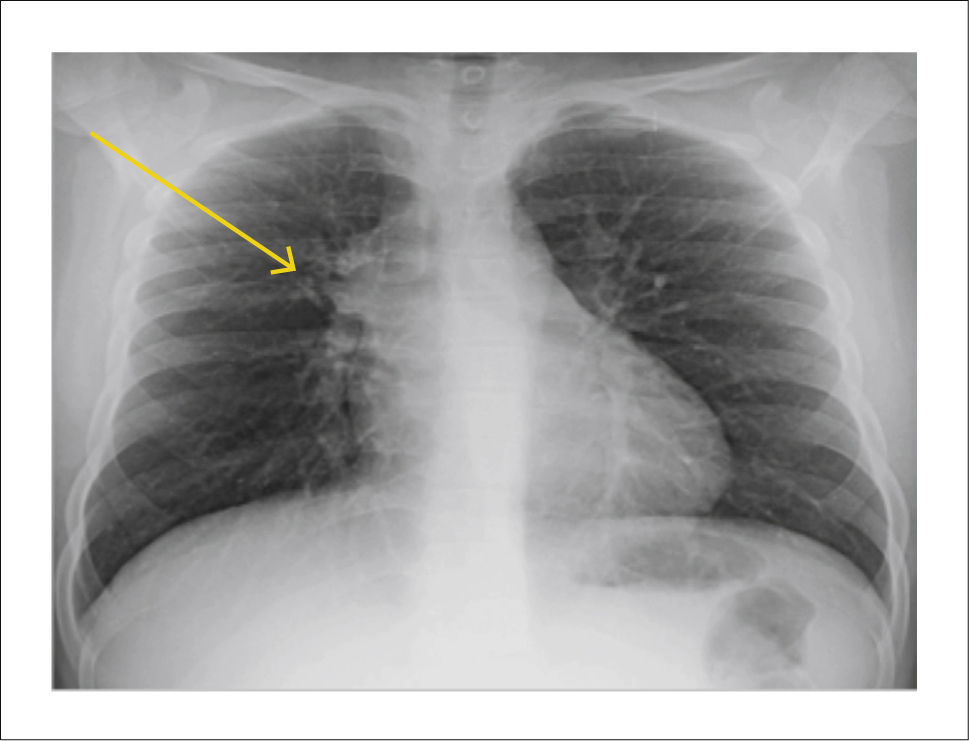
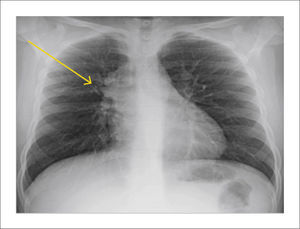
FORMAS DE PRESENTACIÓN RADIOLÓGICAComplejo primarioLa imagen radiológica clásica de un complejo primario son las adenopatías hiliares y paratraqueales. Excepcionalmente podemos encontrar una imagen en palanqueta que corresponde al complejo primario de Ghon (lesión pulmonar, linfangitis y adenopatía hiliar) (Figura 1).
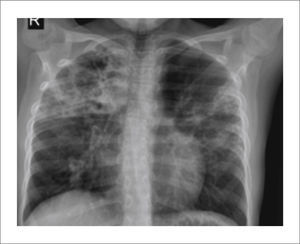
Tuberculosis pulmonar progresivaSe caracteriza por presentar foco de condensación uni o multifocal, homogéneo, en cualquier lóbulo, aun cuando existe cierto predominio por áreas de mayor ventilación. La presencia de adenopatías o la falta de respuesta al tratamiento antibiótico pueden hacer sospechar la presencia de infección tuberculosa.
Progresa a imágenes de necrosis, licuefacción o calcificación dentro de la consolidación y progresar a un extenso daño pulmonar. Si la lesión drena a un bronquio aparecerán imágenes cavitadas, más frecuentes en pacientes inmunocomprometidos 5 (Figura 2).
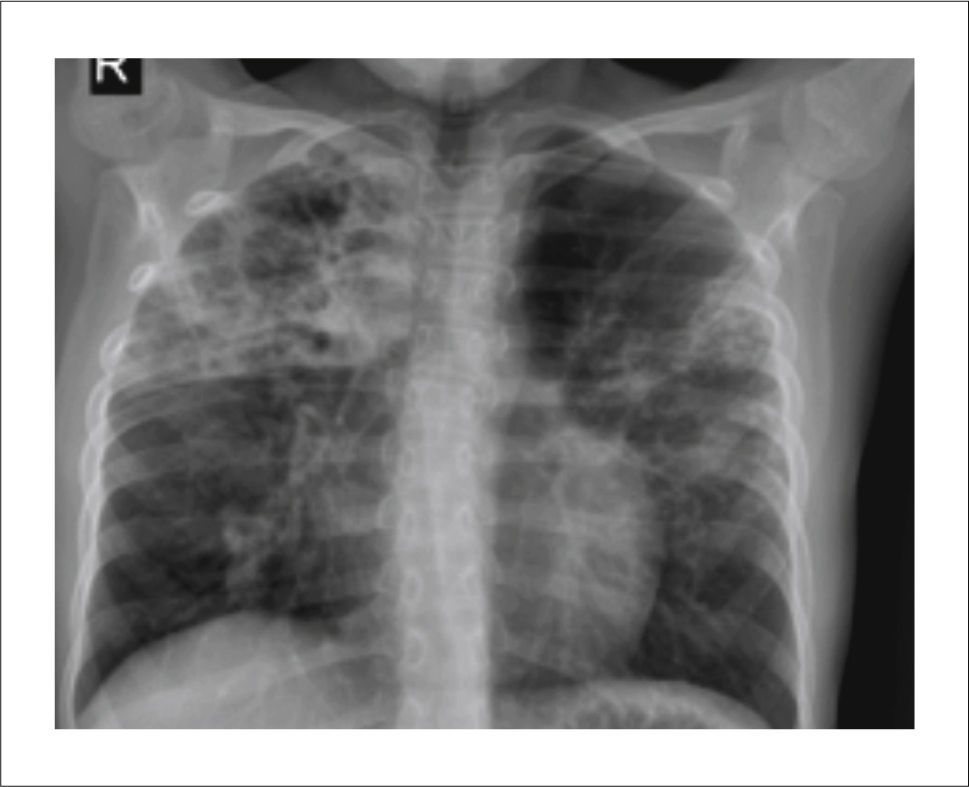
Tuberculosis MiliarLa enfermedad miliar causada por diseminación hematógena del bacilo es más frecuente en lactantes y niños pequeños, así como también en ancianos y pacientes inmunodeprimidos.
La radiografía de tórax puede ser normal al inicio de los síntomas, pues los nódulos son muy pequeños. En general el clásico hallazgo de múltiples pequeños nódulos de entre 2 a 3mm de diámetro distribuidos en forma difusa y simétrica, características que se encuentran en alrededor de un 85% de los casos.
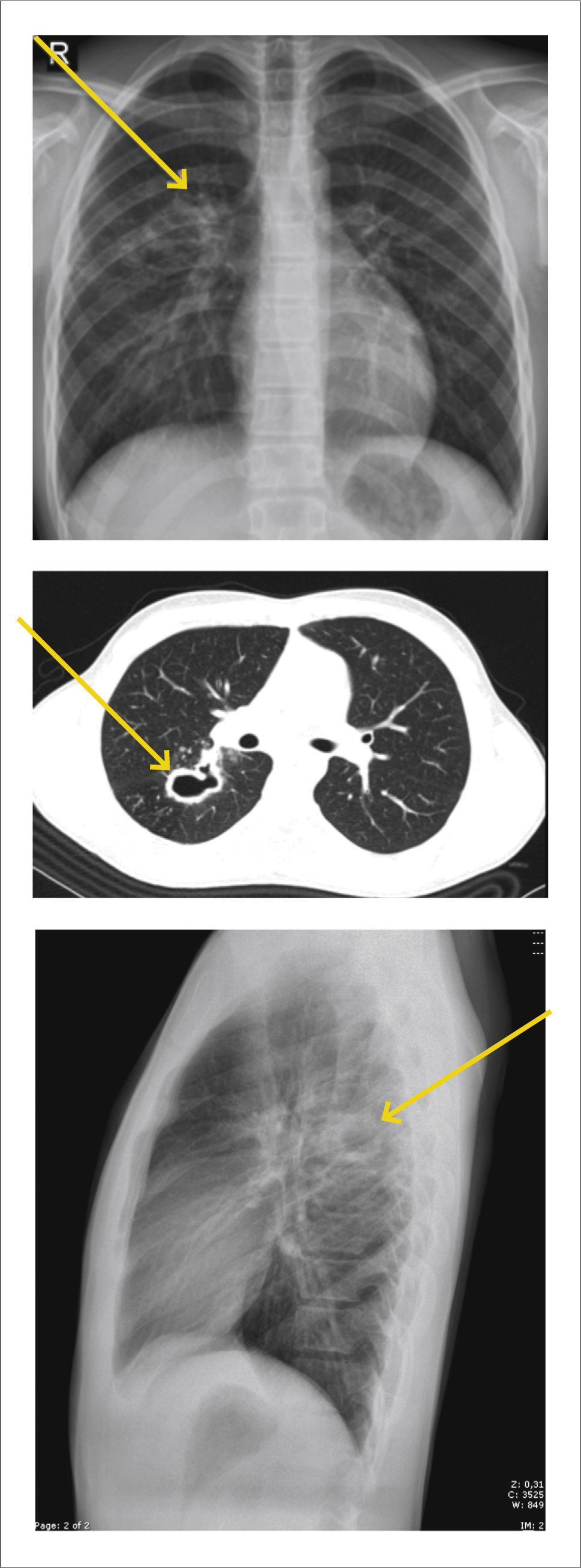
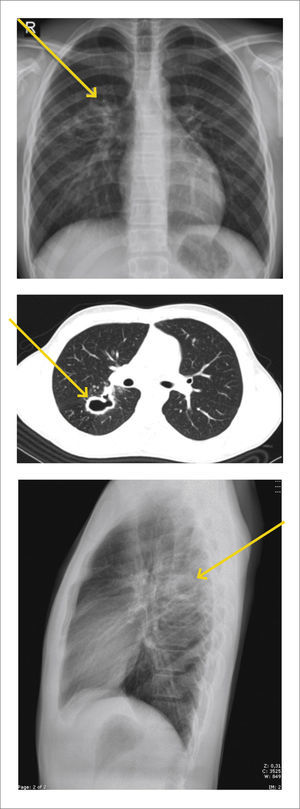
Tuberculosis PosprimariaPropio del adolescente y adulto. Se manifiesta por la presencia de opacidades parenquimatosas mal definidas, con predominio en los segmentos apicales y posteriores de los lóbulos superiores.
La cavitación es una de las características de la enfermedad parenquimatosa post primaria, afectando aproximadamente a un 50% de los pacientes.
A las imágenes aparece como una cavidad de pared gruesa e irregular y si hay nivel aire-líquido se debe sospechar sobreinfección bacteriana.
También puede haber diseminación a través del árbol traqueobronquial (Figura 3).
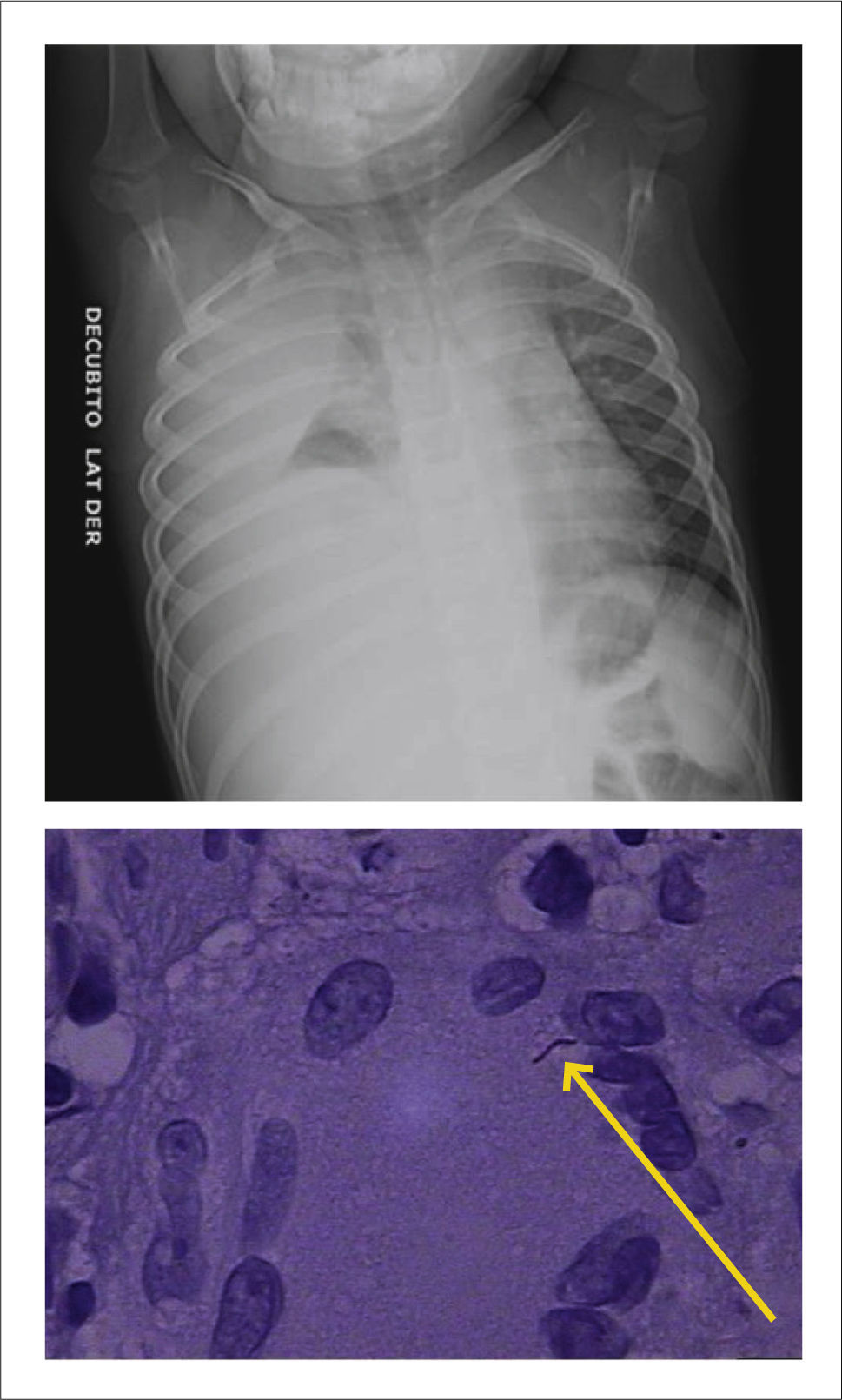
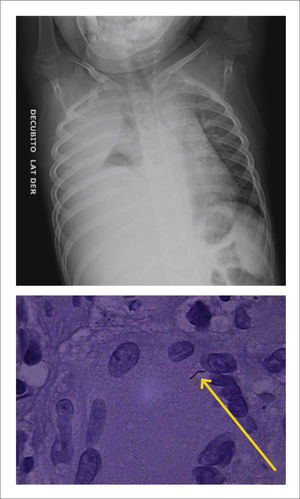
Pleuresía TuberculosaLa pleuresía tuberculosa se ha considerado como una TBC extrapulmonar, sin embargo, de manera habitual se puede demostrar lesiones a nivel de parénquima pulmonar asociado. Esta ocurre como resultado de la rotura de una lesión subpleural en el espacio pleural, diseminación a partir de linfonodos 7, siendo el derrame habitualmente unilateral.
Ningún estudio de imágenes es concluyente en el diagnóstico diferencial (Figura 4).
PRUEBA DE TUBERCULINALa prueba de tuberculina, PPD (purified proteic derivative) o test de Mantoux es la reacción de hipersensibilidad a la inyección intradérmica de proteínas purificadas del complejo de Mycobacterium. Esta prueba utilizada desde 1907, ha seguido siendo de gran utilidad en el diagnóstico de la Tuberculosis, pero su interpretación en niños aún es controversial.
Los puntos de cortes se han establecido de manera arbitraria y estos consideran el estado de vacunación por BCG, presencia de infección por VIH, estado nutricional y edad del niño. La mitad de los niños que recibieron la vacuna BCG, responden con una induración significativa al PPD.
En niños de alto riesgo, portadores de VIH, desnutridos o inmunodeprimidos se considera positiva una induración mayor o igual a 5mm; y en niños sin factores de riesgo la positividad se considera si la induración es igual o mayor a 10mm 9.
También se considera positivo un viraje del PPD en los últimos 2 años en aquellos con PPD <10mm que aumenta 6mm o más por sobre los 10mm. Y una reacción mayor o igual a 15mm (PPD hiperérgico) tiene altísimas posibilidades de ser secundario a infección por Tuberculosis 2.
Debe tenerse en cuenta la prevalencia de la enfermedad en un determinado lugar, puesto que ello determina el valor predictivo positivo; en lugares de alta prevalencia el VPP del PPD es alto. De todas formas, el resultado por si sólo de PPD no permite definir presencia de infección por Mycobacterium tuberculoso u otro no tuberculoso (no es capaz de distinguir entre los distintos Mycobacterium). Debe siempre interpretarse en el contexto de la historia clínica, existencia de contacto con personas enfermas, radiografías sugerentes. Pudiendo existir falsos negativos inmunodeprimidos, infecciones agudas como influenza, sarampión y también en infección tuberculosa grave 10. La interpretación del PPD, de acuerdo a últimos estudios, se vería afectada por la vacunación BCG en etapa de recién nacido, fundamentalmente hasta los 3 años de edad.
PRUEBAS DE LIBERACIÓN DE INTERFERÓN GAMALas pruebas de liberación de Interferón gama o IGRAS (Interferón–Gamma Release Assays) son inmunoensayos que detectan la producción de Interferón gamma por los linfocitos T (LT) sensibilizados frente a antígenos específicos del Mycobacterum Tuberculoso. Los métodos actualmente disponibles son el Quantiferón TB GOLD, que evalúa la respuesta a los antígenos ESAT-6, CFP-10 y TB7.7. Es una prueba ELISA y se considera positiva un valor mayor o igual a 0.35ui/ml y mayor al 25% del control negativo. Otro método disponible es el T-SPOT TB, el cual utiliza los antígenos ESAT-6 y CFP-10, midiendo el número de linfocitos T que producen Interferon Gamma frente a estos antígenos: utiliza la técnica ELISPOT (considerándose positivo un valor mayor o igual a 8). Diversos metaanálisis han demostrado que no existe una diferencia significativa en cuanto a sensibilidad y especificidad entre ambas pruebas.
Al compararlos con el PPD, los IGRAS tienen la ventaja de; no se ser afectado por el estado de vacunación de BCG, puesto que utilizan antígenos específicos de Micobacterium tuberculoso. Tienen una mayor especificada que puede ser de 89-100% en vacunados, en tanto la prueba de tuberculina puede tener una especificidad que varía entre 49-65%. En cuanto a la sensibilidad no existiría una diferencia significativa, siendo de 76-85% 11. A pesar de las ventajas siguen siendo exámenes que no permiten diferenciar entre infección latente o enfermedad tuberculosa 12. En los menores de 5 años y especialmente en los < de 3 años, las IGRAs, aunque van mejorando, tienen altos resultados indeterminados.
BACTERIOLOGÍALas baciloscopías requieren de un cantidad mínima de 5000 bacilos/ml. Se realizan en esputo en caso que el niño lo presente, también puede ser esputo inducido con solución hipertónica. Al menos 2 baciloscopías (BK) en 1 o más días. Se puede complementar con BK de contenido gástrico (tomadas temprano, ojalá antes que despierte el niño).
Si hay imágenes extensas pulmonares o con sospecha de conexión a bronquios, se puede intentar obtener por Broncoscopía.
El rendimiento incluso con fibrobroncocoscopia no supera al 30%, dadas las lesiones paucibacilares en los niños.
- -
Cultivos: requieren de un cantidad mínima de bacilos 10BK/ml para su positividad. Existen distintos medios de cultivos:
- -
Cultivos sólidos: Löwenstein-Jensen; estos demoran 3-6 semanas en hacerse positivo, y la Sensibilidad, 3 semanas más. Siempre se deben realizar para identificación y detección de resistencia.
- -
Cultivos líquidos: 1-3 semanas, fácil manipulación y permite lectura automatizada continua del crecimiento micobacteriano. Tienen mayor sensibilidad (88% vs 76%), pero no permiten diferenciar los distintos tipos de Micobacterium, por lo que requieren agregar un método de identificación 1–5.
Tienen una alta sensibilidad (96%) y especificidad (85-95%), pero SOLO en muestras BK+ (que es una situación rara en el niño); son capaces de detectar desde pocas copias de ácido nucleico, con gran rapidez y además pueden detectar micobacterias específicas y resistencia a drogas. Siendo una desventaja que pueden existir falso positivo en un 3-5% (TB inactiva, BK muertos), tienen un alto costo y no están disponibles en zonas de mayor prevalencia donde son más necesarias.
Actualmente se recomiendan: Line Probe assays (LPAs) - Xpert MTB/RIF assay.
Xpert MTB/RIF assay: completamente automatizado, demora 100 minutos.
Permite detección del Micobacterium tuberculoso y el gen de resistencia a rifampicina (RIF) con una sensibilidad de 98%.
La OMS ya en el año 2010: recomendó este test para aplicarlo incluso directamente en el esputo, permitiendo detectar resistencia a RIF.
Recomendó su uso en países con TBC endémica o con co-infección VIH y lo declaró piedra angular para el diagnóstico de TBC MDR. El mayor problema es que al igual que las otras técnicas de amplificación siguen siendo muy caras para amplias zonas del planeta.
OTRAS HERRAMIENTAS DIAGNÓSTICASADA: en líquido pleural – meníngeo
Se usa valor de corte para considerarlo positivo sobre 40U/lt.
Se ha revisado el rendimiento del ADA positivo mayor 40 en el contexto de un líquido pleural con predominio linfocitario y mejora el rendimiento diagnóstico 13.
BIOPSIA: se puede obtener de cualquier tejido (pulmonar, pleural, ganglio). El hallazgo en general es de proceso inflamatorio crónico granulomatoso, necrotizante y caseoso. Rara vez se encuentra Micobacterium14.
En Chile el Estudio y Tratamiento de la Tuberculosis, está garantizado por el Ministerio de Salud y es gratuito. La técnicas disponibles a nivel ministerial, incluyen PPD, baciloscopías, cultivo rápidos y lentos, técnicas moleculares de identificación y resistencia (incluido XpertMTB/RIF assay). Las técnicas IGRA, no están cubiertas por el programa ministerial.
TRATAMIENTOEn general la TBC pulmonar en el niño se trata según la extensión de lesiones y bacteriología. Se usan las mismas drogas que el adulto, adecuando por peso hasta los 30 – 40KG y hay 2 fases, una diaria de 50 dosis y luego una trisemanal de 48 dosis con menos drogas. Los esquemas son propuestos por la OMS y que son muy semejantes en todo el mundo.
TBC latente: se considera como tal el paciente con Clínica y radiología normal, pero con PPD+ (en Chile>10mm, salvo inmunodeprimidos >5mm). Se ha demostrado que hacer prevención en estos pacientes puede reducir la progresión a enfermedad hasta en 90%. Se usa una sola droga: HIN: 5mg/kg de lunes a domingo, vigilando cumplimiento y evolución del paciente 2,15.
CONCLUSIÓNLa enfermedad tuberculosa, a pesar de los esfuerzos mundiales por intentar erradicarla sigue siendo una patología presente en pleno siglo 21. Factores como la inmigración y el VIH han influido en la persistencia de las tasas sobre los parámetros considerados como en vías de erradicación (5 por 100000). En Chile, la tasa en los últimos 5 años se ha mantenido sin cambios significativos a pesar del esfuerzo y el objetivo de llegar al año 2020 bajo los 10 casos por 100000 no se podrá alcanzar. Teniendo en cuenta estos antecedentes epidemiológicos debe tenerse presente como diagnóstico diferencial en ciertos sindromes compatibles, buscarla activamente en niños en contacto con adultos enfermos o con factores de riesgo (inmunodeprimidos, portadores de VIH, drogadictos). A pesar del desarrollo de nuevas técnicas diagnósticas, lo principal sigue siendo la búsqueda activa de niños con enfermedad tuberculosa o tuberculosis latente, apoyándose con la clásica radiografía y PPD, los que siguen siendo elementos insustituibles en el proceso diagnóstico. Las nuevas técnicas como IGRAS y biología molecular a la fecha se consideran como elementos complementarios.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.