La pubertad es una de las etapas más importantes de la vida. Está definida como un periodo de transición donde el sujeto adquiere las características sexuales secundarias, y la capacidad reproductiva. Esto ocurre como consecuencia de la activación del eje Hipotálamo - pituitaria - gónada. El cambio de frecuencia de estimulación de la GnRH de los gonadotrofos es uno de los mecanismos involucrados en las diferencias de secreción de las gondotrofinas durante el ciclo ovulatorio. En este artículo se revisan los eventos que son normales en el período de la pubertad, en ambos sexos y las posibles patologías que se describen en este periodo.
Puberty is one of the most important milestones in life course. It is defined as a transition period where the subject acquires secondary sex characteristics and reproductive capacity. Occurs secondary to the activation of the Hypothalamic-Pituitary -Gonadal axis. A changing frequency of GnRH stimulation of the gonadotrope is one of the mechanisms involved in the differential gonadotropin secretion during ovulatory cycles. Herein, we review the normal pubertal events in both genders and abnormalities described in this period.
La pubertad es el período de transición comprendido entre la infancia y la adultez. Se caracteriza por la presencia de importantes cambios físicos, fisiológicos psicológicos y psicosociales. Sus principales cambios son la aparición de las características sexuales secundarias, la adquisición de la capacidad reproductiva y el alcance de la talla final (1).
Mecanismos neuroendocrinosLos cambios hormonales que dan origen a la pubertad son el resultado de cambios en el patrón de secreción de GnRH hipotalámico, que a su vez produce un aumento en el patrón de frecuencia y amplitud en la pulsatilidad de las gonadotropinas (LH y FSH) que a través de sus receptores, localizados en la gónada, aumentan la secreción de esteroides sexuales.
Estos cambios a nivel hipotalámico ocurren alrededor de los 7 años en las mujeres y 9 años en el varón. Los cambios iniciales ocurren principalmente durante el sueño nocturno.
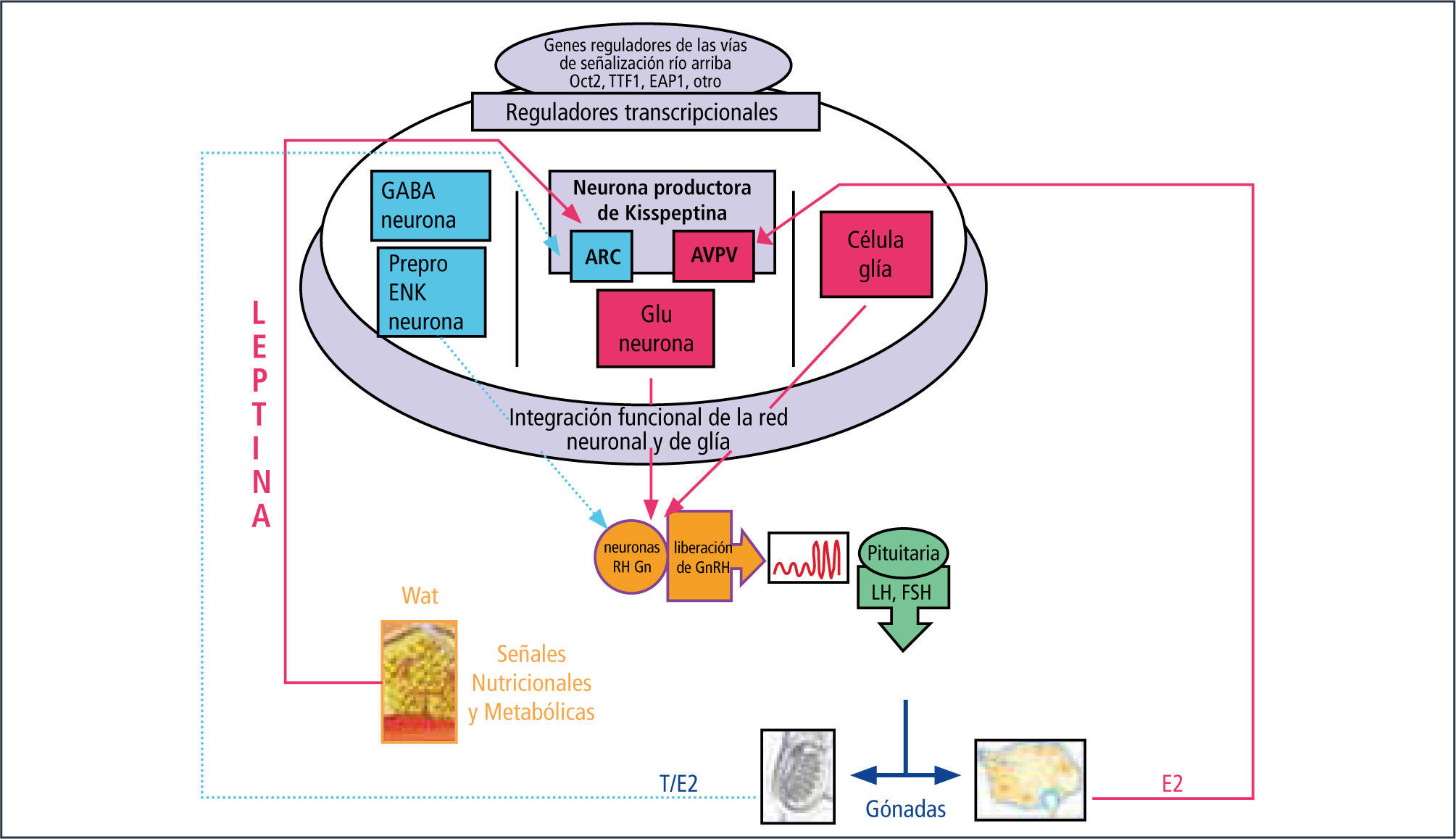
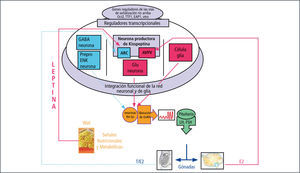
El GnRH es un decapéptido secretado por aproximadamente 1000 neuronas localizadas en el hipotálamo (núcleo arcuato y eminencia media). Es responsable de la secreción de gonadotrofinas a través del estímulo ejercido sobre la hipófisis, vía sistema portal. Se han identificado 2 tipos de neuronas: GnRH I, que se origina en el período embrionario y posee una secreción endógena en el período temprano del desarrollo. Posterior al nacimiento, esta secreción es inactivada por la presencia de hormonas sexuales circulantes, las que producen un feedback negativo. En el período puberal este “gonadostato” es activado, dando origen a la cascada del desarrollo puberal. GnRH II, no tiene actividad reconocida en los seres humanos (2).
El glutamato y el neuropéptido Kisspeptina y su receptor acoplado a proteína G (GPR54) son esenciales para el inicio de la activación de GnRH (3, 4). Las células de la glia facilitan la secreción de GnRH mediante factores de crecimiento TGF alfa e IGF-1 entre otros. Los efectos inhibitorios más importantes son los mediados por GABA y las neuronas opiáceas, los que disminuyen su acción al momento de activarse la pubertad (1).
Otro factor importante que ha sido descrito es la Leptina, la que induce la secreción de GnRH y gonadotrofinas a través de un mecanismo directo o indirecto, que abarca la participación de neuronas que controlan la actividad secretoria de las neuronas de GnRH. La leptina es un péptido de 16 KDa liberado por los adipocitos y su función es informar al hipo-tálamo, ejerciendo una función permisiva en la regulación del comienzo de la pubertad.
La acción de GnRH se traduce en el aumento de los niveles de FSH y LH, con la consecuente producción de esteroides sexuales a nivel ovárico en la mujer y testicular en el varón, (5) Figura 1.
En la mujer la FSH se une a receptores específicos en las células de la granulosa e induce maduración de los folículos ováricos para que produzcan estrógenos, y la LH, en conjunto con la FSH, conduce a la maduración de los folículos de Graaf y la formación del cuerpo lúteo.
Los andrógenos ováricos son aromatizados principalmente en las células del tejido adiposo y se transforman en el metabolito activo, el Estradiol, que circula unido a la SHBG hasta alcanzar su receptor nuclear para ejercer su acción.
El estradiol estimula el crecimiento mamario, uterino, la distribución del tejido adiposo y el crecimiento del cartílago epifisiario; además promueven el desarrollo de los caracteres sexuales secundarios, el engrasamiento de la mucosa vaginal y el adelgazamiento el moco cervical.
En el varón la LH se une a los receptores de las células de Leydig e induce un aumento de AMPc y a través de la activación de las enzimas 20-22 desmolasa, 17alfa hidroxilasa y 17,20 desmolasa, aumenta la síntesis y secreción de testosterona y en menor cantidad de and rotenediona, androstenediol, dihidrotestosterona y estradiol.
La FSH se une a los receptores de las células de Sértoli y estimula la síntesis y secreción de Inhibina y Hormona anti mulleriana (AMH), y aparentemente inicia la espermatogénesis. Para que ésta se produzca se requiere que la FSH actúe directamente en los túbulos espermatogénicos, así como la acción indirecta de LH que aumenta los niveles de testosterona. LH y FSH actúan sobre el testículo, induciendo aumento de volumen de los túbulos espermáticos y de las células de Leydig, estas últimas representan menos del 10% del volumen testicular. El estímulo de las células de Leydig se refleja por el aumento de la concentración sérica de testosterona y sobre los túbulos con el desarrollo de la espermatogénesis.
El inicio de la pubertad es precedido por la maduración de la zona reticulata de la corteza suprarrenal, desde los 6 a los 8 años de edad, lo que se denomina adrenarquia. El desarrollo de la zona reticular en conjunto con la mayor actividad enzimática 17,20 liasa y disminución de la actividad de la enzima 3 Beta esteroide deshidrogenasa produce el aumento de los andrógenos (DHEA y DHEA-S). Esta adrenarquia se caracteriza por la aparición de olor apocrino, en ocasiones acné, vello axilar y vello púbico.
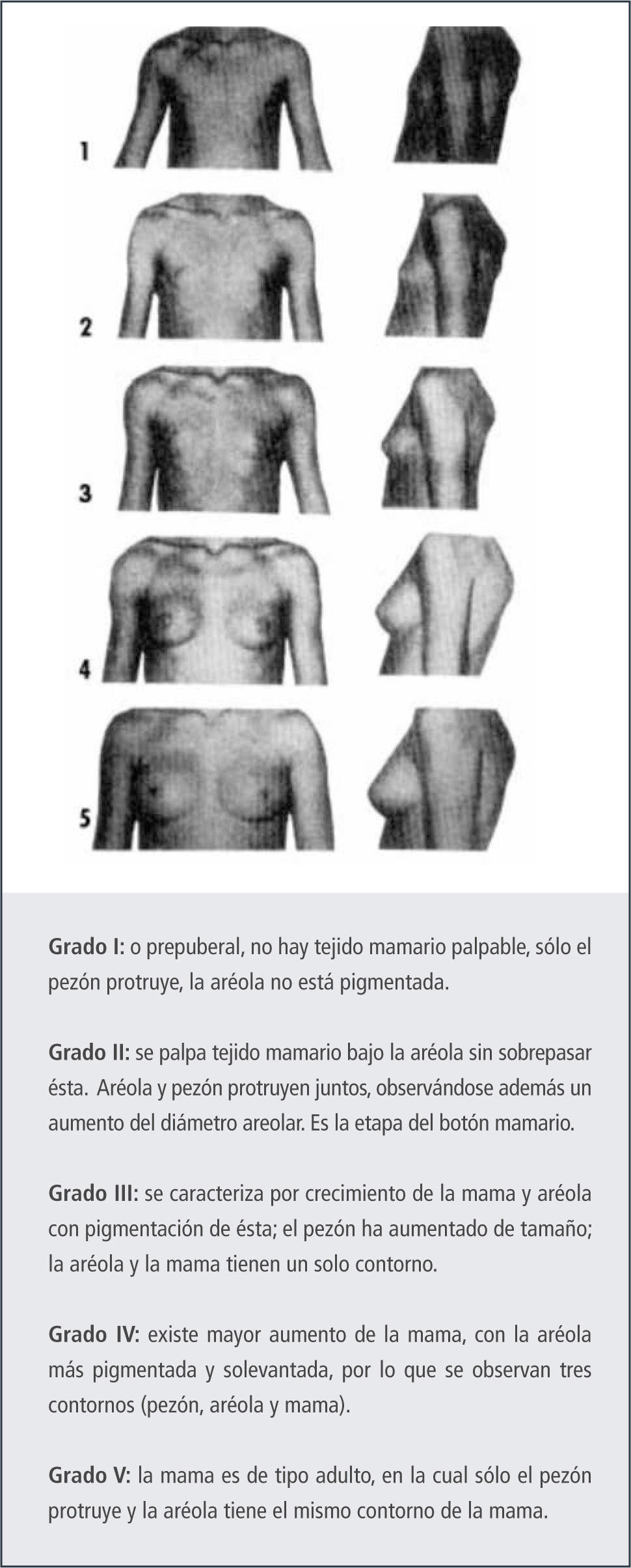
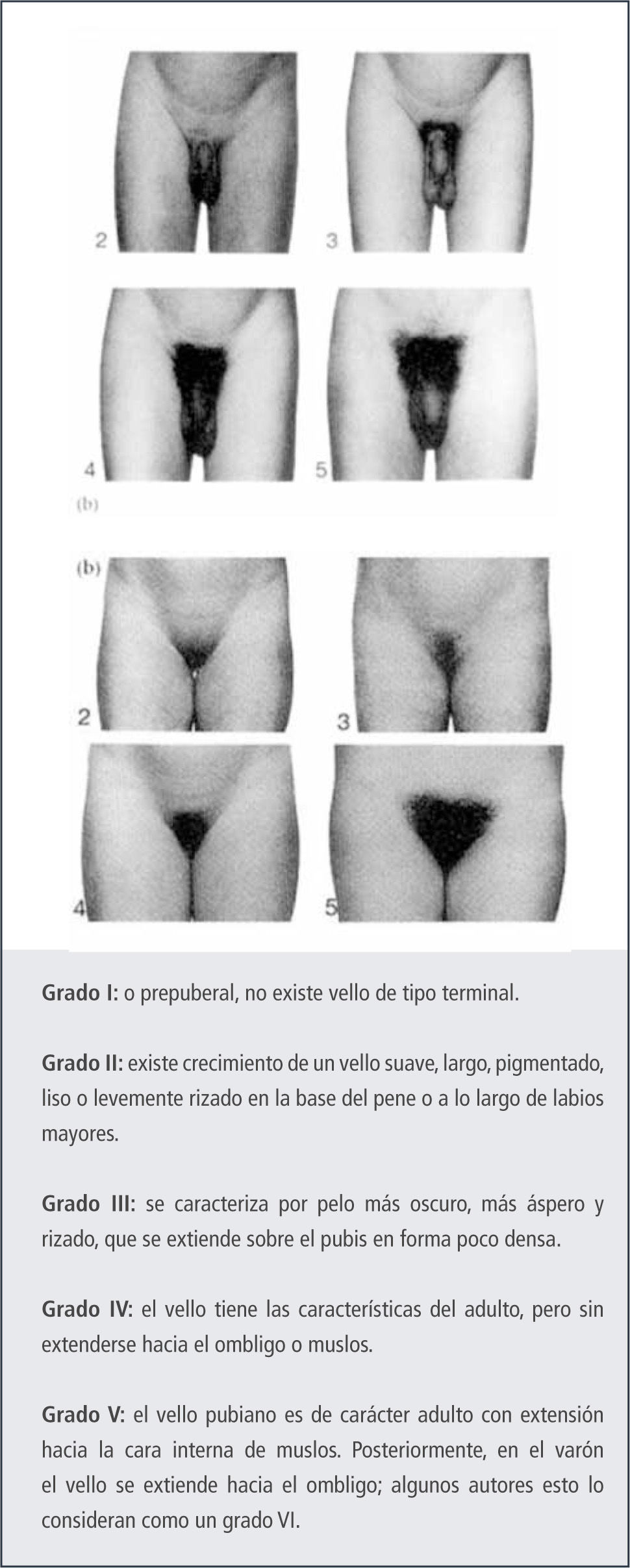
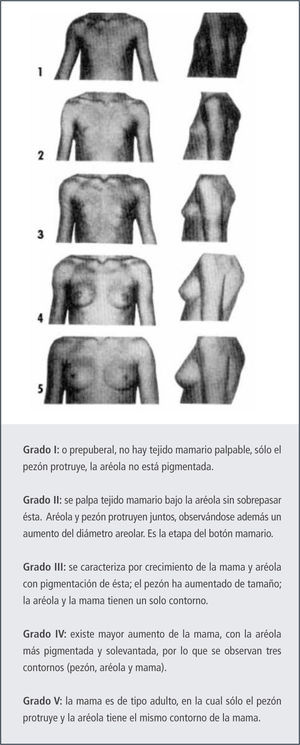
Secuencia de los eventos puberalesEn la niñaLa caracterización de los cambios puberales en la niña se ha basado en los grados de desarrollo de Tanner (6). Esta clasificación descrita en los años 60 fue realizada en niñas de un orfanato, de bajo nivel socioeconómico y por medio de la inspección. Sin embargo, los clínicos actuales deben realizarla por medio de la palpación, puesto que los altos índices de obesidad pueden llevar a un error en el grado de desarrollo mamario descrito.
La primera manifestación de la pubertad en la niña, en el 90% de los casos, es el crecimiento mamario, el que puede ser unilateral o bilateral, Figura 2.
Existe alrededor de un 10% en que el inicio del desarrollo puberal es con la aparición del vello púbico. En caso que el vello púbico progrese y no aparezca desarrollo mamario, debemos tener una conducta activa para descartar alteraciones del desarrollo puberal como veremos más adelante. El progreso del desarrollo en cada etapa descrita por Tanner es de alrededor de 6-8 meses.
Durante los últimos años se ha planteado que las edades de inicio normal del desarrollo, descritas por Tanner, podrían estar sufriendo un adelanto. Especialmente tomando en cuenta la forma en que se llevó a cabo el estudio de Tanner. Incluso la edad de la menarquia reportada por Tanner fue más tardía que la existente en niñas no institucionalizadas en el Londres de esa época.
En EE.UU. un estudio epidemiológico transversal analizó a 17.077 niñas de raza blanca y negra entre los 3 y 12 años que consultaron por control sano o por morbilidad. Las pacientes fueron evaluadas a través de inspección por pediatras y se determinó su estado Tanner mamario y vello pubiano. Estos autores demostraron que la edad promedio del inicio del desarrollo mamario fue de 9,9 años en niñas caucásicas y 8,8 años en afro-americanas. Estos datos fueron corroborados posteriormente por el estudio norteamericano NHANES III el que encontró en población americana presencia de mamas Tanner 2 en promedio a los 9,7 años.
En Chile, varios estudios también sugieren que la edad de la telarquia promedio se ha adelantado a una edad similar a las de las Afroamericanas del estudio Norteamericano. Sin embargo, no existen cambios en la edad promedio de menarquia (7).
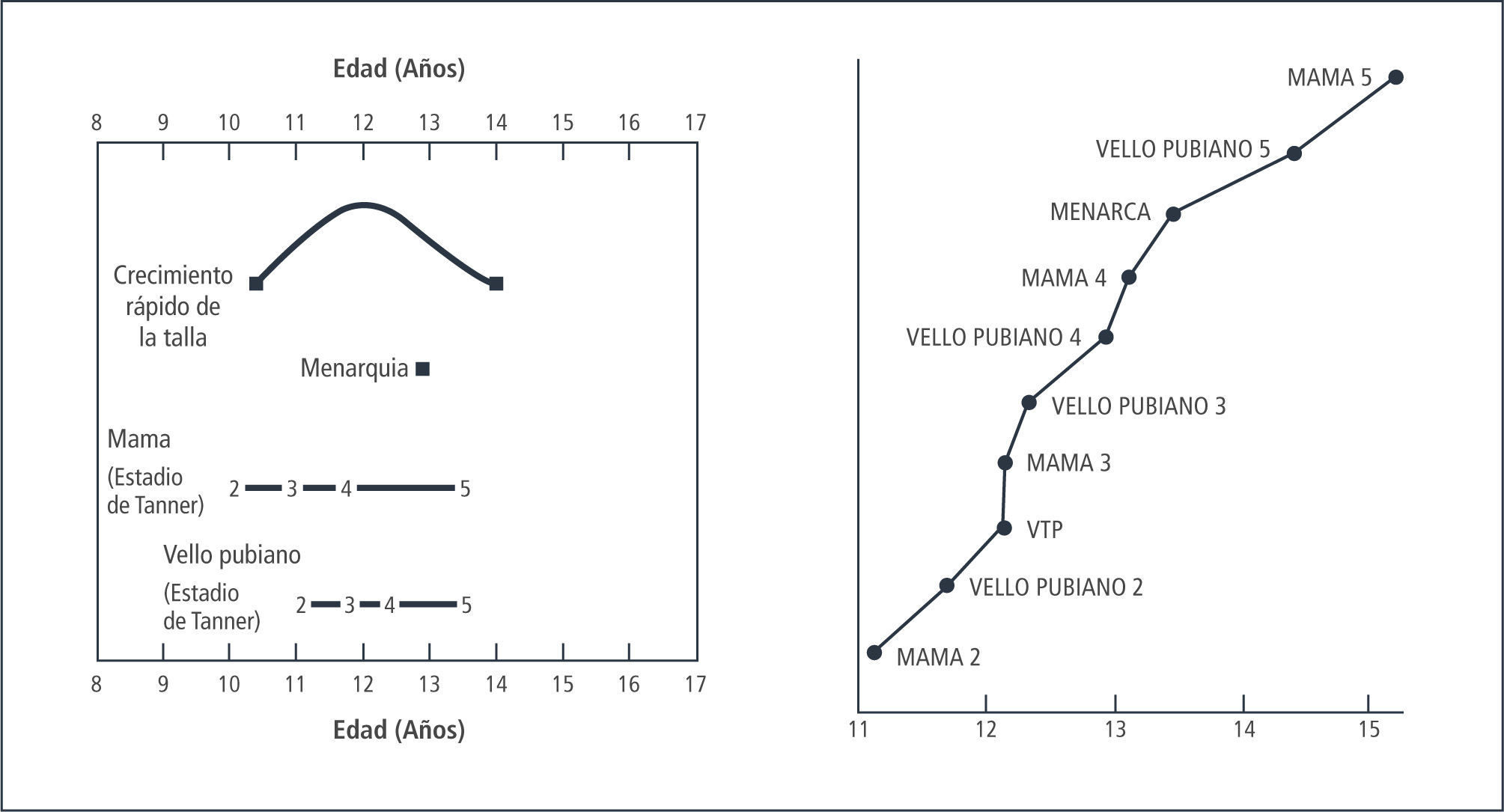
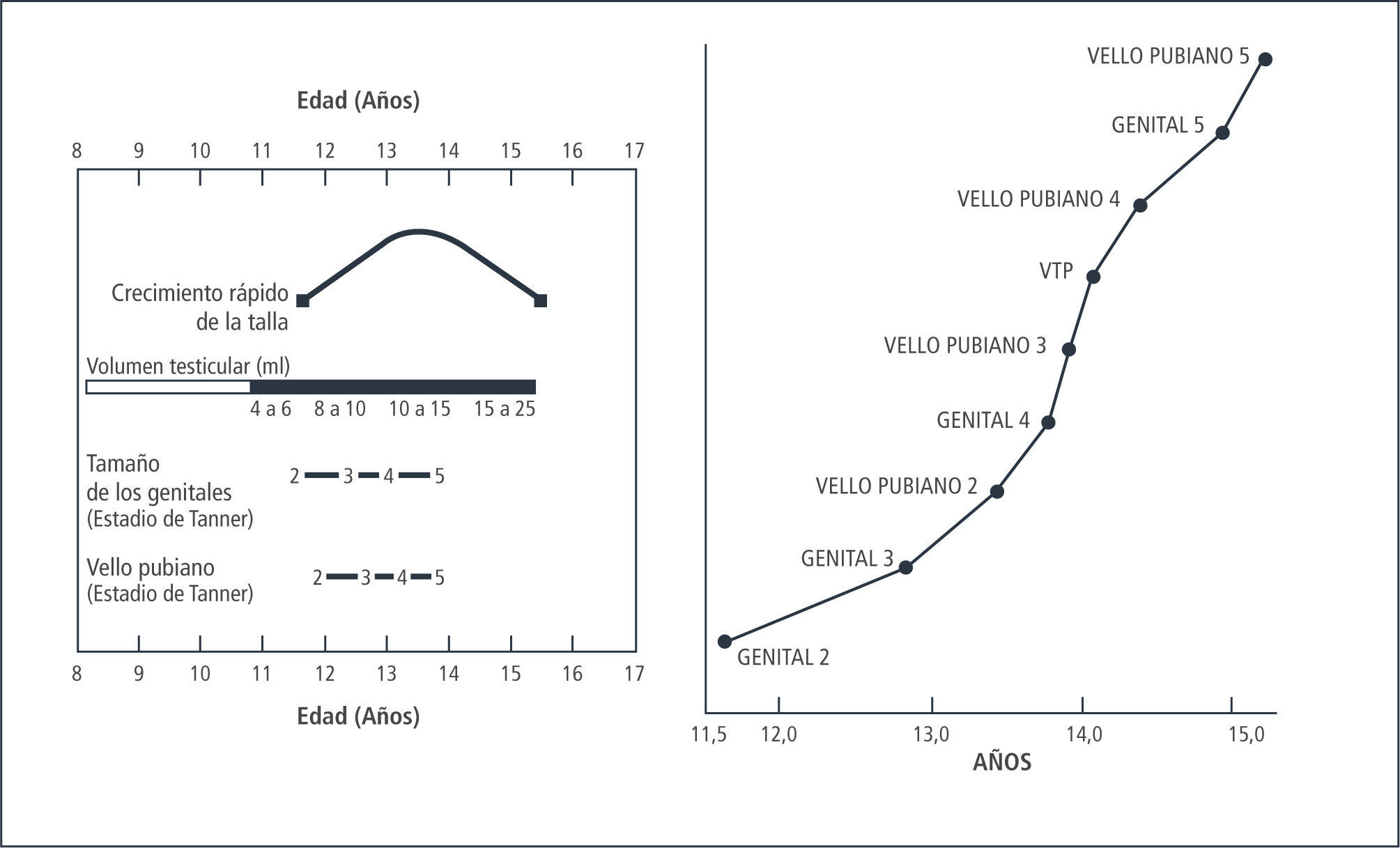
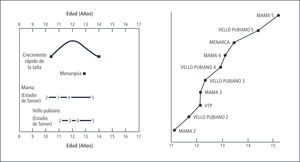
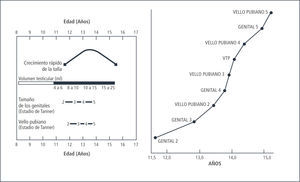
En conjunto con el desarrollo mamario (Tanner II), se produce el estirón puberal, el que alcanza su peak máximo en el desarrollo Tanner III, con una velocidad de crecimiento de alrededor de 9cms/año. El incremento de talla durante los tres años de máximo crecimiento es de 20-25cms, con un incremento global de un 20 a 25% de la talla inicial. Este cambio en el patrón de crecimiento se debe al efecto estrogénico sobre el hipotálamo, aumentando la producción de Hormona de Crecimiento. De esta forma aumentan tanto los niveles basales, como los peaks máximos en la secreción de esta hormona con el consecuente aumento de IGF-1 y su acción a nivel del cartílago de crecimiento (1).
En conjunto con el aumento en la talla, existe un aumento en la masa grasa, la que adquiere una distribución ginecoide, con el consecuente aumento de peso el que se manifiesta alrededor de 6 meses después que el peak de crecimiento. La masa grasa adquirida durante la pubertad es tres veces mayor en los estadios finales de Tanner que al inicio (8). Bajo la influencia de los esteroides sexuales y de la GH se produce un incremento en el contenido mineral óseo y en la masa muscular. Durante la pubertad se adquiere alrededor del 45% del contenido mineral óseo. En la regulación del proceso de mineralización de la matriz ósea están involucrados importantes factores genéticos y hormonales, dentro de los cuales cabe destacar la acción de los metabolitos de la Vitamina D, la parathormona (PTH) y la calcitonina, que en su conjunto regulan el metabolismo fosfocálcico. Los estrógenos de forma directa o a través de la aromatización de la testosterona son responsables del efecto permisivo de la ganancia ósea, estimulando la acción osteoblástica para un adecuado desarrollo de la matriz ósea y regulando la acción resortiva de los osteoclastos a través de la inhibición de RANKL y estimulación de la osteoprotegerina (9).
En cuanto a la maduración ósea, el inicio de la pubertad suele coincidir con una edad de entre los 10,5 a 11 años y la menarquia en torno a los 12,6 años.
Las proporciones corporales cambian, el crecimiento de las extremidades inferiores es más rápido que el de la vértebras y la relación segmento superior/inferior es menor a 1.
A nivel de los genitales internos, los ovarios a partir de los 9 años muestran un crecimiento acelerado, son ovalados y lisos. Existe aumento del estroma ovárico y de los folículos (5-7mm). Este aumento es progresivo desde 2ml en el inicio de la pubertad (Tanner II) hasta alcanzar el tamaño ovárico adulto. El patrón ecográfico es multiquístico, en la adolescencia, y se evidencian por lo menos 6 folículos mayores de 4mm. El útero aumenta lenta y progresivamente de tamaño a partir de los 9 años por estímulo estrogénico, tiene forma y tamaño constante: en gota, sin ángulo entre cuerpo y cuello, con el cuerpo corto y relación cuerpo/cuello 1:2. El cuerpo cambia su morfología y posición. Se desarrolla el miometrio y aumenta el tamaño del cuerpo de 1 a 1,5cm al año para mantener una relación 2:1; adquiere forma de pera invertida y sus dimensiones aumentan hasta alcanzar una longitud de 75mm y un volumen de 20ml en la mujer adulta (10). El desarrollo progresivo del endometrio ocasiona una línea de ecodensidad más alta en el centro del útero.
A nivel de los genitales externos, la vulva cambia aspecto aumentando su grosor por el acúmulo de grasa a nivel del monte de Venus. Así mismo los labios mayores y menores aumentan de tamaño. La vagina crece longitudinalmente, la mucosa vaginal es más gruesa, húmeda y de tonalidad mate, el himen se engruesa y también existe un leve aumento del clitoris. Al activarse las glándulas de Bartolino se produce una secreción vaginal blanquecina fisiológica (8,10).
La menarquia es, normalmente, el último evento del desarrollo puberal. Se presenta en 1 año y medio a 2 años posterior al inicio del desarrollo mamario (Tll), poco después de haber alcanzado el máximo peak de crecimiento. Posterior a ella la talla aumenta entre 5 a 8cms, tanto cuanto más precoz sea su aparición.
Se ha observado un leve adelanto de la edad de la menarquia en las niñas de colegios públicos, pero éste ha sido de mucho menor magnitud que el adelantamiento de la telarquia. El aumento del peso es un factor determinante en la presencia de menarquia temprana en algunas niñas, por lo cual es fundamental el manejo del peso, para evitar este riesgo de la obesidad infantil (11).
Habitualmente los ciclos siguientes serán anovulatorios, por lo cual la menstruación puede ser irregular durante los 2 primeros años posteriores a la menarquia. En caso que la menarquia ocurra antes de los 12 años los ciclos ovulatorios son aproximadamente 50% en el primer año; si es más tardía puede demorarse hasta alrededor de 10 años en que sean completamente ovulatorios. Los ciclos iniciales pueden durar entre 21 y 45 días y luego se van acortando. Al tercer año postmenarquia entre 60-80% de las niñas tiene ciclos de entre 21 y 35 días. El ciclo con periodicidad de adulto se establece aproximadamente a los 6 años post menarquia (12), Figura 3.
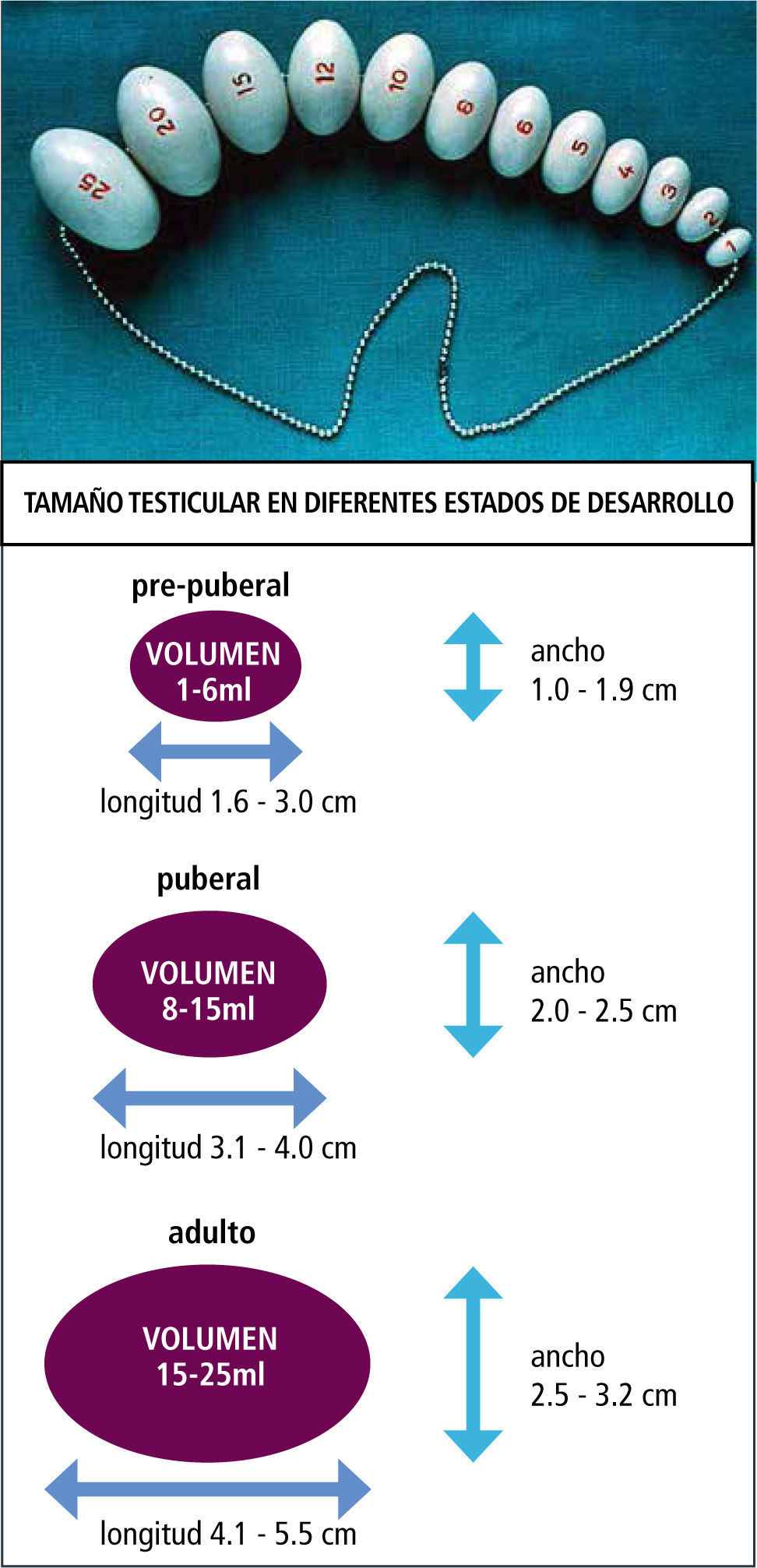
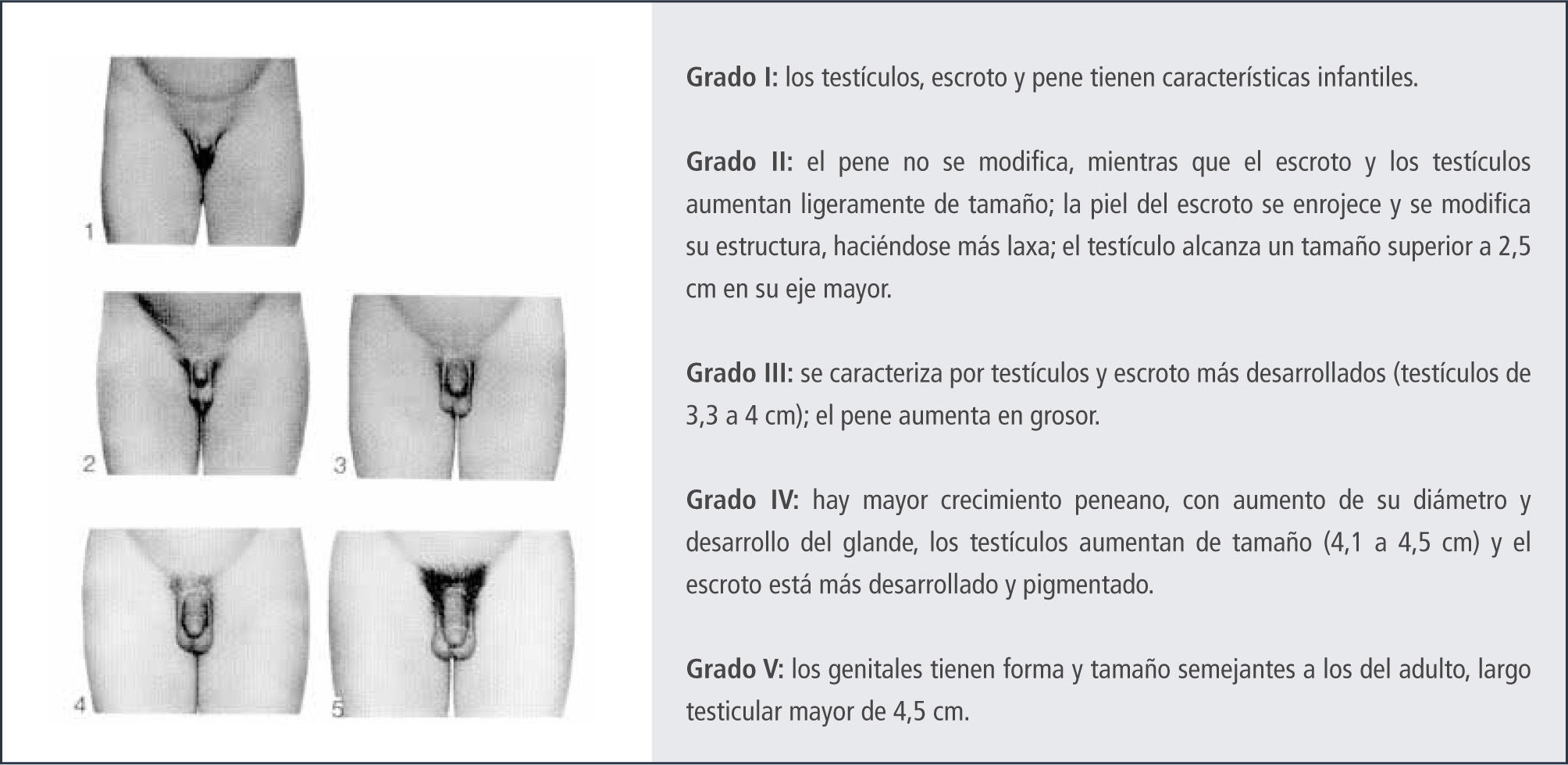
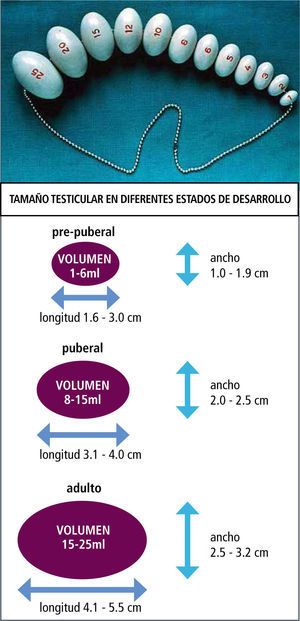
En el varónEl primer signo de desarrollo puberal en el varón, es el crecimiento testicular (4ml) como resultado del desarrollo de los tubos seminíferos. En conjunto se produce el cambio escrotal, en el que la piel escrotal se hace más rugosa y de color rojizo oscuro. Estos cambios se deben al aumento en los niveles de testosterona (95% testicular y 5% adrenal).
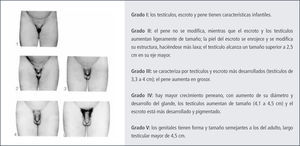
La edad de comienzo es sobre los 9 años, con una edad promedio de 12 años. La evaluación clínica se realiza por comparación con el orqui-dómetro de Prader, Figura 4. En conjunto con el aumento del volumen testicular se desarrolla la próstata y las vesículas seminales, Figura 5 y 6.
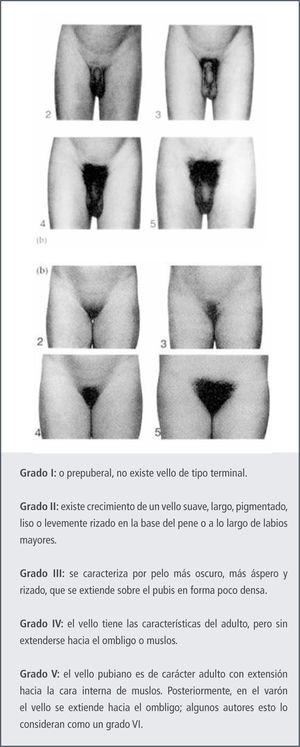
Posterior a las primeras manifestaciones de desarrollo puberal, le sigue la aparición del vello púbico y el crecimiento peneano, el que comienza a desarrollarse entre los 12 a 18 meses después del crecimiento testicular, primero en longitud y después en grosor. El crecimiento del vello axilar aparece 2 años después de aparecer el vello púbico y va seguido del vello facial.
En el varón el inicio puberal normal coincide con una edad ósea de alrededor 12 a 13 años y la aparición del hueso sesamoideo del carpo suele coincidir con esta etapa.
El estirón puberal se inicia en el estadio III, coincidiendo con el crecimiento longitudinal del pene, alcanzando la velocidad máxima de 10±2cms, con un incremento de la talla de 25cms en total.
Los cambios de voz aparecen generalmente en la fase avanzada del desarrollo genital. También aumenta la vellosidad en zonas como la cara anterior y posterior de tórax, pectoral y a nivel lumbosacro. El bigote aparece tres años después de iniciada la fase acelerada y final de la pubertad.
En la pubertad también aumenta el tamaño areolar de la mama masculina y en casi un 75% de los niños, también lo hace el tejido mamario subyacente. La ginecomastia puberal generalmente coincide con etapa III de Tanner y desaparece habitualmente en menos de 1 año. En caso de persistir, la mama se fibrosa y puede requerir terapia quirúrgica. En cuanto a la espermarquia, la primera polución suele aparecer alrededor de los 13 años, con un volumen testicular de alrededor de 12cc, Figura 7.
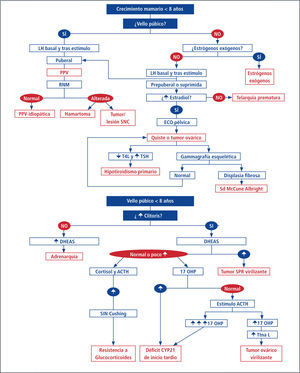
Variantes normales del desarrollo puberalPubarquia PrecozSe define como la aparición de vello púbico, antes de los 8 años en la niña y 9 años en el varón, sin otros signos de desarrollo puberal ni de virilización (13,14). Existe una variabilidad racial, considerándose dentro del rango normal de inicio en Norteamérica en pacientes de raza blanca después de los 7 años mientras que en afroamericanos se considera normal después de los 6 años (15, 16). Se puede acompañar o no de vello axilar, olor apocrino y/o acné. Puede coincidir con un aumento en la velocidad de crecimiento y de la edad ósea en forma transitoria, no significativo, que no compromete la talla final (17, 18).
La etiología es desconocida, en algunos casos se atribuye a la maduración exagerada de la zona reticular de la corteza adrenal, incrementando los niveles androgénicos a valores similares medidos en la pubertad temprana. También se ha propuesto que exista una hipersensibilidad del folículo piloso a los andrógenos. La pubarquia precoz es una condición frecuente en niños y en la mayoría de los casos es una condición benigna. En un estudio reciente realizado en Chile, un 26% de los pacientes de la muestra fue diagnosticado con alguna patología (Pubertad Precoz Central o Hiperplasia Suprarrenal Congénita no Clásica), que requirió terapia y seguimiento para evitar un impacto negativo en su evolución. Estos resultados sugieren que se realice una mínima evaluación no invasiva por especialista, en todos los niños con PP (19) para descartar patología subyacente (20).
Estudios recientes muestran una mayor incidencia de sobrepeso/obesidad y alteraciones metabólicas en estas niñas (21, 22, 23).
El seguimiento a largo plazo de estos pacientes nos permitirá confirmar si existe asociación entre la PP con la disminución de la sensibilidad a la insulina, síndrome metabólico y/o desarrollo de hiperandrogenismo ovárico.
Se recomienda su seguimiento y control para evaluar su progresión. En los casos asociados a sobrepeso los cambios en estilo de vida son fundamentales para evitar progresión (24).
Telarquia PrematuraSe define como la aparición temprana del desarrollo mamario sin la presencia de otros signos de maduración sexual. No hay adelantamiento de la edad ósea ni aumento en la velocidad de crecimiento, ni aumento del volumen ovárico. Es muy frecuente en los primeros 2 años de vida y su frecuencia ha sido reportada hasta un 36,6%. Aunque su etiología es desconocida, algunos autores han planteado un aumento de la sensibilidad a los estrógenos circulantes y también se ha visto que tienen niveles más elevados de estradiol medido por técnicas ultrasensibles no disponibles en la práctica clínica (25). La secreción transitoria de estrógenos por los folículos ováricos, el aumento de los estrógenos de origen suprarrenal y la activación transitoria del eje hipotálamo-hipófisis gonadal con aumento de la secreción de FSH; también pueden ser causa de la telarquia prematura (26, 27).
Es importante sospechar la posibilidad de que sea una manifestación de producción ovárica autónoma de estradiol como en casos de síndrome de McCune-Albrigth. En estos casos el estudio de la presencia de mutación de la proteína G podría orientar a confirmar el diagnóstico aunque su negatividad no lo descarta (28).
En la anamnesis, se debe pesquizar la presencia de los llamados “disruptores endocrinos” o de contaminantes ambientales como el consumo de soya, exposición a derivados de lavanda o cremas con fitoestrogenos que serían posibles causantes de la telarquia (29).
En su mayoría la evolución es a la resolución espontánea, con un desarrollo puberal posterior normal, aunque podría haber mayor incidencia de pubertad precoz que en la población normal.
Retraso Constitucional de la PubertadEste se define como el retraso del inicio en el desarrollo puberal en adolescentes sanos. Tienen talla baja para la edad cronológica, pero adecuada para la edad ósea y el desarrollo puberal, los que están retrasados de la misma forma. Es más frecuente en varones con una relación 10:1 y el antecedente familiar es la clave. Sin embargo, algunos de estas familias poseen mutaciones en genes claves para el desarrollo/síntesis y/o secreción de gonadotrofinas que en algunos miembros se manifiesta como RC y en otros hipogonadismo franco (30). La talla alcanzada va de acuerdo a la carga genética, aunque en un alto porcentaje de casos quedan 3-5cm menos (31). Las bajas concentraciones de esteroides, transitoria, no parece afectar la densidad mineral ósea en forma significativa (32).
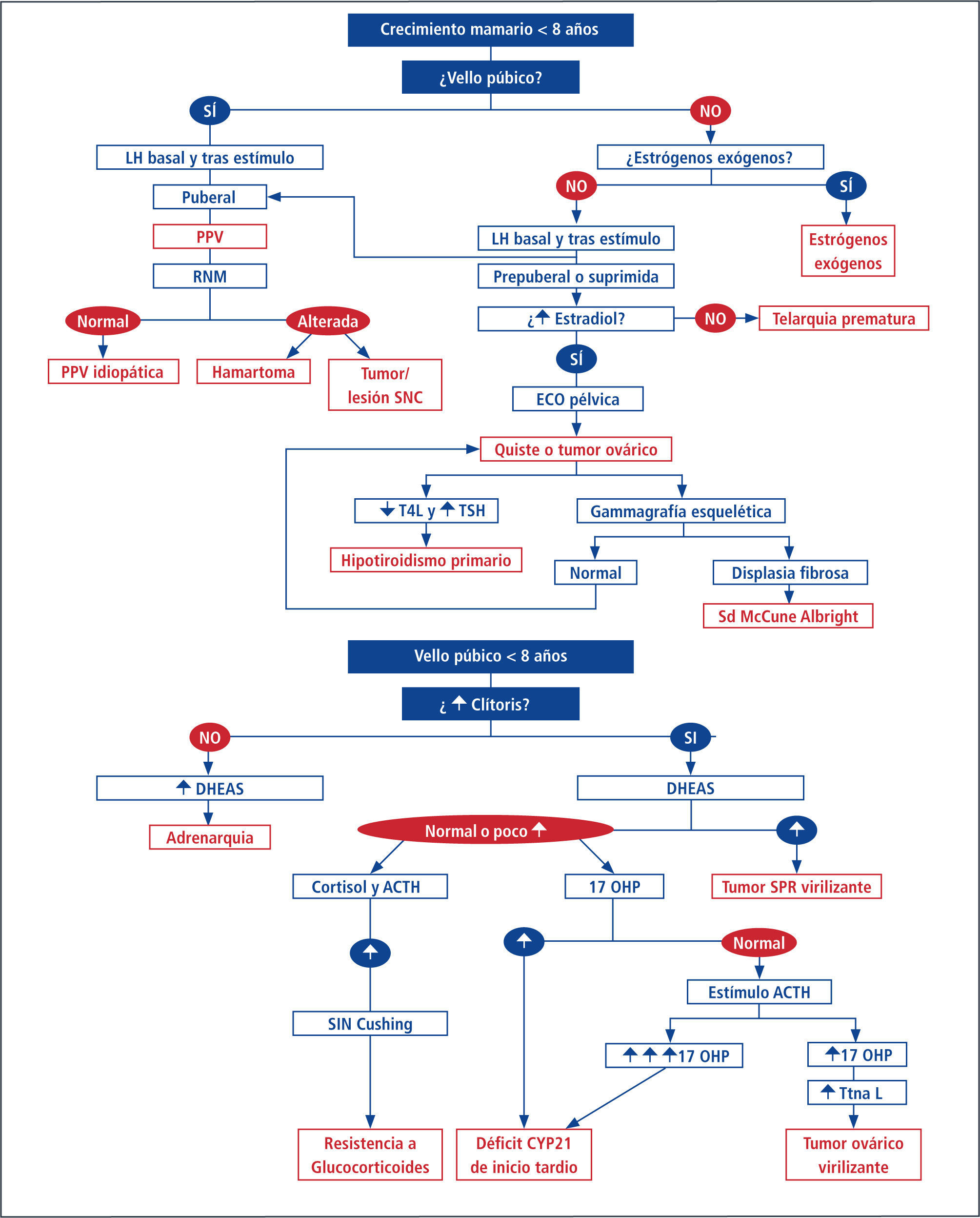
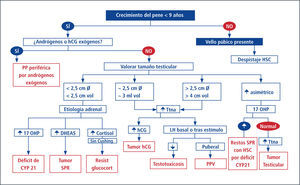
Alteraciones de la pubertadPubertad PrecozSe define en la niña como la aparición del botón mamario antes de los 8 años y en el varón aumento del volumen testicular antes de los 9 años (Esquema 1). Dado los últimos antecedentes de edad de inicio de telarquia, algunos autores han modificado la definición a niñas menores a los 7 años (Caucásicas) y menores a 6 (Afroamericanas) (33), y entre los 7-8 hablaríamos de pubertad temprana. Creemos que aún con los datos actuales no hay aun estudios con un número suficiente de pacientes que avalen estos últimos conceptos en nuestra población (34). Cabe recordar que en los varones con patología de SNC es más frecuente la aparición de Pubertad Precoz Central.
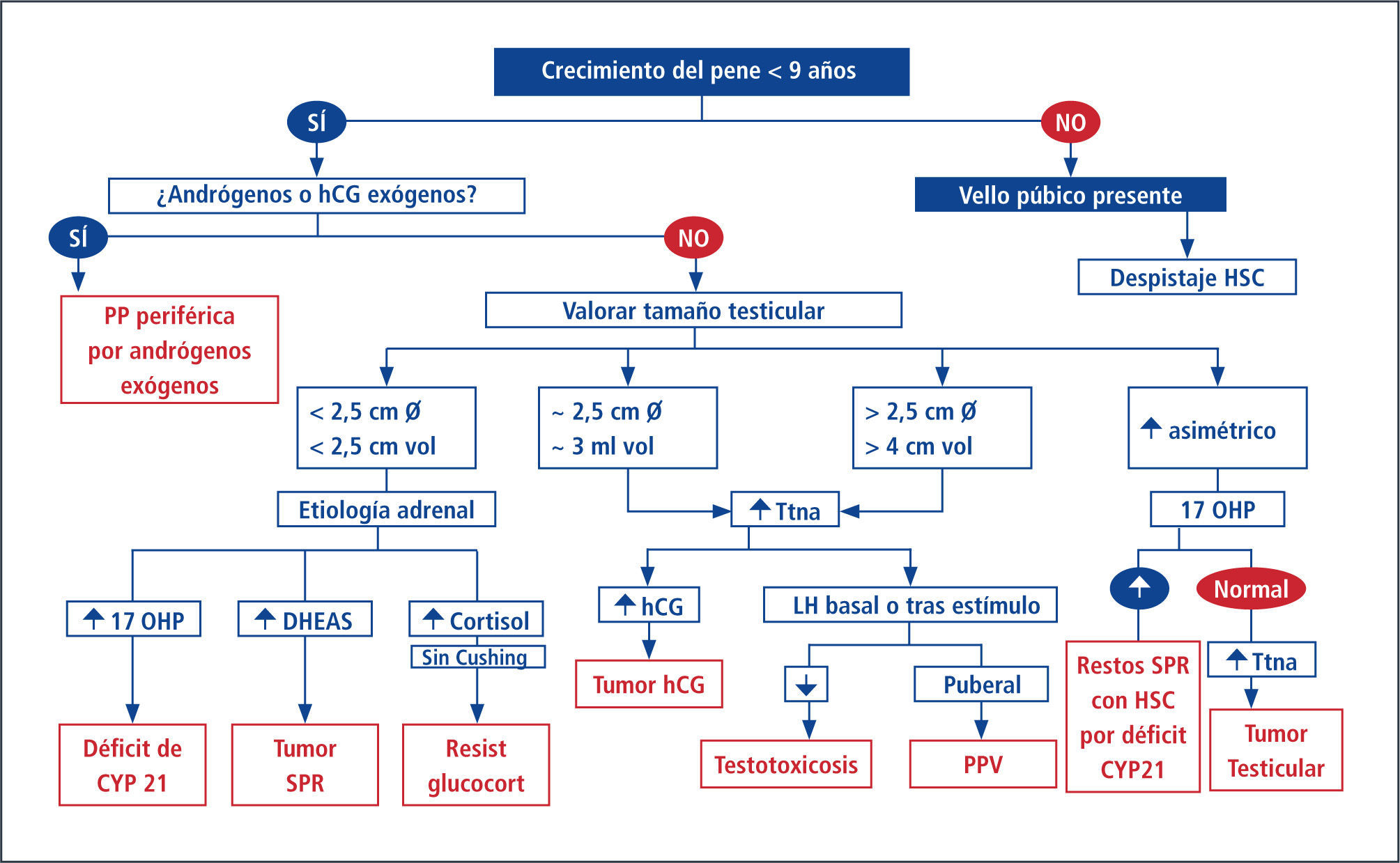
Dentro de la clasificación de Pubertad Precoz se divide en la Pubertad Precoz Central (PPC) y la Pubertad Precoz Periférica (PPP). La primera se caracteriza por cursar con activación del eje hipotálamo hipófisis gonadal y la aparición armónica de los caracteres sexuales secundarios, similar a la cronología de la pubertad normal pero más temprana. En cuanto a la segunda, no existe inicialmente activación del eje HHG aunque puede ocurrir más tarde en forma secundaria al aumento de estrógenos periféricos.
En estos casos existe un aumento de estrógenos ovárico (como por ejemplo Síndrome de McCune Albrigth o tumores) o de otro órgano (tumores productores de estrógenos suprarenales u hepáticos) o bien exógenos, con la aparición de los caracteres sexuales de forma disarmónica, incluso pudiendo ocurrir como primera manifestación de pubertad la menarquia (15, 35). El paciente debe ser referido al especialista (en-docrinólogo infantil) para completar el estudio que incluye imágenes del SNC y discutir el beneficio de los tratamientos disponibles (Esquema 2).
Pubertad RetrasadaSe define como la ausencia de caracteres sexuales secundarios a los 14 años en el varón y a los 13 años en las niñas (36, 37).
También cabe dentro de esta definición la progresión de los caracteres sexuales secundarios que no alcanzan el estadio final en el tiempo normal: ausencia de la menarquia 5 años después de la aparición del botón mamario y en el niño la falta del desarrollo genital también 5 años posterior al aumento del volumen testicular (Tanner II) (19).
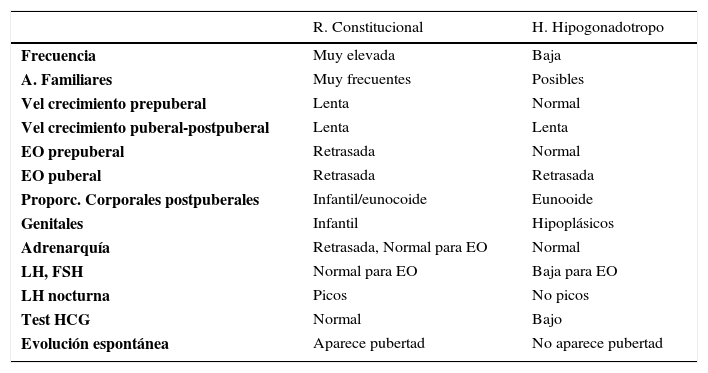
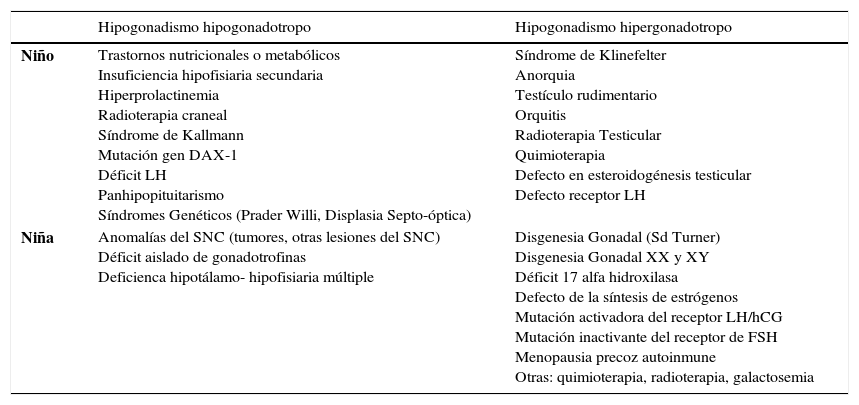
Puede corresponder a un extremo de los retrasos constitucionales o a Hipogonadismo. Estos cuadros se clasifican en hipogonadotrofos o hipergonadotrofos, Tabla 1 y 2.
Diagnóstico diferencial
| R. Constitucional | H. Hipogonadotropo | |
|---|---|---|
| Frecuencia | Muy elevada | Baja |
| A. Familiares | Muy frecuentes | Posibles |
| Vel crecimiento prepuberal | Lenta | Normal |
| Vel crecimiento puberal-postpuberal | Lenta | Lenta |
| EO prepuberal | Retrasada | Normal |
| EO puberal | Retrasada | Retrasada |
| Proporc. Corporales postpuberales | Infantil/eunocoide | Eunooide |
| Genitales | Infantil | Hipoplásicos |
| Adrenarquía | Retrasada, Normal para EO | Normal |
| LH, FSH | Normal para EO | Baja para EO |
| LH nocturna | Picos | No picos |
| Test HCG | Normal | Bajo |
| Evolución espontánea | Aparece pubertad | No aparece pubertad |
| Hipogonadismo hipogonadotropo | Hipogonadismo hipergonadotropo | |
|---|---|---|
| Niño | Trastornos nutricionales o metabólicos Insuficiencia hipofisiaria secundaria Hiperprolactinemia Radioterapia craneal Síndrome de Kallmann Mutación gen DAX-1 Déficit LH Panhipopituitarismo Síndromes Genéticos (Prader Willi, Displasia Septo-óptica) | Síndrome de Klinefelter Anorquia Testículo rudimentario Orquitis Radioterapia Testicular Quimioterapia Defecto en esteroidogénesis testicular Defecto receptor LH |
| Niña | Anomalías del SNC (tumores, otras lesiones del SNC) Déficit aislado de gonadotrofinas Deficienca hipotálamo- hipofisiaria múltiple | Disgenesia Gonadal (Sd Turner) Disgenesia Gonadal XX y XY Déficit 17 alfa hidroxilasa Defecto de la síntesis de estrógenos Mutación activadora del receptor LH/hCG Mutación inactivante del receptor de FSH Menopausia precoz autoinmune Otras: quimioterapia, radioterapia, galactosemia |
El estudio se debe realizar dirigido a lo obtenido en la historia clínica, considerando los antecedentes familiares y los hallazgos al examen físico.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.