En la última década se ha producido un incremento sustancial en el conocimiento de las bases genéticas de las cardiomiopatías, en consideración a lo cual las Sociedades Americanas y Europea de Cardiología, han propuesto una nueva clasificación con el fin de incluir tales aspectos.
Aunque se carece de datos precisos, aproximadamente el 30% de los pacientes con miocardiopatías referidos para pruebas genéticas presentan una variante genética patogénica. En la herencia de la miocardiopatía dilatada familiar, la modalidad predominante es la autosómica dominante, siendo mucho menos frecuentes las ligadas al cromosoma X, la herencia autosómica recesiva y la mitocondrial. A su vez, pruebas provenientes de ensayos clínicos y experimentales indican que la infección, la inflamación y el sistema inmunológico están de alguna manera interrelacionados en los mecanismos patogénicos implicados en la miocardiopatía dilatada.
No hay duda que en un futuro próximo las mejoras en la secuenciación de genes y el mayor conocimiento de la patogenia influirán decididamente en el diagnóstico, evaluación y tratamiento de esta entidad.
In the last time, a substantial increase in the knowledge of the genetic basis of cardiomyopathy has occurred. Therefore in the last decade the American Heart Association, the American College of Cardiology and the European Society of Cardiology have proposed a new revision of the classification of cardiomyopathies in order to include the genetic basis on the etiology.
Although precise data are lacking, approximately 30% of patients currently referred for clinical genetic testing will be found to have a pathogenic genetic variant. The predominant mode of inheritance for familial dilated cardiomyopathy is autosomal dominant, with X linked autosomal recessive and mitochondrial inheritance being less frequent. Evidence from experimental and clinical trials indicates that infection, inflammation and the immune system are in some way interrelated on the pathogenic mechanisms involved in the dilated cardiomyopathy.
There is no doubt that in the future, improvements in sequencing genes and insight into pathogenesis will influence the diagnosis, evaluation and management of familial dilated cardiomyopathy.
Las miocardiopatías son un grupo de enfermedades que afectan primariamente al músculo cardíaco y no son el resultado de patologías congénitas, valvulopatías adquiridas, cardiopatía hipertensiva, enfermedad coronaria o enfermedad pericárdica.
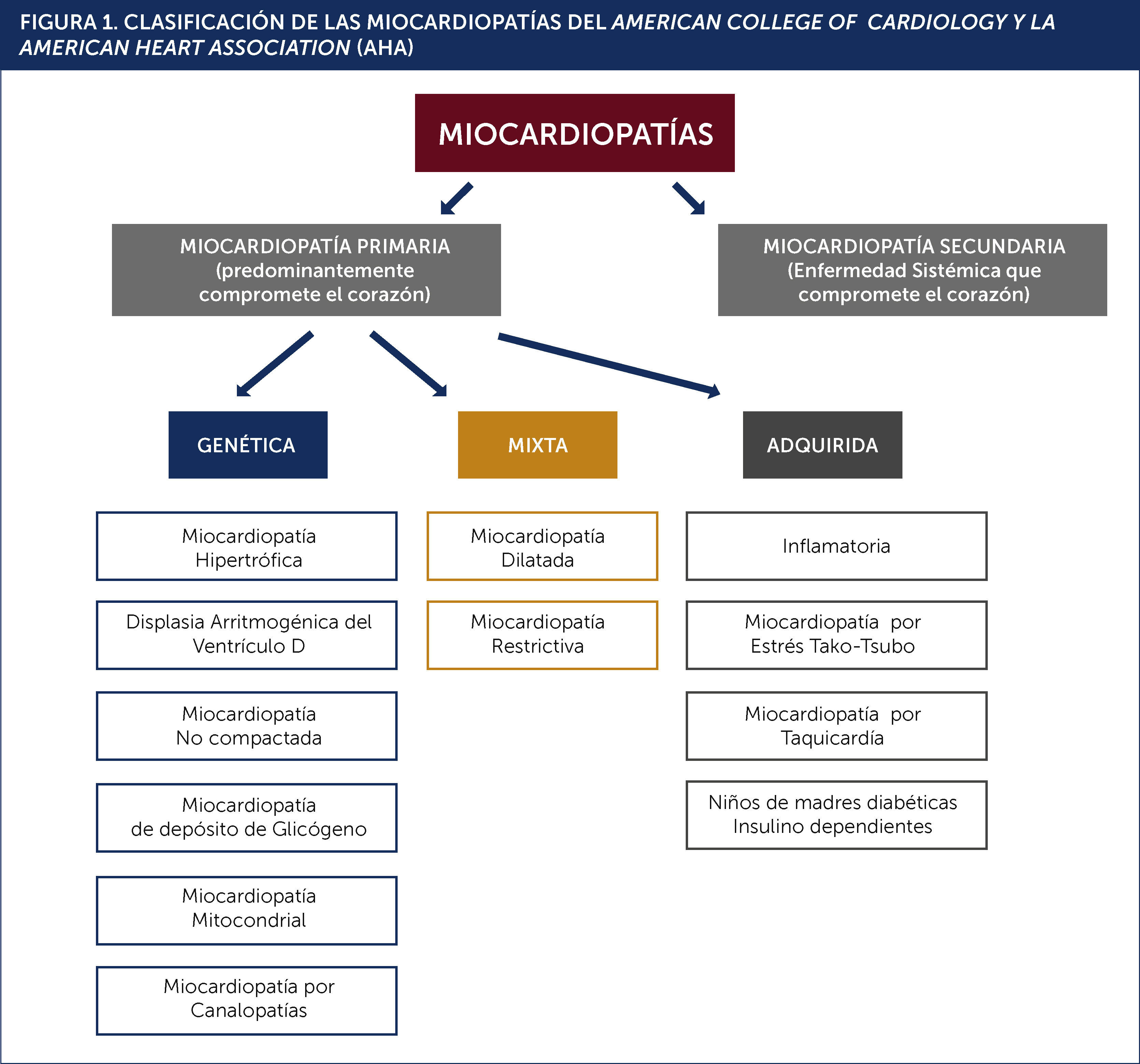
CLASIFICACIONESEn el último tiempo se ha producido un incremento significativo en el conocimiento de las bases genéticas de las miocardiopatías. Al mismo tiempo, la caracterización no invasiva fenotípica también ha presentado un avance sustancial. En consideración a lo expuesto en la última década la American Heart Association (AHA) junto al American College of Cardiology (ACC) efectuaron una actualización de la clasificación de los trastornos miocardiopático (Figura 1). En esta nueva clasificación se postuló que las miocardiopatías corresponden a un grupo heterogéneo de enfermedades miocárdicas asociadas a una disfunción mecánica y/o eléctrica que se pueden acompañar de dilatación o hipertrofia ventricular, con un rol predominante de la condición genética. Para ello se partió de la etiología basada en la genética seguida por la descripción fenotípica del compromiso miocardio1.
La orientación inicial las divide en:
- 1.
Genéticas
- 2.
Adquiridas
- 3.
Mixtas
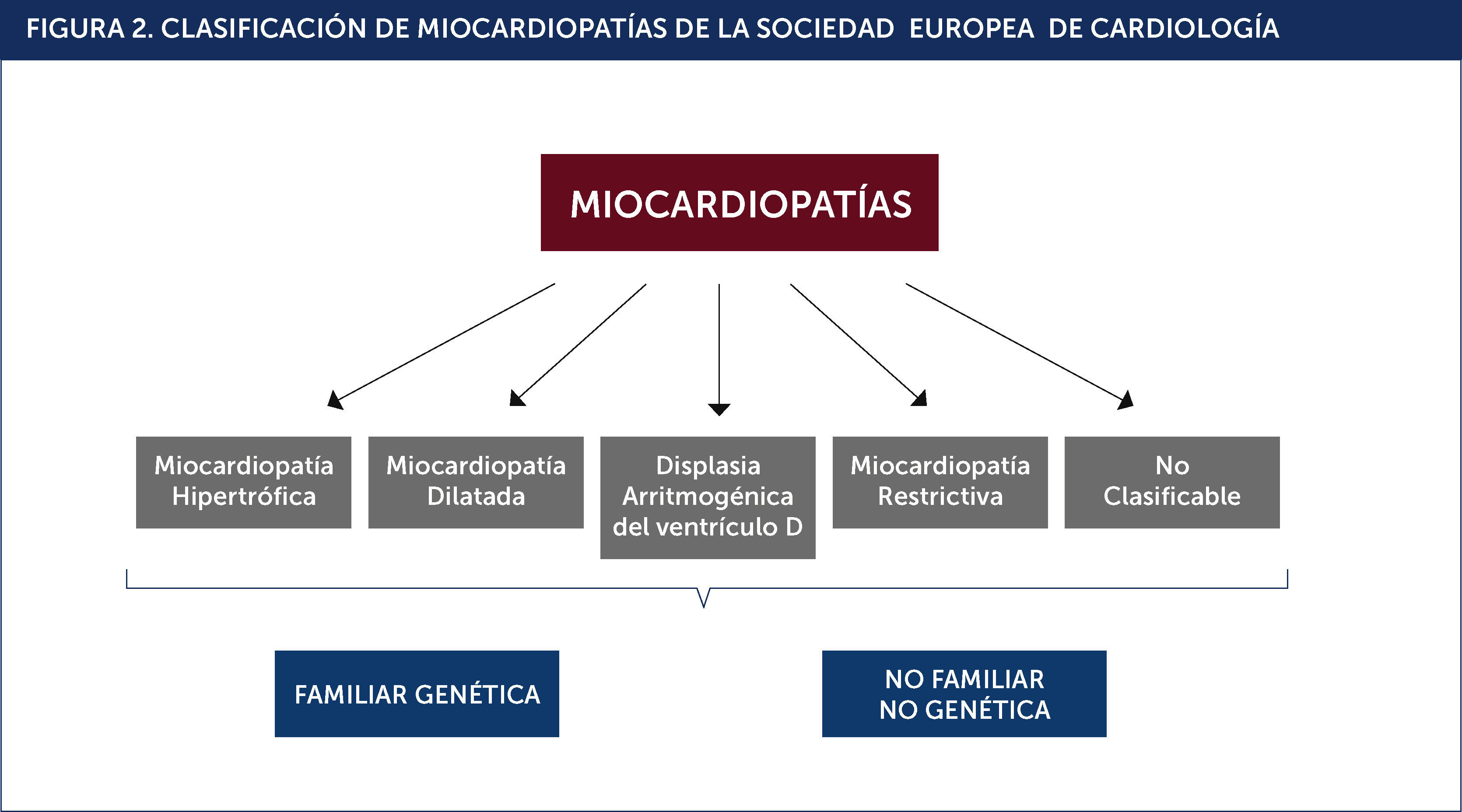
Por su parte, la Sociedad Europea de Cardiología consideró, en el año 2008, que el fenotipo morfofuncional continúa siendo la base en el manejo clínico de las miocardiopatias. Por lo tanto, éste debería mantenerse como el eje central de toda nueva clasificación de miocardiopatías y la condición genética debería incorporarse en segundo orden2.
NUEVA CLASIFICACIÓN EUROPEA DE MIOCARDIOPATÍAS (FIGURA 2):Otra diferencia importante entre estas dos clasificaciones es que la europea no considera a las alteraciones eléctricas secundarias a canalopatias como miocardiopatías. Esto se fundamenta en que los genes que codifican los canales iónicos cardíacos no siempre resultan en una expresión fenotípica morfofuncional. Figura 2
Es una realidad que en el estudio clínico de las miocardiopatías, las pruebas genéticas son cada vez más solicitadas; sin embargo, éstas presentan una gran heterogeneidad como consecuencia de lo cual las miocardiopatías asociadas a mutaciones de genes diferentes han recibido una gran variedad de nombres. Este nuevo problema hizo necesario incorporar una nomenclatura actualizada.
Para resolver esta situación se creó el sistema de nosología MOGES propuesta recientemente y aprobada por la Federación Mundial de Cardiología. En esta nomenclatura se informa el fenotipo clínico, el compromiso de otros órganos aparte del corazón y el genotipo con su modo de herencia3:
(M) = Morfofuncional Fenotipo
(O)= Órganos participantes
(G)= Patrón de herencia genética incluyendo el defecto genético
(E) = Connotación etiológica o enfermedad/sustrato subyacente
(S) = El estado funcional de la enfermedad mediante la etapa de American College of Cardiology/American Heart Association y la clase funcional de la New York Heart Association.
Patogenia de Miocardiopatía Dilatada:a) Patogenia genéticaExiste cada vez más evidencia de que un alto porcentaje de las miocardiopatías dilatadas son determinadas por una condición genética. Se han identificado más de 40 genes productores de miocardiopatía4. Las miocardiopatías dilatadas familiares son heredadas por un mecanismo autosómico dominante que en la mayoría de los casos presenta sólo el compromiso miocárdico. Las modalidades ligadas al cromosoma X, autosómicas recesivas y formas mitocondriales son escasas y frecuentemente están asociadas a miopatías esqueléticas.
La miocardiopatía dilatada de etiología genética se puede presentar a cualquier edad, pero preferentemente aparecen en la adolescencia o en adultos jóvenes. La expresión clínica puede ser muy variable; a modo de ejemplo, en una misma familia una proporción va a desarrollar insuficiencia cardíaca refractaria en la niñez y otros sobrevivirán hasta una edad adulta avanzada con síntomas mínimos5-7.
Los defectos genéticos pueden ser causas primarias de miocardiopatías dilatadas, o actuar favoreciendo la interacción entre el agente agresor, el anfitrión y el ambiente. Se ha postulado que en los cuadros de miocarditis la exposición a virus conduce a miocardiopatía dilatada, preferentemente en las sub poblaciones de individuos con predisposición genética. Esta predisposición puede ser de importancia fundamental en la historia natural de la miocardiopatía dilatada.
Los genes implicados en causar miocardiopatía dilatada codifican componentes del sarcómero, citoesqueleto (proteínas Z-disco), envoltura nuclear y sarcolema. Además de estos elementos estructurales, también se han identificado mutaciones en genes importantes en el ciclo del calcio, transcripción y post transcripción de RNA como así también en el transporte de proteínas8,9.
Es particularmente interesante que mutaciones de genes como el MYBPC3 pueden estar asociados a diferentes fenotipos tales como miocardiopatía hipertrófica, restrictiva o dilatada en tanto que mutaciones de genes como el DYS pueden causar un fenotipo único, generando solo miocardiopatía dilatada10.
La utilización de test genéticos en las miocardiopatías dilatadas ha ido aumentando progresivamente en los países más desarrollados; sin embargo, su alto costo y ausencia de modificaciones sustanciales en la conducta terapéutica han limitado su amplia aceptación. Es importante destacar que un test genético negativo en un paciente índice no significa que no posea una enfermedad genética, solo permite afirmar que con los test disponibles a la fecha no se encontró una causal genética.
El mayor rendimiento de los exámenes genéticos se da cuando en un caso índice se encuentran una o más mutaciones capaces de generar un fenotipo miocardiopático, esto debido a las implicancias que puede tener en el manejo de hermanos y descendencia. El identificar estas mutaciones en los familiares directos es más rápido y económico que examinar un panel completo de posibles genes alterados y su vez permite eliminar la necesidad de realizar un screening continuo en aquellos familiares que no presentan la mutación. El encontrar la mutación del caso índice en un familiar directo no determina enfermedad y su interpretación dependerá del conocimiento que se tenga de la penetrancia y expresividad de la variante encontrada.
Existe gran expectación de que en un futuro próximo la caracterización genética en la miocardiopatía familiar no sólo va a permitir identificar a sujetos susceptibles de éstas patologías, sino que también impulsará la implementación de terapias preventivas que limiten el desarrollo de dilatación ventricular, insuficiencia cardíaca y arritmias.
B) Patogenia inflamatoria – inmunológicaLa miocarditis viral y post viral representan la mayoría de las causas de miocardiopatía dilatada aguda y crónica. Estudios epidemiológicos y moleculares desarrollados en Europa y Estados Unidos han identificado que en la década de 1950 e inicio de la década de los 1990 los brotes de miocarditis se relacionaron con virus Coxsackie B. A fines del decenio de los 90 el espectro de virus en biopsias endomiocárdicas pasó a adenovirus y en los últimos cinco años los virus más frecuentemente relacionados con miocarditis han sido el Parvovirus B19 y el Herpesvirus 611,12.
Otros virus que se han relacionado con compromiso miocárdico son el Epstein Barr, Citomegalovirus y el Virus de la inmuno deficiencia adquirida (VIH). En el caso del VIH, su compromiso cardíaco es mediado por daño directo en la contractilidad del miocito y también por la presencia de co infecciones o reacciones adversas a medicamentos13.
Además de las etiologias virales otras causas que deben plantearse, particularmente en Sudamérica, es la infección por el parásito Trypanosoma cruzi (enfermedad de Chagas). Esta se presenta como una carditis o miocardiopatía dilatada. Entre sus manifestaciones se encuentra el bloqueo completo de rama derecha, aneurismas apicales y alteraciones en la motilidad segmentaria14.
Otra enfermedad parasitaria a considerar es la enfermedad de Lyme provocada por la Borrelia burgdorferi, ésta debuta frecuentemente con alteraciones en la conducción atrio ventricular15.
La mayoría de la evidencia sobre la patogenia del compromiso miocárdico secundario a virus o procesos autoinmunes proviene de estudios realizados in vitro en animales16.
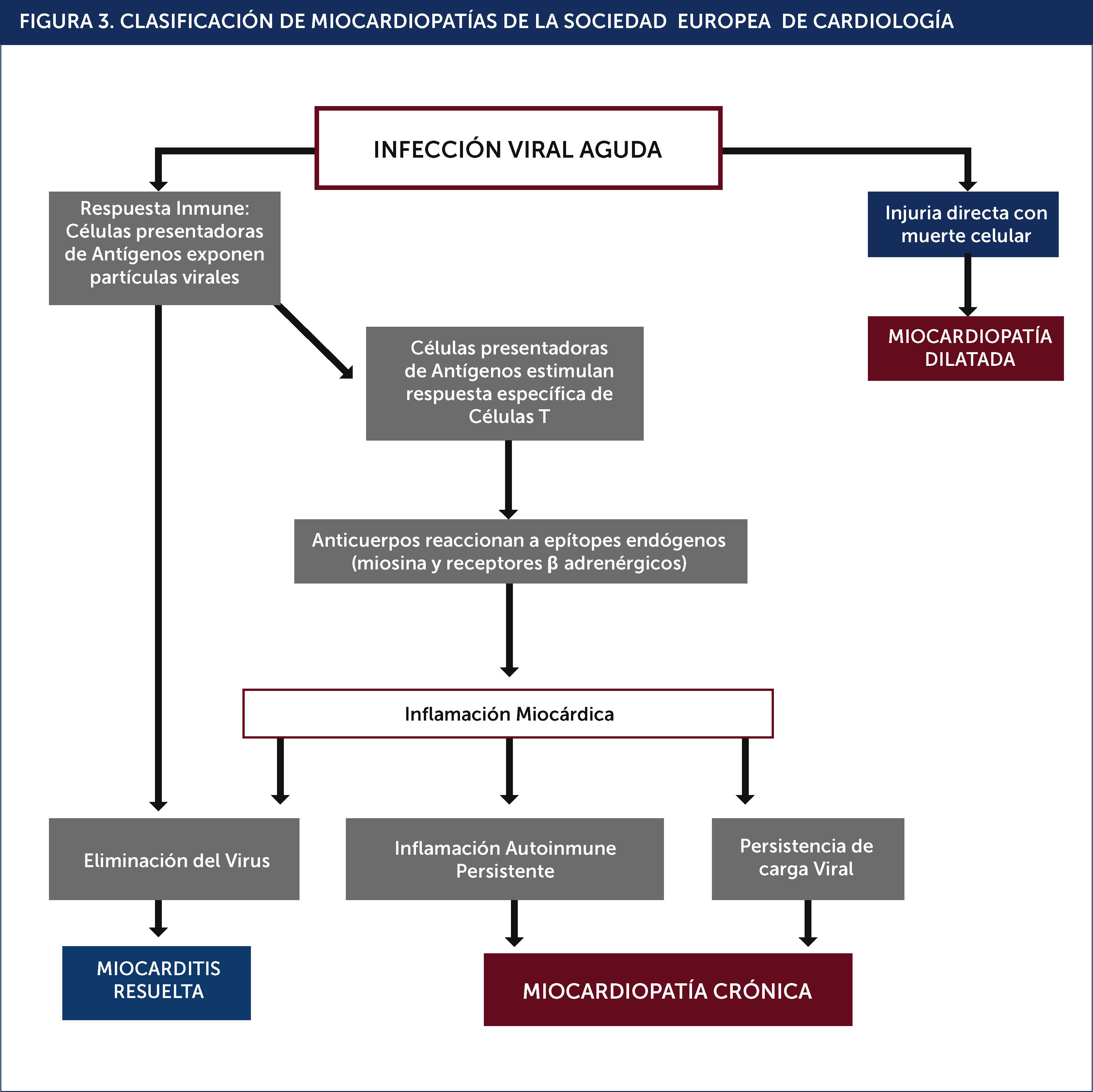
Se sabe que los virus penetran en los cardiomiocitos a través de receptores y correceptores específicos, produciendo su injuria inicial. La miocarditis causada por virus depende de señales estimulantes influenciadas por la inflamación, por lo tanto, la inflamación y replicación del virus están atrapados en un círculo sinérgico. La activación de proteínas pro inflamatorias, como por ejemplo la p38 MAP quinasa, Akt, son necesarias para la replicación exitosa del virus en la célula huésped; de este modo, un ambiente altamente inflamatorio y reactivo, al intentar limpiar la invasión, paradójicamente fomentará la replicación del virus17.
Durante la infección viral la respuesta inmune es fundamental para la defensa precoz. Los virus y también la proteína M del Streptococo, desencadenan una respuesta inmune que estimula la producción de células presentadoras de antígenos con la consecuente liberación de citoquinas18 (Figura 3).
En este fenómeno se producen altos niveles de linfocitos T Helper tipo 1 y 2, los que estarían involucrados en el daño de miocitos post cuadro infeccioso. No todas las células T son pro inflamatorias. Las células T reguladoras (Treg) actúan para moderar la fuerza de una respuesta y prevenir la autoinmunidad.
La participación de un proceso de autoinmunidad post infección se ha visto confirmada por el hallazgo de autoanticuerpos dirigidos a una variedad de sustratos cardíacos, generando la hipótesis de “infección inmune”19,20.
Esta condición de autoinmunidad se produce por que, al menos los casos del virus Coxsackie B y Proteina M del Streptococo, comparten epítopes iguales a los de la miosina cardíaca (un antígeno intracelular). Debido a la similitud antigénica se produce un fenómeno de autoinmunidad contra el miocito. También se han encontrado anticuerpos a miosina cardíaca con una reacción cruzada a receptores adrenérgicos B. Estos anticuerpos gatillan muerte celular cardíaca por apoptosis21.
Debido a la evidencia creciente de una participación inmunológica en algunos tipos de miocardiopatía dilatada crónica, se han empezado a desarrollar terapias basadas en inmunosupresión. En este sentido Frustaci y cols22 randomizaron a 85 pacientes con miocardiopatía crónica sin evidencia de genomas virales miocárdicos y sin respuesta a la terapia convencional. Se trató a una rama con inmunosupresión basada en prednisona y azatioprina y se comparó con un grupo tratado con terapia tradicional. A los seis meses el grupo tratado con inmunosupresión mostró una mejoría significativa en la fracción de eyección asociada a una disminución significativa en las dimensiones y volúmenes ventriculares izquierdos.
En consideración a este y otros estudios, el grupo de trabajo de miocardiopatía y enfermedades pericárdicas de la Sociedad de Europea de Cardiología, el año 2013, planteó que la inmunosupresión puede considerarse como terapia, en forma individual, en miocarditis linfocítica refractaria a la terapia estándar. Los pacientes no deben tener ninguna contraindicación a la inmunosupresión, lo cual implica descartar de manera absoluta un cuadro infeccioso en la biopsia endomiocárdica.
SÍNTESISSe puede afirmar que en la miocardiopatía dilatada el conocimiento creciente de la estrecha interrelación de componentes genéticos, infecciosos, inflamatorios y del sistema inmune genera grandes expectativas en su próxima implementación en la prevención, tratamiento precoz e individualizado de esta patología.
El autor declara no tener conflictos de interés, en relación a este artículo.