Las demencias constituyen un problema severo de salud a nivel mundial, y describen una gran cantidad de síntomas. Se caracterizan por un deterioro cognitivo adquirido irreversible que afecta principalmente, pero no exclusivamente, la memoria. Además, afecta especialmente a las personas mayores, pero no constituye una consecuencia normal del envejecimiento. Existen múltiples técnicas imagenológicas que apoyan el diagnóstico, que están en etapa de investigación o que se utilizan actualmente en el aspecto clínico. Protocolos estándar de imágenes de resonancia magnética, escalas de evaluación visual de la atrofia, técnicas de volumetría cerebral, paradigmas de resonancia magnética funcional, técnicas de conectividad funcional de reposo, SPECT y PET son las técnicas que se comentarán en este artículo.
Dementias correspond to a severe worldwide health problem, and it involves many symptoms. Dementias are characterized by an irreversible cognitive decline that affects mainly, but not exclusively, the memory. Dementias mainly affects elderly people, but it is not a normal consequence of aging. There are multiple imaging techniques that support the diagnosis of dementias: some are in clinical use, and other are research techniques. Magnetic resonance imaging standard protocols, visual assessment scales atrophy, cerebral volumetry techniques, fMRI paradigms, resting state functional connectivity, SPECT and PET are the techniques discussed in this article.
Las demencias constituyen un problema severo de salud pública a nivel mundial, proyectándose como el grupo de enfermedades con mayor impacto en términos de prevalencia y gasto del presupuesto. Actualmente 46,8 millones de personas en el mundo están viviendo con demencia1, lo que se proyecta a 131,5 millones para el año 2050. La mayoría de estas personas recibe un diagnóstico tardío2, lo que genera un retardo del inicio de tratamiento.
La característica que define las demencias es un deterioro cognitivo adquirido irreversible, que afecta habitualmente -aunque no exclusivamente- dominios de memoria, con consecuencias en las actividades de vida diaria. Un conjunto de patologías de distinto origen y con distintos mecanismos fisiopatológicos pueden llevar al desarrollo de demencia. En este sentido, la demencia constituye un estadio final común de un grupo de noxas que confluyen en un daño neuronal que supera los mecanismos de defensa y compensación funcional y estructural del sistema nervioso.
Dentro de las patologías que llevan a la generación de demencia se encuentran mecanismos de tipo reversible y de tipo irreversible. Dentro de las primeras se encuentran causas como infecciones, procesos autoinmunes, tumores, o hidrocefalia. El segundo grupo está constituido principalmente por enfermedades neurodegenerativas. Cada uno de los mecanismos de daño que conducen al desarrollo de demencia poseen un perfil de lesión funcional, anatómica y temporal distinto, lo que genera manifestaciones particulares en las imágenes. Esto tiene implicancias directas en el tipo de imagen a utilizar en cada momento de la evolución de la enfermedad, dentro del algoritmo de enfrentamiento diagnóstico.
En la mayoría de los casos, y particularmente en el grupo de patologías neurodegenerativas, el diagnóstico de demencia continua siendo clínico. Esto contribuye sustancialmente al retardo en el mismo, ya que al momento de la manifestación de síntomas, las alteraciones neuropatológicas son usualmente extensas3. Lo anterior influye a su vez en el fracaso actual de las terapias farmacológicas y no-farmacológicas. El rol fundamental y el desafío del desarrollo de nuevas técnicas de neuroimágenes, es lograr detectar con una alta sensibilidad y especificidad, las alteraciones funcionales prodrómicas que llevan al daño estructural irreversible.
Tradicionalmente, las técnicas de imagen en el enfrentamiento de las demencias han tenido un rol principalmente de apoyo, orientándose a descartar causas tratables. Actualmente, este rol está migrando progresivamente hacia la aproximación diagnóstica, contribuyendo en la diferenciación entre distintos tipos de demencia. En este ámbito, las técnicas de mayor uso son la resonancia magnética (RM) estructural para la evaluación de atrofia cortical4–6 así como alteraciones de la sustancia blanca y más recientemente la tomografía por emisión de positrones (PET) para la medición de depósitos de amiloide o proteína Tau, en el caso de la enfermedad de Alzheimer. Ambas técnicas detectan alteraciones morfológicas y moleculares específicas de enfermedad.
En los últimos años, debido a la necesidad de realizar el diagnóstico precoz, el esfuerzo se ha centrado en el desarrollo de técnicas de neuroimágenes que permitan lograr la detección de enfermedad en etapas preclínicas, antes que el daño cerebral irreversible se produzca7. Estas técnicas se centran en la medición de marcadores de injuria y disfunción neuronal, e incluyen técnicas avanzadas de RM, como imágenes de tensor de difusión (DTI), espectroscopía, y conectividad neuronal mediante resonancia funcional de estado de reposo; PET con 18F fluoro-deoxiglucosa (FDG-PET); SPECT (tomografía computada por emisión de fotón único) de perfusión cerebral con HMPAO y TRODAT-1 (ambos disponibles en Chile) e imágenes del transportador de dopamina con iodine-123-b-carbo-metoxi-3-b- (4-iodofeniltropano) fluropropil; así como estudios mediante técnicas de imágenes multimodales6. Cada una de ellas ha mostrado utilidad en la evaluación y diagnóstico de patologías específicas que llevan a demencia, y pese a mostrar cambios que están indirectamente relacionados a los cambios moleculares patológicos que las subyacen, en muchos casos están asociadas más robustamente con los síntomas clínicos medidos mediante test psicométricos8.
En el caso de la enfermedad de Alzheimer (la más frecuente de las patologías neurodegenerativas que provocan demencia), los nuevos criterios sugeridos para la investigación consideran el uso de biomarcadores basados en neuroimágenes9, y los criterios establecidos para el diagnóstico10 plantean su uso como herramienta clínica cuando estén disponibles y cuando el médico lo considere oportuno, lo que reafirma la utilidad de las recientes técnicas desarrolladas para el diagnóstico precoz y el seguimiento de los pacientes con demencia. Falta definir aún el rol específico que cada una de estas técnicas tendrá en el algoritmo diagnóstico de las demencias.
En el presente artículo, se da una visión general de las técnicas más usadas actualmente de neuroimágenes para la evaluación de los diagnósticos más frecuentes de demencia, delineando las características imagenológicas de cada una de ellas y los protocolos utilizados.
RESONANCIA MAGNÉTICA ESTRUCTURALComo se mencionó previamente, la resonancia magnética estructural, en el ámbito de las demencias, ha estado orientada en las décadas pasadas a excluir patologías potencialmente tratables. Este rol de exclusión, que puede ser llevado a cabo en la mayoría de los casos mediante el uso de la tomografía computarizada (TC), se encuentra actualmente migrando hacia la demostración de marcadores positivos de enfermedad (e.g. atrofia hipocampal para el caso de la enfermedad de Alzheimer).
Las dos patologías más frecuentes para el desarrollo de demencia son la enfermedad de Alzheimer (EA) en primer lugar, y la patología vascular. Debido a ello, el enfrentamiento diagnóstico mediante las técnicas de RM estructural debe estar orientado a evaluar, principalmente, 1) el patrón y extensión de atrofia cortical, y 2) el nivel de daño vascular, que incluye el patrón, extensión, y los sitios específicos (estratégicos) de compromiso.
El protocolo estándar de imágenes de RM estructural para el estudio de las demencias incluye las siguientes secuencias: 3D T1-ponderado Gradient Echo, Fluid Attenuation Inversion Recovery (FLAIR), T2-ponderado Turbo o Fast Spin Echo (TSE/FSE), T2*-Gradient Echo (GE).
En el 3D T1-ponderado Gradient Echo, el uso de una secuencia 3D gradient-echo T1-ponderado con preparación mediante un pulso de inversión adicional, permite obtener imágenes volumétricas con alta resolución espacial, que muestran además un alto contraste entre la sustancia gris y la sustancia blanca. De las más utilizadas actualmente se encuentra el MPRAGE (magnetization-prepared rapid acquisition gradient echo). Estas secuencias permiten generar reconstrucciones multiplanares (MPR) para generar secciones en diferentes proyecciones.
En la secuencia FLAIR, debido a que esta incluye el uso de un pulso de inversión aplicado al tiempo de relajación T1 del agua (principalmente ubicada en el líquido céfalo-raquídeo), y por lo tanto suprimir su representación, esta secuencia permite visualizar lesiones hiperintensas cercanas a los espacios que contienen LCR, como los ventrículos cerebrales. Detecta además con buena sensibilidad lesiones ubicadas en la corteza y regiones subcorticales. Sin embargo, posee baja sensibilidad para lesiones de fosa posterior, lesiones lacunares del tálamo, y en la médula espinal.
Varias aproximaciones han sido propuestas para la interpretación de imágenes estructurales en la evaluación de demencias. Barkhof11 ha sugerido un algoritmo de seis pasos, que se muestra en la Tabla 1.
EVALUACIÓN ESTRUCTURADA DE RM EN EL ENFRENTAMIENTO CLÍNICO DE LAS DEMENCIAS
| 1. Excluir una lesión estructural susceptible de tratamiento quirúrgico. Considerar tanto lesiones con efecto de masa significativo (e.g. hematoma subdural, meningioma) y lesiones con menor efecto de masa (e.g. MAV). |
| 2. Excluir edema cerebral, tanto edema generalizado (e.g. hidrocefalia) o edema focal (e.g. edema del lóbulo temporal medial en encefalitis por VHS). En cualquier caso que exista edema, considerar el uso de DWI e imágenes con contraste. |
| 3. Evaluar incremento de señal en T2/FLAIR, tanto en sustancia blanca (e.g. cambios de sustancia blanca en enfermedad vascular) y en sustancia gris (e.g. infarto talámico en enfermedad vascular o alteraciones del pulvinar en CJ). Considerar aplicar una escala de evaluación de alteraciones de sustancia blanca, tales como el Fazekas o el ARWMC. Cuando se describan los cambios vasculares, evaluar y reportar específicamente lagunas, état criblé, y lesiones talámicas (bilaterales), y si los cambios involucran el tronco cerebral o los ganglios basales. |
| 4. Evaluar microsangramientos en T2*GE, especialmente en sujetos con cambios de sustancia blanca. |
| 5. Determinar el grado y patrón de atrofia cortical general (GCA), y reportar específicamente si la atrofia: a) Es anormal para la edad o no. b) Es simétrica o asimétrica. c) Tiene un patrón regional. d) Tiene un gradiente posterior o anterior. |
| 6. Evaluar la atrofia focal, especialmente en las siguientes regiones: a) Lóbulo temporal medial (e.g. en EA). b) Polo temporal y/o lóbulos frontales (e.g. consistente con DFT). c) Atrofia biparietal (atrofia cortical posterior, principalmente EA). d) Atrofia occipital (atrofia cortical posterior o síndrome de Balint, usualmente EA pero existe considerable sobreposición con otras patologías neurodegenerativas, e.g. DCL). e) Cingulado posterior y precúneo (e.g. presenil o EA posterior). f) Atrofia mesencefálica (e.g. PSP). g) Atrofia pontina (y cerebelosa) (e.g. AMS). h) Atrofia cerebelosa (e.g. abuso de alcohol, priones, etc). |
CJ: Enfermedad de Creutzfeldt-Jakob, DCL; Deterioro Cognitivo Leve, PSP; Parálisis Supranuclear Progresiva, AMS; Atrofia Multisistémica.
Barkhof et al 201111
En los casos en que la sospecha clínica de demencia es razonablemente alta y el algoritmo ha resultado negativo para hallazgos de una patología específica, se recomienda reevaluar con nueva(s) imagen en un intervalo de tiempo que depende de la progresión del deterioro clínico y de la sospecha diagnóstica.
ESCALAS VISUALES DE EVALUACIÓN DE ATROFIA CEREBRALA partir de lo propuesto por Scheltens en 1992 para el caso del lóbulo temporal medial4, una serie de escalas visuales de evaluación cualitativa han sido propuestas para analizar el grado de atrofia cerebral, tanto local como global, con orientación etiológica.
Escala de atrofia cortical global (GCA)La escala de atrofia cortical global fue propuesta por Pasquier en 199712, como un método de evaluación cualitativo para evaluar atrofia cerebral, especialmente para el caso de enfermedades neurodegenerativas. El método considera la evaluación de atrofia en 13 regiones cerebrales evaluadas separadamente en cada hemisferio. Para cada una de ellas, un puntaje de 0 a 3 es asignado dependiendo de la severidad de la atrofia (Tabla 2). El puntaje final asignado corresponde a la suma de los puntajes de cada región. Las trece regiones incluyen:
- -
Dilatación de surcos: frontal, parieto-occipital, temporal (derechos e izquierdos).
- -
Dilatación ventricular: frontal, parieto-occipital, temporal (derechos e izquierdos); tercer ventrículo.
ESCALA DE EVALUACIÓN DE ATROFIA CORTICAL GLOBAL (GCA-SCALE)
| PUNTAJE | Característica |
|---|---|
| 0 | No atrofia cortical |
| 1 | Leve atrofia: apertura de surcos |
| 2 | Moderada atrofia: pérdida de volumen de los giros |
| 3 | Atrofia severa (etapa final): atrofia tipo “hoja de cuchillo” |
De acuerdo a lo propuesto por Pasquier12.
Descrita originalmente por Scheltens en 19924, está orientada a evaluar el grado de atrofia cortical específicamente en la región mesial del lóbulo temporal (Tabla 3; Figura 1), la cual aparece principalmente en el caso de la EA, y se mantiene normal para el caso de controles sanos (Tabla 4).
ESCALA DE EVALUACIÓN VISUAL DE ATROFIA DEL LÓBULO TEMPORAL MEDIAL (MTA-SCALE). VER FIGURA 1
| PUNTAJE | Ancho de fisura coroidea | Ancho del cuerno temporal | Altura del hipocampo |
|---|---|---|---|
| 0 | N | N | N |
| 1 | ↑ | N | N |
| 2 | ↑↑ | ↑ | ↓ |
| 3 | ↑↑↑ | ↑↑ | ↓↓ |
| 4 | ↑↑↑ | ↑↑↑ | ↓↓↓ |
De acuerdo a Scheltens4.
COMPARACIÓN DE ESCALA MTA PARA DIFERENTES DEMENCIAS Y SANOS
| Presente | Ausente | |
|---|---|---|
| Enfermedad de Alzheimer (n=28) | 100% | - |
| Demencia vascular (n=24) | 87% | 13% |
| Demencia por cuerpos de Lewi (n=26) | 62% | 38% |
| Controles sanos (n=26) | 4% | 96% |
MTA en diferentes demencias y en controles sanos (http://www.radiologyassistant.nl/en/p43dbf6d16f98d#i445b139abe503).
Un puntaje de 2 o superior es anormal en edades previas a los 75 años, mientras que un puntaje de 3 o superior es anomal sobre los 75 años.
Si bien posee una alta sensibilidad para la EA, posee una baja especificidad por la superposición de las lesiones con otras patologías neurodegenerativas, particularmente con la demencia fronto-temporal (DFT).
Escala de atrofia parietal (Koedam)Diseñada por Koedam en 201113 para evaluar atrofia en región parietal asociada a variantes de EA precoz (EA presenil), los cuales pueden tener puntajes de MTA normales.
La escala puntúa la atrofia parietal en corteza cingulada posterior, precúneo y regiones parietales superiores, en las 3 proyecciones ortogonales, sagital, coronal y axial (Tabla 5).
ESCALA VISUAL DE ATROFIA POSTERIOR/PARIETAL A PARTIR DE MR MULTIPLANAR
| SAGITAL | AXIAL | CORONAL | |
|---|---|---|---|
| PUNTAJE | Ancho del surco cingulado posterior y el surco parieto-occipital, atrofia del precúneo | Amplitud del surco cingulado posterior y dilatación surcal en lóbulos parietales | Amplitud del surco cingulado posterior y dilatación surcal en lóbulos parietales |
| 0 | Normal | Normal | Normal |
| 1 | ↑ | ↑ | ↑ |
| 2 | ↑↑ | ↑↑ | ↑↑ |
| 3 | ↑↑↑ | ↑↑↑ | ↑↑↑ |
Las lesiones de sustancia blanca juegan un papel causal en el desarrollo de deterioro cognitivo progresivo y demencia. Estudios poblacionales longitudinales y hospitalarios han confirmado una relación de dosis dependencia entre las alteraciones de sustancia blanca y el resultado clínico14–18. Aún en el caso de la enfermedad de Alzheimer, en la cual la mayoría de los estudios se han enfocado en las alteraciones secundarias al depósito de amiloide, las hiperintensidades de sustancia blanca en la RM constituyen una característica central de la patología19, las cuales pueden ser de mayor importancia que el amiloide en sí mismo en influir el curso de la enfermedad14.
Varias escalas se han propuesto para evaluar la cantidad, tamaño y distribución de las lesiones de sustancia blanca en el envejecimiento y la demencia. La Tabla 6 muestra la sencilla escala de cuatro pasos de Fazekas20, que puede ser suficiente para la evaluación rutinaria de imágenes. En el contexto del diagnóstico diferencial de la demencia, escalas más complejas pueden ser utilizadas, como la de cambios de sustancia blanca relacionados a la edad (ARWMC, Tabla 7).
ESCALA DE EVALUACIÓN DE CAMBIOS DE SUSTANCIA BLANCA RELACIONADOS A LA EDAD (ARWMC)
| PUNTAJE | Lesiones de sustancia blanca |
|---|---|
| 0 | Sin lesiones (incluyendo bandas bien definidas simétricas) |
| 1 | Lesiones focales |
| 2 | Comienzo de confluencia de lesiones |
| 3 | Compromiso difuso de la región completa/ con o sin compromiso de las fibras en U |
| PUNTAJE | Lesiones de ganglios basales |
| 0 | Sin lesiones |
| 1 | Una lesión focal (>5 mm) |
| 2 | Más de una lesión focal |
| 3 | Lesiones confluentes |
Cambios de sustancia blanca en MR se definen como lesiones hiperintensas >5mm en T2, PD o FLAIR. Los hemisferios derecho e izquierdo sin punteados separadamente. Las siguientes áreas cerebrales son usadas para puntuación: frontal, parieto-occipital, temporal, infratentorial/cerebelo y ganglios basales (estriado, globo pálido, tálamo, cápsula interna/externa e ínsula).
De acuerdo a Wahlund22
En el caso de la escala de Fazekas, un puntaje de 1 puede ser considerado normal aún bajo los 65 años, pero con seguridad sobre los 65. Un puntaje de 2 es anormal bajo 70 años, mientras que un puntaje de 3 es siempre anormal e implica un mal pronóstico en términos cognitivos y de sobrevida.
En un estudio reciente21, seis de las escalas visuales más utilizadas para el estudio de demencia fueron validadas en términos de la precisión para distinguir grupos patológicos de controles y entre los distintos grupos. Los resultados mostraron una precisión comparable a estudios previos usando biomarcadores moleculares, con la ventaja del bajo costo.
Volumetría CerebralLa volumetría cerebral es una técnica avanzada de postprocesamiento semiautomático, que a partir de una imagen volumétrica de resonancia magnética ponderada en T1 (preferentemente MPRAGE por su alto contraste entre sustancia blanca y corteza), se obtiene la segmentación y volumen de estructuras corticales y subcorticales. Uno de los software más utilizados a nivel mundial es FreeSurfer23.
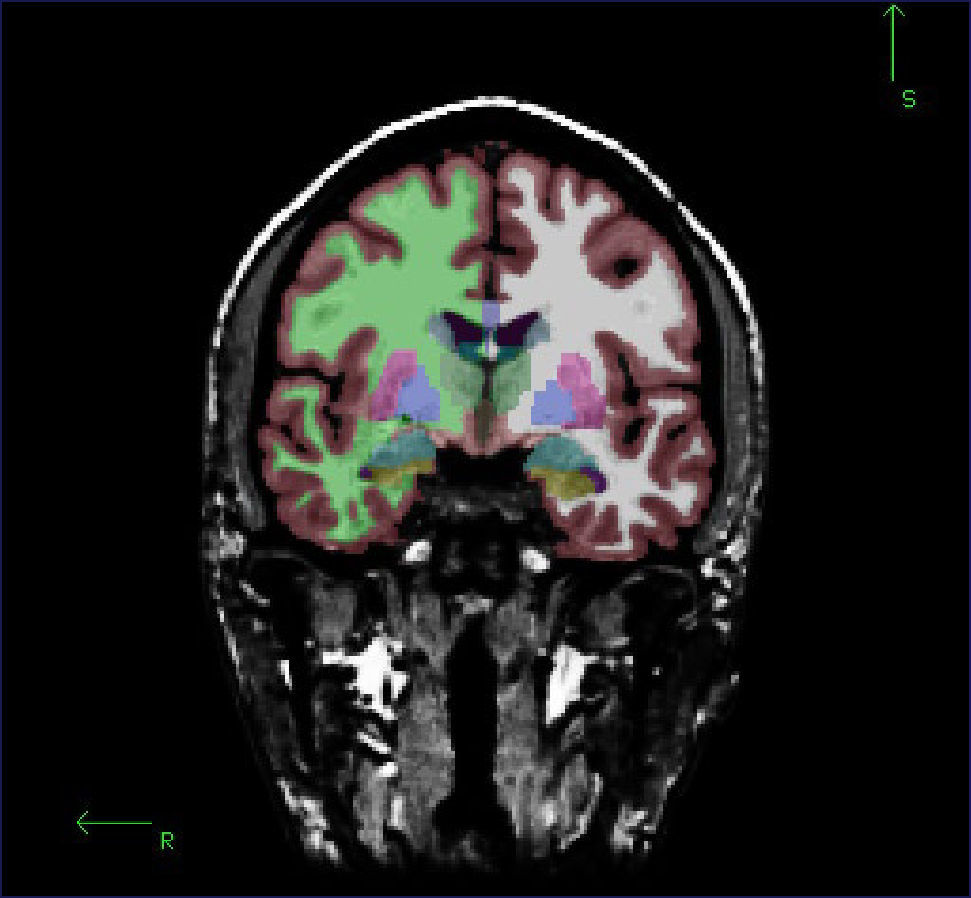
Este software a partir de una o más adquisiciones volumétricas, determina de forma automática entre otros datos: el volumen de corteza, sustancia blanca, múltiples estructuras subcorticales, y espesor cortical. En la Figura 2 se muestra un corte coronal de la segmentación de un individuo sano. Cada color indica una estructura diferente: por ejemplo, amarillo corresponde al hipocampo, celeste a la amígdala, verde a la sustancia blanca hemisferio derecho, blanco a la sustancia blanca izquierda, café corteza, y morado corresponde al putamen. Figura 3 muestra la delimitación entre sustancia blanca y sustancia gris en color amarillo y en una línea color rojo muestra el borde de la corteza pial (con esta información FreeSurfer calcula el espesor cortical). En Figura 4 se muestra una reconstrucción 3D de ambos hipocampos de un paciente en el cual el hipocampo izquierdo es bastante más pequeño que el derecho (3651mm3 y 4393mm3 respectivamente).
CORTE CORONAL DE INDIVIDUO SANO DONDE SE MUESTRA LA SEGMENTACIÓN OBTENIDA CON SOFTWARE FREESURFER
Corte coronal similar a Figura 2, pero se agregó la delimitación entre sustancia blanca y corteza (línea amarilla), y la superficie de la corteza (línea roja).
En múltiples trabajos publicados, se ha demostrado la variación normal del volumen de diversas estructuras subcorticales con respecto a la edad en individuos normales24–28, y en el caso de diversas patologías 29–31. Algo similar ha ocurrido en el caso del espesor cortical. Salat et al.24 evaluó el espesor cortical en 106 individuos sin demencias de 18 a 93 años de edad. Salat concluye que el adelgazamiento global fue evidente en mediana edad, y el grado de adelgazamiento es similar entre hombres y mujeres. Algunos resultados, tales como la atrofia prominente de la corteza prefrontal, y el leve adelgazamiento de la corteza temporal y parahipocampal, se correlacionan con resultados anteriores. Otros resultados son inesperados, tales como la atrofia prominente en la corteza frontal cerca de la corteza motora primaria y la corteza calcarina cerca de la corteza visual primaria. Estos resultados demuestran que el adelgazamiento cortical ocurre en la edad media y se extiende ampliamente por regiones que incluyen la corteza primaria y de asociación24. Walhovd et al.25 evaluó 883 individuos sanos, y concluyó que de las 17 estructuras subcorticales estudiadas, todas excepto el tronco cerebral tiene variación de su volumen en relación a la edad. Las variaciones más fuertes y consistentes se encontraron en la corteza cerebral, pálido, putamen, y núcleo accumbens. El volumen cerebral total, la sustancia blanca, caudado, hipocampo y los ventrículos mostraron variación no lineal relacionado con la edad26.
Diferenciar clínicamente la enfermedad de Alzheimer (EA) con respecto a demencia fronto-temporal (DFT) es difícil, ya que tienen síntomas similares. Por ello, Du et al.30 realizó un estudio volumétrico en 22 pacientes con EA, 19 con DFT y 23 sujetos cognitivamente normales. Los pacientes con EA tienen la corteza más delgada en el lóbulo frontal, parietal, temporal y occipital bilateral con respecto a los sujetos normales. Los pacientes con DFT tienen una corteza más delgada en regiones frontales y temporales bilaterales y un adelgazamiento en regiones parietales inferiores y el cingulado posterior. Los pacientes con EA con respecto a la DFT, tienen una corteza más delgada en regiones parietales bilaterales y precúneo. El daño cognitivo en los pacientes con EA tiene correlación negativa con el espesor cortical en los lóbulos frontal, parietal y temporal. Este tipo de correlación no ocurre en los pacientes con demencia frontotemporal. En conclusión, las mediciones de espesor cortical, mejoran significativamente la clasificación entre Alzheimer y demencia frontotemporal, en comparación al uso de la prueba Mini-Mental y la versión modificada del Trail- Making Test.
En individuos normales, el volumen cerebral disminuye un 0,4% a 0,5% anual, y en el caso de pacientes con EA el cerebro disminuye más de 1% al año. En el caso de los hipocampos, el volumen disminuye de 1.2% a 1.4% anual y en el caso de pacientes con EA, esta disminución es mayor a 4.3% anual32–34.
En el Laboratorio de Procesamiento Avanzado de Imágenes Médicas de Clínica Las Condes, se ha desarrollado una base de datos de volumetría cerebral normal para uso clínico. Utilizando imágenes de individuos normales de la base de datos OASIS-BRAINS35 se han desarrollado curvas de normalidad con respecto a la edad de diferentes estructuras cerebrales. Para generar los gráficos, se han utilizado 80 individuos de ambos sexos de 18 a 84 años de edad.
Se tiene una paciente de sexo femenino, 62 años de edad, con demencia cortical moderada. Se realiza segmentación y estudio volumétrico con software FreeSurfer23 y se utiliza la base de datos implementada en el Laboratorio (Figura 5). Se obtiene el resultado de que ambos hipocampos tienen una atrofia mayor a tres desviaciones estándar con respecto a la curva normal para su edad (ver gráficos en Figura 6). Además, la corteza tiene una atrofia relativa de una desviación estándar (atrofia leve) y la sustancia blanca derecha e izquierda tienen una atrofia leve y moderada respectivamente (1 y 2 desviaciones estándar).
ESTUDIO VOLUMÉTRICO CON FREESURFER CON BASE DE DATOS DE LABORATORIO
A-C) Cortes coronales de segmentación obtenida con FreeSurfer de la imagen MPRAGE de paciente femenino de 62 años de edad con demencia cortical moderada (D-F) cortes coronales T2 con posición similar a segmentación.
GRÁFICO VOLUMEN HIPOCAMPO DERECHO E IZQUIERDO
(A) Gráfico del volumen hipocampo derecho, e (B) hipocampo izquierdo con respecto al volumen normal para su edad. En ambos casos el volumen del hipocampo del paciente, corresponde a una atrofia mayor a tres desviaciones estándar con respecto al volumen hipocampal normal para su edad (atrofia severa).
La resonancia magnética funcional (fMRI) es una técnica de imágenes funcionales que mediante imágenes de resonancia magnética se mide la respuesta hemodinámica en los cambios de flujo sanguíneo relacionado con la energía utilizada por las neuronas. Este efecto se denomina efecto BOLD (blood-oxygen-level dependent;36,38.
Para realizar la resonancia magnética funcional de un sujeto, se le solicita que realice alguna tarea, o se le presenta un estímulo. La forma en que se realiza la tarea o se presenta el estímulo al sujeto, se llama paradigma. Existen tres maneras de diseñar los paradigmas de fMRI. Uno se denomina de “bloques”39, “relacionado a eventos”40,41, y “combinado”39. El primero es útil para eventos o tareas sistemáticas o repetitivas, y la otra para eventos que no lo son y que tienen una duración variable más cercano a las tareas del mundo real. El paradigma de bloques tiene un mayor poder estadístico que el relacionado a eventos.
La fMRI se ha utilizado para determinar la ubicación de áreas elocuentes para planeación quirúrgica42, paradigmas cognitivos en diversas patologías (Alzheimer, déficit atencional con hiperactividad, etc.), también se han realizado estudios de cambios de la memoria con respecto a la edad o por diversas patologías37.
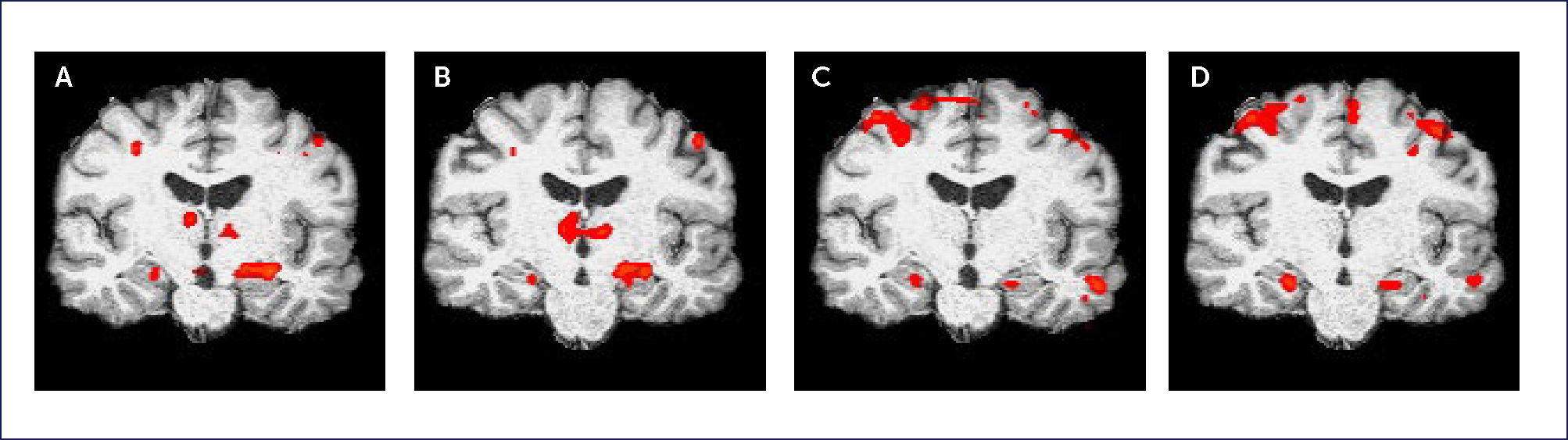
Basado en Golby et al43 y Rabin et al44 se implementa un paradigma de resonancia funcional de memoria. Es un paradigma en bloques en que los “on” corresponden a fotos de interiores y exteriores y el “off” corresponde a una de las fotos degradada con la aplicación de ruido blanco (Figura 7). Se tiene un paradigma para codificación y evocación de memoria. En el paradigma de codificación se le solicita al paciente que memorice las fotos, y en el de evocación se le solicita que trate de reconocer fotos ya vistas. En Figuras 8a y 8b se visualiza la activación correspondiente a la tarea de codificación y en las Figuras 8c y 8d se visualiza la activación de la tarea de evocación. En Figura 8a-8d se obtiene activación en ambos hipocampos. En Figura 9 se puede visualizar la activación en los hipocampos fusionado con la segmentación realizada con FreeSurfer (en la segmentación de FreeSurfer los hipocampos son de color amarillo).
PARADIGMA DE RESONANCIA MAGNÉTICA FUNCIONAL DE ACTIVACIÓN DE MEMORIA
(A-B) Imágenes (de interiores y exteriores) que se utilizan para los “on”, y (C) para los “off” (imagen a la cual se le aplicó ruido blanco) del paradigma de resonancia magnética funcional de activación de memoria.
ACTIVACIÓN DEL PARADIGMA DE ACTIVACIÓN DE MEMORIA
(A-B) muestra activación de codificación de memoria lo que corresponde a que al paciente se le muestran imágenes y se le solicita que las memorice, y (C-D) muestra la activación que corresponde a la evocación de memoria en el cual se le muestran imágenes y se le solicita al paciente que trate de recordarlas. En (A-D) se activan ambos hipocampos.
Morcom45 utilizando un paradigma relacionado a eventos, estudia la codificación de memoria en función de la edad. Este autor realiza una prueba de memoria de reconocimiento de información verbal presentada previamente en sujetos mayores (14 con 68 años de edad promedio) y jóvenes (14 sujetos con 21 años de edad promedio). Los sujetos jóvenes mostraron mayor activación que los mayores en corteza temporal anterior inferior izquierda (área de Brodmann 20), y los sujetos mayores mostraron mayor activación que los jóvenes principalmente en la corteza prefrontal anterior bilateral (área de Brodmann 10)45.
Rombouts et al46 para demostrar la hipótesis de que la activación disminuye en el sistema de memoria en el lóbulo temporal medial en pacientes con Alzheimer con respecto a voluntarios sanos, utilizó 12 pacientes con Alzheimer (edad promedio 65,1, Mini prueba del estado mental (MMSE) promedio 21,67, y CDR de 0,5-2.0) y 10 voluntarios sanos (edad promedio 61,5 y MMSE promedio 30,0) y le realizó dos tareas de resonancia funcional que consisten en la codificación de nueva información visual. Los máximos locales en los controles son en la corteza occipital (BA 19), giro fusiforme (BA 36/37), giro parahipocampal izquierdo (BA 36), lóbulo parietal (BA 7) y giro frontal inferior izquierdo (BA 44). En los pacientes, los máximos locales son en la corteza occipital (BA 18), giro parahipocampal derecho (BA 36), giro fusiforme (BA 20), y cerebelo. Se encontró que los controles tienen mayor activación que los pacientes con EA en el hipocampo izquierdo y en el giro parahipocampal bilateral46.
En el artículo de Rombouts et al47 se analiza la activación de la corteza frontal en pacientes con demencia fronto-temporal y enfermedad de Alzheimer temprana. Se analizan siete pacientes con DFT (CDR: 0-5-1.0, MMSE promedio: 28.0) y misma cantidad de pacientes con EA (CDR: 1.0, MMSE promedio: 23.1). A los 14 pacientes se les realiza una tarea de memoria de trabajo 1-back (memoria de trabajo simple) y 2-back (carga aumentada de memoria de trabajo) para evaluar la activación frontal en relación con la carga de memoria de trabajo. La red de memoria de trabajo que se activa en la DFT y en la EA incluye tálamo, lóbulos frontal y parietal. En la DFT, la activación en la corteza frontal y parietal disminuye de forma importante. Regiones frontales en pacientes con DFT, muestran menor aumento de la activación con respecto a la carga de memoria de trabajo, que en los pacientes con EA. Finalmente, la pérdida de activación funcional en regiones frontales en DFT inicial, sugiere que la resonancia funcional puede identificar esta patología cerebral en el caso que la resonancia magnética estructural sea normal.
Conectividad funcional mediante resonancia magnética funcionalEl cerebro está formado por redes. Es decir, regiones funcionales separadas entre sí, pero que funcionan de forma simultánea. Existen nuevas técnicas para obtener estas redes, basadas en secuencias de resonancia magnética funcional con la que se mide la dependencia temporal de esas regiones cerebrales no contiguas48.
Se ha determinado que existen redes relacionadas a diferentes funciones cerebrales. Según Yeo49 existen siete redes funcionales: red visual, somatomor, atención dorsal50, de atención ventral49, límbica50, frontoparietal52,53, red por defecto54,55, las cuales comprenden diferentes regiones cerebrales (Figura 10) y funciones sensitivas, cognitivas y procesamiento de modo por defecto50–55.
IMAGEN DE CONECTIVIDAD FUNCIONAL CON fMRI
(A) Imagen en la cual se visualizan las siete redes de conectividad funcional publicadas por Yeo (Yeo et al., 2011). En (B-C) se visualiza la red de modo por defecto en diferentes ángulos de visualización. Estas imágenes se generaron mediante software IBraiN
(Rojas et al, 2015).
Es posible medir la conectividad funcional entre diferentes estructuras y regiones cerebrales. Por ejemplo, en la Figura 11 se muestra el corte coronal de un voluntario sano. Se analizó la conectividad funcional de cada hipocampo mediante semillas en esas estructuras subcorticales. Mediante una semilla en el hipocampo derecho se obtiene su conectividad en color azul-celeste, y mediante una semilla en el hipocampo izquierdo se obtiene su conectividad en color rojo-amarillo. En este corte se visualiza que cada hipocampo tiene una alta conectividad funcional con el hipocampo contralateral. Procesando la resonancia funcional de estado de reposo con resonancia funcional con semillas o con ICA (Análisis de componentes principales) se obtendrá la conectividad funcional de la región cerebral correspondiente a la semilla, lo que podría ser útil para la planeación quirúrgica en el caso de que la resonancia funcional en bloques no se pueda realizar al paciente debido a la escasa edad del paciente, o que debido a su patología no pueda cooperar en el paradigma de resonancia funcional en bloques.
CORTE CORONAL EN EL CUAL SE VISUALIZA LA CONECTIVIDAD FUNCIONAL DE CADA HIPOCAMPO
Se analizó mediante semillas en el hipocampo izquierdo y derecho. Mediante una semilla en el hipocampo derecho se obtiene conectividad azul-celeste, y mediante semilla en el hipocampo izquierdo se obtiene red de conectividad rojo-amarillo. Se visualiza que cada hipocampo tiene conectividad hipocampal contralateral.
Sorg et al56 analizó los cambios en la conectividad y cambios estructurales en pacientes con deterioro cognitivo leve. Se analizaron 16 controles sanos de 68,1 años de edad promedio y 24 pacientes con 69,3 años de edad promedio. Sorg comenta que la conectividad se ve disminuida en regiones específicas de la red de modo por defecto, y la red de atención ejecutiva. Es decir, en los controles existe conectividad entre ambos hipocampos y en el cingulado posterior de la red de modo por defecto, pero en los pacientes esa conectividad no existe. Mediante un análisis estructural de morfometría basado en vóxel, se revela que existe atrofia cerebral en ambos lóbulos temporal medial. Entonces, de este trabajo se concluye que en pacientes con deterioro cognitivo leve, existe disminución de conectividad y atrofia cerebral en ciertas regiones cerebrales.
Conclusiones similares obtuvo Michael Greicius57. Utilizando 13 pacientes con enfermedad de Alzheimer leve, y la misma cantidad de individuos normales, concluye que la conectividad hipocampal bilateral es disminuida en los pacientes con EA, y en la corteza cingulada posterior. Esto se podría asimilar con el hipometabolismo del PET en el cingulado posterior.
PET EN DEMENCIAEL PET y PET/CT son técnicas de evaluación funcional y molecular del cerebro que permiten estudiar la distribución encefálica de un radiotrazador, el que puede ser un marcador de metabolismo (glucosa, oxigeno), de perfusión, de neuroreceptores (benzodiacepinas, dopamina, GABA), o de otras moléculas (amiloide, proteína tau). Cada uno de estos trazadores son ligados a un isótopo emisor de positrones, como por ejemplo el Flúor-18 (F18), lo que hace posible “ver” cómo se distribuye en el cerebro.
El radiotrazador más utilizado en la práctica clínica es el F18-fluorodeoxiglucosa (F18-FDG), con aplicación clínica en el estudio de demencias y epilepsia. Sin embargo, en los últimos años se han desarrollado un sinnúmero de nuevos compuestos más específicos, particularmente en el estudio de deterioro cognitivo y demencias, dirigidos a estimar el depósito de amiloide cerebral, y últimamente aquellos que permiten evaluar depósito de proteína tau cerebral.
La interpretación de las imágenes del PET habitualmente se realiza de manera visual y semicuantitativa. Para ésta última se dispone de una variada gama de software que permiten procesar la imagen con el objeto de complementar la evaluación visual. Mediante estos programas es posible por ejemplo comparar el estudio de un paciente con una base de datos de cerebros normales, comparando vóxel a vóxel para detectar las áreas alteradas.
PET con F18-FDGEl PET cerebral con F18-FDG traduce el consumo de glucosa en la corteza cerebral y núcleos de la base, que en personas normales es alto, simétrico y relativamente homogéneo. Esta distribución es bastante invariable en individuos jóvenes, adultos y adultos mayores sanos (Figura 12).
El PET ha sido utilizado para el diagnóstico precoz y diferencial de deterioro cognitivo y demencias, existiendo patrones de alteraciones metabólicas características para cada tipo de patología.
En deterioro cognitivo leve es una condición clínica que agrupa diversos tipos de pacientes sintomáticos, alguno de los cuales presentarán buen pronóstico con el tratamiento y otros que caerán progresivamente en demencia, particularmente enfermedad de Alzheimer (EA). El PET con F18-FDG puede distinguir precozmente grupos de riesgo de acuerdo a la alteración metabólica existente, individualizando aquellos pacientes con mayor riesgo de desarrollar demencia. Se estima que un 10 a 15% de los pacientes con deterioro cognitivo leve desarrollarán EA cada año58. Un PET normal hace poco probable una progresión a corto o mediano plazo. Hallazgos al PET como hipocaptación bilateral de corteza parietotemporal y cíngulo posterior se consideran pródromos de EA59,60.
La enfermedad de Alzheimer presenta típicamente un patrón de hipometabolismo parietotemporal y en cíngulo posterior bilateral y en corteza frontal en casos avanzados, como se muestra en la Figura 13.
Otras demencias con un patrón característico son la de cuerpos de Lewy y la demencia frontotemporal.
Para una adecuada interpretación de las imágenes del PET es indispensable realizar análisis de tipo cuantitativo o semicuantitativo de la captación del radiotrazador en el cerebro, normalmente una comparación vóxel a voxel con una base de datos de estudios PET de pacientes normales. Diversas publicaciones han evaluado nuevos métodos de análisis cuantitativos en demencias, reafirmando su gran utilidad al aumentar el rendimiento versus el análisis visual simple, y permitiendo diagnósticos más precoces de la EA.
Hoffman y cols61 estudiaron el rendimiento diagnóstico del PET-FDG en pacientes con demencia, con confirmación histopatológica en todos ellos. Realizaron solo una evaluación cualitativa de las imágenes en busca del patrón clásico de hipometabolismo temporoparietal bilateral, sin estudio cuantitativo, obteniendo una sensibilidad de 93% y especificidad de 63% para EA.
En un estudio multicéntrico utilizando PET F18-FDG y un análisis de “proyección de superficie estereotáxica”, Foster y cols lograron diferenciar pacientes con EA y con demencia frontotemporal con una eficiencia de 90%, con utilidad especialmente en aquellos casos en que existió dificultad clínica para hacer el diagnóstico diferencial62.
Mosconi y cols lograron reconocer correctamente 95% de los pacientes con EA clínica en un grupo de 548 sujetos (controles sanos y pacientes con diversas causas de demencias) utilizando un análisis “automatizado estándar”63.
Estas y otras publicaciones han apuntado a una evaluación cuantitativa “automatizada” de los estudios metabólicos cerebrales, comparando a un paciente con modelos obtenidos de sujetos normales o de pacientes enfermos. Esto disminuye los errores diagnósticos en el estudio de pacientes con demencia, cuyas características clínicas e imagenológicas tienden a sobreponerse y mezclarse64.
PET con otros radiotrazadoresDebido a que se ha demostrado que el depósito de ß-amiloide y proteína tau en el cerebro antecede en 15 años al comienzo del deterioro cognitivo en pacientes con EA, se ha prestado atención a maneras de medir estos compuestos en el líquido cefalorraquídeo y cerebro con el objeto de efectuar un diagnóstico precoz de esta enfermedad, antes que haya ocurrido el proceso neurodegenerativo avanzado65. La utilidad de estos biomarcadores reside no sólo en la posibilidad de diagnosticar precozmente la enfermedad, sino también en la estimación de pronóstico y en el control de respuesta a tratamiento66.
Los radiotrazadores para PET aceptados actualmente en USA y Europa para estudio de ß-amiloide son: 18F-AV-45 (18F-florbetapir; Amyvid™), 18F-BAY94-9172 (18F-florbetaben; Neuraceq™) y 18F-3′-F-PIB (18F-flutemetamol; Vizamyl™)67, aún no disponibles en nuestro país.
La evaluación in vivo de depósito de tau en el cerebro mediante PET/CT está en pleno desarrollo, y se han propuesto varios radiotrazadores cuyo depósito en el cerebro se correlaciona con el grado de deterioro cognitivo y de pérdida de volumen cerebral y del hipocampo68. Radiotrazadores afines a los ovillos neurofibrilares que resultan de la agregación de proteína tau como el 18F-THK5105 podrían diferenciar pacientes de EA de individuos controles68, dado su alta concentración en ciertas áreas cerebrales como la base de lóbulos temporales e hipocampos de pacientes enfermos69.
Si bien hay una clara relación entre los depósitos de ß-amiloide y proteína tau en el cerebro demostradas por PET y el grado de deterioro cognitivo en pacientes con EA, falta aún evidencia suficiente para incorporar este método de imagen molecular en el estudio rutinario de estos pacientes y considerarlo un método con valor diagnóstico en EA. Por el momento, la utilidad del PET cerebral con estos marcadores reside principalmente en identificar pacientes con riesgo de desarrollar demencia en el futuro, permitiendo un tratamiento precoz antes que el deterioro clínico aparezca.
IMÁGENES FUNCIONALES. ROL DEL SPECT EN EVALUACIÓN DE DEMENCIASLa tomografía computada por emisión de fotón único (SPECT por sus siglas en inglés) es una técnica de medicina nuclear que permite adquirir imágenes mediante el uso de trazadores radioactivos. En la evaluación de demencias se ha transformado en una valiosa herramienta ya que se puede adquirir una imagen representativa de la perfusión cerebral mediante SPECT, realizar análisis cuantitativos de perfusión regional y evaluaciones estadísticas. Los trazadores más utilizados en el SPECT de perfusión cerebral son el Hexametil-propilenamino-oxima (HMPAO) y el Etil-cisteinato-dimero (ECD) que se marcan con el isótopo radioactivo Tecnecio 99m, ambos disponibles en Chile en la actualidad. La principal característica de estos trazadores es su habilidad para atravesar mediante difusión la barrera hemato-encefálica indemne, esto se logra por su pequeño tamaño y carácter lipofílico y distribuirse posteriormente en forma proporcional al flujo sanguíneo en el cerebro70,71. La imagen obtenida posteriormente representa la perfusión al momento de la administración del radiofármaco, por lo que se requiere realizar esta inyección en condiciones de hipoestimulación para que se reflejen las características basales de perfusión cerebral.
En demencias se han descrito diferentes patrones de perfusión según la etiología así como del tiempo de evolución. La enfermedad de Alzheimer (EA) presenta inicialmente una hipoperfusión témporo-parietal posterior bilateral, que a medida que la enfermedad progresa puede ir aumentando en extensión hasta alcanzar lóbulo frontal. Se observa además una hipoperfusión del cíngulo posterior así como una perfusión conservada de la corteza sensorio-motora, ganglios basales, cerebelo y tronco. La demencia fronto-temporal (DFT) muestra un patrón de hipoperfusión en lóbulo frontal y/o en región temporal anterior (Figura 14)72. La demencia por cuerpos de Lewy (DCL) muestra un patrón de hipoperfusión similar al de la EA, pero presenta una característica diferenciadora que es la marcada hipoperfusión de la corteza occipital. En la demencia vascular (DV) el patrón descrito son múltiples defectos de perfusión de distribución general, que pueden corresponder a pequeños infartos corticales y subcorticales de tipo lacunar73. Al estar íntimamente ligadas la perfusión con el metabolismo, estos patrones se repiten al realizar la técnica PET con FDG, con la ventaja de contar con mejor resolución espacial pero a un mayor costo en la actualidad.
DEMENCIA FRONTO-TEMPORAL
Se muestra hipoperfusión frontal y temporal.72.
En los últimos años, las mejoras en los equipos con capacidad SPECT, específicamente el auge de las modalidades híbridas donde se combina el detector tradicional con un tomógrafo multicorte (CT) así como una nueva generación de detectores, permiten importantes mejorías en la resolución y calidad de imagen obtenida por el SPECT de perfusión cerebral. Existe una variedad de programas computacionales que apoyan el análisis de las imágenes obtenidas, permitiendo su estandarización para posterior comparación contra bases de datos de pacientes normales. La estandarización generalmente se logra transformando los estudios obtenidos a un volumen tridimensional conocido, como el atlas de Talairach, para de esta forma contar con un adecuado correlato espacial de las estructuras que se desean evaluar y así poder definir el grado de perfusión relativa.
La ventaja de la técnica SPECT de perfusión cerebral en la evaluación de demencias, es que permite detectar cambios en el patrón regional de perfusión antes que se produzcan o manifiesten las alteraciones anatómicas degenerativas, por lo que una de sus principales indicaciones es la evaluación precoz de demencias. Esto es de particular importancia cuando se manifiesta el deterioro cognitivo leve, siendo el SPECT una herramienta para predecir si el paciente progresará a una EA74. Dada la existencia de patrones reconocibles de cada una de las demencias descritas anteriormente, el SPECT de perfusión cerebral es una herramienta útil en el diagnóstico diferencial de EA, DFT o DCL cuando clínicamente es complejo dado la similitud de los cuadros. Una revisión de la literatura publicada75 indica que el SPECT de perfusión cerebral con HMPAO es una técnica de buen rendimiento en el diagnóstico diferencial de demencias, con sensibilidad global de 79,7% (71,0-87,3 95%IC) y especificidad global de 79,9% (74,8-85,6 95%IC) para diferenciar EA y DFT. En el caso de diferenciar EA con DV, los resultados fueron 74,5% de sensibilidad (68,5-80,1 95%IC) y 72,4 de especificidad (66,6-77,9 95%IC). Finalmente, para diferenciar entre EA y DCL, la sensibilidad global observada fue de 70,2% (60.5-78,7 95%IC) y la especificidad de 76,2% (64,8-85,4 95%IC).
En los casos de demencia asociadas a temblores, puede existir la duda si está o no involucrada la enfermedad de Parkinson como etiología. En estos casos la posibilidad de obtener neuroimágenes con trazadores específicos del sistema dopaminérgico es de gran utilidad para el diagnóstico diferencial. En Chile contamos desde hace varios años con un trazador que se une a los transportadores de Dopamina llamado TRODAT-1, que es marcado con Tc99m, lo que facilita su disponibilidad76,77,79. En los casos de enfermedad de Parkinson el trazador disminuye su captación a nivel de ganglios basales por menor concentración del transportador de Dopamina (Figura 15)79.
TRAZADORES ESPECÍFICOSDEL SISTEMA DOPAMINERGICO TRODAT
(A) Cortes axiales muestran adecuada captación del Tc99m-TRODAT en ganglios basales en paciente sano, (B) Hipocaptación en ganglios basales izquierdos en un paciente con un Hemiparkinsonismo derecho y (C) marcada hipocaptación en un paciente con Enfermedad de Parkinson avanzada.78.
En este artículo se realizó una revisión de las principales técnicas de neuroimágenes (tales como MR y sus postprocesamientos, fMRI, PET, SPECT) que se utilizan actualmente en la evaluación del diagnóstico de las demencias. Además, se describen algunas técnicas (principalmente de postprocesamiento tales como volumetría cerebral y conectividad funcional) que su uso está en etapa de investigación para este tipo de patologías.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Las imágenes de este artículo han sido autorizadas para su publicación.