El conocimiento en Enfermedad Celíaca (EC) ha mejorado sustancia/mente en las últimas décadas, cambiando muchos de los conceptos históricamente aceptados sobre este tema. Las novedades se están incorporando lentamente a algunos sectores de nuestro país, a pesar de que gozamos de una situación de privilegio en comparación a otros países, contando con un Servicio Nacional de Salud formado por profesionales y que mantiene alta cobertura de la población. Es urgente mejorar las capacidades del equipo de salud en el tema de enfermedad celíaca; aun existe un sub diagnóstico importante, con pacientes en los que el diagnóstico no se buscó activamente, a menudo no se siguieron los criterios actualmente aceptados para llegar a él, el tratamiento está mal indicado y finalmente, el paciente es mal manejado. En este artículo revisamos qué entendemos hoy por EC, cómo ha cambiado la epidemiología debido a la mejor capacidad de búsqueda, en qué consisten las presentaciones clínicas típicas y atípicas, cómo hacer el diagnóstico, cuándo indicar dieta sin gluten y los requerimientos que hay para mantener un adecuado seguimiento.
Knowledge on celiac disease has greatly improved in the last decades, changing many of the concepts historically accepted. New developments are being incorporated rather slowly in some areas in our country, despite the existence of a National Health Service formed by professionally trained people that covers a large proportion of the population. It is urgent to update the capacities of our professionals on celiac disease; under diagnosis is still prevalent, cases are not actively searched for, diagnosis often does not follow current accepted criteria, treatment is inadequately indicated and as a result the patient is poorly managed. In this paper we review what we understand by celiac disease today, how epidemiology has changed derived from the new screening methods, what are the typical and atypical clinical presentations, how we reach diagnosis, when to indicate gluten free diet and the requirements to maintain a adequate follow up.
En las últimas décadas los conocimientos acerca de la Enfermedad Celíaca (EC) mejoraron dramáticamente. Muchos de los conceptos en el tema cambiaron y se hicieron más complejos, haciéndonos enfrentar un nuevo escenario que nos obliga a ponernos al día. Las novedades han llegado lentamente a Chile, a pesar de contar con la situación privilegiada en comparación a otros países, por contar con un Sistema Nacional de Salud formado por profesionales y que tiene una amplia cobertura de la población. Aun existe sub diagnóstico importante y es frecuente recibir pacientes en los que el diagnóstico no se buscó o no se siguieron los criterios actuales para realizarlo, o bien el tratamiento está mal indicado y el paciente mal manejado. Ante esta situación creemos conveniente revisar qué entendemos hoy por EC, cómo ha cambiado la epidemiología debido a la mejor capacidad de búsqueda y diagnóstico, las presentaciones clínicas más frecuentes (típicas y atípicas), cuándo indicar el tratamiento y los requerimientos que tiene el seguimiento. En aspectos en los que aún existe discusión hemos tomado como base los principales documentos generados en los últimos años, como el Consenso elaborado por el NIH (2004) (1) y publicado en el Gastroenterology (2005) (2), el informe del Working Group, FISPGHAN (2008) (3) y el informe del National Institute for Health and Clinical Excellence (2009) (4). Se ha privilegiado dar datos chilenos, cuando los hay.
¿Qué entendemos hoy por enfermedad celíaca?En la descripción original de Aretaeus (Capadocia) de hace ~ 2000 años, la condición aparece caracterizada por diarrea intensa, con desnutrición grave, en un paciente probablemente descompensado. En 1888 Samuel Gee, patólogo del hospital de San Bartolomeo en Londres mantiene esa conceptualización y describe el cuadro en niños, aunque aún se desconoce su causa; en honor a Aretaeus usa el nombre enfermedad celíaca. Aunque siempre se especula que su causa está en la dieta, es sólo en 1950 que se la describe formalmente, asociando el consumo de harina de trigo con la aparición de síntomas y la mejoría de la sintomatología cuando el paciente hace dieta sin gluten (5). Es notable que la correcta descripción hecha por Dicke ocurriera cuando aún no existía la posibilidad de obtener biopsias intestinales y no se sabía que el aparato inmune es el gran efector que traduce la predisposición genética del individuo en la sintomatología que observamos.
La variedad de síntomas con que se manifiesta y la poca claridad que había para definirla clínicamente hizo que en 1969 la Sociedad Europea de Gastroenterología y Nutrición Pediátrica emitiera “criterios” para diagnosticar la condición, basándose en los hallazgos histológicos: la mucosa duodeno-yeyunal debe mostrar daño intenso al momento del diagnóstico, cuando el paciente está consumiendo gluten; el daño histológico debe mejorar claramente después de un tiempo en dieta sin gluten, y las alteraciones deben reaparecer cuando el individuo es desafiado con gluten nuevamente. En esta primera normativa, el proceso diagnóstico completo exige obtener tres biopsias intestinales a lo largo de la vida, que demuestren los cambios histológicos mencionados, sin tomar en cuenta las características clínicas del paciente.
Más recientemente, los cambios acerca de qué entendemos por EC derivan de la aparición y luego uso generalizado de las mediciones de anticuerpos antiendomisio (EMA) y antitransglutaminasa (tTG), anticuerpos de alta sensibilidad y especificidad que describiremos en detalle más adelante. Como consecuencia, hoy día se entiende por EC una intolerancia permanente al gluten del trigo (gliadina), del centeno (secalinas) de la cebada (hordeina) y del triticale (híbrido de trigo y centeno), que se presenta como una enfermedad inmune/autoinmune, en la que pesa fuertemente la predisposición genética del individuo, que afecta primariamente el tracto digestivo donde induce algún grado de inflamación crónica de la mucosa del intestino delgado. Los fenómenos que ocurren en la mucosa intestinal se traducen habitualmente en daño moderado a grave de la mucosa, pero en ocasiones puede ser menor y difícilmente demostrable. La sintomatología es variable y frecuentemente incluye fenómenos autoinmunes. Finalmente, puede empezar a cualquier edad, ya sea tempranamente en la vida o bien en la adultez. Así, de ser una enfermedad digestiva relativamente poco frecuente de los niños, ha pasado a ser una condición sistémica de manifestaciones digestivas (que pueden ser sutiles) e inmunes/autoinmunes (también variables), de alta frecuencia, que afecta tanto a niños como adultos. En la actualidad, el mayor el número de casos se diagnostica entre niños mayores y adultos, y no en niños menores.
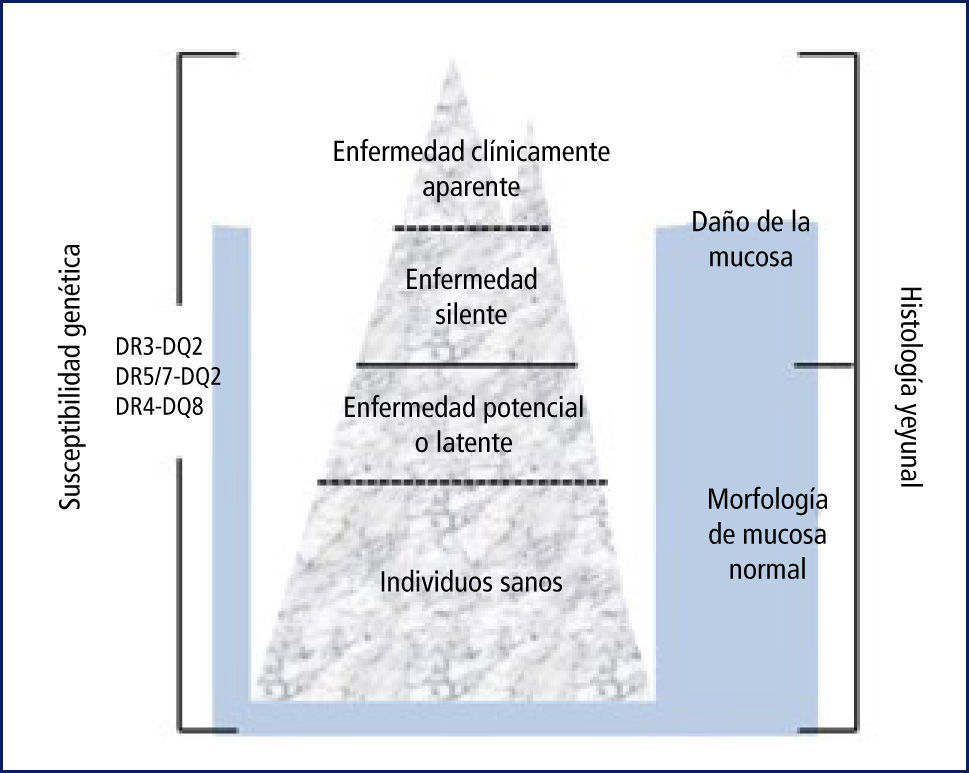
El nuevo escenario, la nueva epidemiologíaEn el nuevo escenario la EC se caracteriza por tener alta frecuencia en todos los países en que se le ha estudiado. La medición de anticuerpos EMA y tTG en grandes subgrupos de población (6) reveló un alto número de individuos positivos, en los que el diagnóstico es confirmado cuando se les practica biopsia intestinal. Las personas así identificadas pueden no referir molestias, encuestados por el especialista a menudo se descubre que sí tienen sintomatología, pero ésta es escasa o leve o inespecífica y no necesariamente se circunscribe al tracto digestivo. Dado lo variable de su presentación y alto costo que tiene medir los dos anticuerpos y hacer la biopsia intestinal la prevalencia real de la EC en la población es difícil de medir. El concepto del “iceberg” celíaco que está en boga ilustra bien la situación actual, donde la punta del iceberg representa a los casos diagnosticados, que es el grupo más pequeño y el resto que permanece bajo el agua, sin diagnosticar, es el grupo mayoritario (Figura 1).
Los estudios de rastreo mediante anticuerpos llevaron a identificar subgrupos en los que la frecuencia de EC es mayor que en el resto de la población, son los llamados “grupos de riesgo”. Actualmente se acepta que la búsqueda de celíacos en la población general, utilizando EMA y/o tTG como herramienta rastreo, no es costo efectiva; en cambio, el concepto de búsqueda activa, que consiste en examinar sistemáticamente a los grupos de riesgo, se considera la manera más apropiada de abordar el problema de sub diagnóstico (1 -4, 7). Hoy existe abundante literatura que describe la epidemiología de la enfermedad, pero hay que ser cauto al interpretarla ya que frecuentemente las muestras evaluadas están sesgadas y las metodologías empleadas son criticables. Es fundamental considerar si se incluyen casos identificados solamente por medición de anticuerpos sanguíneos, si los casos fueron confirmados por biopsia intestinal, o si se trata de poblaciones que portan la susceptibilidad genética, pero aún no son sintomáticos.
En el mundo, la prevalencia de casos demostrados en la infancia varía entre 0,7% y 2,0%, incluso en los países en que tradicionalmente se pensaba que la EC era poco frecuente. Las cifras encontradas dependen de la manera en que se busque la enfermedad. En Finlandia por ejemplo, se encontró 1:230 habitantes cuando se usó como criterio tener confirmación por biopsia yeyunal y 1:67 rastreando mediante IgA-tTG en niños con riesgo genético (8). En poblaciones blancas no europeas de Australia, Nueva Zelandia, Argentina e Israel, se han encontrado cifras semejantes. En EE.UU. se ha reportado que la frecuencia de niños hispánicos que tienen IgA-tTG persistentemente positiva es tres veces menor que en los niños no hispánicos blancos (9), lo que podría estar relacionado a una menor frecuencia de HLA-DR3, que incluye el alelo de riesgo DQB1*201, entre los niños hispánicos. Esto es consistente con el hecho que en Asia del este, donde la población carece de este haplotipo HLA, la frecuencia de EC es muy baja. En Santiago de Chile, la caracterización genética de la EC realizada en 1999 encontró que en el país predominaba la conformación DQ8 (10, 11), en vez de la DQ2, más frecuente en Europa. Sin embargo, un estudio reciente encontró que, 10 años más tarde, el predomino era DQ2, sugerente del fenómeno de migración desde el sur hacia la ciudad capital de grupos con predominio genético Mapuche (enviado a publicación).
El aumento sustancial de diagnóstico está relacionado a la mayor conciencia acerca de la enfermedad, a la búsqueda activa y a los mejores métodos de rastreo y no a un aumento real de la enfermedad. Finalmente, es interesante mencionar que en Europa actualmente se utiliza en concepto de “susceptibilidad” genética, que se usa para denominar a las personas que tienen genes que favorecen la aparición de la enfermedad, y donde se concentran los estudios actuales. A menudo la ausencia haplotipos de riesgo DQ2 y DQ en un paciente se usa como criterio para descartar la enfermedad, especialmente en casos en que la evidencia para hacer el diagnóstico es incompleta. Aunque es correcto que el carecer de estos haplotipos hace que el diagnóstico sea improbable, no estamos de acuerdo usar estos estudios genéticos para descartar el diagnóstico, ya que el tipaje genético tiene baja especificidad (1-4). En un estudio genético reciente de pacientes celíacos chilenos y argentinos hemos encontrado que un 11% de los pacientes con diagnóstico confirmados eran no DQ2/DQ8 (no publicado).
Criterios para hacer el diagnósticoUn punto crucial para el diagnóstico es recordar que la miríada de manifestaciones clínicas que se puede encontrar sirve para sugerir, nunca para confirmar el diagnóstico. Tampoco el laboratorio aporta una prueba única y patognomónica que permita asegurar el diagnóstico. Es la combinación de la clínica, los estudios en sangre y la histología los que dan el diagnóstico. Dada la complejidad que tienen algunos casos el consenso actual es que la enfermedad celíaca no debe ser diagnosticada a nivel de salud primaria.
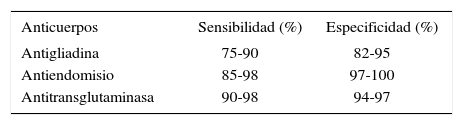
Aunque no es objetivo de este artículo revisar la historia, características y rendimiento de los distintos anticuerpos que se miden en sangre, creemos que vale la pena destacar que tanto EMA como tTG tienen alta sensibilidad y especificidad (Tabla 1). Por esto hoy en día se consideran las herramientas indicadas para realizar el rastreo de los pacientes, tanto los de alto y bajo riesgo. En cambio, el consenso también indica que los anticuerpos antigliadina tradicionales no deben ser utilizados, debido al franco mejor rendimiento que tienen los Erna y tTg (1 -4).
Históricamente, las personas con síntomas consultaban, eran estudiados y diagnosticados. Hoy la “búsqueda activa” añade la búsqueda de casos en los grupos de riesgo. Aunque este criterio no está en discusión, los altos costos que tiene definir de una u otra manera las condiciones en que debe realizarse el screening para enfermedad celíaca, existen discrepancias entre los grupos de expertos. Algunos sólo definen las condiciones en que la EC se ha descrito con mayor frecuencia, mientras otros indican que ciertos grupos “deben estudiarse”, mientras que a otros se les “debe ofrecer” hacerse el estudio. La Tabla 2 muestra la posición del NHS (4).
Situaciones en que debe llevarse a cabo la búsqueda activa de enfermedad celíaca, según el nhs*
| El estudio serológico debe hacerse en niños y adultos con los siguientes signos, síntomas y condiciones | |
|---|---|
| Signos y síntomas | Condiciones |
| Diarrea crónica o intermitente. Falla de crecimiento (en niños) o pérdida de peso (adultos). Sintomatología gastrointestinal de causa no precisada (incluyendo vómitos y nausea). Fatiga crónica (“todo el tiempo cansado”). Dolor abdominal recurrente, cólico o distensión. Anemia por deficiencia de hierro o anemia de causa no precisada | Tiroiditis autoinmune. Dermatitis herpetiformis. Síndrome de intestino irritable. Diabetes tipo 1. Familiares de primer grado de un celíaco conocido (padres, hijos o hermanos). |
| El estudio serológico debe ofrecerse en niños y adultos con cualquiera de los siguientes signos, síntomas y condiciones. | |
| Enfermedad de Adison. Amenorrea. Estomatitis aftosa. Condiciones hepáticas autoinmunes. Miocarditis autoinmune. Púrpura trombocitopénico crónico. Defecto del esmalte dentario. Síndrome de Down. Epilepsia. Fractura por trauma menor. Linfoma. Enfermedad ósea metabólica (ejemplo: raquitismo o osteomalacia. | Colitis microscópica. Constipación persistente o de causa no precisada. Enzimas hepáticas elevadas de causa desconocida. Polineuropatía. Aborto repetido. Densidad mineral ósea disminuida. Sarcoidosis. Síndrome de Sjôgren. Síndrome de Turner. Alopecia de causa desconocida. Sub-fertilidad de causa no precisada. |
Ref 4
El algoritmo que lleva al diagnóstico tiene tres pasos: se inicia con la sospecha diagnóstica, basada en la clínica sugerente, en que el paciente pertenece a uno de los grupos de riesgo o bien porque es familiar de primer grado de un celíaco ya confirmado. La segunda etapa consiste en medir IgA, EMA y tTG. Entre 3 y 7% de los pacientes celíacos tienen deficiencia de IgA y los anticuerpos EMA y tTG que se miden habitual-mente en los laboratorios clínicos son IgA-EMA e IgA-tTG, por lo que es indispensable contar con esta información para interpretar los exámenes negativos. Cuando el paciente tiene niveles de IgA bajos se deben medir los mismos anticuerpos en sus formas IgG. Los estudios disponibles sugieren que la sensibilidad y especificidad de los anticuerpos IgA-e IgG- EMA y tTG no son distintas. Tercero, la confirmación diagnóstica la da la biopsia de intestino delgado mediante endoscopía, que debe realizarse cuando al menos uno de los anticuerpos está elevado o bien cuando la clínica es muy sugerente, aunque los anticuerpos sean negativos. La endoscopía sin biopsia no es aceptada como método diagnóstico. Las biopsias deben ser varias ya que la lesión puede ser parcelar. Una lesión catalogada como Marsh 1 no confirma el diagnóstico; los casos en esta situación requieren evaluación por el especialista. Es fundamental que todos los estudios tendientes a hacer el diagnóstico se realicen mientras el paciente está consumiendo gluten. La sintomatología debe mejorar después de instaurar la dieta sin gluten. La necesidad de una segunda o tercera biopsia intestinal debe ser decidida caso a caso, por el especialista.
¿Debemos buscar activamente EC en la infancia?En la edad pediátrica son más frecuentes las presentaciones sintomáticas, de manera que es menos notoria la necesidad de efectuar la búsqueda activa. Sin embargo, debemos tener presente que si no se busca activamente, la mayoría de los celíacos permanecen sin diagnosticar. En un estudio multicéntrico realizado en Santiago, en niños mayores de 10 años se encontró que 21% de los casos tuvieron presentaciones atípicas y 10% del total de casos diagnosticados se estudiaron porque eran familiar directo de un caso conocido (12).
Presentaciones clínicasEn la actualidad las formas de clasificar las presentaciones clínicas presentan algunas diferencias de autor a otro. Dado que la evaluación del daño histológico persiste como criterio vigente para hacer el diagnóstico, lo hemos elegido como hilo conductor.
Forma típicaExpresa la enteropatía completa y los síntomas son intestinales, con diarrea crónica, pérdida de peso, distensión abdominal y aspecto de infelicidad en el niño. Hoy en día el diagnostico se busca precozmente, por lo tanto no es habitual el aspecto típico descrito en los libros. Es la forma de presentación más frecuente en el niño menor y es menos frecuente en el adulto. En Chile, se ha encontrado repetidamente que la presentación con desnutrición es infrecuente, los individuos con sobrepeso y obesidad representan una proporción no despreciable de los pacientes diagnosticados (10, 13, 14).
Forma atípicaPuede expresar la enteropatía completa o no y tiene síntomas intestinales y/o extra intestinales, incluyendo anemia ferropriva, talla baja, osteoporosis, retraso puberal, defectos del esmalte dentario. Suele haber consultado anteriormente y se diagnosticó como otro cuadro, por ejemplo síndrome de intestino irritable. Es habitualmente una presentación más tardía o del niño mayor. Es actualmente la forma más diagnosticada, consecuencia de la búsqueda activa. Esta presentación incluye aquellas con manifestaciones autoinmunes. Hasta qué punto el riesgo de complicaciones de estos pacientes es parecido o no al de los pacientes con presentaciones típicas, se desconoce. Sin embargo, la evidencia disponible sugiere que el fenómeno autoinmune está relacionado al tiempo de exposición al gluten (15).
Forma silenteTambién expresa la enteropatía completa, con sinto-matología mínima o sin síntomas; frecuentemente son casos aparentemente sanos detectados por rastreo serológico, o por ser familiar de primer grado de un caso conocido. En nuestro medio, es cada vez más frecuente el estudio de adolescentes obesos con cuadros dispépticos que la endoscopía alta revela la lesión histológica. Es frecuente que los pacientes silentes describen “sentirse mejor” luego de estar en dieta sin gluten y reconocen “no haberse dado cuenta que podían sentirse así de bien, ya que creían que su estado anterior era “su manera de ser”.
Forma potencial o latenteGeneralmente la mucosa intestinal es normal o muestra cambios mínimos. El paciente es habitualmente asinto-mático. Son casos que presentaron anticuerpos EMA y/o tTG positivos en alguna etapa de la vida. O bien tienen predisposición genética (portan haplotipos de riego DQ2 o DQ8). O bien, fueron diagnosticados en la infancia (por biopsia) y no recayeron después del desafío con gluten. Se considera que estos casos pueden desarrollar la enfermedad con la enteropatía típica más tarde en la vida, pero la información actual no permite estimar con qué frecuencia.
Formas refractariasSon pacientes con la lesión histológica bien documentada en los que los síntomas no mejoran después de excluir el gluten de la dieta. Es importante descartar que el paciente no esté ingiriendo gluten de manera inadvertida, que no tiene un diagnóstico alternativo o bien alguna condición adicional que explica la persistencia de síntomas (por ejemplo deficiencia de disacaridasas, insuficiencia pancreática, sobre crecimiento bacteriano). También puede significar que el diagnóstico es otra condición, que cursa con aplanamiento de las vellosidades (por ejemplo sprue tropical, linfoma intestinal). Los casos más graves requieren hospitalización y tratamiento por especialista.
Tratamiento y seguimientoEn la EC se conoce su causa y tiene tratamiento, situación excepcional en medicina. La dieta sin gluten es el único tratamiento de la enfermedad celíaca, debe ser estricta y para toda la vida. La EC no “se pasa” ni “se cura”. La dieta es fácil, agradable y de costo razonable cuando se prepara con productos naturales y en la casa, siguiendo nuestra cultura y costumbres (cuadro 1). Desgraciadamente, la vida moderna nos hace, frecuentemente, alimentarnos fuera de casa y consumimos numerosos productos elaborados, generalmente comida chatarra. Son estos últimos los que le hacen difícil la vida al celíaco, ya que a consecuencia de la inadecuada legislación chilena en estas materias, los alimentos en el país no declaran su contenido de gluten y el celíaco no logra tener un número razonable de productos seguros, a los que pueda recurrir para mantener su dieta.
La dieta sin gluten basada en nuestras raíces
| La mejor dieta sin gluten la tenemos en nuestros pueblos originarios. |
| Mapuches, Atacameños, Diaguitas, Onas, Yaganes, etc. no consumían gluten porque no conocían el cultivo de trigo. |
Agradezcamos lo que nos heredaron y aumentemos el consumo de productos saludables, nativos y libres de gluten:
|
La “dieta sin gluten” significa que la cantidad de éste en el alimento está por debajo de un determinado punto de corte y no necesariamente que no contiene gluten. En Chile, el Ministerio de Salud define que un alimento “libre de gluten” es aquel que está preparado únicamente con ingredientes que por su origen natural y, por la aplicación de buenas prácticas de fabricación que impidan contaminación cruzada, no contiene prolaminas procedentes de trigo, de todas las especies de tritricum, kamut, trigo duro, centeno, ni sus variedades cruzadas, así como también la avena. A partir de octubre del 2009 la norma otorga al Instituto de Salud Pública la facultad de definir la normativa y técnicas para certificar a alimentos como “libres de gluten”. Alimento exento de gluten está definido como aquel que contiene “cantidades menores de 1 a 1,5 ppm de prolaminas, que deberán corresponder a los límites de determinación para gluten de las técnicas de laboratorios que se usan en Chile”. A pesar de los esfuerzos realizados por varios grupos, especialmente COACEL (Corporación de Ayuda al Celíaco), aun no se consigue que el Ministerio de Salud norme acerca del etiquetado de alimentos, de manera que obligue a estipular elcon-tenido de gluten en ellos (16).
¿Cuánto es mucho gluten?En población no celiaca la ingesta promedio de gluten es 10 a 20 grs por día; en los celíacos dosis sobre 1 gr de gluten día producen daño severo en la mucosa intestinal. Las investigaciones realizadas hasta hoy han llevado a la opinión generalizada que la cantidad de gluten que no produce daños en la mucosa del intestino de celiacos, y por lo tanto no conduce a respuesta inmunológica ni inflamatoria, es menos de 20 ppm, o sea menos de 20mg de gluten por kilogramo de producto, por día. Traducir los resultados publicados a indicaciones concretas como la mencionada no es fácil, ya que los tiempos de duración de los estudios son cortos, y no hay evidencias que permitan afirmar o descartar que los resultados sean similares cuando la exposición al gluten es a dosis bajas y períodos prolongados. Criterios más extremos, como poner el punto de corte en menos de 1ppm o en 0 ppm, aunque teóricamente mejores, atenían contra la disponibilidad de alimentos y encarecen los procesos de elaboración, y no necesariamente contribuirían al bienestar de los celíacos.
¿Cómo hacer una buena dieta?Una dieta libre de gluten implica no consumir alimentos que contengan trigo, cebada y centeno. La avena debe excluirse porque siempre se contamina con trigo durante su cultivo, molienda y preparación. Los cereales que no se consumen se reemplazan por el arroz, quínoa, maíz, por tubérculos como la papa o zapallo, además de legumbres como porotos, lentejas, garbanzos, arvejas, que dan un mejor aporte proteico. Además de eliminar el gluten como ingrediente, la dieta sin gluten exige evitar la contaminación cruzada con otros alimentos que sí lo contienen. La contaminación cruzada puede ocurrir en cualquier momento, desde el cultivo, molienda, almacenamiento y envasado industrial, hasta la preparación y almacenamiento domésticos. La mayoría de las veces no es posible darse cuenta que se produjo la contaminación, por lo que es importante que en todo producto (alimento) elaborado, en que desconocemos los detalles de su fabricación, se cuantifique la cantidad de gluten en el producto final; es la manera de asegurar al celíaco que no hay “gluten oculto”. Estudios en este tema han determinado que un alimento contaminado con gluten puede tener más de 400ppm de gluten, cantidad que es claramente dañina para el celiaco.
Finalmente, vale la pena destacar que en el mundo moderno la gran morbilidad y mortalidad está relacionada a la mala nutrición, que en buena parte significa consumir exceso de hidratos de carbono en forma de masas (pan y pastas). El paciente celíaco debe tener presente que llevar una alimentación saludable, como los expertos en nutrición promueven hoy en todo el mundo, es una buena opción para todos, y él también puede beneficiarse de ella (Cuadros 1 y 2). Vivir sin gluten contribuye a tener una buena calidad de vida en todo el mundo, también en el celíaco.
Consejos para una alimentación saludable
| • Consuma 3 veces en el día productos lácteos como leche, yogur, quesillo o queso fresco, de preferencia semidescremados o descremados. |
| • Coma al menos 2 porciones de verduras y 3 porciones de frutas de distintos colores cada día. |
| • Elija preparar porotos, garbanzos, lentejas o arvejas al menos dos veces por semana, en reemplazo de la carne. |
| • Acostúmbrese a comer pescado, mínimo 2 veces por semana, cocido, al horno, al vapor o a la plancha. |
| • Prefiera los alimentos con menor contenido de grasas saturadas y colesterol, como las grasas provenientes de animales. |
| • Reduzca su consumo habitual de azúcar y sal. Es fácil reducirlos porque son gustos adquiridos, lo puedes modificar mediante el acostumbramiento. |
| • Tome 6 a 8 vasos de agua al día. |