El advenimiento de la fecundación in vitro cambió radicalmente el pronóstico del factor masculino en relación a su participación en la esterilidad conyugal, mejorando sustancialmente las tasas de embarazo por ciclo con la aplicación de la técnica de ICSI. No obstante, otras situaciones serán las que tendrán que evaluarse en el futuro, como es el incremento del número de pacientes que desean preservar su fertilidad, ya sea por motivos oncológicos, de fertilidad, por portar enfermedades infecciosas trasmitidas por vía sexual, especialmente virus (inmunosupresores (HIV-SIDA), inductores de daño inflamatorio (Hepatitis B) ylo oncológicos (HPV); o que se someten en forma voluntaria a la esterilización quirúrgica, debiéndose contar para ello con métodos de criopreservación. En el área de la criobiología, la utilización de técnicas de congelación ultrarrápida ha permitido en forma exitosa preservar ovocitos, embriones y tejido ovárico; y en forma reciente este método se está utilizando para preservar el gameto masculino.
The advent of in vitro fertilization radically changed the prognosis of the male factor in relation to their participation in conjugal sterility, this substantially improves pregnancy rates per cycle with the application of the technique of ICSI. However, other situations will be evaluated in the future, such as the increase in the number of patients who wish to preserve their fertility, whether for cancer, fertility, because of being a carrier of infectious diseases transmitted through sex, especially viruses (immunosuppressant (HIV-AIDS), inducing inflammatory damage (Hepatitis B) and/ or cancer (HPV) or voluntarily submit to surgical sterilization, doing this with methods of cryopreservation in the area of cryobiology. In the area of cryobiology, the use of ultra rapid freezing techniques has allowed successfully preserve oocytes, embryos and ovarian tissue and in recent form this method is being used to preserve the male gamete.
Entre el 10 el 25% de las parejas presenta problemas de alteración de la fertilidad. Se estima que en Chile, parejas no fértiles tendrán un incremento anual de 16.000 casos. Aproximadamente en un 40% de los casos existe un factor masculino, en otro 40% es factor femenino y en un 20% de los casos existen factores en ambos componentes de la pareja (1). En la alteración de la fertilidad masculina hasta la aplicación de los nuevos métodos diagnósticos, solamente alrededor de un 40% tenía alguna etiología verificable y el resto era considerado de etiología no precisada. En este grupo estaban las enfermedades endocrinológicas y genéticas (2). No obstante, al existir un factor masculino asociado en la pareja no fértil, se reducía su posibilidad de embarazo por ciclo a aproximadamente un 10%. Esta cifra se mantenía en la fecundación in vitro y en la inseminación intrauterina. Este valor señalaba que en todos estos procesos debía existir una falla en los múltiples mecanismos asociados a la función del espermatozoide. Cuando se logra evitar el factor “función espermática”, que ocurre con la incorporación de la inyección intracitoplasmática de gametos (ICSI), los porcentajes de embarazo por ciclo se hacen comparables a los obtenidos con las técnicas de fecundación in vitro convencional asociado a un factor femenino, como por ejemplo la falta de tubas uterinas (3). El uso de la ICSI ha permitido dar tratamiento a más del 90% de las parejas con factor masculino, pero el alto costo de este procedimiento deja aun fuera un número importante de parejas, en especial en los países en vías de desarrollo.
Asimismo, el mejor conocimiento de la fisiología espermática y el desarrollo de nuevos métodos de evaluación de su función, abren la posibilidad de mejorar tanto las nuevas técnicas de fecundación in vitro incluida la ICSI, como realizar diagnósticos más precisos, implementar nuevas terapias y permitir el tratamiento a nivel celular, recuperando o evitando que se altere la función del espermatozoide, dando origen así a la Andrología Molecular. Este cambio radical de evaluar al hombre con falla en su fertilidad ha hecho variar la definición de la Andrología Clínica incorporando estos conceptos. Definiendo al Andrólogo, como aquel médico que además de estudiar los aspectos clínicos de la infertilidad en el varón, es un especialista en la evaluación y tratamiento de defectos espermáticos. Las pruebas efectuadas por el andrólogo determinan no solo los aspectos biológicos de los espermatozoides desde su producción en los testículos, sino también sus atributos funcionales y capacidad fecundante.
Esta reciente denominación se ha comenzado a difundir desde la estandarización de diferentes técnicas que permiten evaluar en forma efectiva la función de los espermatozoides, y el conocimiento más adecuado de los procesos de capacitación, reacción de acrosoma, regulación de la| población espermática (apoptosis), extracción de los espermatozoides desde el tracto genital y orientación hacia el ovocito (quimiotaxis). A su vez se ha podido precisar el efecto de factores que previamente no se consideraban excesivamente deletéreos sobre la función espermática, como eran los procesos infecciosos, especialmente la infección seminal silente. La aplicación de los métodos de andrología molecular ha precisado el diagnóstico, lo que ha permitido establecer que aproximadamente el 30% de la causa de esterilidad masculina está comprometido un factor infeccioso (4). Esto ha permitido a su vez avanzar hacia la evaluación de los espermatozoides que se emplean en las técnicas de fecundación in vitro, es así que los periodos prolongados de incubación de espermatozoides, espermatozoides extraídos por biopsia testicular o espermatozoides de pacientes con patologías que se ven incrementada la producción de especies reactivas de oxigeno (infección, varicocele, citopatología mitocondrial, congelación, entre otras) presentan mayores tasas de fragmentación del ADN, que aunque se produzca con ICSI adecuadas tasa de fecundación, se eleva la tasa de aborto temprano (5). Este proceso si es adecuadamente diagnosticado puede revertirse con el uso de sustancias antioxidantes ya sea in vivo o in vitro.
Este mismo efecto se ha mostrado durante la crio conservación de semen, que presenta un alto impacto sobre la función espermática y que explica finalmente las bajas tasas de embarazo por ciclo. Es así que otro avance importante al aplicar andrología molecular fue determinar que la vitrificación aséptica de espermatozoides conserva adecuadamente la función espermática, que permite por primera vez eliminar el plasma seminal y preservar espermatozoides libres de plasma seminal, conociendo el número exacto de las células funcionales que se preservan. Esto permitirá mejorar a futuro las tasas de embarazo por ciclo en programas de inseminación intrauterina tanto homologas como heterólogas.
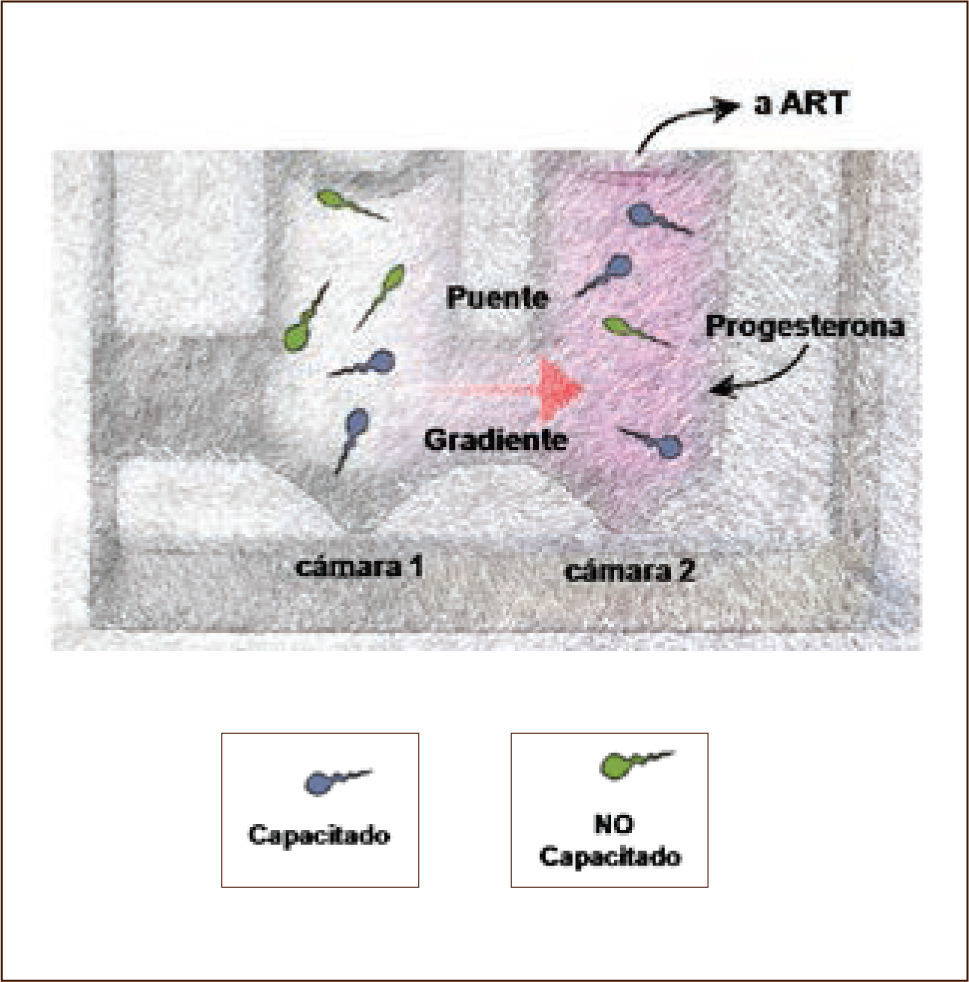
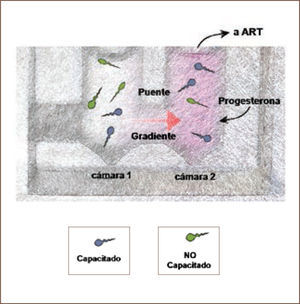
Otra aplicación que se tendrá en un futuro cercano es la selección del espermatozoide único para la técnica de ICSI. En la actualidad se están utilizando técnicas que permiten magnificar la imagen del espermatozoide para seleccionar al que morfológicamente se vea más adecuado, pero ello no garantiza un espermatozoide con un ADN intacto, ya que no existe una correlación exacta entre morfología y daño en el ADN, por ello es que se investigan algunas alternativas para esta visualización, pero estos procedimientos son de alto costo. De ahí que la selección fisiológica de espermatozoide a través de quimiotaxis, donde son atraídos por su quimioatractante natural que es progesterona, genera una alternativa de bajo costo y de fácil implementación (Figura 1 y 2).
Selección de espermatozoides por quimiotaxis
El método consiste por la atracción quimiotactica de espermatozoides a un gradiente de progesterona. Se observan dos cámaras y en relación de ellas u puente que comunica los espermatozoides que son puestos en la cámara sin progesterona una vez que se capacitan migra hacia la gradiente de progesterona Estos espermatozoides son retirados y utilizados para FIV seleccionados a travé de un proceso fisiológico.
En todas aquellas parejas candidatas a Fertilización In Vitro Inyección Intracitoplasmática de Espermatozoide (FIV-ICSI) por un factor masculino severo (oligoastenozoospermia severa o azoospermia), se debería realizar un estudio de Andrología Molecular antes de iniciar el ciclo para descartar la posible existencia de una alteración genética, con alta incidencia en este grupo de pacientes, descartar posibles factores capaces de reducir los porcentajes de éxito de estas técnicas, fragmentación del ADN, alteraciones en la dotación cromosómica de los espermatozoides y la infección de la vía seminal y descartar posibles patologías genéticas transmisibles (estudio de mutaciones del gen CFTR y del alelo 5T, microdelecciones (deleción del gen DAZ, regiones AZFa, AZFb, AZFc) en el brazo largo del cromosoma Y (Yq), anomalías cromosómicas somáticas (cariotipo). Determinante es la evaluación de las regiones del gen AZF previo a la extracción de espermatozoides a nivel testicular en pacientes con azospermia no obstructiva, debido a que la supresión completa de la región AZFa o región AZFb siempre están asociados con la ausencia total de espermatozoides maduros sobre las biopsias testiculares. A nivel testicular, la mayoría de los pacientes con una deleción AZFa tienen un Sindrome de solo células de Sertoli, mientras que el fenotipo más común entre los pacientes con una deleción AZFb es una detención de la maduración de spermatogenesis. Por lo tanto, el diagnóstico de una supresión en AZFa AZFb tiene consecuencias importantes para la orientación adecuada de los pacientes, la biopsia testicular no es necesaria debido a la ausencia de espermatozoides para la inyección intracitoplasmática de espermatozoides (ICSI) (6).
Evaluación de los espermatozoides recuperados de epididimo o testículo en varones con azoospermia o necrozoospermiaEstas técnicas se han implementado para el tratamiento tanto de pacientes con azoospermia obstructiva como no obstructiva y últimamente para pacientes que presentan fallos de fecundación repetidos a la ICSI por incremento de la fragmentación del ADN en espermatozoides obtenidos post selección espermática. No obstante, los espermatozoide extraídos desde el testículo son altamente sensibles a la fragmentación del ADN, de ahí la importancia de contar con medios de cultivo con alto contenido en antioxidantes durante la selección de estos espermatozoides y realizar la ICSI de inmediato, si esto no es posible se debe realizar la congelación en forma inmediata con técnicas de vitrificación. Se deben obtener exámenes de fragmentación del ADN en las muestras previa a la congelación para conocer su índice de fragmentación y evitar los procesos de selección espermática post descongelación y/o incubación prolongada de estos espermatozoides ya que esto favorece a la fragmentación de su ADN (7).
Previo a criopreservación de espermatozoides para descartar infección seminal silente, y especialmente en pacientes con HIV-SIDA, Hepatitis C y Virus Papiloma Humano (HPV)Se debe analizar previo a la congelación de espermatozoides la membrana espermática y la fragmentación del ADN, ya que los procesos infecciosos generan altos niveles de especies reactivas de oxígeno que son producidas por los leucocitos que inducen este daño en forma directa. Igualmente después de los procesos de lavado espermático a que son sometidos los pacientes portadores de hepatitis C, HPV o HIV-SIDA para disminuir la carga viral. Debido a que el lavado de los espermatozoides consigue la eliminación de las partículas virales que existen en el semen, evitando así la posible infección de la mujer que se puede producir mediante relaciones sexuales no protegidas. Este método consiste en la separación exhaustiva de espermatozoides móviles procedentes del semen que posteriormente son analizados mediante técnicas de biología molecular para descartar la presencia de partículas virales que hayan escapado al proceso del lavado. Una vez comprobada la ausencia del virus los espermatozoides lavados, son criopreservados y posteriormente utilizados para llevar a cabo técnicas de reproducción asistida (Fecundación “in vitro” o la Inseminación Intrauterina) (8).
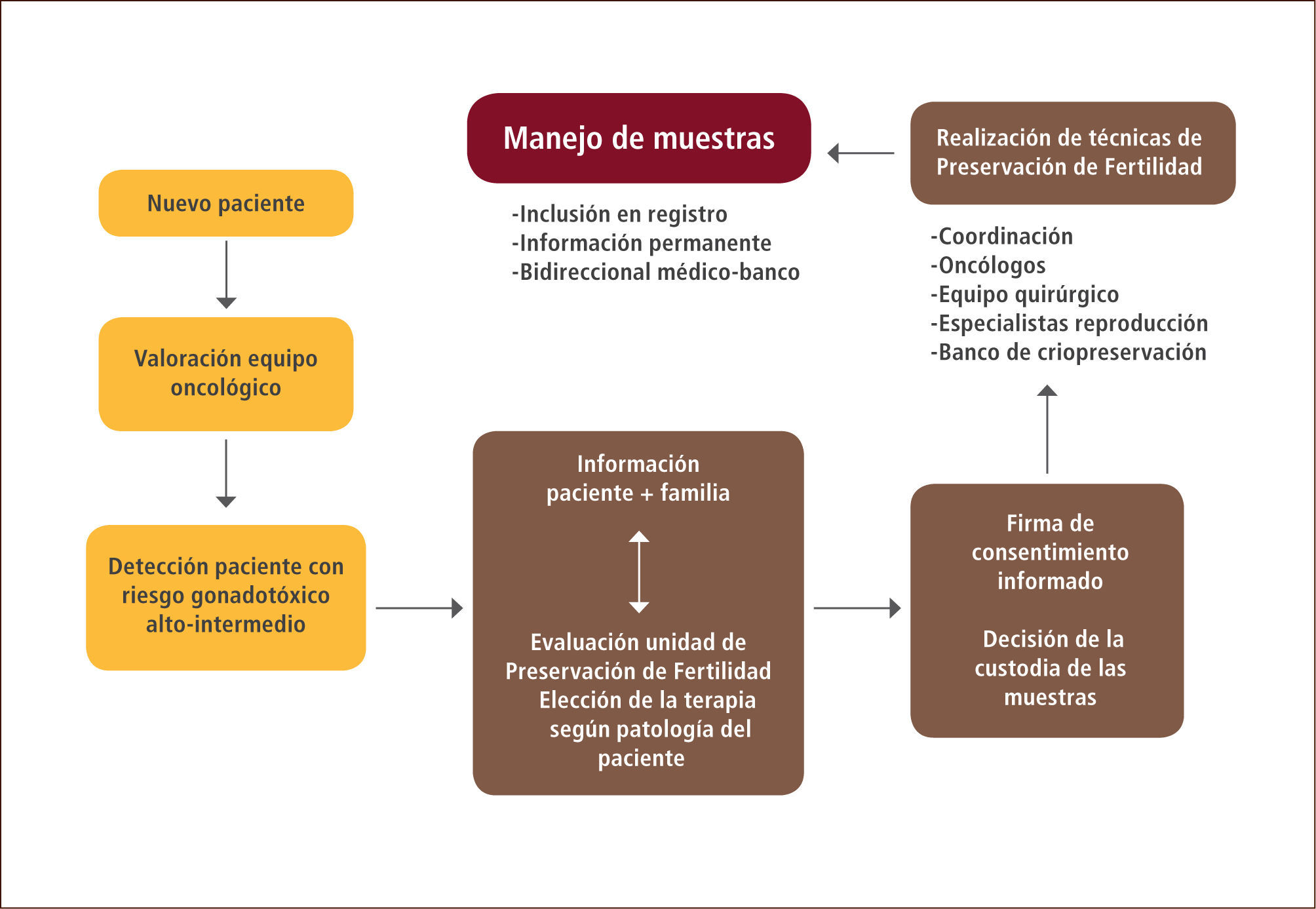
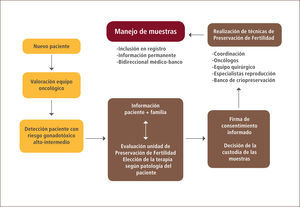
Preservación de la fertilidadEn la última década, especialmente por los altos niveles de sobrevida en pacientes oncológicos jóvenes, se ha generado una nueva área de aplicación de la Medicina Reproductiva, que tiene relación con la posibilidad de proteger la fertilidad de estos pacientes, ya que la efectividad de los tratamientos de quimioterapia y radioterapia conlleva la pérdida de su fertilidad futura (9). Esta preocupación, tanto de los mismos pacientes como de los familiares en caso de adolecentes o niños tratados con cáncer, ha llevado a la medicina moderna a proponer nuevas terapia para estos casos (10).
Sin embargo no solo la quimioterapia y radioterapia son utilizadas en pacientes oncológicos, sino también en otras variadas patologías, como ejemplo Lupus o Artritis Reumatoide, cuyos pacientes también tienen riesgo de perder o disminuir su fertilidad. Parte de esta terapia es aun experimental, pero la crio preservación de embriones, gametos, y tejido gonadal; la transposición de ovarios, el uso de inhibidores del eje hipotálamo hipófisis-gónada, ya han demostrado su efectividad (11). Se han incorporando otras áreas hasta ahora poco consideradas en este grupo de terapias médicas, como ocurre con el daño que generan en el aparato reproductor las diferentes infecciones, ya sean de tipo viral o bacteriano, especialmente aquellas que llevan asociados procesos inflamatorios que producen daño definitivo y consecuentemente esterilidad tanto en el hombre como en la mujer. Aunque hasta ahora, el daño a las tubas uterinas que ocurre en los procesos inflamatorios pélvicos tiene una solución quirúrgica o fecundación in vitro, sin posibilidad de hacer otra prevención que la educación sexual y el uso de preservativo. En el varón, además de lo anterior, si es posible ofrecer alternativas de preservación de fertilidad mediante la crio preservación de espermatozoides, periodos que hasta después de 15 años se ha demostrado que mantienen su función (12).
Otra patología prevalente en poblaciones jóvenes son la infección por virus VIH-SIDA, Hepatitis B-C, virus HPV, en estos casos la mantención de la fertilidad de estos pacientes pasa por un proceso de terapia antiviral y congelación de gametos, para un posterior tratamiento con inseminaciones intrauterinas o bien fecundación in vitro (13).
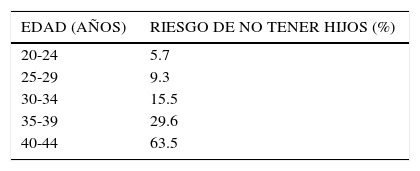
Otro grupo de personas que se vería favorecido con este programa, son quienes desean retrasar su fertilidad, debido a que en la actualidad existe una mayor expectativa de vida, que en nuestro país ya es de 80.9 años para la mujer y 74.2 años para los hombres (www.cia.gov/library/publications/the-world-factbook/geos/ci.html), lo que les genera la posibilidad de la congelación de gametos. Esto es especialmente importante ya que se produce un incremento de hasta cinco veces de aborto espontaneo en parejas donde el hombre es mayor de 40 años y la mujer sobre 35 años (14). Asimismo, hay un aumento de casos espontáneos de la acondroplasia con la edad paterna, siendo una incidencia hasta 10x sobre los 50 años (15). Pero no solo está asociado a patologías, sino que la edad del hombre es influyente, especialmente cuando su edad es cinco años mayor que su pareja, donde se producen menos embarazos tanto espontáneos como in vitro (Tabla 1). De ahí que en forma similar como las mujeres preservan sus ovocitos para retrasar su maternidad, así también los hombres podrían crio preservar sus gametos para evitar, tanto el riesgo de infección, como también enfermedades genéticas y deterioro en su ADN.
Es posible que surjan otras aplicaciones en el desarrollo de esta área de la medicina, que por ahora se ha definido como “la aplicación de procedi-mientos quirúrgicos, médicos y de laboratorio tendiente a la preservación de la descendencia genética en adultos y/o niños con riesgo de esterilidad previo a la finalización natural de la vida reproductiva” (16) (Tabla 2).
Indicaciones para la preservación de fertilidad en el varón
| A. Conservar la fertilidad a paciente oncológicos, especialmente en patologías de mayor prevalencia como Leucemia Aguda, Enfermedad de Hodgkin, Tumores Testiculares. |
| B. Paciente que requieren quimioterapia intensiva y trasplante de medula ósea asociada a radioterapia |
| C. En pacientes no oncológicos que requieran quimioterapia y/o radioterapia, ejm: Artritis Reumatoide, Lupus, Esclerosos Múltiple |
| D. Antecedentes enfermedades genéticas y endocrinas que conlleven a disminución prematura de la fertilidad como pacientes con Síndrome de Klinefelter, Galactosemia. |
| E. Criopreservación de gametos, en personas que desean mantener su fertilidad posterior a vasectomía o que desean postergar la posibilidad de ser padres. |
| F. Pacientes con patologías infecciosas que requieren de procedimientos de medicina reproductiva, especialmente VIH-Sida, Hepatitis B-C, Virus Papiloma. |
Esta nueva área de la medicina generará una nueva visión de integración de estos programas, donde se produce una mayor integración de diferentes especialidades médicas, pacientes y familiares (Figura 3).
Nuevos métodos de preservación de gametosComo parte del futuro de la Andrología se deberá considerar la preservación de fertilidad y en países en vías de desarrollo que no pueda aplicarse ICSI se deberá tener en consideración terapias que permitan el almacenamiento de espermatozoides con buena función espermática hasta tener un número adecuado para realizar inseminación intrauterina.
El primer gran avance en preservación de fertilidad en el hombre, es haber encontrado una técnica que permite preservar en un alto porcentaje de espermatozoides viable con alta motilidad y función espermática. Esto se logró con la congelación ultrarápida o vitrificación (17,18).
La vitrificación aséptica es un método que conserva íntegra la funcionalidad espermática, con un alto porcentaje de espermatozoides que conservaron la función mitocondrial y ADN intactos. A su vez, protege al espermatozoide de la criocapacitación, con un alto porcentaje de espermatozoides con membrana acrosomal intacta y mínima translocación de fosfatidilserina comparado con la congelación tradicional.
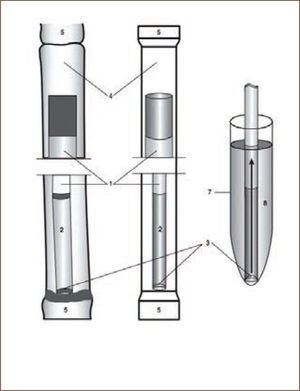
Esta es una técnica metodológicamente simple de implementar y menos laboriosa que la congelación (Figura 4). Se suma a ello la introducción de pajuelas selladas que evitan el contacto de los espermatozoides con N2, por lo cual es una técnica completamente aséptica, generando un nuevo concepto que es el cambio de los bancos de semen a bancos de espermatozoides.
Técnica de vitrificacionción
1. Pajuela Interna de 0.25ml, llenada con 0.01mL de espermatozoides previamente seleccionados, libres de plasma seminal; 2. Suspensión de espermatozoides; 3. Menisco de suspensión; 4. Pajuela de 0.5ml; 5. Sellado con calor; 6. Marca sobre la pajuela; 7. Tubo para descongelar; 8. Medio de descongelación.
El gameto libre de plasma seminal con función conservada puede ser utilizado de inmediato para cualquier técnica de medicina reproductiva, minimizando los daños generados por la centrifugación y las horas de cultivo, ambos procesos deletéreos para la célula, ya que producen una alta concentración de Reactivos de Antioxidantes (ROS) y posible daño al ADN.
Los espermatozoides vitrificados conservan su función a temperatura de - 86ºC, esto simplifica el almacenamiento de muestras, reduciendo el espacio, un menor tiempo y esfuerzo para encontrar las muestras almacenadas y más seguro para el operador (quemaduras, derrames de nitrógeno líquido cuando se recarga, entre otros) (19). Esto implica a una disminución de los costos, especialmente para personas que desean preservar su fertilidad y en los pacientes con oligoasthenozospermia que les permite ir preservando muestras para los ciclos de IIU, antes de iniciar directamente una ICSI (Tabla 3). Recientemente se han reportado los primeros embarazos con inseminaciones intrauterinas aplicando esta terapia en Chile (20,21).
Indicaciones para inseminación intrauterina con espermatozoides vitrificados
| A. Pacientes con oligo asteno teratozoospermia que corresponde aprox. al 70% de los factores masculinos idiopáticos |
| B. Recuento espermático bajo 1 millon esp/mL |
| C. Fragmentación del ADN dentro de límites normales (<20%) |
| D. Descartar infección seminal silente |
| E. Almacenar espermatozoides con técnicas de vitrificación espermática hasta tener un mínimo de 2-3 millones de células motiles/mL |
| F. Realizar un total de 4 inseminaciones intrauterinas |
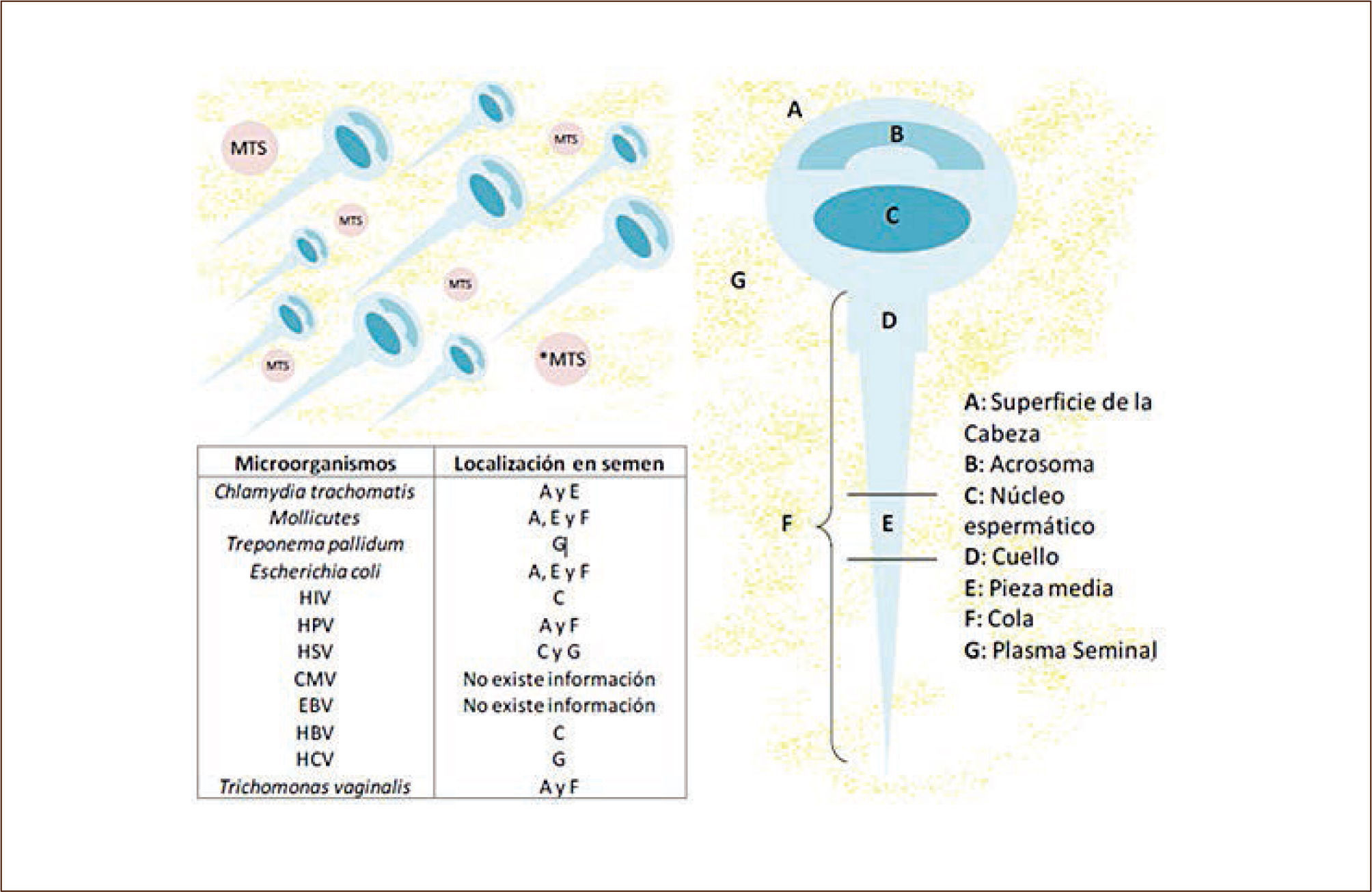
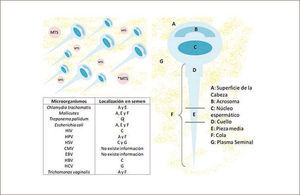
El estudio del semen como vía de transmisión de enfermedades virales ha incrementado su importancia debido principalmente a la afinidad de algunos patógenos con los espermatozoides (22). Estos virus están asociados a la inmunosupresión como el HIV-SIDA, pero también con efecto inflamatorio crónico como el virus de hepatitis B y C, y una mayor preocupación por la transmisión de virus oncológicos en el hombre (HPV), que se han asociado a cánceres que están en la esfera sexual (Tabla 4). Dentro de los principales microorganismos infectantes en semen se encuentran Chlamydia trachomatis, Neisseria gonorrhoeae, Mollicutes, Virus de la Inmunodeficiencia Humana tipos 1 y 2, Virus Herpes Simplex 1 y 2, Virus Papiloma Humano, Virus de la Hepatitis B y C, Citomegalovirus, Virus Epstein-Barr y Trichomonas vaginalis (Figura 5). En los últimos años se ha incrementado el número de casos de ITS, debido principalmente al aumento en el número de compañeros sexuales en parejas heterosexuales y de hombres que tienen sexo con hombres (HSH), lo que hace aún más factible y rápida su propagación (23). Los principales riesgos asociados son daños en los hijos de madres infectadas durante la gestación o el nacimiento, entre éstos, ceguera, deformidades óseas, retraso mental e inclusive la muerte. Además, en las mujeres pueden causar enfermedad inflamatoria pélvica, infertilidad, embarazos ectópicos y cáncer en el aparato reproductor (24). En hombres la infección está asociada a algia pelviana, prostatitis cró-nica, infertilidad y últimamente se ha asociado la infección por virus papiloma humano (HPV) a tumores de piel, región perianal, amígdala, orofaringe, laringe, esófago, próstata y uretra (25,26).
La principal forma de transmisión de estos microorganismos son las relaciones sexuales sin protección, ya sea por vía vaginal, oral o anal. Otros modos son de madre a hijo durante el embarazo, el parto o después del parto, a través de la lactancia, a través de transfusiones u otros contactos con sangre o hemoderivados (27). El semen es susceptible de ser infectado por varios microorganismos, como bacterias, virus y protozoos, los cuales encuentran en el plasma seminal las condiciones óptimas para su supervivencia. El semen contiene una heterogeneidad de componentes: A) fracción celular: células espermáticas, leucocitos y células epiteliales, y B) fracción plasmática. Los espermatozoides pueden infectarse en el epidídimo, conducto deferente o uretra. Los microorganismos pueden estar presentes en el semen y asociarse con espermatozoides, especialmente cuando existe algún tipo de inflamación o trauma de las glándulas sexuales accesorias (próstata, vesícula seminal, o glándula bulbouretral). Es importante mencionar que cada uno de los componentes del semen puede ser considerado como un potencial vehículo de transmisión de ITS (28).
Virus Inmunodeficiencia Humana (HIV)El HIV pertenece a la familia Retroviridae y al género Lentivirus. Su material genético es RNA de cadena simple con una longitud de aproximadamente 9,5 kb. Posee tropismo por las células que expresan en su membrana la molécula CD4, como: macrófagos, linfocitos T, células dendríticas, entre otras. Según el informe anual de la Organización Mundial de la Salud (OMS) en conjunto con UNICEF (United Nations International Children’s Emergency Fund) y UNAIDS (Programa de Naciones Unidas para el SIDA), en el año 2010 se es-tima que 2,7 millones de personas fueron infectadas con este virus. En Latinoamérica desde el año 2000 el número de personas que adquirieron esta infección se ha mantenido estable, oscilando entre las 99.000 a 100.000 personas por año. El contagio heterosexual es hoy, a nivel mundial, la principal vía de contagio del HIV. En los países en vías de desarrollo del 75% al 85% de los infectados lo son por contactos heterosexuales. En los países desarrollados este porcentaje es menor, aunque la vía heterosexual es la segunda causa de contagio (29).
Hombres diagnosticados con uretritis y HIV-1 positivos presentan mayores concentraciones de RNA viral en plasma seminal que aquellos varones seropositivos sin uretritis, al igual que aquellos que presentan una co-infección por HIV-1 y gonorrea, la cual aumenta las concentraciones de HIV-1 en el semen (30,31). Aunque es de conocimiento general que la mayoría de las infecciones por HIV-1 resultan de la exposición del virus en el semen, no se ha establecido aun si las cepas transmisibles se originan como viriones de RNA en el plasma seminal o en forma de DNA proviral integrado en leucocitos semi-nales infectados. El HIV-1 puede infectar a espermatozoides, plasma seminal y leucocitos utilizando como mecanismo de infección receptores CD4 y co-receptores en las células del sistema inmunológico, y otros potenciales receptores en espermatozoides (receptores manosa, DC-SIGN y GAAL) (32).
Los parámetros espermáticos se ven significativamente afectados por la presencia de la infección por HIV y en particular se correlacionan con el recuento de CD4. Finalmente, teniendo en consideración que el semen es la principal vía de transmisión del HIV-1, es poco lo que se conoce acerca de sus efectos sobre la infectividad viral (33). No obs-tante los pacientes portadores del virus deben ser tratados previo a su deseo de ser padres. Solo una vez completado el tratamiento y con carga viral extremadamente baja se pueden realizar procedimientos de inseminación intrauterina o FIV e idealmente con espermatozoide criopreservados, donde se realiza previamente selección espermática y se elimina el plasma seminal (34).
Virus Papiloma Humano (HPV)El HPV es un virus de ADN pequeño, sin envoltura, perteneciente a la familia de los Papillomaviridae. Su cápside icosahédrica está compuesta por 72 capsómeras (60 hexámeros y 12 pentámeros), con un diámetro aproximado de 55nm. El contenido genético consiste en un DNA circular de doble hebra con aproximadamente 7900 pares de bases. Su material genético se divide en tres regiones: una región de control LCR (long control region), una región temprana E (early) y una región tardía L (late) (35). Es una de las ITS más frecuentes en el mundo y es descrito como el principal agente causal del cáncer cervicouterino (99,7%) (36). El HPV afecta a hombres y mujeres por igual, sin embargo, en hombres sólo se ha asociado a lesiones como verrugas anogenitales, pero en la actualidad se ha ido asociando a neoplasias intraepiteliales de pene y ano (25).
El HPV puede encontrarse en el semen de hombres sexualmente activos, asociado a la posible infertilidad masculina debido al deterioro de los parámetros espermáticos, como la motilidad del espermatozoide (37). La infección por HPV en semen se asocia a espermatozoides y plasma seminal, siendo su mecanismo de unión aún desconocido, sin embargo, se cree que este estaría mediado por heparán sulfato que interactúa con la cápside viral. Esta unión se realiza en dos sitios del espermatozoide, la región ecuatorial y la superficie de la cabeza. Los genomas de HPV 6, 16, 18 y 31 se asocian cerca de la cabeza de espermatozoides o al segmento ecuatorial, evidenciando que la mayoría de los tipos de alto riesgo se unen al segmento ecuatoria de la célula espermática (38, 39). El HPV puede infectar a espermatozoides humanos a través de la interacción entre la proteína L1de la cápside del HPV y syndecan-1. Además, los espermatozoides transfectados con genes E6/E7 de HPV y proteínas L1 expuestas de la cápside, son capaces de penetrar en el ovocito y transferir el virus en oocitos donde finalmente se transcribe (40). No obstante la cada vez más contundente evidencia científica, este virus oncológico no se determina de rutina previo al procesamiento del líquido seminal para realizar inseminación intrauterina o FIV y tampoco se recomienda lavado espermático y posterior congelación. Es posible que en los próximos años estos pacientes deban tener el mismo tratamiento del semen que en la actualidad ocurre con los pacientes portadores de HIV-SIDA.
La solución definitiva estará en la vacunación, especialmente en América Latina, donde el grado de infección es sobre el 60% en la población masculina, no obstante en Chile todavía está en discusión la vacunación de los hombres, medida ya adoptada en Australia y Estados Unidos entre otros países.
Virus herpes Simplex (HSV)HSV pertenece a una gran familia de virus de gran envoltura conocida como Herpesviridae, la cual se divide en tres subfamilias (α, β, γ). Específicamente el HSV pertenece a la subfamilia Alphaherpes-virinae. Su genoma se compone de ADN bicatenario (125-250 kb aproximadamente) presente dentro de una cápside icosaédrica (40). El HSV presenta patrones complejos de transcripción, lo que hace dificultoso su conocimiento acabado (41,42). Dentro de los HSV los más comunes y asociados a ITS se encuentran los HSV tipo 1 y 2. HSV-1 es el causante del herpes labial en tanto, las infecciones por HSV-2 se encuentran relacionadas con infecciones virales del tracto genitourinario e infecta a la mayoría de los órganos del sistema reproductor masculino a excepción de los tubos seminíferos, debido a la protección que presentan por la barrera hemato-testícular. Sin embargo, el semen igualmente puede ser contaminado a medida que pasa durante la eyaculación (43).
HSV-1 y HSV-2 pueden infectar diversas porciones del eyaculado como son los espermatozoides, el plasma seminal, células epiteliales o glándulas accesorias y leucocitos aunque aún no se ha establecido el mecanismo concreto por el cual ocurre la infección (43). La infección por estos virus en el tracto genital masculino pudiese explicar los casos de infertilidad masculina debido a la asociación de la presencia de HSV en semen con la disminución de la calidad del mismo (44). Sin embargo, al mezclar el virus HSV-2 con líquido seminal, este no interactuaba con los espermatozoides, permaneciendo en el fluido seminal, lo que podría ser un factor a favor para las técnicas de repro-ducción asistida, en las cuales, al eliminar el fluido seminal estarían eliminando partículas virales y mejorando con ello las preparaciones de espermatozoides (45). HSV-2 ha sido detectado en la próstata y conductos deferentes, y de manera más general, en el tracto genital masculino (46).
Virus de la hepatitisDos tipos virus, el B y C se han encontrado presentes en el semen y probablemente sean transmitidos por esta vía a la pareja sexual.
Virus de la hepatitis B. El Virus de la Hepatitis B (HBV) pertenece a la familia Hepadnaviridae. Tiene un genoma de DNA de doble hebra el cual se transcribe de forma inversa a partir de un RNA pregenómico dentro del núcleo del virus (o de la cápside). El virión está compuesto por tres proteínas de envoltura llamadas Large (L) de 39k Da, Middle (M) de 32k Da y Small (S) de 24k Da (47). Las infecciones por HBV son la principal causa de las enfermedades como cirrosis y cáncer hepatocelular, infectando alrededor de 70 millones de personas a nivel mundial. El HBV se ha encontrado en sangre, saliva, leche materna, secreciones vaginales y líquido seminal, siendo transmitido principalmente por vía parenteral, sexual y perinatal (43). Secuencias de ADN de HBV se ha encontrado en secuencias de cromosomas de espermatozoides, donde el virus posiblemente ha atravesado la barrera hematotesticular e infectado a la línea germinal masculina. Asimismo, se han detectado secuencias de DNA en oocitos de ratón, lo que es de gran importancia debido a la posibilidad que el feto pueda adquirir la infección a través de la madre (48).
En humanos se han realizado estudios en los que pareciera que el virus es detectable en muestras de semen de hombres con hepatitis B aguda así como en el semen de hombres con hepatitis crónica (49).
Virus de la hepatitis C. El Virus de la Hepatitis C (HCV) pertenece a la familia Flaviviridae, al género Hepacivirus y es el principal agente causal de la hepatitis crónica. Posee un genoma RNA lineal de aproximadamente10.000 nucleótidos (50). Generalmente es transmitida por el uso de drogas y transfusiones de sangre, aunque también se puede dar por contacto sexual y transmisión vertical. Gran porcentaje de las personas infectadas por HIV presentan una co-infección con HCV y se ha reportado que mujeres coinfectadas con HCV y HIV tienen un mayor incremento en las posibilidades de transmitir el virus a sus hijos (43).
La posibilidad de que HCV pueda infectar al semen es controversial. Algunos estudios encuentran ADN del virus en semen, mientras que otros no (51). Se postula que el virus no posee la capacidad de integrar su genoma en las células seminales, debido a que no es un virus ADN, como si lo es el HBV y no posee actividad de transcriptasa reversa, como es el caso del HIV. También hay que tener en cuenta que la concentración viral en el plasma seminal varía rápidamente con el tiempo (43). Ante esta situación es posible que HCV se encuentre en una baja carga y cuya detección dependa de la metodología empleada. No obstante, este tipo viral es solicitado de rutina en los programas de medicina reproductiva, y también se recomienda el lavado del líquido seminal con selección espermática y posterior congelación de los espermatozoides, previo a su uso en técnicas de medicina reproductiva.
El autor declara no tener conflictos de interés, con relación a este artículo.