Hay ocasiones en que la capacidad de ser madre de una mujer se ve amenazada. La preservación de la fertilidad se refiere a las intervenciones médicas y/o quirúrgicas destinadas a proteger la fertilidad de estas pacientes y se utilizan especialmente en mujeres con cáncer que van a requerir un tratamiento que puede provocar una falla de la función ovárica. A diferencia de los hombres adultos, en la mujer existen relativamente pocas opciones clínicas para preservar la fertilidad, especialmente si se va a someter a un tratamiento agresivo con quimioterapia y/o radioterapia. La criopreservación embrionaria es, en la actualidad, la alternativa más probada y con mayores tasas de efectividad. La transposición ovárica antes de la radioterapia también es un método probado. Sin embargo, el resto de estos tratamientos son todavía experimentales y su eficacia y fiabilidad aún no han sido bien determinadas. La preservación de la fertilidad es especialmente desafiante en las niñas, ya que en ellas la criopreservación embrionaria u ovocitaria no es posible. El objetivo de este artículo es revisar los avances actuales en las estrategias para preservar la fertilidad en la mujer con énfasis en la criopreservación de tejido ovárico y crear conciencia de que el futuro de estas distintas técnicas es promisorio.
The preservation of fertility in women refers to medical and or surgical interventions aimed at protecting a woman's capacity of nurturing a child when her fertility is threatened. They are most commonly used in women with diagnosis of cancer who require treatment that may result in failure of ovarian function. As opposed to adult males, women have limited clinical alternatives for preserving fertility, especially in cases where aggressive cancer treatment with chemotherapy and/or radiotherapy is required. Embryo cryopreservation is at present the most established and effective alternative. Another proven method is ovarian transposition prior to radiotherapy. Other treatments are still experimental and their efficacy and reliability have not yet been determined. The preservation of fertility is especially challenging in girls, in whom embryo or oocyte cryopreservation is not possible. The objective of this article is to review the current advances in fertility preservation strategies and to discuss future directions with an emphasis on ovarian tissue cryobanking and to create conscience that the future of these different techniques is promising.
La preservación de la fertilidad en la mujer ha recibido considerable atención en los últimos años y se refiere a las intervenciones médicas destinadas a mantener la fertilidad en una paciente cuya capacidad de ser madre se ve amenazada. La principal indicación de preservación de la fertilidad está dada por mujeres con cáncer que van a requerir un tratamiento que puede tener como consecuencia una falla de la función ovárica.
A diferencia de los hombres adultos, en la mujer existen relativamente pocas opciones clínicas para preservar la fertilidad, especialmente si se va a someter a un tratamiento agresivo con quimioterapia y/o radioterapia. La criopreservación embrionaria es, en la actualidad, la alternativa más probada y con mayores tasas de efectividad. Sin embargo, para acceder a ella la mujer debe tener pareja y no presentar reparos morales al procedimiento. La transposición ovárica antes de la radioterapia también se considera como un método probado, pero el resto de estos tratamientos son todavía experimentales y su eficacia y fiabilidad aún no han sido bien determinadas. La preservación de la fertilidad es especialmente desafiante en las niñas, ya que en ellas la criopreservación embrionaria u ovocitaria no es posible. Actualmente, la única opción que puede ofrecerse a pacientes pediátricas es la criopreservación de tejido ovárico. A pesar de esto, el futuro de las distintas estrategias para preservar la función ovárica en la mujer es promisorio.
Indicaciones para preservación de la fertilidad1- Preservación de la función ovárica en la paciente con cáncerEs la indicación más frecuente para preservar la fertilidad en la mujer. Las tasas de sobrevida para niñas y mujeres en edad reproductiva que presentan un cáncer han mejorado en forma dramática. En los últimos 25 años, en la población femenina la tasa relativa de sobrevida a 5 años para todos los cánceres en forma combinada mejoró de un 56% a un 64% (1). En particular, la sobrevida a 5 años para el cáncer de mama se está acercando al 90%. Entre 1974/1976 y 1989/1996 la tasa de sobrevida relativa para los cánceres de la infancia en forma combinada ha mejorado de un 56% a un 75% (2). Se ha calculado que en el año 2000 uno de cada 1000 adultos era un sobreviviente de un cáncer en la niñez (1) y para el año 2010 se estima que este número será de 1 en 250 (3). Es por esto que la preservación de la fertilidad en las niñas, adolescentes y mujeres adultas en edad reproductiva ha comenzado a ser más relevante. En mujeres en edad fértil con cáncer, la demanda para procedimientos de preservación de la fertilidad está dada principalmente por pacientes con linfoma de Hodgkin, que es el tumor sólido más frecuente en adolescentes y pacientes con cáncer de mama, que es la neoplasia más común en mujeres maduras occidentales.
En la patología oncológica, la quimioterapia combinada constituye la base de los tratamientos adyuvantes modernos y frecuentemente tiene como secuela a largo plazo una falla ovárica prematura. Mientras que el daño citotóxico es reversible en algunos tejidos de rápida división celular, parece ser progresivo e irreversible en el ovario, donde el número de células germinales es limitado y fijo desde la vida fetal. El mecanismo exacto de la falla ovárica inducida por quimioterapia es poco conocido, pero luego del tratamiento con quimioterapia los estudios histológicos muestran atrofia ovárica con pérdida marcada de folículos primordiales y destrucción de una porción significativa de folículos ováricos en cada curso de quimioterapia. Los quimioterápicos de alto riesgo de gonadotoxicidad son Ciclofosfamida, Clorambucilo, Melfalán, Mostaza Nitrogenada y Procarbazina. Los de riesgo intermedio son el Cisplatino y la Adriamicina y los de bajo o nulo riesgo son Metotrexate, 5-Fluoracilo, Vincristina, Bleomicina y Actinomicina D (4).
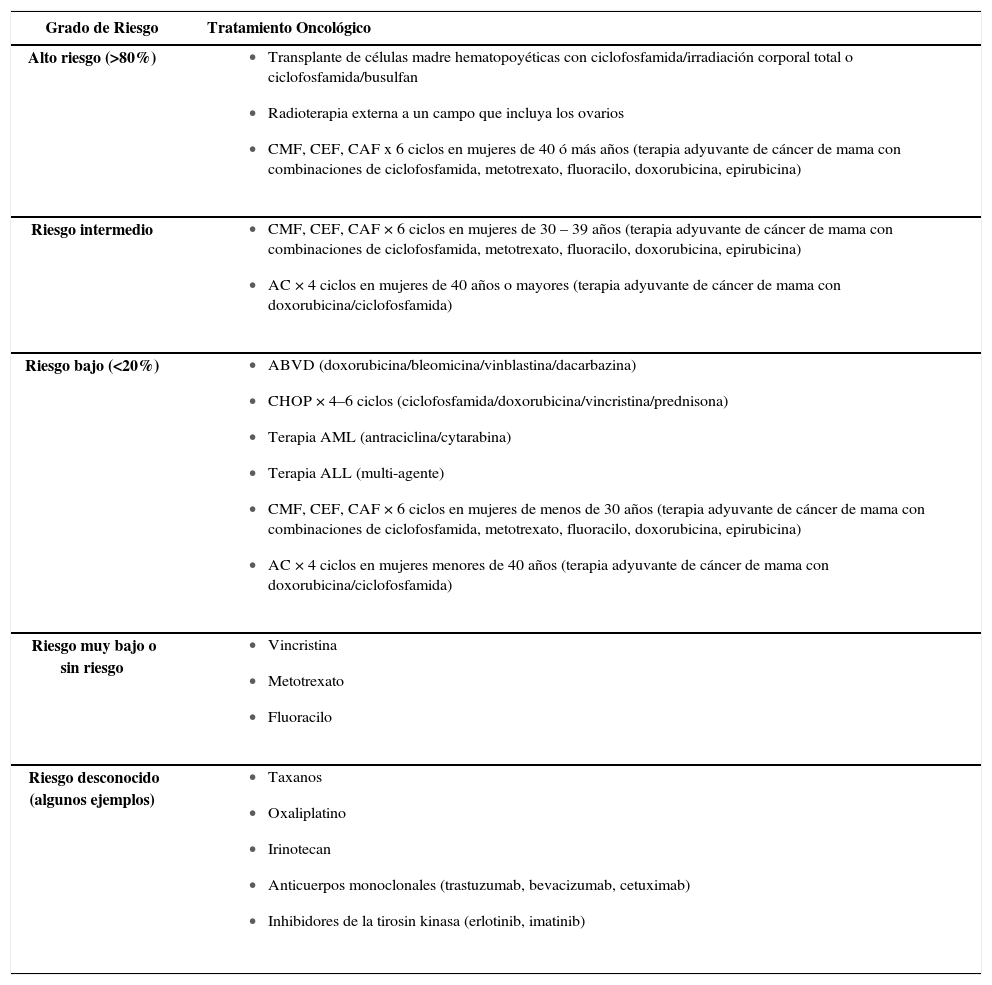
La probabilidad de que una paciente experimente falla ovárica luego de un tratamiento con quimioterapia se asocia a la edad de la paciente y al régimen específico de quimioterapia administrado (drogas utilizadas y dosis acumulativa). La edad ha demostrado ser un fuerte predictor de la incidencia de menopausia después del tratamiento: a mayor edad la dosis de quimioterápico necesaria para producir daño gonadal irreversible es menor (6), (7). La dosis acumulativa de quimioterapia también se ha asociado al riesgo de menopausia posterior (6), pero no está claro si la duración del tratamiento o la intensidad de las dosis tienen efectos independientes a la dosis acumulativa. En la Tabla 1 aparecen los distintos grados de riesgo de amenorrea permanente en mujeres tratadas con esquemas de quimioterapia modernos y radioterapia, publicados en las Recomendaciones en la Preservación de la Fertilidad de Pacientes con Cáncer de la Sociedad Americana de Oncología Clínica (5). Estas son recomendaciones generales basadas en la mejor literatura disponible.
Riesgos de amenorrea permanente en mujeres tratadas con esquemas de quimioterapia modernos y radioterapia, publicados en las recomendaciones en la preservación de la fertilidad de pacientes con cáncer de la sociedad americana de oncología clínica (5) (modificado)
| Grado de Riesgo | Tratamiento Oncológico |
|---|---|
| Alto riesgo (>80%) |
|
| Riesgo intermedio |
|
| Riesgo bajo (<20%) |
|
| Riesgo muy bajo o sin riesgo |
|
| Riesgo desconocido (algunos ejemplos) |
|
Una aparente reanudación de la función ovárica después de la quimioterapia no descarta una reducción significativa en la reserva ovárica. Incluso, el tratamiento para el cáncer puede depletar en forma importante la reserva folicular en las niñas. Estas pacientes no debieran diferir sus embarazos, ya que tienen mayor riesgo de falla ovárica prematura.
Los ovocitos son también muy sensibles a la radiación, que produce una reducción dosis dependiente en el número de folículos ováricos. Se ha calculado que la exposición ovárica a una dosis de 1.99 Gy produce una destrucción del 50% de los folículos primordiales (LD50) (8). Esto no solo ocurre por radiación directa a nivel pélvico, sino que también puede ocurrir si ésta es aplicada sobre otras áreas del cuerpo. La edad al momento de la exposición, la extensión y tipo de radiación y la programación del fraccionamiento de la terapia son factores pronósticos importantes de la función ovárica futura. En general, la radiación es más tóxica cuando es aplicada en una sola dosis comparada con dosis fraccionadas. La radiación corporal total se utiliza en regímenes de acondicionamiento antes del transplante de células madre de médula ósea para erradicar la médula ósea del huésped (ej. en leucemias) y se asocia, comúnmente, a falla ovárica posterior (9, 10).
Aunque la función ovárica no se pierda o se reanude posteriormente, el riesgo de falla ovárica prematura siempre es alto en mujeres que han recibido altas dosis de radiación pélvica o abdominal. Además, si se logra un embarazo, estas mujeres tienen un riesgo aumentado de complicaciones que incluyen aborto precoz, parto prematuro y bajo peso de nacimiento, asociado a flujo sanguíneo y crecimiento uterino disminuido.
La evidencia disponible sugiere que la preservación de la fertilidad es muy importante para muchos pacientes a los que se les ha diagnosticado un cáncer, y que la infertilidad resultante de los distintos tratamientos puede causar un estrés psicosocial considerable. A pesar de esto, se ha reportado que los oncólogos no discuten este tema de la forma como lo hacen sobre otros efectos derivados del tratamiento y los pacientes quedan insatisfechos con la cantidad y calidad de información dada por el médico.
Por último, fuera de algunos síndromes genéticos hereditarios, no hay evidencia de que una historia de cáncer, un tratamiento por cáncer o intervenciones destinadas a preservar la fertilidad aumenten el riesgo de problemas en la descendencia. Publicaciones que incluyen estudios de numerosos registros han revelado que no hay mayor riesgo de anomalías genéticas, defectos de nacimiento o cáncer en los hijos de sobrevivientes de cáncer. Asimismo, la información disponible es tranquilizadora, en el sentido de que no hay un aumento del riesgo en la salud de un sobreviviente de cáncer que ha utilizado procedimientos para preservar la fertilidad o que se ha embarazado posteriormente.
2- Pacientes que serán sometidas a un transplante de médula ósea o a un transplante de células madreEl transplante de médula ósea actualmente se utiliza para patologías oncológicas y no oncológicas. Antes de un transplante de médula ósea o de células madre se utilizan altas dosis de quimioterapia y/o radioterapia para lograr una ablación de la médula ósea. Desafortunadamente, este tratamiento resulta en una falla ovárica en casi todas las pacientes (11).
3- Enfermedades hematológicas y autoinmunesAlgunas enfermedades hematológicas, como la anemia de células falciformes, talasemia mayor o anemia aplástica se tratan con agentes quimioterapéuticos o con radioterapia. De la misma forma, en pacientes con carditis lúpica severa y en otras enfermedades autoinmunes, como las glomerulonefritis, el tratamiento con Ciclofosfamida se utiliza cada vez con mayor frecuencia.
4- Retraso de la maternidaEn la sociedad actual el retraso de la maternidad es una tendencia cada vez más marcada. Como resultado, muchas mujeres tienen dificultades para lograr un embarazo por la disminución de la reserva ovárica asociada a la edad. En ciclos de donación de ovocitos se ha visto que la edad de la receptora parece no tener un rol en la probabilidad de éxito del tratamiento, por lo que la criopreservación de ovocitos ofrece a mujeres jóvenes fértiles, sin deseos de ser madres en ese momento, la posibilidad de ser sus propias donantes en el futuro. Los embarazos a una edad avanzada se asocian a más complicaciones, pero se pueden esperar buenos resultados en la ausencia de condiciones médicas de base y con un adecuado manejo obstétrico.
5- Pacientes con síndrome de TurnerEl síndrome de Turner se caracteriza por la pérdida acelerada de folículos primordiales, lo que deriva en una disgenesia gonadal. En las mujeres con Síndrome de Turner en mosaico, el desarrollo folicular puede persistir hasta después de la pubertad. En las pacientes con Síndrome de Turner no mosaico se ha propuesto la criopreservación de tejido ovárico entre los 12–13 años de edad (12), ya que al examinar el tejido ovárico se encuentran folículos en la mayoría de ellas. Hay que tener en cuenta que en estas pacientes hay un aumento de la incidencia de no-disyunciones meióticas, por lo que tienen alto riesgo de aborto, mortinatalidad y malformaciones congénitas. Además, pueden presentar una disección o ruptura aórtica durante el embarazo con un riesgo muerte materna estimado en un 2%.
6- Ooforectomía indicada por tumores ováricos benignos, malignos o endometriomasEn muchos centros, a pacientes con neoplasias benignas del ovario o endometriomas se les realiza una ooforectomía o una quistectomía sin tener el cuidado suficiente para tratar de minimizar el daño sobre los folículos ováricos remanentes, lo que es fundamental para la reserva ovárica futura. Por otro lado, en algunos cánceres ginecológicos, diagnosticados en etapas precoces (endometrio, ovario o cérvix uterino), se pueden realizar tratamientos quirúrgicos conservadores, que permiten mantener la capacidad de embarazarse.
Estrategias para la preservación de la fertilidad en la mujer1Protección hormonal con análogos de la GnRHAl parecer los ovarios prepuberales son menos sensibles a los agentes alquilantes (13, 14). Basado en esto, algunos investigadores han intentado imitar este estado usando análogos de la hormona liberadora de gonadotrofinas (aGnRH) durante el tratamiento con quimioterapia, con la intención de proteger la función ovárica. El mecanismo exacto por el cual estos medicamentos protegerían al ovario no es bien conocido, pero puede estar relacionado a la inhibición de la actividad mitótica ovárica durante la administración de GnRH. No obstante, la mayoría de los folículos ováricos se encuentran en estadío de folículos primordiales, que son independientes de la acción de las gonadotrofinas y tienen menor riesgo de citotoxicidad que los folículos en desarrollo.
En el trabajo más grande publicado, Blumenfeld (15) muestra los resultados de un estudio prospectivo no randomizado donde se compara la recuperación de la función ovárica en pacientes tratadas con distintos esquemas de quimioterapia por linfoma de Hodgkin, con o sin el uso concomitante de aGnRH. Se observó la recuperación de menstruaciones regulares y ovulación en un 96.9% de las mujeres de grupo tratado con aGNRH y en un 63% del grupo control.
Recchia y cols. (16) publicaron un estudio en que se evaluó en forma retrospectiva 100 mujeres premenopáusicas con cáncer de mama precoz de alto riesgo, que recibieron un aGnRH como protección ovárica durante la quimioterapia adyuvante. Luego de un seguimiento de 75 meses, todas las pacientes menores de 40 años y un 56% de las mayores de 40 años reanudaron una función menstrual normal. Se observaron tres embarazos, que resultaron en 2 partos y un aborto voluntario. Las tasas proyectadas de sobrevida libre de recurrencia a 5 y 10 años fueron de 84% y 76% y las tasas proyectadas de sobrevida global a 5 y 10 años fueron de 96% y 91%. En otra publicación reciente también se concluyó que la administración de aGnRH antes y durante la quimioterapia combinada en pacientes con cáncer de mama puede preservar la función ovárica en mujeres menores de 40 años (17).
En el Hospital Clinic de Barcelona se realizó un protocolo de prevención de falla ovárica en pacientes con Linfoma de Hodgkin. Treinta mujeres utilizaron una inyección mensual de aGnRH desde antes del inicio de la quimioterapia hasta su finalización y el grupo control fueron 27 mujeres de edades comparables que se trataron con esquemas similares de quimioterapia sin el uso de aGnRH. De las mujeres tratadas con análogos, 27 recuperaron sus ciclos menstruales (90%), en comparación a ocho del grupo control (18).
A pesar de estas publicaciones, la eficacia de la protección de la función ovárica mediante el uso de aGnRH en pacientes sometidas a tratamientos citotóxicos es controversial, ya que hasta la fecha no existen en la literatura estudios prospectivos y randomizados con un número importante de pacientes que así lo avalen. Lo que está claro es que los análogos no pueden proteger los folículos primordiales ováricos de la radioterapia (19). Tal vez, una aproximación juiciosa al tema de la preservación de la fertilidad en la mujer joven, sería utilizar análogos en todas las mujeres en edad reproductiva que reciben quimioterapia junto con otras estrategias para preservar la fertilidad.
2Transposición ovárica antes de la radioterapiaUno de los tratamientos de la patología oncológica del tracto urinario o genital, del intestino bajo y de algunos linfomas de Hodgkin es la radiación pélvica local. El hecho de mover los ovarios fuera del campo de radiación evita los efectos directos de ésta sobre las gónadas. A este procedimiento se le denomina ooferopexia o transposición ovárica y se realiza actualmente por laparoscopía, seccionando los ligamentos útero-ováricos y suspendiendo lateralmente los ovarios a un nivel sobre el borde pelvico (20). Al final del procedimiento se coloca un clip metálico en el ovario de modo que el radioterapeuta lo pueda ubicar y dejar fuera del campo de radioterapia. La ooforopexia por vía laparoscópica es simple, segura y efectiva, permite no retrasar el inicio de la radioterapia y con este procedimiento el ovario recibe solo el 5–10% de la dosis de radioterapia. El procedimiento realizado inmediatamente antes de la radioterapia pélvica parece ser efectivo en preservar la función ovárica (21, 22) y se ha reportado la preservación de la función ovárica en un 88% de las pacientes menores de 40 años (23). Las fallas estarían dadas por alteraciones en la irrigación del ovario y por la misma radiación.
Cuando se desea un embarazo no siempre es necesario reposicionar el ovario, ya que se han reportado gestaciones espontáneas en mujeres a las que se les ha hecho este procedimiento. En el caso que la paciente no se embarace es necesario reubicar los ovarios o realizar un procedimiento de reproducción asistida con aspiración folicular, que puede ser técnicamente más difícil por la posición de las gónadas.
Las posibles complicaciones de este procedimiento son la posterior formación de quistes ováricos, daño en la irrigación del ovario, formación de adherencias y dolor pélvico crónico, además de la rara posibilidad de metástasis ováricas y la mayor dificultad para diagnosticar un cáncer de ovario posterior.
La combinación de criopreservación de tejido ovárico con transposición ovárica puede maximizar las opciones de fertilidad futura en mujeres que se enfrentan a una radioterapia pélvica. Este enfrentamiento mixto debe estar incluido entre las opciones que se ofrecen a las mujeres en edad fértil antes de una radiación pélvica.
3Criopreservación de embrionesDe acuerdo a la Sociedad Americana de Oncología Clínica y el Comité de Ética de la Sociedad Americana de Medicina Reproductiva la fecundación in vitro (FIV) con criopreservación de embriones es el procedimiento más establecido para preservar la fertilidad en la actualidad (5), (24). Existen 2 técnicas para criopreservar embriones: la congelación lenta convencional y la criopreservación rápida por vitrificación, con la que se logra una solidificación similar al vidrio sin la formación de cristales de hielo. Utilizando la técnica de congelación lenta la tasa de sobrevida de los embriones descongelados es de hasta un 75% y las tasas de embarazo por transferencia fluctúan entre 20 y 30%. En contraste, la vitrificación se asocia con un 90% de sobrevida a la descongelación (25) y las tasas de embarazo también son superiores (26).
El problema es que la mujer con cáncer que requiere preservar su fertilidad a través de la criopreservación embrionaria debe tener pareja y estar dispuesta a realizar el procedimiento. Por otro lado, en casi todas estas pacientes hay una importante limitación de tiempo y no es posible demorar el inicio del tratamiento oncológico. Por este motivo, pocas veces se puede realizar un protocolo estándar de estimulación de la ovulación, que requiere entre 2 y 6 semanas. Actualmente, se puede utilizar un protocolo con antagonistas de GnRH, que es más corto que un protocolo habitual con agonistas de GnRH. También se ha propuesto el inicio de la estimulación ovárica con FSH recombinante en la fase lútea, previa administración de antagonistas de GnRH para disminuir la LH endógena e inducir la luteólisis (27). Una última alternativa es la aspiración de ovocitos inmaduros, madurarlos in vitro, fecundarlos y criopreservar los embriones obtenidos.
La estimulación ovárica con gonadotrofinas tiene como consecuencia una alta concentración de estrógenos circulantes, que pueden ser deletéreos para algunas neoplasias dependientes de estrógenos, como el cáncer de mama. Por esta razón, algunos centros han ofrecido la aspiración ovocitaria en un ciclo no estimulado (FIV en ciclo natural), pero las tasas de cancelación son altas y las tasas de embarazo son muy bajas (7.2% por ciclo y 15.8% por transferencia embrionaria). Recientemente se ha investigado el uso de inhibidores de la aromatasa en pacientes con cáncer de mama. Estos medicamentos se asocian a niveles de estrógeno mucho más bajos, lo que puede ser favorable para tumores sensibles a esta hormona. En Julio del año 2005 se publicó un trabajo en que se comparó la estimulación ovárica con Tamoxifeno y Letrozole para la criopreservación embrionaria en estas pacientes (28). Se concluyó que la combinación de FSH en dosis bajas con Tamoxifeno o Letrozole resulta en un número mayor de embriones que con el uso de solo Tamoxifeno, pero el protocolo que utiliza Letrozole puede ser mejor, ya que resulta en menores niveles de estrógenos. Las tasas de recurrencia no parecen estar aumentadas en el grupo que se sometió a un IVF.
Por último, otro problema asociado a la estimulación es el riesgo de que estas pacientes puedan presentar un Síndrome de Hiperestimulación Ovárica, que podría retrasar más el inicio del tratamiento del cáncer.
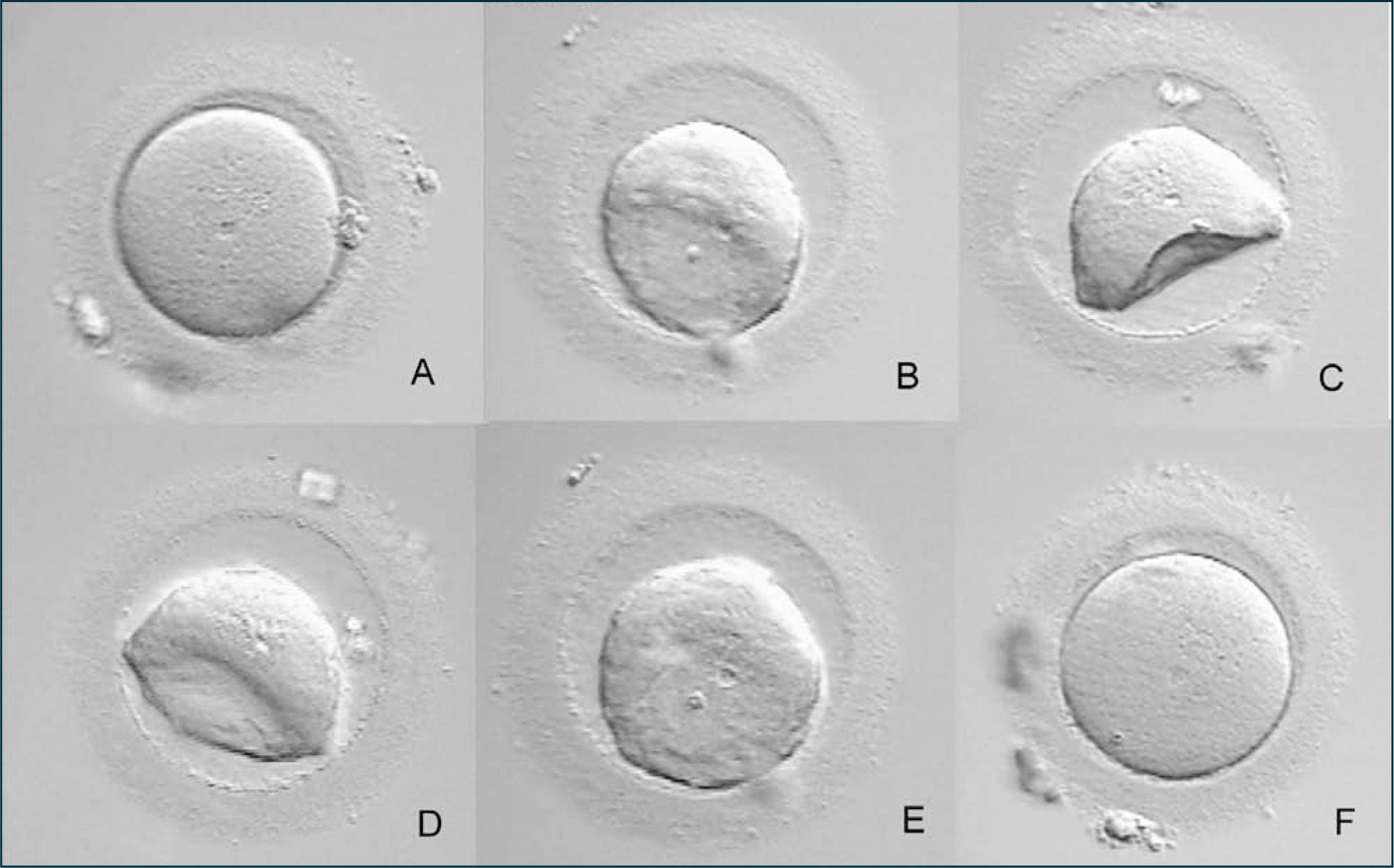
4Criopreservación de ovocitos para una FIV futura (foto 1)La criopreservación de ovocitos evita todos los cuestionamientos éticos y morales de la criopreservación embrionaria. En el año 1986, Chen (29) reportó el primer recién nacido vivo humano de un ovocito criopreservado y descongelado y desde entonces se ha publicado un número creciente de embarazos y nacidos vivos utilizando esta técnica. Hasta marzo de 2008 había reportados 150 nacidos con la técnica de congelación lenta de ovocitos (en más de 20 años) y más de 500 mediante vitrificación (en 8 años). Cuando se analizan los datos de 21 estudios publicados (4) se encuentra una tasa promedio de sobrevida ovocitaria de un 47%, una tasa de fecundación de un 52.2% y una tasa media de embarazo por ovocito descongelado de un 1.52%. Oktay y cols. (30) publicaron recientemente una revisión de la literatura que evalúa la eficiencia de la criopreservación de ovocitos. Los datos de congelación lenta mostraron una mejoría gradual en el tiempo, con tasas de nacidos vivos por transferencia que aumentaron de 21.6% entre 1996 y 2004 a 32.4% entre 2002 y 2004. La tasa de embarazo clínico por ovocito descongelado en el período comprendido entre 1996 y 2005 fue de un 2.3%. Utilizando vitrificación los datos siguieron una tendencia similar, con tasas de nacidos vivos y de embarazo en curso que aumentaron de 29.4% antes de 2005 a 39% después de 2005. Al igual de lo que ha sucedido con la criopreservación embrionaria, las tasas de sobrevida post-descongelación de ovocitos vitrificados han mejorado y las tasas de fecundación y de desarrollo embrionario están de a poco comenzando a competir con las de ovocitos frescos, aunque las tasas de embarazo por ovocito descongelado siguen siendo bajas. Por los buenos resultados obtenidos y la mayor simpleza del procedimiento, la vitrificación es la técnica de criopreservación ovocitaria que más se está utilizando en la actualidad.
La tasa de aborto espontáneo en los embarazos originados de ovocitos criopreservados fue inicialmente alta -entre 28.6 y 50%-, pero con el tiempo se ha visto una disminución de estos porcentajes, que va en paralelo con el aumento de las tasas de nacidos vivos (0 – 20%) (30-32). El número de nacimientos con vitrificación de ovocitos es aún muy bajo para determinar con exactitud la tasa de aborto espontáneo, pero datos iniciales sugieren que es baja (30, 33).
Dada la mejoría en las tasas de sobrevida a la criopreservación y tasas de fecundación, embarazo y parto, la criopreservación de ovocitos se puede usar como un procedimiento para preservar la fertilidad. A pesar de esto, como las tasas de embarazo aún no son lo suficientemente altas, no se justifica su uso rutinario en la práctica clínica.
Los mismos problemas planteados respecto a la demora del inicio del tratamiento, por el tiempo necesario para la estimulación de la ovulación, los riesgos asociados al aumento de los niveles de estrógenos y un potencial Síndrome de Hiperestimulación Ovárica, descritos en la criopreservación de embriones, son válidos para la criopreservación de ovocitos.
Maduración in vitro de ovocitosUna estrategia que elimina el atraso en el inicio del tratamiento de la enfermedad de base y los riesgos asociados a la estimulación ovárica (aumento de los niveles de estrógeno y Síndrome de Hiperestimulación Ovárica) es la recuperación de ovocitos inmaduros en un ciclo espontáneo, seguido por una maduración in vitro y posterior vitrificación de los ovocitos maduros. En un estudio piloto de 20 pacientes tratadas con este régimen se reportó una tasa de recién nacido vivo de 20%, con 4 recién nacidos sanos (34),(35). La media entre la consulta inicial y la aspiración folicular fue de 7 días. Los ovocitos inmaduros también se pueden aspirar en la fase lútea del ciclo y se prefiere la criopreservación de ovocitos madurados in vitro que la criopreservación de ovocitos inmaduros para su posterior maduración post descongelación, ya que con esta última aproximación los resultados obtenidos son peores.
Otra ventaja de esta estrategia de preservación de fertilidad es que se podrían obtener ovocitos inmaduros directamente de la corteza ovárica en pacientes a las que se les realiza una ooforectomía total o parcial, con el fin de criopreservar tejido ovárico, para luego madurarlos in vitro y criopreservarlos (36).
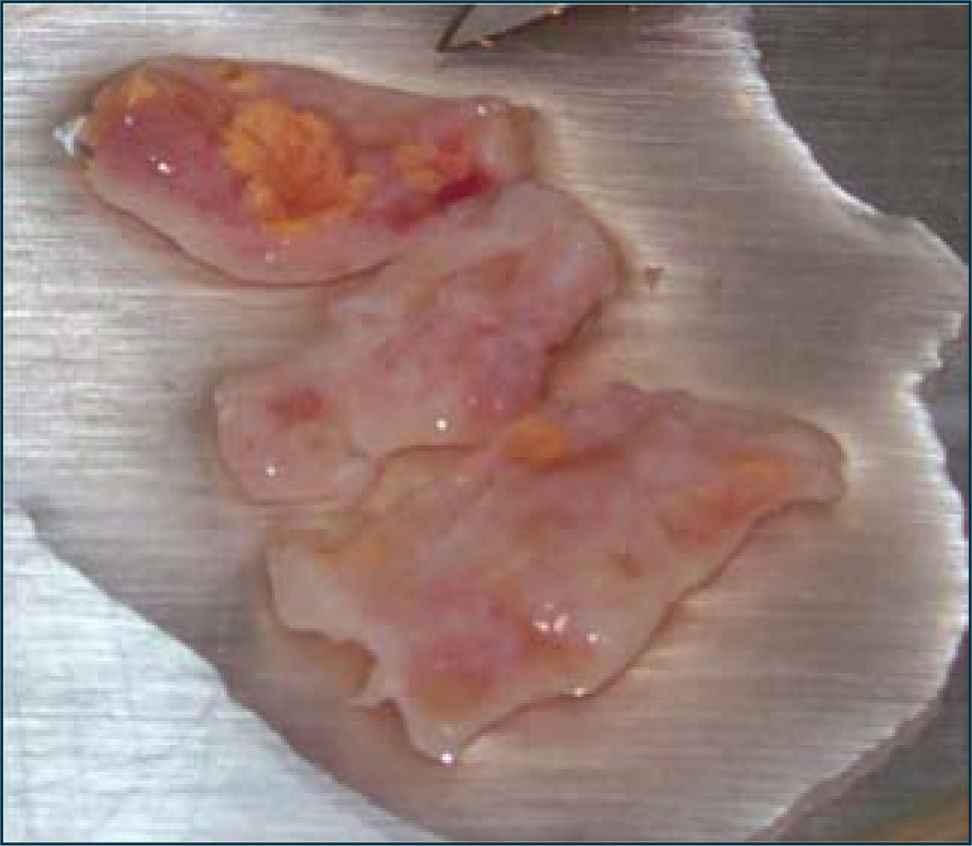
5- Criopreservación de tejido ovárico para un transplante futuro (foto 2)La finalidad de este tratamiento es recuperar la fertilidad mediante el reimplante del tejido ovárico una vez que el tratamiento citotóxico se ha completado y la paciente esté sana. La obtención del tejido debe realizarse, idealmente, antes de comenzar la quimioterapia o, por lo menos, antes del tratamiento con altas dosis de agentes alquilantes, ya que estos son los que tienen más probabilidad de producir daño ovárico irreversible. Además de la probabilidad de preservar la fertilidad, el injerto ovárico puede ser una fuente de esteroides sexuales naturales.
La técnica de criopreservación de tejido ovárico humano fue publicada por Gosden en el año 2002 (37). Los estudios que investigan los efectos del daño de la criopreservación en el tejido ovárico son limitados, al compararlos con aquellos que estudian los mismos efectos en los ovocitos. A diferencia de una célula aislada, la criopreservación de tejido presenta serias restricciones físicas que interfieren con la congelación y, debido a que se trata de una estructura multicelular, la dinámica de penetración del crioprotector es sumamente importante para la sobrevida subsecuente del tejido. En la criopreservación de tejido ovárico se observa una mejor sobrevida de los folículos primordiales, por su menor tamaño y ausencia de líquido folicular.
Las técnicas laparoscópicas descritas para la obtención de corteza ovárica son dos: se pueden tomar muestras de biopsias de tejido ovárico, de más o menos 12–15mm. de longitud por 5mm. de diámetro (38), o se puede realizar una ooforectomía unilateral (39) en cualquier momento del ciclo menstrual. Se estima que se debe obtener al menos un tercio de la corteza de un ovario para contar con tejido suficiente para criopreservar y tener posibilidades de fertilidad futura. En las pacientes pediátricas, en cambio, se prefiere realizar una ooforectomía unilateral. La técnica quirúrgica utilizada debe ser muy cuidadosa, con el fin de evitar la formación de adherencias que, en el futuro, le provoquen a la mujer un factor tubo-peritoneal que empeore su pronóstico reproductivo.
Utilidad potencial del tejido ovárico criopreservadoEn humanos, se ha demostrado el restablecimiento de la función endocrina y de la función reproductiva después del autotransplante de tejido ovárico. Luego de descongelado, el tejido ovárico puede autotransplantarse en forma ortotópica (cercano a los ligamentos infundibulopélvicos o en un ovario remanente) o heterotópica (en un sitio distinto de la cavidad pélvica).
Es necesario tener en cuenta que el autotransplante no se puede realizar en pacientes con cáncer que tienen alto riesgo de metástasis ovárica. Este riesgo depende del tipo de neoplasia, la actividad de la enfermedad, el estadío y la masa de células malignas transferidas. En todo caso, las metástasis ováricas son raras en los cánceres más comunes que afectan a mujeres jóvenes, como el Linfoma de Hodgkin.
Transplante Ortotópico: La ventaja del transplante ortotópico es la posibilidad de la concepción natural. A la fecha, hay varios reportes de autotransplante ortotópico de tejido ovárico humano criopreservado. De éstos, seis resultaron en un embarazo.
El primer nacido vivo con esta técnica fue reportado en al año 2004 (38) en una mujer con Linfoma de Hodgkin, a la que se tomaron muestras de corteza ovárica antes de comenzar la quimioterapia. A los cuatro años se le reimplantó el tejido ovárico descongelado, por vía laparoscópica, en una ventana peritoneal cerca de los vasos ováricos y de la fimbria derecha. Luego de cinco meses se reiniciaron ovulaciones mensuales demostradas por ecografía y niveles de progesterona. Al noveno mes se desarrolló un folículo de 26mm. en el lado derecho, claramente por fuera del ovario, visualizándose además los dos ovarios atróficos remanentes. Este ciclo resultó en un embarazo espontáneo seguido por el nacimiento de una niña sana. Se le critica a este caso que no se puede descartar que la ovulación que originó el embarazo haya sido verdaderamente del tejido ovárico injertado, a pesar de que la paciente se encontraba en falla ovárica.
El segundo embarazo fue reportado en año 2005 (40) en una mujer de 28 años que quedó con una falla ovárica secundaria a una quimioterapia de alta dosis por la recurrencia de un Linfoma no Hodgkin. Se obtuvo tejido ovárico que contenía muchos folículos primordiales luego de la administración de un régimen de quimioterapia convencional de segunda línea. A los 24 meses se le transplantó el tejido ovárico criopreservado al ovario izquierdo remanente. Ocho meses después se observó un folículo preovulatorio y al mes siguiente se constataron niveles normales de FSH, LH y estradiol. Se realizo una fecundación in vitro en un ciclo natural modificado, donde se aspiró un ovocito maduro y se transfirió un embrión de cuatro células, consiguiéndose un embarazo normal y una recién nacida sana.
El tercer embarazo fue reportado el año 2006 (41). Se trata de una mujer que presentó un Linfoma de Hodgkin a los 24 años de edad a la que se le realizó una ooforectomía laparoscópica para criopreservación de tejido ovárico. Se le había administrado previamente un ciclo de Adramicina, Bleomicina, Vincristina y Dacarbazina. Luego del tratamiento, la enfermedad rápidamente recurrió, por lo que fue necesario realizar un transplante autólogo de médula ósea. La paciente quedó curada pero en falla ovárica. Cuatro años después se realizó el autotransplante del tejido a dos sitios, al ovario izquierdo atrófico y a un bolsillo peritoneal. También se transplantaron algunos fragmentos en forma subcutánea sobre la incisión abdominal izquierda utilizada para el trócar. Tres meses después de transplante, los niveles séricos de FSH comenzaron a disminuir, en forma concomitante con un aumento de los niveles de Inhibina B. Luego de esto, se documentaron cinco ovulaciones y menstruaciones espontáneas consecutivas, observándose desarrollo folicular en todos los sitios transplantados. Los folículos dominantes de mayor tamaño fueron los del sitio ovárico. Los folículos que se desarrollaron en el tejido subcutáneo nunca crecieron hasta un tamaño suficiente para ser puncionados (máximo 13mm.). En agosto del 2005 la paciente presentó un embarazo intrauterino con un aborto espontáneo posterior. El estudio citogenético mostró una triploidía asociada a una tetrasomía del cromosoma 10. Recientemente, se reportó un segundo embarazo espontáneo en esta misma paciente, luego de repetir el transplante orto y heterotópico. El embarazo llegó a término y se obtuvo un parto a las 41 semanas, con una recién nacida sana (42).
Andersen y cols. (43) reportaron el año 2008 los casos de seis pacientes de edades entre 26 y 35 años a las que se les criopreservó un ovario completo antes del tratamiento con quimioterapia. En todas ellas se recuperó la ciclicidad menstrual a las 14–20 semanas post transplante. Cuatro de las seis pacientes se embarazaron después de un tratamiento de reproducción asistida: en dos mujeres (cuyo tejido ovárico había sido transportado en hielo por 4–5 horas antes de la criopreservación) se obtuvo el parto de un niño sano, otra presentó un aborto espontáneo a las 7 semanas y la última paciente tuvo un embarazo bioquímico.
Por último, el grupo de Silber reportó una serie de 8 pares de gemelas monocigóticas discordantes para falla ovárica prematura. Siete gemelas con falla ovárica recibieron un transplante de tejido cortical fresco y una de ellas también recibió tejido criopreservado luego de que el primer transplante dejara de funcionar a los 3 años. La octava recibió un transplante microvascular en fresco. Todas las receptoras reiniciaron ciclos menstruales ovulatorios espontáneos, con normalización de los valores de FSH a los 77–142 días. Seis mujeres se han embarazado espontáneamente (una de ellas 2 veces). Al momento de la publicación, habían nacido dos bebés sanos y otros tres embarazos estaban en curso. El transplante más antiguo funcionó por 36 meses, resultando en un recién nacido y un aborto espontáneo posterior. Esta mujer se volvió a embarazar después de un transplante de tejido ovárico criopreservado, no encontrándose diferencias evidentes entre el retorno de la función ovárica de este tejido criopreservado al compararlo con los transplantes en fresco (44).
Transplante Heterotópico: La duración de los injertos de ovario parece no ser muy prolongada y la repetición del transplante puede ser necesaria en algunos casos. Es por esto que podría ser conveniente utilizar sitios heterotópicos para el transplante, como el tejido subcutáneo y así evitar procedimientos invasivos para la recuperación de ovocitos. Hay varios reportes de transplante heterotópico de tejido ovárico, tanto en fresco, como después de ser criopreservado y descongelado, generalmente al brazo o al abdomen (45, 46) pero, en contra de lo esperado, en estos casos es difícil obtener ovocitos normales para FIV.
Por todo lo anteriormente expuesto, la criopreservación de tejido ovárico solo puede ser recomendada como un procedimiento experimental para pacientes cuidadosamente seleccionadas. Es importante enfatizar que hay una tendencia creciente a ofrecer esta alternativa en muchos centros, solo por su potencial uso futuro. Como hay muchas preguntas sin responder acerca de cuál paciente es una candidata adecuada y de cuáles son los métodos óptimos para recolectar el tejido y criopreservarlo, la criopreservación de tejido ovárico, aún sin su transplante posterior, también debe considerarse experimental.
ConclusionesLos distintos métodos de preservación de la fertilidad se están desarrollando cada vez más y se utilizan en pacientes con cáncer que se verán expuestas a tratamientos que pueden afectar su fertilidad futura, en mujeres que quieren retrasar su fertilidad y en pacientes con algunas enfermedades reumatológicas en tratamiento con agentes quimioterápicos.
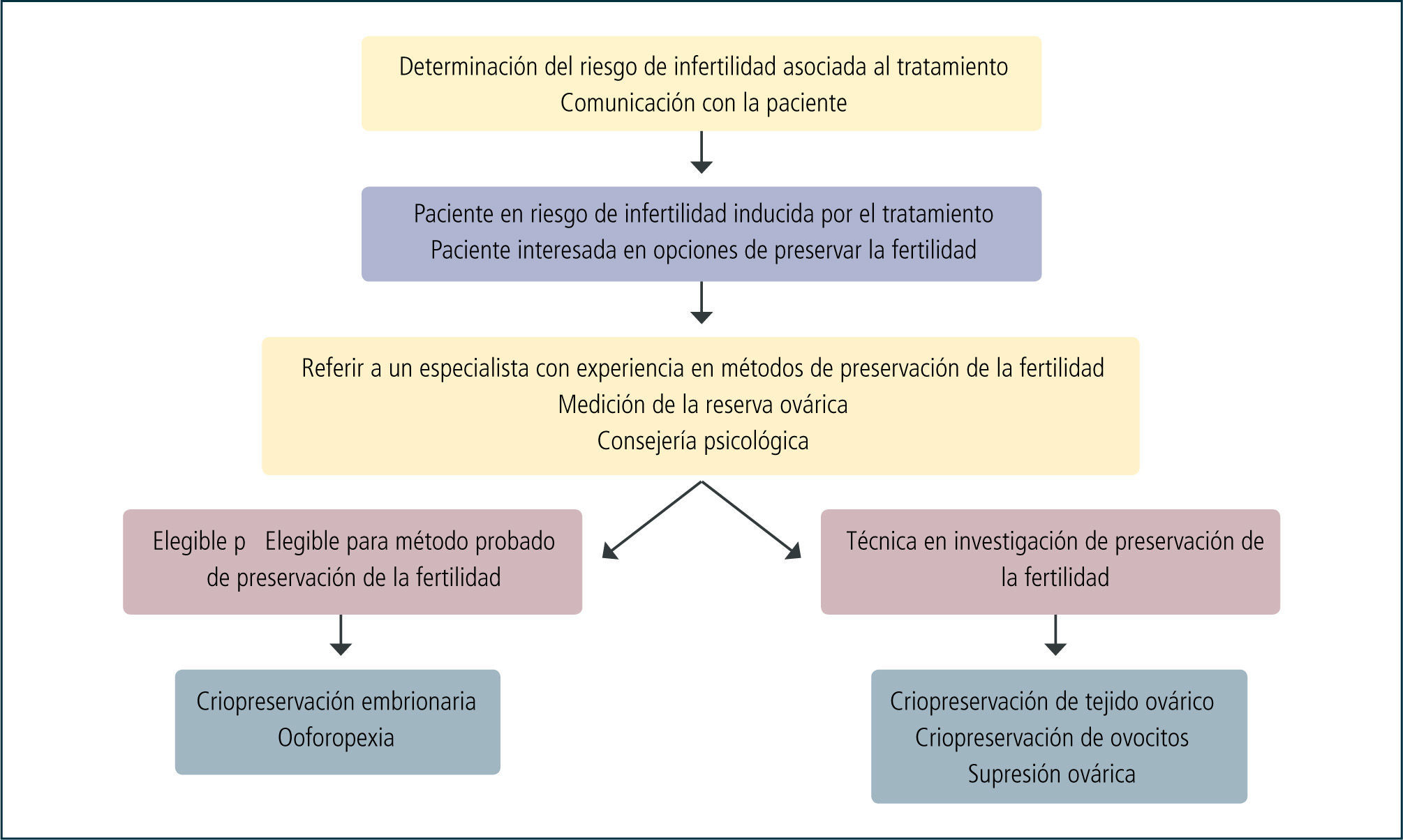
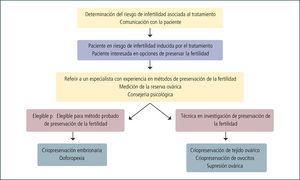
En la práctica de la oncología hay que tener presente que aunque la primera prioridad es el tratamiento de la enfermedad, no se pueden olvidar las importantes secuelas que éste puede tener en la fertilidad futura. Al peso emocional que produce el hecho de tener un cáncer se agregan otras preocupaciones, como la potencial falla ovárica, por lo que es imprescindible dar una completa información sobre las alternativas para prevenirla y las posibles opciones deben considerarse lo más temprano posible dentro de la planificación del tratamiento. Para esto, el trabajo en equipo entre los especialistas en oncología y fertilidad es imperativo para dar un cuidado médico adecuado a las pacientes con cáncer que desean preservar su fertilidad. En la Figura 3 se muestra un diagrama de flujo de cómo se debe referir y manejar una paciente en riesgo de infertilidad inducida por distintos tratamientos médicos.
A pesar de que existen varias alternativas para preservar la fertilidad en la mujer, ninguna es tan fiable como la preservación de la fertilidad en el hombre a través de la criopreservación espermática, y todas requieren procedimientos invasivos y/o la utilización de drogas. En la actualidad, la criopreservación embrionaria sigue siendo la alternativa más probada y con mejores tasas de efectividad, pero no se puede aplicar a todas las pacientes, ya que puede retrasar el tratamiento y requiere tener una pareja. Sin embargo, los avances en las otras tecnologías para preservar la fertilidad han avanzado bastante en la última década. En particular, la mejoría en las tasas de embarazo con la vitrificación de ovocitos son muy alentadoras y la criopreservación de tejido ovárico parece ser una opción para preservar la fertilidad en el futuro, especialmente en niñas. Es por todo esto que los profesionales médicos, los pacientes y sus familiares deben saber que, en algunas situaciones, la función reproductiva de la mujer se puede preservar. Aunque no es posible garantizar la fertilidad futura, actualmente se puede ofrecer una esperanza real a aquellas pacientes en riesgo de una falla ovárica prematura iatrogénica.
Aún existen muchos temas no resueltos relacionados con estas tecnologías. Aún así, se deben desarrollar programas de preservación de la fertilidad que tengan un enfoque exhaustivo en este tema, dependiendo de la edad y reserva ovárica de la paciente, presencia o ausencia de compromiso neoplásico de los ovarios, el tiempo disponible antes de comenzar el tratamiento oncológico y las distintas indicaciones para la preservación de la función ovárica.
Los aspectos éticos involucrados con la aplicación de estos procedimientos son desafiantes y siempre deben ser considerados en conjunto con la paciente y su oncólogo, ya que uno de los más relevantes está relacionado con la sobrevida. A pesar de que la mayoría de las estrategias para preservar la fertilidad son experimentales en este momento, los esfuerzos incesantes para mejorar los distintos tratamientos, eventualmente, van a beneficiar a muchas niñas y mujeres con cáncer en el futuro. Además, tecnologías innovadoras y posiblemente revolucionarias están actualmente en desarrollo, las cuales, una vez establecidas, pueden cambiar el enfoque actual en la preservación de fertilidad en mujeres con cáncer. Por todo lo anteriormente expuesto, no se debe negar la oportunidad de preservar la fertilidad a una mujer.
Por ahora, la combinación de varias de las modalidades que existen para una paciente específica pueden aumentar las posibilidades de preservar su fertilidad. Por ejemplo, no hay contraindicación para realizar una biopsia ovárica u ooforectomía unilateral para criopreservación de tejido y aprovechar de aspirar ovocitos inmaduros de la corteza ovárica, para luego madurarlos in vitro y criopreservarlos. Esto, además, se puede asociar a la administración de análogos de la GnRH durante el tratamiento con quimioterapia, como otra forma de proteger la función de él o los ovarios remanentes.
La autora declara no tener conflictos de interés, en relación a este artículo.