La prevención del parto prematuro es uno de los desafíos de la obstetricia en el siglo XXI. Los prematuros tienen riesgo de morbimortalidad perinatal, sobre todos los nacidos antes de las 30 semanas, tienen mayor riesgo de lesiones neurológicas generalmente secundarias a isquemia o infección intrauterina ascendente. Existen estrategias para prevenir el daño neurológico fetal en el trabajo de parto prematuro. La administración de sulfato de magnesio endovenoso reduce en forma significativa la probabilidad de desarrollar parálisis cerebral y disfunciones motoras. También se ha mostrado la utilidad del pinzamiento tardío del cordón umbilical y la administración antenatal y postnatal de N-acetilcisteína. En estudios animales se ha observado un potencial efecto neuroprotector de stem cells mesenquimáticas, estradiol y progesterona, melatonina y creatina.
The prevention of preterm birth represents one of the most significant challenges to the field of obstetrics in the 21st century. Preterm infants have risk of perinatal mortality and morbidity. Preterm infants born before the 30th week of pregnancy are especially at risk of perinatal brain damage which is usually a result of cerebral ischemia or an ascending intrauterine infection. The prophylaxis against fetal neuronal injury during threatened preterm labor. It has been shown that administering magnesium intravenously leads to a significant reduction in the likelihood of the infant developing cerebral palsy and motor skill dysfunction. It has also been demonstrated utility that delayed clamping of the umbilical cord after birth and administration antenatal and postnatal N-acetylcysteine. In addition, mesenchymal stem cells, estradiol and progesterone, melatonin and creatine seem to have significant neuroprotective potential in animal experiments.
Uno de los problemas actuales de la obstetricia es la prematurez, sobre todo en los casos que el nacimiento ocurre antes de las 30 semanas, por existir un mayor riesgo de morbimortalidad neonatal.
La parálisis cerebral es una consecuencia del daño que afecta a un cerebro inmaduro, se define internacionalmente como un grupo de desórdenes permanentes del desarrollo del movimiento y postura, causando limitación en la actividad, que es atribuida a disturbios no progresivos que ocurren en el desarrollo cerebral fetal o infantil1. Además, frecuentemente se acompañan de alteraciones de la sensación, percepción, cognición, comunicación y comportamiento, de epilepsia y problemas músculo-esqueléticos. La prevalencia estimada de parálisis cerebral es de 2-2.5/1000 recién nacidos vivos y su riesgo es inversamente proporcional a la edad gestacional al momento del nacimiento2. Antes de las 28 semanas, el riesgo de desarrollar parálisis cerebral es 30 a 80 veces mayor que un recién nacido de término3–5, ya que las manifestaciones en el sistema nervioso central y la fisiopatología depende de la edad gestacional. En recién nacidos de pre-término lesiones típicas son: leucomalacia periventricular secundaria a isquemia o infección, se producen radicales libres (lipoperoxidación y nitración de proteínas), citotoxinas (lipopolisacáridos, TNF-α, IL-2, IL-6, IFN-γ), alteración en la excitotoxicidad de los receptores y transportadores de Glutamato, además se dañan los oligodendrocitos con falta de mielinización secundaria. Hemorragia peri o intraventricular, la cual destruye la matriz germinal y la producción de un infarto hemorrágico periventricular de la sustancia blanca6. El periodo crítico es entre las 24 y 34 semanas, periodo en el cual los preoligodendrocitos son vulnerables al efecto de la hipoxia e inflamación por un déficit superóxido dismutasa, la red vascular es inmadura y hay un escaso desarrollo del mecanismo de autorregulación cerebral, con una capacidad muy restringida de la capacidad de vasodilatación y aumento de la circulación sanguínea durante y después de hipotensión arterial.
La principal causa de la parálisis cerebral es la prematuridad, otras causas son la asfixia del parto, exposición intrauterina a infección/inflamación, accidentes vasculares encefálicos (50% de ellos secundarios a algún tipo de trombofilia), malformaciones congénitas por mal desarrollo, embarazos múltiples y causas genéticas.
Por los altos costos sociales, emocionales y económicos de tener un niño con parálisis cerebral, en los casos que no es posible evitar un parto prematuro, existen estrategias para prevenir el daño neurológico de estos niños:
SULFATO DE MAGNESIOEl sulfato de magnesio es conocido por su uso como tocolítico y prevención de eclampsia. En los años 80 se publican los primeros estudios observacionales que muestran una disminución en hemorragia intraventricular y hemorragia intracerebral en recién nacidos de muy bajo peso de nacimiento, que sus madres recibieron sulfato de magnesio7–9.
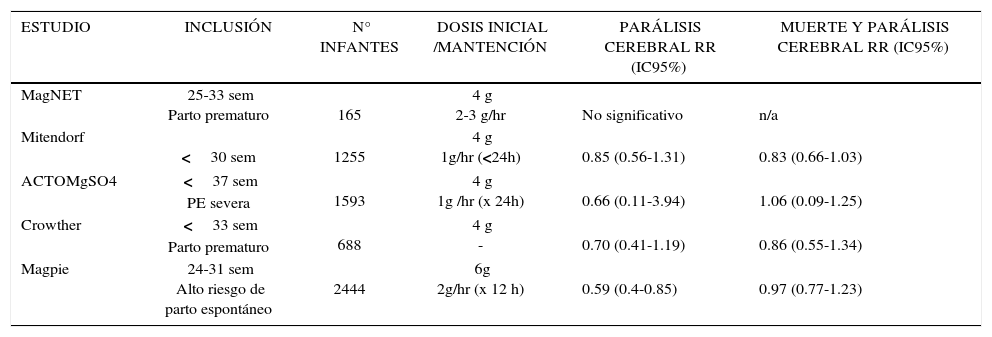
En 1995, Nelson y Grether publican el primer estudio de casos; estudiaron a recién nacidos con menos de 1500grs. que sobrevivieron a los 3 años de vida, encontrando en los expuestos a MgSO4, menos casos de parálisis cerebral (7.1% vs 36%); Odds ratio, 0.14; 95% IC,0.05-0.5110. Posteriormente se publicaron otros 6 estudios retrospectivos caso control y solamente en uno de ellos se muestra una reducción estadísticamente significativa en el daño neurológico relacionado al MgSO4. A consecuencia de estos resultados favorables se realizan 5 estudios controlados y randomizados con la hipótesis “MgSO4 reduce el riesgo de parálisis cerebral y la mortalidad en recién nacidos prematuros”, estos trabajos tienen la limitación de tener diferentes criterios de inclusión y exclusión, edad gestacional de administración, dosis de carga y mantención, duración. Obteniendo reducción del resultado combinado de mortalidad perinatal y parálisis cerebral entre un 15 y 40%11–15 (Tabla 1).
ESTUDIOS CONTROLADOS RANDOMIZADOS DE SULFATO DE MAGNESIO Y NEUROPROTECCIÓN
| ESTUDIO | INCLUSIÓN | N° INFANTES | DOSIS INICIAL /MANTENCIÓN | PARÁLISIS CEREBRAL RR (IC95%) | MUERTE Y PARÁLISIS CEREBRAL RR (IC95%) |
|---|---|---|---|---|---|
| MagNET | 25-33 sem Parto prematuro | 165 | 4 g 2-3 g/hr | No significativo | n/a |
| Mitendorf | <30 sem | 1255 | 4 g 1g/hr (<24h) | 0.85 (0.56-1.31) | 0.83 (0.66-1.03) |
| ACTOMgSO4 | <37 sem PE severa | 1593 | 4 g 1g /hr (x 24h) | 0.66 (0.11-3.94) | 1.06 (0.09-1.25) |
| Crowther | <33 sem Parto prematuro | 688 | 4 g - | 0.70 (0.41-1.19) | 0.86 (0.55-1.34) |
| Magpie | 24-31 sem Alto riesgo de parto espontáneo | 2444 | 6g 2g/hr (x 12 h) | 0.59 (0.4-0.85) | 0.97 (0.77-1.23) |
Posteriormente en base a los trabajos anteriores se realizaron 3 metaanálisis que muestran convincentemente que el sulfato de Mg en mujeres con riesgo de parto prematuro reduce significativamente el riesgo de PC en un 30% sin aumentar el riesgo de muerte perinatal o infantil16–18 (Tabla 2).
METAANÁLISIS DE SULFATO DE MAGNESIO Y NEUROPROTECCIÓN
| METANALISIS | N° TOTAL PARTICIPANTES | MUERTE NEONATAL INFANTIL | PARÁLISIS CEREBRAL | PARÁLISIS CEREBRAL O MUERTE | NNT |
|---|---|---|---|---|---|
| DOYLE COCHRANE 2009 | 6145 | RR 1.04 IC 95% (0.92-1.17) | RR 0.68 IC 95% (0.54-0.87) | RR 0.85 IC 95% (0.74-0.98) | 63 <28 s 29 >28 s 265 |
| CONDEAGUDELO AJOG 2009 | 5357 | RR 1.01 IC 95% (0.89-1.14) | RR 0.69 IC 95% (0.55-0.88) | <34 s 52 | |
| CONSTANTINE OG 2009 | 5235 <32-34 sem | RR 1.01 IC 95% (0.89-1.14) | RR 0.70 IC 95% (0.55-0.89) | RR 0.85 IC 95% (0.73-0-99) | 56 |
| 3107 <30 sem | RR 1.0 IC 95% (0.87-1.15) | RR 0.69 IC 95% (0.52-0.92) | RR 0.84 IC 95% (0.71-0.99) | 46 |
El número de mujeres en riesgo de parto prematuro que necesitan ser tratadas con sulfato de magnesio para prevenir un caso de parálisis cerebral infantil (NNT) depende de la edad gestacional al momento del parto: 52 pacientes antes de las 34 semanas17 y 29 pacientes antes de las 28 semanas20. Otro trabajo calcula 15 pacientes entre las 22-27 sem, 35 pacientes entre las 28-32 sem y 333 entre las 32 -36 semanas5.
Con la administración de sulfato de magnesio se ha descrito la existencia de riesgos de mortalidad materna por sobredosis accidental y edema pulmonar, los cuales son bastante infrecuentes. Antes de alcanzar niveles tóxicos (pérdida de reflejos: 9-13mg/dL, depresión respiratoria>14mg/dL), existen síntomas como pérdida de reflejos, visión borrosa, letargia o debilidad muscular. Otros efectos menores son bochornos, náuseas, vómitos, letargia, sensación de opresión torácica, irritación de la piel en el sitio de punción y aumento en un 50% el riesgo de hipotensión y taquicardia. No hay diferencias en la frecuencia de cesáreas, hemorragias post parto17,19.
De acuerdo a datos combinados obtenidos de estudios controlados randomizados no se ha demostrado un aumento en la mortalidad fetal, neonatal o infantil21. Teóricamente tienen el riesgo de depresión respiratoria, hipotonía, ausencia o disminución de reflejos periféricos y en casos severos estupor o coma, pero solamente han sido descrito en casos de recién nacidos expuestos intrauterinamente a dosis extremadamente alta (>500grs) para prevenir eclampsia o por uso prolongado, mayor a 5-7 días en utilización como tocolítico21–23. Con dosis mayores a 50grs de magnesio se han descrito mayor hemorragia intraventricular y vasculopatía lenticulostriatrial24,25. También se ha descrito que tienen mayor incidencia de ductus arterioso persistente y retinopatía del prematuro17,26,27. Pero en general con los esquemas actuales es seguro en el periodo postnatal inmediato.
Respecto al uso concomitante del sulfato de magnesio con otros tocolíticos, teóricamente la combinación de magnesio con bloqueadores de canales de calcio, en algunos reportes de casos que sugieren que podría ocasionalmente resultar en bloqueo neuromuscular. Pero otros datos muestran que su combinación no aumenta el riesgo de complicaciones serias en pacientes con preeclampsia, como depresión miocárdica, por el contrario mejoraría la función cardiaca28–30. Se ha visto que actúan a nivel de diferentes canales de calcio (Nifedipino bloquea canales tipo L voltaje dependientes y Sulfato de magnesio actúa sobre canales tipo N)31.
Los posibles mecanismos de acción del sulfato de magnesio como neuroprotector son:
- -
Prevención de la injuria de excitotoxicidad inducida por calcio mediante el down regulation en los impulsos exitatorios desde el SNC, al bloquear los receptores NMDA-Glutamato (N-metil-D-aspartato) y canales de calcio voltaje dependientes, produciendo una menor entrada de calcio a las células cerebrales y menor actividad eléctrica y potenciales de acción32–34.
- -
Vasodilatador35,36 al bloquear canales de calcio voltaje dependientes vasculares, produciendo vasodilatación cerebral y efecto inótropo negativo. En fetos de ovejas se ha demostrado que no altera la respuesta cardiovascular y cerebro vascular a la hipoxia y logra aumentar la perfusión vascular periférica durante eventos perinatales adversos37.
- -
Disminuye la liberación de óxido nítrico y reduce la producción postisquémica de radicales de oxígeno38.
- -
Efecto antiinflamatorio al disminuir la producción de citoquinas proinflamatorias y radicales libres, disminuyendo la apoptosis en el cerebro fetal y neonatal39.
- -
Inhibe el efecto de agregación trombocitaria, aumentando el flujo sanguíneo, además aumenta la deformabilidad de los glóbulos rojos38,40.
Los diferentes estudios utilizan diferentes esquemas, para disminuir estos efectos secundarios maternos y neonatales, sin embargo, algunas guías clínicas recomiendan su utilización antes de las 32 semanas, una dosis de carga de 4grs en 20-30 minutos, con una dosis de mantención de 1 gr/hora, por un máximo de 24hrs.41,42. En caso de un nacimiento electivo, comenzar la infusión 4 horas antes de la intervención, ya que la administración endovenosa a la madre ha demostrado estar presente en el suero fetal 1 hora después de la administración y un mínimo de 4hrs parece tener buenos resultados. La American College of Obstetricians and Gynecologists (ACOG) recomienda su uso antes de las 32 semanas y por un máximo de 48hrs43,44. (Tabla 3).
INDICACIONES MATERNAS DE SUSPENSIÓN DE INFUSIÓN DE SULFATO DE MAGNESIO
| INDICACIONES MATERNAS DE SUSPENSIÓN |
|---|
| -Frecuencia respiratoria materna es<12 resp/min. |
| -PAD disminuye más de 15mmHg de la presión basal. |
| -Abolición de reflejo patelar. |
| -Diuresis menor a 100ml en 4hrs. |
| -Magnesemia en niveles tóxicos. |
ANTIDOTO: 1 gr de Gluconato de Calcio en 10ml de solución (10%), pasar lentamente (más de 10 minutos).
El volumen sanguíneo de un recién nacido es influido en forma significativa por el momento en que se realiza el pinzamiento del cordón umbilical45. Cuando ocurre al minuto del nacimiento presentan en un 35% casos de hemorragia cerebral vs un 77% en casos de pinzamiento inmediato46.
El pinzamiento tardío actúa disminuyendo el riesgo de hipoperfusión y mejora la entrega de oxígeno a nivel cerebral47. Además aumenta la concentración de factores de coagulación y el número de stem cells48,49.
Riesgos de un pinzamiento tardío en recién nacido: policitemia, hiperbilirrubinemia y necesitad de fototerapia. ACOG recomienda un pinzamiento tardío de cordón umbilical en todos los prematuros menores a 32 semanas50, además debe permanecer el recién nacido a nivel de la placenta. Para reducir en un 50% la incidencia de hemorragia cerebral.
N-ACETILCISTEINALa N-Acetilcisteina se utilizó en un estudio en casos de corioamnionitis clínica por vía endovenosa materna antenatal y postnatal en recién nacido. Cruza la barrera hematoencefálica y actúa disminuyendo el stress oxidativo y producción de citoquinas en SNC y repone el glutatión (antioxidante intracelular mayor), disminuye las proteínas proinflamatorias (VEFG), aumenta las proteínas antiinflamatorias (IL-1Ra), mantiene la autoregulación cerebrovascular y sensibilidad al óxido nítrico51.
ESTUDIOS EXPERIMENTALES EN ANIMALESStem Cells52: Las stem cells pueden tener un origen neuronal, mesenquimático o hematopoyético. Las células mesenquimáticas son las que tienen mayor potencial de aplicación clínica. Pueden crecer fácilmente desde médula ósea y tejidos extraembrionarios (placenta, gelatina de Wharton y estroma del cordón umbilical). Actuarían mejorando el resultado en casos de daño hipóxico isquémico, ya que en dicha área se induce la formación y la migración de stem cells neuronales para la estimular la expansión de dendritas y axones y suprimir la inflamación postisquémica.
Las stem cells mesenquimaticas modulan varias señales durante la apoptosis, neurogénesis, angiogénesis y sinaptogénesis. Reducen el número de microglias activadas M1 (libera citoquinas proinflamatorias, radicales libres y neurotoxinas) e inhibe la liberación de citoquinas proinflamatorias.
ESTRADIOL Y PROGESTERONAEl estradiol tiene un efecto neuroprotector receptor dependiente (genómico y no genómico) o receptor independiente. Induce el crecimiento dendrítico y axonal, promueve el desarrollo de sinapsis y la integración de la corteza cerebral. Además tiene propiedades antioxidantes52.
La progesterona reduce el edema celular post isquémico, al mantener la integridad de la barrera hematocerebral
MELATONINAEs un antioxidante con efectos antiinflamatorios y anti apoptóticos. La administración materna en animales puede reducir el riesgo de discapacidad neurosensorial, incluyendo parálisis cerebral y muerte, en fetos prematuros y de término53.
CREATINAEs un aminoácido que se obtiene de pescados y carnes o por síntesis endógena desde arginina, glicina y metionina. En estudios animales mediante el aporte dietario de la madre durante el embarazo, tendría un efecto neuroprotector, al disminuir el riesgo de resultados adversos en el neurodesarrollo, como la parálisis cerebral54.
La autora declara no tener conflictos de interés, en relación a este artículo.