La existencia del sistema Renina-Angiotensina-Aldosterona (RAA) fue postulada hace más de 100 años. Posterior al descubrimiento de sus principales componentes se inició una etapa en la que se estableció su rol patogénico en enfermedades cardiovasculares y renales. El desarrollo de fármacos capaces de inhibir la producción o bloquear la acción de los diferentes componentes de este sistema ha revolucionado la forma en la que manejamos la patología cardiovascular y renal. La identificación de nuevos elementos constituyentes de este sistema promete mejorar nuestra comprensión del funcionamiento del mismo y la posibilidad de desarrollar nuevos fármacos más selectivos en sus efectos. Todo ello garantiza que el sistema RAA continúe siendo centro de nuestra atención por muchos años.
The existence of the renin-angiotensin-aldosterone system was first postulated over 100 years ago. Following the identification of all the major components, came the discovery of their potential pathogenicity in cardiovascular and renal disease. The introduction of drugs that inhibit the synthesis or actions of this system has prompted a number of trials that have largely shaped how cardiovascular and renal disease is managed today. The continued discovery of yet more components of this system promises to further our understanding of its influence on disease processes and herald the development of more highly selective drugs, ensuring that the renin-angiotensin-aldosterone system will continue to be a key area of interest for many years to come.
La Enfermedad Renal Crónica (ERCr) comprende un amplio espectro de daño renal. Según la definición dada por National Kidney Foundation (KDOQI) adoptada por la Sociedad Chilena de Nefrología, comprende diversas etapas. La primera etapa o etapa 1, incluye a los pacientes que tienen un daño renal sin deterioro de la velocidad de filtración glomerular (VFG). Dicho daño se establece mediante ciertas evidencias definidas ya sea por la presencia de alteraciones en el examen de orina (por ejemplo albuminuria o microhematuria), alteraciones estructurales (por ejemplo exámenes de imágenes renales anormales), enfermedad renal genética (por ejemplo enfermedad renal poliquística) o enfermedad renal comprobada histológicamente por biopsia renal. A partir de la etapa 2 se consideran pacientes con daño renal y grados crecientes de disminución de la VFG.
Clasificación de la ERCr según el grado de disfunción renal utilizando la clasificación de la guía K/DOQI (Tabla 1).
La Enfermedad Renal Crónica (ERCr)
| Estadio de ERCr | Velocidad de Filtrado Glomerular ml/min por 1.73m2 | Descripción |
|---|---|---|
| Etapa 1 | > 90 | Daño renal con VFG normal o aumentada |
| Etapa 2 | 60 – 89 | Daño renal con VFG levemente disminuida |
| Etapa 3 | 30 – 59 | Moderada disminución de VFG |
| Etapa 4 | 15 – 29 | Severa disminución de VFG |
| Etapa 5 | < 15 o en diálisis | Falla renal terminal |
En el mundo desarrollado, un 13% de la población está afectada por diversos estadios de esta condición y según cifras más recientes su prevalencia estaría aumentando (Coresh, Selvin et al. 2007), lo que constituye un serio desafío desde la perspectiva de la salud pública. En Chile datos reportados en la Encuesta Nacional de Salud del año 2003 estimaban que la prevalencia total de la ERCr sería cercana a un 11% del total de la población (5.7% en etapa 3, 0.2% en etapa 4 y 0.1% en etapa 5 aprox). Ello proyectado a la actualidad se traduciría en que un 14% de la población nacional podría estar afecta por diversos grados de ERCr.
La ERCr en todo su amplio espectro se asocia a una mayor mortalidad y por tanto a una expectativa de vida muy inferior (Go, Chertow et al. 2004). La población con ERCr en estadios iniciales y que aún no ha precisado de técnicas dialíticas, tiene un mayor riesgo de mortalidad que comienza a partir de los 60ml/min de VFG. Éste se incrementa progresivamente cuanto menor sea la función renal de cada paciente (Gráfico 1). A modo de ejemplo, pacientes con VFG 45–59ml/min e iguales o inferiores a 15ml/min, el riesgo es de 17% y 600% mayor, respectivamente, comparado con población de similares características sin falla renal respectivamente.
Este fenómeno se registra de forma más marcada aún en la población de pacientes nefrópatas en diálisis y trasplantados renales. Esta realidad queda graficada al comparar las diversas expectativas de vida que tienen a diferentes edades dichos grupos de pacientes comparadas con población general en Estados Unidos de Norteamérica (Tabla N° 2).
Expectativa De Vida En Años De Población General, Dializados Y Trasplantados Por Grupos Etarios En Estados Unidos Año 2005
| Edades en años | Población General | Pacientes Transplantados | Pacientes Dializados |
|---|---|---|---|
| 0–14 | 70.9 | 50.0 | 18.3 |
| 15–19 | 61.1 | 39.7 | 16.0 |
| 20–24 | 56.3 | 36.2 | 13.9 |
| 25–29 | 51.6 | 32.3 | 12.0 |
| 30–34 | 46.8 | 28.5 | 10.5 |
| 35–39 | 42.1 | 25.2 | 9.0 |
| 40–44 | 37.5 | 21.9 | 7.8 |
| 45–49 | 33.0 | 19.0 | 6.8 |
| 50–54 | 28.6 | 16.3 | 5.9 |
| 55–59 | 24.4 | 13.8 | 5.0 |
| 60–64 | 20.4 | 11.5 | 4.3 |
| 65–69 | 16.8 | 9.6 | 3.7 |
| 70–74 | 13.4 | 7.9 | 3.1 |
| 75–79 | 10.4 | 6.7 | 2.6 |
| 80–84 | 7.8 | – | 2.2 |
| 85 y + | 4.3 | – | 1.8 |
Los pacientes con ERCr, independientemente de sus características epidemiológicas, presentan una mayor causa de mortalidad asociada a eventos cardiovasculares. (U.S Renal Data System 2005). Nuevamente muy por encima de la prevalencia respecto a la población control no nefrópata.
El riesgo de eventos cardiovasculares es desigual entre los diferentes grupos de pacientes nefrópatas crónicos (Tabla N° 3); es muy superior en los pacientes en terapia de sustitución renal con hemodiálisis (Foley, Parfrey et al. 1998) y peritoneodiálisis (Johnson, Dent et al. 2009), algo menor en los pacientes trasplantados (Meier-Kriesche, Schold et al. 2004) e inferior en pacientes con ERCr en estadios iniciales. (Go, Chertow et al. 2004), cuyo riesgo supera ampliamente al de la población sin falla renal.
Riesgo Cardiovascular Comparado Entre Poblaciones de Nefrópatas Con Diversos Estadios De ERCr Y Población Sana.
| Estadio de ERCr | Velocidad de Filtrado Glomerular ml/min por 1.73m2 | Incremento del Riesgo Cardiovascular comparado con población no nefrópata (Odds Ratio) |
|---|---|---|
| Etapa 1 | > 90 | 1.5 |
| Etapa 2 | 60 – 89 | 2 – 4 |
| Etapa 3 | 30 – 59 | 4 – 10 |
| Etapa 4 | 15 – 29 | 10 – 50 |
| Etapa 5 | < 15 o en dialisis | 20 – 1000 |
Asimismo, existe una relación inversamente proporcional entre riesgo cardiovascular y disminución de VFG, que se inicia a los 60ml/min/1.73m2 (Go, Chertow et al. 2004). A modo de ejemplo, pacientes con 45–59ml/min e iguales o inferiores a 15ml/min de VFG éste es de 43% y 343% mayor, respectivamente, comparado con población de similares características sin falla renal (Gráfico N° 2).
Estos pacientes son mucho más propensos en su evolución a fallecer secundariamente a un evento cardiovascular, que a progresar a una falla renal terminal que requiera de diálisis o de trasplante renal (Keith, Nichols et al. 2004).
El incremento del riesgo cardiovascular en esta población de pacientes no es explicable por los factores de riesgo “tradicionales”. Algunos de los reconocidos factores de riesgo cardiovascular en la población general se comportan como factores protectores en pacientes nefrópatas, asociándose a una menor morbimortalidad cardiovascular. Ello se conoce como fenómeno de la “causalidad reversa” (Baigent and Landray 2007).
Existe una gran evidencia científica que avala el que el sistema RAA esté íntimamente involucrado en la patogénesis y en la fisiopatología de la evolución de la ERCr así como también en el incremento de la morbimortalidad cardiovascular de estos pacientes (Ferrario 2006).
En este artículo se enumeran algunos de los hitos históricos más importantes en el descubrimiento de los componentes del sistema RAA. Se menciona la evidencia científica que sustenta los beneficios de la modulación farmacológica de dicho sistema, particularmente en lo referente a su capacidad de disminuir el riesgo cardiovascular y del retardo de la progresión de la ERCr en pacientes nefrópatas crónicos.
Historia del descubrimiento de los principales componentes del sistema renina-angiotensina-aldosterona (RAA)El Dr. Richard Bright (1779–1858), realizó múltiples aportes en el reconocimiento y descripción de la insuficiencia renal. Tal fue su contribución que inicialmente a la insuficiencia renal se la denominó como la enfermedad de Bright (Bright, Becker et al. 1958; Bright 1983) y es reconocido como uno de los padres de la Nefrología como especialidad médica. Mientras trabajaba en el Hospital Guy's de Londres, reconoció en sus pacientes la correlación entre el desarrollo de insuficiencia renal y el hallazgo postmortem de hipertrofia ventricular izquierda.
El Dr. Frederick Akbar Mohamed (1849–1884), uno de los sucesores del Dr. Bright, fue pionero en el uso de el esfigmomanómetro como método de medición no invasiva de la presión intraarterial así como en la descripción y estudio de la rigidez arterial. Él describió una clara asociación entre la hipertensión arterial y la enfermedad de Bright (O'Rourke 1992; Cameron and Hicks 1996).
Años más tarde, el Dr. Charles-Édouard Brown-Séquard (1817–1894), ampliamente reconocido como el padre de la endocrinología e inspirador del personaje novelístico Dr. Jekyll y Mr. Hyde, postuló la existencia de las hormonas, basado en sus experimentos consistentes en la inyección de concentrados de tejidos animales a otros animales vivos de su misma especie (Brown-Sequard and d'Arsonnval 1892).
El Dr. Robert Tigerstedt (1853–1923), profesor de fisiología del Instituto Karolinska de Estocolmo y su ayudante el Sr. Per Bergman fueron quienes reportaron el que extractos tisulares obtenidos de la corteza renal de conejos, inyectados a otros conejos vivos producían un incremento de su presión arterial. Denominaron a dicha sustancia responsable como la “renina” (Tigerstedt and Bergman 1898; Phillips and Schmidt-Ott 1999). En la conclusión de su manuscrito incluso sugieren de forma profética el que sería el aumento de la concentración de renina circulante en sangre, ya sea por un incremento en su producción o bien por el retardo de su eliminación, el responsable del incremento de la resistencia vascular arterial. Secundario a ella se produciría la hipertrofia ventricular izquierda en pacientes portadores de insuficiencia renal. Tal aseveración fue sólidamente confirmada luego (Go, Chertow et al. 2004), quedando claramente establecido el factor que asociaba la ocurrencia de insuficiencia renal con el desarrollo de la falla cardíaca en los pacientes.
Desafortunadamente los descubrimientos antes mencionados no fueron debidamente considerados sino hasta que el Dr. Harry Goldblatt (1891–1977), publicó su reporte en el que mencionaba que había una persistente alza de la presión arterial como respuesta a la generación de una isquemia renal en 1934 (Goldblatt, Lynch et al. 1934). Fue así como el foco de atención volvió a entrarse en aquella sustancia secretada por el riñón capaz de generar aumento de la presión arterial (la renina).
En forma simultánea en 1939 dos grupos de investigación científica liderados por el Dr. Irvine H. Page (1901–1991) en Indianápolis, USA (Page, Mc et al. 1957) y el Dr. Eduardo Braun-Menéndez (1903–1959) en Argentina (Braun-Menéndez and Fasciolo 1939) determinaron que no era la renina per se la hormona responsable de elevar la presión arterial. Ella era una enzima cuyo rol era transformar su sustrato en un potente péptido vasoactivo, quien si era capaz de generar tales incrementos de la presión arterial. A dicha hormona se la denominó Angiotensina (angiotonina + hypertensina)(Braun-Menéndez and Page 1958).
En 1957 como parte del trabajo de purificación de esta nueva sustancia vasoactiva, el Dr. Leonard T. Skeggs Jr. (1918–2002) reportó que este péptido se encontraba presente en la sangre en dos formas distintas que denominaron angiotensina I y II (ANG I y ANG II). (Skeggs, Kahn et al. 1957). Además demostró que la ANG I era el sustrato de otra enzima, la “enzima conversora de Angiotensina” (ECA), para generar así el péptido vasopresor de mayor efecto biológico que era la ANG II (Skeggs, Kahn et al. 1957).
Poco después diversos grupos de investigadores concluyeron que adicionalmente a su efecto vasopresor la ANG II sumaba la capacidad de inducir la secreción por parte de la Pars cortical de la glándula suprarrenal de Aldosterona, uno de los más importantes reguladores del balance del Sodio y Potasio corporales (Tait and Tait 1998; Atlas 2007).
La suma de todos estos descubrimientos llevó a la generación conceptual de el sistema renina-angiotensina-aldosterona (RAA), estableciéndolo como uno de los más importantes elementos participantes en la regulación de la presión arterial así como también del equilibrio hidroelectrolítico de un ser humano (Figura 1).
Una vez identificados los principales elementos constituyentes de el sistema RAA lo que vino fue el descubrimiento y posterior desarrollo de drogas capaces de modular los diferentes elementos constituyentes de este sistema y evaluar sus efectos sobre diferentes tipos de pacientes.
1 - La renina y el desarrollo de los inhibidores directos de renina (IDR):La Renina es una aspartyl proteasa, la que es sintetizada como un cimógeno inactivo conocido como prorenina (Campbell 2008). La prorenina puede ser producida en otros tejidos extrarenales del organismo tales como en la glándula suprarrenal, ovarios, testículos, placenta, y la retina (Campbell 2008). La importancia de la producción extrarrenal de prorenina queda reflejada en pacientes anéfricos, en los que sus niveles plasmáticos alcanzan la mitad de los valores obtenidos en sujetos normales (Campbell 2008). En los riñones ella es sintetizada y secretada por las células juxtamedulares de la arteriola aferente del riñón en respuesta al censado por los baroreceptores (mediado por una activación del β-adrenoreceptor) de una hipovolemia efectiva así como también como respuesta a la disminución de la concentración de sodio en la mácula densa. En humanos los niveles plasmáticos de renina normalmente son menores de <1pmol/L mientras los de prorenina usualmente son 10 veces mayores (Campbell 2008).
En ciertos fluidos compartimentalizados como el humor vítreo de pacientes diabéticos portadores de retinopatía proliferativa, pueden alcanzarse concentraciones hasta 100 veces mayores de prorenina que las normalmente encontradas en el plasma (Hsueh and Baxter 1991). La asociación entre elevados niveles plasmáticos de prorenina con el desarrollo de complicaciones en pacientes diabéticos tales como la retinopatía diabética ha llevado a postularle un rol etiopatogénico en el desarrollo de ella (Danser, van den Dorpel et al. 1989; Wilson and Luetscher 1990).
El receptor de prorenina y renina fue recientemente identificado (Nguyen, Delarue et al. 1996; Nguyen, Delarue et al. 2002). La unión de ambas moléculas (renina y prorenina) a su receptor no sólo genera la producción de angiotensina, también activa otras señales de transducción diferentes de la del receptor de ANG II, (Schefe, Menk et al. 2006). En los pacientes tratados con Inhibidores de la enzima conversora de Angiotensina (IECA) hay un aumento de renina y prorenina plasmáticas. El que la unión de ambos ligandos a su receptor estimule otras señales de transducción diferentes de la de la ANG II podría sugerir una posible explicación para que por esta vía los pacientes en tratamiento con IECA vean atenuados los beneficios de esta terapia (Campbell 2008).
El primer inhibidor de la acción de renina fue sintetizado hace 40 años (Gross, Lazar et al. 1972), pero su pobre absorción intestinal, su corta vida media y su baja potencia evitaron el ulterior desarrollo de este compuesto (Staessen, Li et al. 2006).
Aliskiren, el primer inhibidor directo de renina (IDR), fue desarrollado sobre la base de un estudio que incluyo cristalografía de rayos X y modelamiento molecular (Wood, Maibaum et al. 2003; Hollenberg 2009). Los IDR han suscitado un creciente interés porque:
- 1)
Actúan en la fase limitante de la cadena de reacciones químicas que se dan en el sistema RAA,
- 2)
el uso de IECA y bloqueadores de el receptor de Angiotensina (BRA) generan un aumento de la actividad de la renina plasmática, lo que aumentaría la producción de ANG II intrarenal y
- 3)
los IDR pueden bloquear los efectos de la prorenina, lo que sumaría efectos terapéuticos benéficos por esa vía (Hollenberg 2009).
Hoy en día aliskiren ha demostrado ser un eficiente fármaco antihipertensivo, comparable a otros fármacos pertenecientes a otras clases de antihipertensivos (Allikmets 2007); genera una favorable respuesta neurohumoral cuando se le adiciona al tratamiento convencional de pacientes con falla cardiaca (McMurray, Pitt et al. 2008) y ha demostrado que cuando se usa adicionándolo a Losartan genera una mayor disminución de la proteinuria de pacientes diabéticos tipo II (Parving, Persson et al. 2008). En términos de su potencial efecto sobre el riesgo cardiovascular en estos momentos esta en desarrollo un estudio clínico en el que se adiciona Aliskiren a pacientes diabéticos tipo II con un alto riesgo cardiovascular que están en tratamiento, ya sea con IECA o BRA. Sus resultados son esperados con expectación (Parving, Persson et al. 2008). Los IDR parecen ser fármacos promisorios y estamos a la espera de ver sus efectos sobre indicadores de morbimortalidad en diferentes grupos de pacientes.
2- La enzima conversora de angiotensina y el descubrimiento con el posterior desarrollo de los fármacos inhibidores de enzima conversora de angiotensina (IECA).En 1970 el farmacólogo brasileño Sergio H. Ferreira reportó que péptidos contenidos en el veneno de la víbora lanceolada o serpiente jararaca brasileña (Bothrops jararaca) eran capaces de inhibir la acción de la Kinasa II, una enzima involucrada en la degradación de las bradikininas que luego se demostró ser idéntica a la ECA (DiBianco 1986). Análogos sintéticos de dichos péptidos tales como el nonapéptido teprotide, resultaron ser eficientes hipotensores en pacientes portadores de hipertensión (Niarchos, Pickering et al. 1980; Antonaccio 1982) y además producían cambios hemodinámicos favorables en pacientes portadores de falla cardiaca (Curtiss, Cohn et al. 1978; Gavras, Faxon et al. 1978). Tales evidencias impulsaron la búsqueda de un fármaco capaz de inhibir la ECA que se administrase por vía oral, siendo el primero Captopril.
Este fue diseñado a semejanza de un inhibidor de otra metaloproteinasa (la carboxypeptidase A) al que se le adicionó a su estructura química una aminoácido quien contenía un grupo sulfhydrylo que servía como ligando con el Zinc contenido en la ECA (Rubin, Antonaccio et al. 1978). Al Captopril le siguieron un gran número de otros compuestos relacionados de similar función que son frecuentemente usados hoy (Ver Tabla) (Ferguson, Vlasses et al. 1982; Millar, Derkx et al. 1982; Karlberg, Fyhrquist et al. 1984; Xiang, Linz et al. 1985; Klutchko, Blankley et al. 1986; Richer, Doussau et al. 1986).
Efectos clínicos de los inhibidores de enzima conversora de angiotensina (IECA):-Protección cardiovascular;El CONSENSUS I en 1987 fue el primer estudio que buscó como objetivo primario ver si los IECA disminuían la mortalidad en pacientes con falla cardiaca. Éste demostró una disminución del 40% en la mortalidad de pacientes con falla cardiaca severa, clasificada como clase IV de la New York Heart Association (NYHA). Adicionalmente efectos benéficos producidos por estos fármacos han sido demostrados en pacientes portadores de disfunción ventricular izquierda sintomática y asintomática, independientemente de su etiología, así como también en pacientes tratados con ellos inmediatamente después de haber sufrido un infarto agudo al miocardio (Khalil, Basher et al. 2001). Posteriormente los IECA demostraron mejoría de la sobrevida en pacientes que, sin tener disfunción ventricular izquierda, tenían un elevado riesgo cardiovascular (Yusuf, Sleight et al. 2000; Dagenais, Pogue et al. 2006). Se incluyó entre los últimos pacientes portadores de ERCr (Mann, Gerstein et al. 2001).
La microalbuminuria definida como la excreción urinaria de albúmina entre 30 a 299mg/dl/dia, 20–200μg/min o bien a razón de 30–300μg de albúmina por cada mg de creatinina, es un reconocido marcador precoz de un elevado riesgo y morbimortalidad cardiovasculares (Brantsma, Bakker et al. 2008). Recientemente se ha expresado que ello se daría incluso desde valores de proteinuria aún inferiores a los previamente mencionados (Brantsma, Bakker et al. 2008). Refleja a nivel renal la presencia de una disfunción vascular sistémica (Jensen, Borch-Johnsen et al. 1995). Esta condición es altamente prevalente en la población de pacientes hipertensos y nefrópatas crónicos entre los cuales destacan los portadores de nefropatía diabética.
Los IECA son más eficientes que otros fármacos antihipertensivos en reducir la excreción de albúmina renal en pacientes diabéticos, no diabéticos e hipertensos (Erley, Haefele et al. 1993; Ravid, Savin et al. 1993; 2000; Brenner, Cooper et al. 2001; Lewis, Hunsicker et al. 2001). Desde el punto de vista clínico se suma a lo anterior el que los IECA en pacientes diabéticos con microalbuminuria disminuyen significativamente su riesgo cardiovascular (Sano, Kawamura et al. 1994; Trevisan and Tiengo 1995; Agardh, Garcia-Puig et al. 1996; Ahmad, Siddiqui et al. 1997; 2000; Jafar, Schmid et al. 2001).
-Protección renal;En la poblaciones de pacientes portadores de insuficiencia renal crónica prediálisis, de diferentes etiologías, varios estudios prospectivos, randomizados y controlados han demostrado que los IECA pueden retardar o incluso evitar la progresión de la insuficiencia renal (nefroproteccion), lo que lograrían en forma independiente de la baja de la presión arterial alcanzada en pacientes tratados con ellos.
Los IECA demostraron disminuir la progresión a la insuficiencia renal crónica terminal en pacientes diabéticos tipo 1 normotensos con nefropatía diabética ya establecida (Lewis, Hunsicker et al. 1993). Posteriormente en estos pacientes se demostró que el tener microalbuminuria era un marcador clínico de nefropatía diabética en una fase más precoz. El tenerla implicaba para ellos una mayor probabilidad a evolucionar hacia una nefropatía diabética avanzada y a través de ella a una falla renal crónica terminal.
Los IECA no sólo demostraron ser eficientes en la regresión de la microalbuminuria sino que también fueron superiores en la prevención del desarrollo de la nefropatía diabética y en el retardo de la evolución hacia la falla renal terminal comparados con otros antihipertensivos (Erley, Haefele et al. 1993; Ravid, Savin et al. 1993; Sano, Kawamura et al. 1994; Trevisan and Tiengo 1995; Agardh, Garcia-Puig et al. 1996; Ahmad, Siddiqui et al. 1997; 2000; Brenner, Cooper et al. 2001; Jafar, Schmid et al. 2001; Lewis, Hunsicker et al. 2001). Actualmente es tal el peso de la evidencia que sólo omitimos su uso en este tipo de pacientes cuando tienen una contraindicación formal o bien han tenido una reacción adversa al medicamento tal que se desaconseja su uso.
Este beneficio también se evidencio en pacientes normotensos portadores de nefropatías crónicas no diabéticas con niveles de excreción de proteinuria mayores a 1gr/día (1997; Ruggenenti, Perna et al. 1999; Wright, Bakris et al. 2002). Esta protección renal se mantiene aún si se indica su uso en estos últimos pacientes en etapas avanzadas de la falla renal (con valores de creatinina sérica entre 3.3–5.5mg/dl o 264–440mmol/l) (Hou, Zhang et al. 2006).
En pacientes hipertensos, nefrópatas crónicos no diabéticos un metanálisis de los datos obtenidos de 11 diferentes estudios prospectivos, controlados y randomizados que evaluaron diferentes fármacos antihipertensivos, se mostró que a igual control de cifras de presiones arteriales, los pacientes tratados con IECA tenían una significativa menor incidencia de falla renal terminal (Jafar, Schmid et al. 2001). El beneficio antes mencionado se potenciaba aún más en el subgrupo de pacientes que tenían valores de proteinuria diaria iguales o mayores a 0.5gr/día y mientras era mayor el valor de su proteinuria basal, mayor era el beneficio en términos de protección renal. En pacientes nefrópatas con menores cuantías de proteinuria diaria el estudio AASK demostró en pacientes Afroamericanos portadores de nefropatías crónicas no diabéticas, con niveles basales de proteinuria menores de 0.5gr/día que había en los tratados con IECA una disminución estadísticamente significativa de el objetivo combinado de tener un deterioro mayor a un 50% de la velocidad de filtración glomerular y/o una falla renal terminal comparados con los tratados con bloqueadores de calcio o β-bloqueadores (Wright, Bakris et al. 2002).
3- La angiotensina y el descubrimiento de los fármacos bloqueadores del receptor de angiotensina (BRA).La ANG II es capaz de unirse a un mínimo dos receptores; el receptor de angiotensina tipo-1 (AT1) y el receptor de angiotensina tipo-2 (AT2) (Mogi, Iwai et al. 2007; Steckelings, Rompe et al. 2009). Es el AT1 el que media la mayoría de los efectos fisiológicos y fisiopatológicos de la ANG II. Ellos se dan en 4 diferentes ámbitos; 1) Sistema cardiovascular: produce vasoconstricción, aumento de la presión arterial, aumento de contractilidad miocárdica e hipertrofia vascular y miocárdica. 2) Renal: aumento de la reabsorción tubular de sodio e inhibición de la liberación de renina (feedback negativo), 3) Sistema Nervioso Simpático aumenta la secreción de noradrenalina (Vonend, Christian Rump et al. 2008) y 4) Corteza suprarrenal con el aumento de la síntesis y secreción de aldosterona (Carey and Siragy 2003; Steckelings, Rompe et al. 2009).
El receptor AT2 en la etapa fetal se encuentra ampliamente distribuido en la economía destacando su mayor densidad por gramo de tejido particularmente en el cerebro y en el riñón. En el periodo postnatal su densidad disminuye francamente (Steckelings, Rompe et al. 2009). Existe evidencia científica de que a pesar de tener una menor expresión tisular en el adulto la activación del receptor AT2 mediaría ciertos eventos tales como; 1) En el Sistema Cardiovascular la vasodilatación arterial, un efecto antiproliferativo y proapoptótico en las células musculares lisas vasculares, inhibiría el crecimiento de las células miocárdicas y el remodelamiento cardiaco (Steckelings, Rompe et al. 2009). 2) En los riñones disminuiría la reabsorción tubular proximal de sodio (Steckelings, Rompe et al. 2009).
En 1970 con el estudio de diversos péptidos análogos de la ANG II comenzó el desarrollo de los bloqueadores de el receptor de angiotensina (BRA) (Ferrario 2006). Estos primeros compuestos mantenían todavía una acción agonista y sólo se podían usar por vía endovenosa lo que restringía su uso. En forma sintética realizando variadas manipulaciones moleculares se desarrollo una segunda generación de BRA no peptídicos entre los que estaba el Losartan que fue el primer BRA susceptible de ser usado vía oral (Chiu, McCall et al. 1990).
Luego de él un sinnúmero de otros compuestos de similares características se han desarrollado y hoy están en uso clínico (Theodoratou, Maniadakis et al. 2009).
Efectos clínicos de los bloqueadores del receptor de angiotensina (BRA):Los BRA han demostrado fehacientemente que confieren renoprotección en dos grandes estudios randomizados realizados en pacientes diabéticos tipo II con nefropatía diabética ya establecida (Brenner, Cooper et al. 2001; Lewis, Hunsicker et al. 2001).
En cuanto a su efecto sobre microalbuminuria los BRA son más eficientes que otros tratamientos antihipertensivos (no IECA) en su reducción, tanto en los pacientes diabéticos, no diabéticos e hipertensos (Erley, Haefele et al. 1993; Ravid, Savin et al. 1993; 2000; Brenner, Cooper et al. 2001; Lewis, Hunsicker et al. 2001). Particularmente en pacientes diabéticos con microalbuminuria estos fármacos son capaces de revertirla o bien en su defecto enlentecer la progresión a la nefropatía diabética avanzada así como también el desarrollo de falla renal terminal y adicionalmente disminuyen el riesgo cardiovascular de estos pacientes (Sano, Kawamura et al. 1994; Trevisan and Tiengo 1995; Agardh, Garcia-Puig et al. 1996; Ahmad, Siddiqui et al. 1997; 2000; Jafar, Schmid et al. 2001).
Efectos clínicos del uso combinado de los inhibidores de enzima conversora de angiotensina (IECA) con bloqueadores de los receptores de angiotensina (BRA):Varios estudios han sugerido el que usar dosis mayores tanto de IECA como de BRA así como también el uso combinado de ambos agentes podría tener mejores resultados clínicos especialmente en lo referido al retardo de la progresión de la falla renal, comparado con el uso de ambos agentes por separado en sus dosis habituales (Nakao, Yoshimura et al. 2003; Rossing, Schjoedt et al. 2005; Hou, Zhang et al. 2006).
Esta teoría ha sido cuestionada recientemente por dos hechos; 1) por el reciente retiro del estudio Combination treatment of angiotensin-II preceptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease (COOPERATE), dada la presencia de serias contradicciones en sus resultados. Este informaba una acción nefroprotectora de la asociación de trandolapril y Losartan en la prevención de la progresión de nefropatías proteinúricas de pacientes no diabéticos (Kunz, Wolbers et al. 2008; 2009) y por 2) los resultados comunicados por el estudio ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial (ONTARGET) (Mann, Schmieder et al. 2008). En éste se usó en forma combinada IECA con BRA a dosis fijas en pacientes hipertensos sin demostrarse un retardo de la evolución a la falla renal terminal. Debe decirse eso sí que en estos pacientes la presencia de proteinuria no fue considerada.
Es así que algunos autores recomiendan su uso combinado sólo en aquellos pacientes portadores de nefropatías proteinúricas en los que uno podría titular las dosis de ambos fármacos en forma dinámica según su efecto sobre la proteinuria (Jain, Campbell et al. 2009).
4- La aldosterone el receptor de mineralocorticoidesLa Aldosterona es un mineralocorticoide que se sintetiza a partir de el colesterol, el cual es sometido a una serie de reacciones enzimáticas en la pars glomerulosa de la glándula suprarrenal (Cachofeiro, Miana et al. 2008). Ella es el eslabón final del sistema RAA y tiene receptores en los tejidos renal y del colon mediante los cuales regula la reabsorción de sodio y la secreción de potasio. La secreción de Aldosterona es promovida por los aumentos de las concentraciones plasmáticas de ANG II y de potasio (Booth, Johnson et al. 2002). Se ha reportado la secreción extraadrenal de aldosterona en el corazón, tejido vascular y en el Sistema Nervioso Central (Takeda, Yoneda et al. 2000; Schiffrin 2006; Skott, Uhrenholt et al. 2006).
La Aldosterona se une a receptores de mineralocorticoides (RM) citoplasmáticos (Fuller and Young 2005). Ellos han sido encontrados tanto en células endoteliales como musculares lisas lo que ha llevado a especular el que la aldosterona sintetizada y secretada localmente podría actuar de una forma paracrina y/o autocrina, dando lugar a que altas concentraciones locales de esta hormona podrían ocupar una gran cuantía de RM vecinos (Connell, MacKenzie et al. 2008). La cuantía de la expresión de los RM se encuentra aumentada en variadas situaciones patológicas tales como en el paciente hipertenso (Takeda, Miyamori et al. 1997; Fuller and Young 2005; Jaffe and Mendelsohn 2005).
En 1954 Conn describió un paciente con hipertensión asociada a hipokalemia hipotetizando que las glándulas suprarrenales del paciente producían una cantidad exagerada de Aldosterona (Conn 1955). Una concentración elevada de Aldosterona en sangre ha demostrado tener efectos cardio y nefrotóxicos tanto in vitro así como también en modelos experimentales animales (Fiebeler, Muller et al. 2007; Cachofeiro, Miana et al. 2008; Connell, MacKenzie et al. 2008). No es de sorprender entonces el que se haya descrito en pacientes portadores de hiperaldosteronismo una mayor hipertrofia ventricular izquierda y una mayor fibrosis miocárdica al ser comparados tales parámetros con los de individuos portadores de hipertensión esencial, (Fiebeler, Muller et al. 2007; Connell, MacKenzie et al. 2008). Esto ha aumentado la sospecha de que incluso niveles moderados de hiperaldosteronismo pudiesen ser patológicos (Auchus 2003).
En pacientes nefrópatas crónicos de variadas etiologías, diversos grados de Hipertrofia suprarrenal e hiperaldosteronismo han sido reportados (Ibrahim and Hostetter 2003). Tanto el aumento de la masa total de sodio corporal así como los efectos vasoconstrictores de los mineralocorticoides han sido incriminados en la génesis de la hipertensión de estos pacientes (Ibrahim and Hostetter 2003). En ellos adicionalmente se estableció una correlación lineal estricta entre la elasticidad de vasos arteriales de gran tamaño con los niveles de aldosterona plasmáticos (Ibrahim and Hostetter 2003) y se describió el que la Aldosterona interfiere con la producción de óxido Nítrico endotelial, con la consecuente generación de disfunción endotelial (Cachofeiro, Miana et al. 2008).
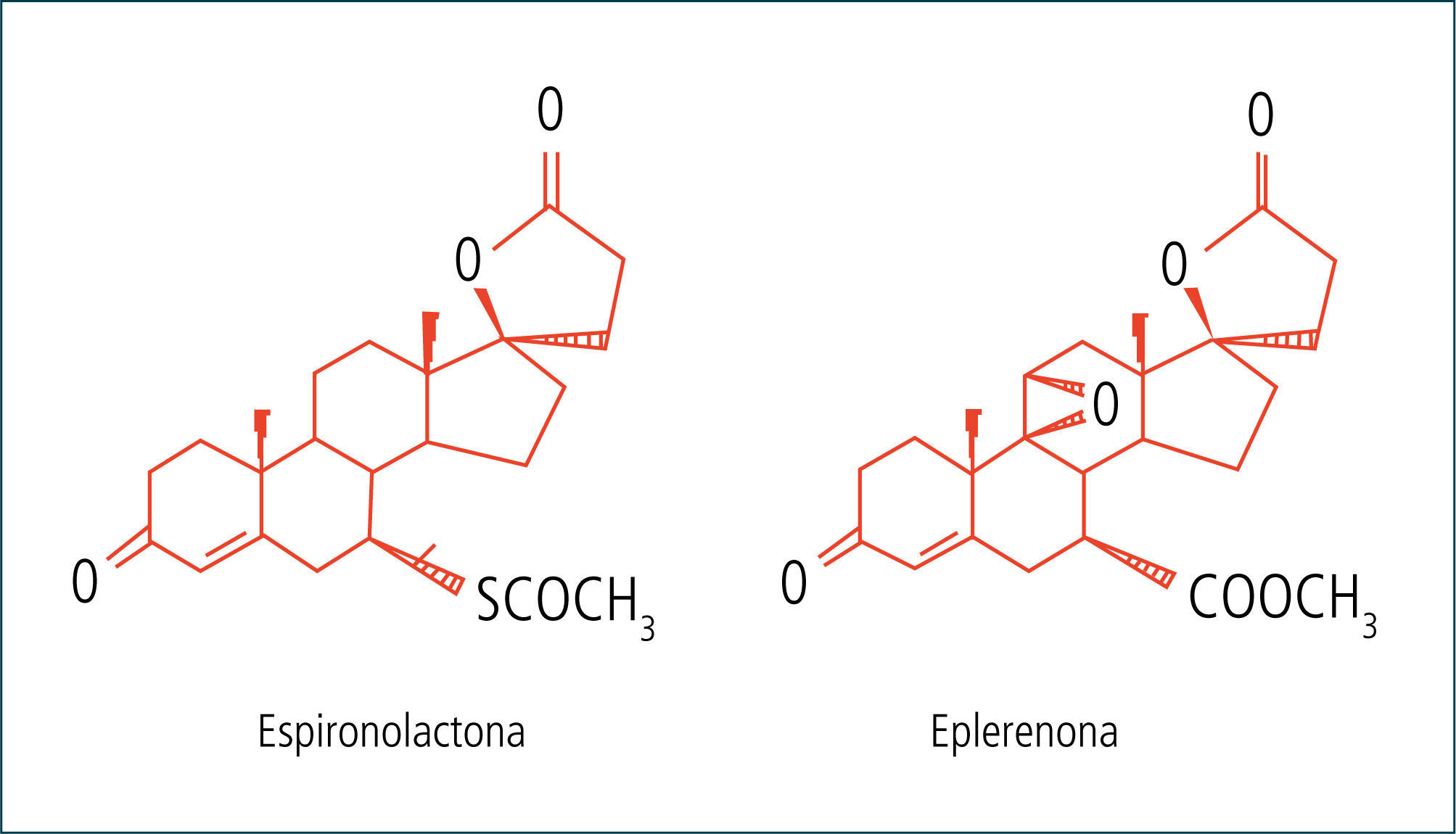
Antagonista del receptor de mineralocorticoide (RM)El Dr. Kagawa fue el primero en sintetizar el esteroide 17-espironolactona (Kagawa, Cella et al. 1957) el cual demostró ser un antagonista especifico de la aldosterona. Desafortunadamente estos compuestos fueron muy débiles o incluso inactivos al ser administrados por vía oral. No fue sino hasta que en 1960 los Drs. Gant y Dyniewicz desarrollaron la Espironolactona (SC.9420) que los antagonistas de aldosterona pudieron ser clínicamente utilizados (Farrelly, Howie et al. 1960).
La espironolactona es un antagonista no selectivo de la Aldosterona capaz de unirse a otros receptores de esteroides (Menard 2004; Struthers, Krum et al. 2008). Entre sus efectos adversos más alla de su conocida capacidad de producir una hiperkalemia y secundario a sus efectos progestínico y antiandrogénico se cuentan; congestión mamaria, irregularidades menstruales, ginecomastia, hipertrofia prostática y disfunción eréctil. Hasta un 10% de los hombres adultos tratados con ella en dosis de 25mg/d puede reportar congestión mamaria (Garthwaite and McMahon 2004).
Luego en el 2001 se desarrolló la Eplerenone, el primer antagonista selectivo de la Aldosterona (Delyani, Rocha et al. 2001). Este compuesto causa menos efectos adversos comparado con la espironolactona, pero al mismo tiempo es menos activo que ella (Struthers, Krum et al. 2008; Jain, Campbell et al. 2009). Hay una creciente evidencia científica que sugiere el que el bloqueo de los mineralocorticoides tendría beneficios que irían más allá de su efecto hipotensor (Auchus 2003).
Tanto los IECA y los BRA reducen las cantidad de Aldosterona circulante (Hollenberg 2009), pero su uso prolongado en el tiempo se asocia a una elevación sostenida de la concentración de Aldosterona plasmática, lo que se conoce como el “escape”. Tal evento daría pie al uso combinado de IECA y BRA con antagonistas de la Aldosterona (Bomback and Klemmer 2007; Jain, Campbell et al. 2009). El hacerlo desde el punto de vista clínico ha demostrado consistentemente una mayor disminución de la proteinuria en pacientes previamente tratados sólo con IECA o BRA (Jain Campbell et al. 2009). Obviamente el asociar tales fármacos implica riesgos inherentes tales como desarrollar una hiperkalemia. Ella usualmente suele ser clínicamente relevante en pacientes que tienen VFG <30ml/min/1.73m2, cuando en forma concomitante se usan otros fármacos que se asocian a hiperkalemia y cuando se le administran suplementos de potasio al paciente. Estudios clínicos de cohortes de pacientes reducidas han comunicado que el uso de espironolactona en bajas dosis incluso fue bien tolerado en pacientes nefrópatas en hemodiálisis crónica con escasa diuresis residual (Jain, Campbell et al. 2009).
En la esfera cardiovascular estudios prospectivos controlados y randomizados realizados en pacientes cardiópatas con disfunción ventricular izquierda demostraron un incremento de un 30% de la sobrevida en los pacientes a los que se les adicionó un antagonista de la Aldosterona a su tratamiento de base, que incluía el uso de IECA o BRA (Jain, Campbell et al. 2009).
Por otra parte un estudio randomizado, controlado con placebo y doble ciego en pacientes nefrópatas con un estadio inicial de falla renal crónica determinó en pacientes normotensos, tratados en forma precoz con Espironolactona un beneficio en términos de un retardo en el desarrollo de rigidez arterial así como de hipertrofia ventricular izquierda (Edwards, Steeds et al. 2009).
Proyecciones futurasA pesar de que la existencia de el sistema RAA fue postulada hace ya más de 100 años y de que recientemente múltiples nuevos descubrimientos en esta área se han sucedido vertiginosamente, todavía hay un sinnúmero de incógnitas por resolver tales como la actividad de otras enzimas conversoras de angiotensina o la actividad anti -ANG II que pudiese tener la angiotensina 1–7 (Burns 2007; Santos and Ferreira 2007). Se requiere tener una mayor claridad sobre las funciones de los diferentes receptores de angiotensina, sobre todo luego de reportarse el que un ratón Knockout para el receptor AT2 era más longevo que sus controles sanos, lo que hizo teorizar que el bloqueo de éste pudiese disminuir el daño tisular y así prolongar la expectativa de vida (Nishiyama, Matsusaka et al. 2009).
Otra área a explorar es la de intentar establecer interacciones entre el sistema RAA con otros sistemas involucrados en la homeostasis del organismo tales como la vitamina D, la endotelina y vasopresina entre otros. Ello permitiría la generación de nuevas medidas terapéuticas que podrán mejorar aún mas el pronostico de nuestros pacientes (Ferro, Spratt et al. 1998; Kurtz and Klein 2009).
Si bien es cierto que debemos aceptar el que en el pasado la comunidad nefrológica no se destacó precisamente por llevar adelante estudios clínicos randomizados y controlados que aportaran evidencia científica capaz de sustentar nuestras conductas terapéuticas (Strippoli, Craig et al. 2004) podemos decir que ello ha estado cambiando en este último tiempo (Wheatley, Ives et al. 2009). En ese contexto a nuestro juicio la investigación clínica centrada en el intentar encontrar la mejor forma de combinar las terapias capaces de modular el sistema RAA actualmente disponibles debería ser priorizada, dados los enormes beneficios que a nuestros pacientes ello podría reportar. En conclusión por lo anteriormente expuesto creemos que el sistema RAA continuara estando en el centro de nuestro quehacer por muchos años más.
Los autores declaran no tener conflictos de interés, en relación a este artículo.