La hipertensión arterial tiene una prevalencia cercana al 30% en la población adulta chilena y es la mayor causa de muerte en el mundo. La hipertensión primaria resulta de la interacción de distintos factores tanto genéticos, como funcionales renales y en particular un estilo de vida poco saludable. En este artículo se describe la influencia del exceso de sodio y el déficit de potasio, característicos de nuestra alimentación, en el desarrollo de hipertensión. Se revisan los estudios observacionales más importantes, los mecanismos fisiopatológicos para explicar el rol dañino del exceso de sodio y el déficit de potasio y finalmente se hacen recomendaciones para adecuar su consumo con el fin de prevenir hipertensión y sus complicaciones.
Arterial hypertension has a prevalence of about 30% in the adult Chilean population and it is the major cause of mortality worldwide. Primary hypertension results from the interaction of genetic factors, functional renal impairment and particularly from an altered life style. This article describes the impact of the excess of sodium and the deficit of potassium of our usual alimentation in the development of hypertension. In this setting, some important observational studies and physiopathological mechanisms were discussed, and finally some recommendations to reduce sodium and to increase potassium intake to prevent hypertension and vascular complications, were made.
Un bello salero de oro con incrustaciones de piedras preciosas le fue regalado al rey, quién no murió en el campo de batalla montando su brioso corcel, sino de madrugada a causa de un accidente vascular encefálico, a la edad de 52 años (Figuras 1 y 2).
El aumento sostenido de la presión arterial es la mayor causa de muerte y la segunda causa de discapacidad, sólo comparable a la malnutrición infantil, en el mundo (1). La ingesta exagerada de sodio, especialmente en la forma de cloruro de sodio, y el reducido aporte de potasio, característicos de la alimentación del mundo occidental, son determinantes, junto a la obesidad y al sedentarismo, de un aumento progresivo de la incidencia y prevalencia de hipertensión arterial (1). La Encuesta Nacional de Salud del Ministerio de Salud de Chile del año 2003, reporta una prevalencia de valores iguales o mayores de 140/90mmHg en un 33.7% de una muestra representativa de la población mayor de 17 años, empleando dos mediciones en una sola visita (2).
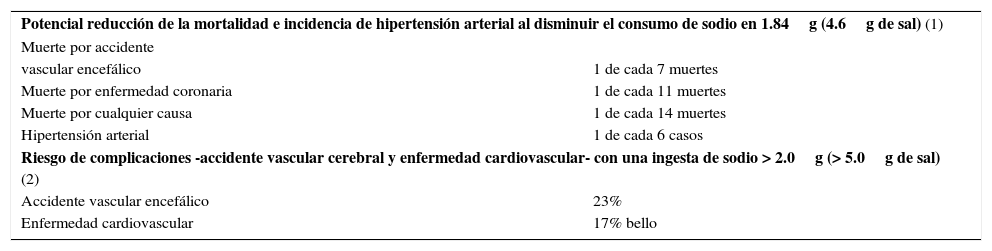
Ingesta de sodio e hipertensiónLa relación directa entre mayor consumo de sodio y valores elevados de presión arterial se demuestra en diversos estudios, destacando el INTERSALT que registra en una población de 5000 personas de 40 a 59 años de edad, mediciones promedio de presión sistólica 7.8 y presión diastólica 3.5mmHg más altas, en los individuos que consumen diariamente más de 2.3g de sodio, equivalentes a 5.8g de cloruro de sodio (3). Para recordar, 2.5g de sal contienen 1g de sodio. La estrecha relación entre sodio y presión arterial se aprecia también en algunas poblaciones que prácticamente no lo consumen, como los indígenas Yanomami, habitantes de la región amazónica de Brasil y Venezuela, quienes por consumir menos de 0.2g al día (< 0.5g de sal), alcanzan una presión promedio de 100/64mmHg a los 50 años de edad (4) (Figura 3). Especial mención merecen los sorprendentes resultados de las investigaciones lideradas por Cruz-Coke en algunas poblaciones chilenas seleccionadas (Figura 4). En un artículo publicado el año 1964, muestra la total ausencia de hipertensión en los habitantes de Rapa-Nui (5), sin embargo, una nueva evaluación publicada el año 1990, demuestra hipertensión arterial en un 30% de la población pascuense estudiada (6). ¿Qué había sucedido? La población nativa habría modificado sus hábitos de alimentación aumentando de peso e incrementando el consumo de sodio (6). En este contexto, la disminución del sodio en la alimentación también se traduce en una significativa reducción de los valores de presión arterial, como lo demuestra el estudio DASH. En este ensayo clínico prospectivo efectuado en 202 personas mayores de 22 años, la disminución de la ingesta diaria de cloruro de sodio de 8 a 6 y a 4g, reduce la presión sistólica en 2.1 y 4.6mmHg respectivamente (7). La causalidad y reversibilidad de la hipertensión en relación al consumo de sodio fue demostrada hace más de sesenta años por Kempner (8). Este investigador comunicó en un acucioso estudio, la disminución de la presión arterial media en a lo menos 20mmHg en el 62% de los enfermos hipertensos tratados sólo con una dieta en base de arroz, frutas y vegetales, con un contenido de sal menor de 0.5g. Llama mucho la atención la franca reducción radiológica de la cardiomegalia y de los signos de retinopatía hipertensiva, así como también la normalización de ondas T invertidas en los electrocardiogramas de los enfermos, considerando la nula disponibilidad de fármacos antihipertensivos en la época que se hizo el ensayo clínico (8). El efecto favorable de la disminución del consumo de sodio a largo plazo, también se observa en otros estudios, destacando una reducción del riesgo de complicaciones cardiovasculares entre 25 y 30% en dos grupos poblacionales, seguidos por 10 a 15 años después de una intensa labor educativa para disminuir el aporte diario de sodio en 0.75 y 1.0g, equivalentes a 1.87 y 2.5g de sal (9). Sólo la disminución de la ingesta de sodio en 1.84g (4.6g de sal) al día, puede reducir la prevalencia de hipertensión en un 30% (10) y disminuir significativamente la mortalidad por accidente vascular encefálico y enfermedad coronaria (11) (Tabla 1). En general, el consumo de menos de 2.9g de cloruro de sodio previene el desarrollo de hipertensión arterial; por el contrario, la ingesta mayor de 5.8g incrementa el riesgo de adquirir esta enfermedad (12).
| Potencial reducción de la mortalidad e incidencia de hipertensión arterial al disminuir el consumo de sodio en 1.84g (4.6g de sal) (1) | |
| Muerte por accidente | |
| vascular encefálico | 1 de cada 7 muertes |
| Muerte por enfermedad coronaria | 1 de cada 11 muertes |
| Muerte por cualquier causa | 1 de cada 14 muertes |
| Hipertensión arterial | 1 de cada 6 casos |
| Riesgo de complicaciones -accidente vascular cerebral y enfermedad cardiovascular- con una ingesta de sodio > 2.0g (> 5.0g de sal) (2) | |
| Accidente vascular encefálico | 23% |
| Enfermedad cardiovascular | 17% bello |
Reducción del riesgo de muerte y de hipertensión al disminuir el consumo de sodio (1): Policy – Sodium, Blood Pressure Canada. Basado en: Whelton PK et al. Primary prevention of hypertension: clinical and public health advisory from the National High Blood Pressure Education Program. JAMA 2002; 288:1882–88. Riesgo de complicaciones vasculares al aumentar el consumo de sodio, el riesgo es directamente proporcional a la cantidad de sodio ingerida (2). Tomado de: Strazzullo P et al. Salt intake, stroke and cardiovascular disease: metaanalysis of prospective studies. BMJ 2009; 339: b4567.
La reducción de 1.2g de sodio (3g de sal) en la alimentación habitual norteamericana, permitiría, según un estudio recientemente publicado, disminuir los costos en salud de EE.UU. en 10 a 20 mil millones de dólares al año (13).
En Chile, no existen suficientes datos fidedignos acerca del consumo de sal en la población general. Este se estima entre 9 y 12g al día. Sin embargo, sólo se registra un estudio efectuado en 146 mujeres embarazadas del área urbana de Concepción que cuantifica en forma aproximada su ingesta, la que alcanza en ese grupo en particular de personas a 11.7g (14).
La sal se utiliza desde hace muchos años en la preparación de alimentos tan diversos como helados, jugos de frutas, cereales, galletas y carne debido a sus características bacteriostáticas y principalmente, para preservarlos en el tiempo (15). También se agrega para disminuir el sabor amargo y para incrementar el sabor dulce, convirtiéndose en el aditivo más importante de los alimentos procesados (15). De muestra un botón, el año 2006, la Organización de Consumidores y Usuarios de Chile denunció un gran contenido de sodio en pollos puestos a la venta en supermercados, entre 255 y 395mg por cada 100g, aproximadamente 0.65 y 1.0g de sal (16). Los alimentos procesados contienen la mayor cantidad de sodio, en cambio en los alimentos naturales, el contenido total de sodio es mínimo. El 77% del sodio ingerido proviene de los alimentos procesados, el 12% corresponde al contenido de alimentos naturales y sólo el 11% restante, se agrega al cocinar y en la mesa (17). Solamente una comida rápida que consumen muchos chilenos los fines de semana, sobrepasa largamente la cantidad diaria máxima de sodio recomendada (18) (Tabla 2).
Contenido De Sodio De Una Comida “Rápida”
| Doble hamburguesa con queso | 1.120mg |
| Porción mediana de papas fritas | 340mg |
| Ensalada con trozos de pechuga de pollo | 1.085mg |
| Aliño para la ensalada | 194mg |
| Postre de chocolate | 252mg |
| Bebida cola “light” grande | 114mg |
| Total | 3.105mg |
| Equivalente a 7.8g de sal | |
¡Niños, vamos a comer! Contenido de sodio de una comida. Tomado de: Información nutricional de productoswww.mcdonalds.cl
La alimentación actual, preparada con alimentos procesados y escasa en frutas y vegetales, además de ser rica en sodio, es pobre en potasio. En el estudio efectuado en mujeres de la ciudad de Concepción, sólo un 13.6% tuvo una ingesta de potasio por encima de un mínimo de 90 mEq (3.5g) (14). Cabe hacer notar, que en las poblaciones que consumen alimentos naturales, la ingesta diaria de potasio es del orden de 150mEq (5.8g) (4). El consumo reducido de potasio es un tópico de gran interés en el desarrollo de hipertensión; de hecho, el déficit de potasio aumenta las cifras de presión arterial (19) y la administración oral de suplementos de potasio a pacientes hipertensos disminuye sus valores, como lo demostró Valdés el año 1991 (20). El aumento de la ingesta de potasio tiene un significativo efecto antihipertensivo (21) y potencia la reducción de la presión arterial lograda con la disminución del consumo de sodio. El estudio DASH demuestra una disminución de la presión sistólica en 5.9, 5.0 y 2.2mmHg al incrementar el contenido de potasio en sólo 1.9g a los tres regímenes de 8, 6 y 4g de sal del ensayo (7). Pacientes hipertensos que aumentan el consumo de vegetales y frutas y por lo tanto el aporte dietético de potasio, evidencian una mejoría de los signos de disfunción endotelial y un mejor pronóstico cardiovascular (22).
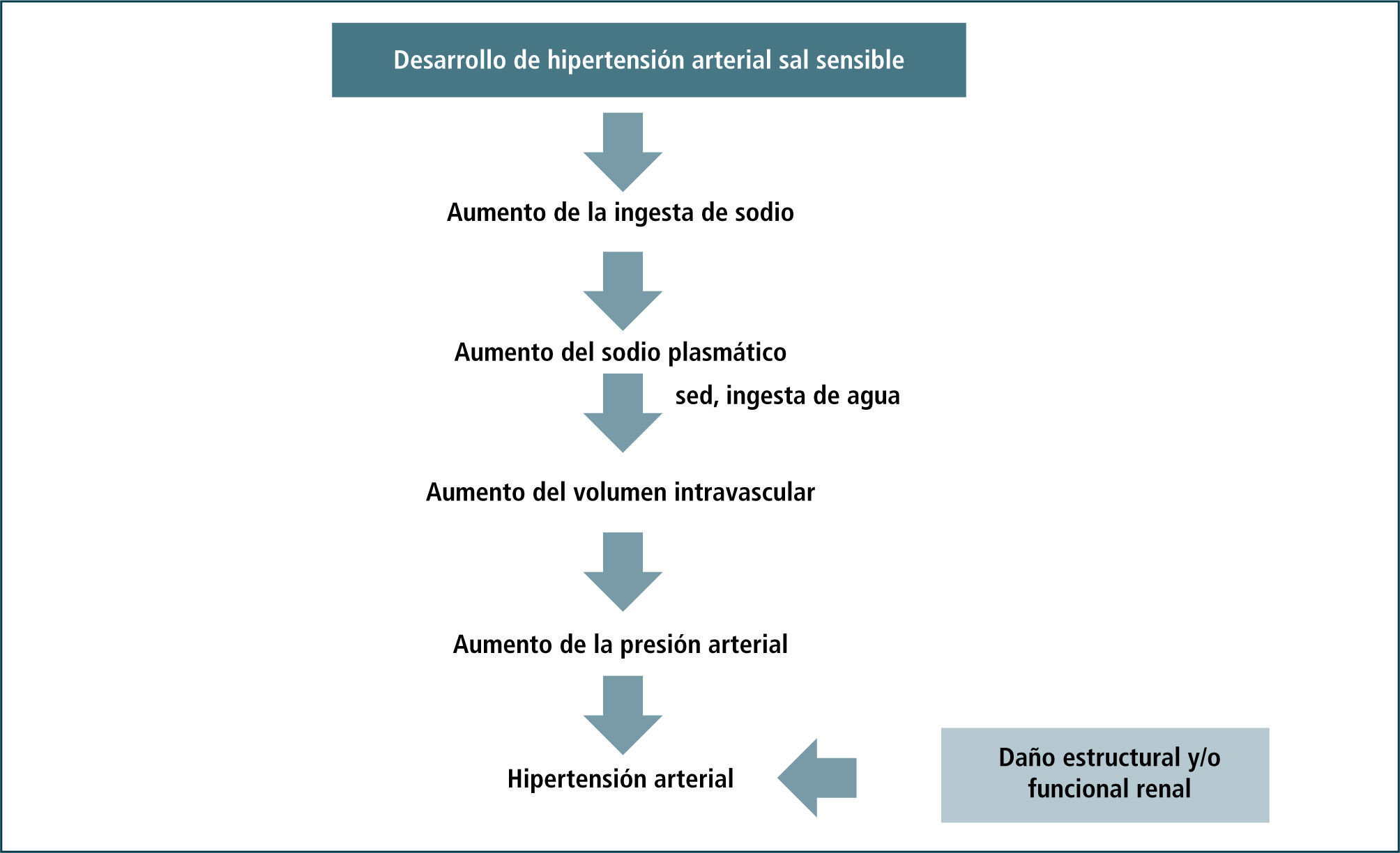
Mecanismos de hipertensión por exceso de sodio1Alteraciones estructurales y/o funcionales renalesEl exceso de sodio ingerido, se absorbe rápidamente en el intestino, determinando un aumento de la osmolalidad plasmática. Ésta estimula la sensación de sed y obliga al consumo de agua con la consiguiente expansión del volumen intravascular. Para compensar y controlar este aumento de volumen, los riñones responden eliminando la sobrecarga de sodio y agua. El año 1963 Borst y Borst-de Geus postularon a la hipertensión arterial como parte de un mecanismo homeostático necesario para aumentar la excreción renal de sodio (23). Un gran avance para la comprensión de este fenómeno lo estableció Guyton, quién sugirió un defecto patológico renal que impide la eliminación de todo el sodio ingerido (24). Para lograr eliminar el exceso, la presión arterial debe aumentar con el fin de incrementar la presión de filtración en los glomérulos y de esta manera, aumentar la carga filtrada y la excreción urinaria de sodio. En condiciones normales existe un balance entre la presión de perfusión renal (aproximadamente 100mmHg) y la eliminación urinaria de sodio (aproximadamente 100 – 120mEq). Este equilibrio se rompe, al asociar un consumo exagerado de sodio con diferentes factores que afectan la integridad anatómica y funcional renal, apareciendo hipertensión (Figura 5).
Los mecanismos de hipertensión postulados por Guyton y otros, presuponen un daño renal intrínseco que dificulta la excreción urinaria de sodio. Los más importantes son los siguientes: disminución del número de nefronas y aumento del transporte tubular de sodio.
1. 1Disminución del número de nefronasEl mecanismo de hipertensión se basa en la hipótesis de la hiperfiltración publicada el año 1982 por Brenner, Meyer y Hostetter (25). Esta teoría postula cambios hemodinámicos glomerulares en respuesta a una reducción congénita o adquirida del número de nefronas. Al disminuir el número de nefronas, se produce un aumento de la filtración glomerular en cada una de las remanentes, con el fin de mantener la filtración glomerular global y la carga total filtrada de sodio. Este mecanismo de compensación es necesario para evitar la retención de sodio. Se debe principalmente a una activación local del sistema renina- angiotensina- aldosterona (SRAA) con aumento de angiotensina II, determinando vasoconstricción arteriolar eferente, aumento de la presión intraglomerular e hipertensión arterial. La angiotensina II, además de los efectos hemodinámicas descritos, modula el crecimiento celular renal y su aumento contribuye al desarrollo de glomeruloesclerosis y fibrosis túbulointersticial, comportándose como una verdadera citoquina pro-inflamatoria y pro-fibrótica (26).
Las causas más importantes de una disminución del número de nefronas son la desnutrición intrauterina y el bajo peso al nacer, la obsolescencia glomerular relacionada al envejecimiento, la disfunción endotelial arterial y arteriolar con esclerosis glomerular y las distintas enfermedades renales (nefroesclerosis hipertensiva, nefropatía diabética, glomerulopatías, nefropatías intersticiales, infartos renales etc.).
Los niños con retardo en el crecimiento intrauterino y bajo peso de nacimiento, tienen una significativa reducción de la cantidad de glomérulos y presentan una mayor incidencia de hipertensión arterial en la edad adulta (27, 28). Más aún, en un estudio pareado de autopsia en hipertensos esenciales jóvenes y un grupo de personas sanas fallecidas en accidentes, se demostró una disminución cercana al 50% del número de glomérulos en los hipertensos en relación a los controles (29).
El envejecimiento se asocia a una disminución progresiva de la función renal debido a esclerosis glomerular por lo que no es de extrañar, una mayor prevalencia de hipertensión a medida que envejece una población (2).
1. 2Aumento del transporte tubular de sodioEn muchos estudios efectuados tanto en animales como en humanos espontáneamente hipertensos, se ha identificado un aumento de la reabsorción tubular de sodio, que será mayor mientras mayor sea la ingesta. Se ha encontrado entre otros, un aumento congénito o adquirido de la expresión y actividad de distintos transportadores de sodio en los túbulos proximales, como de la bomba Na+/K+/ATP asa, del intercambiador Na+/H+, del co- transportador Na+/K+/2Cl y del co-transportador Na+/glucosa. En los túbulos distales la alteración más frecuente es un aumento de la actividad de los canales epiteliales de sodio (ENaC).
En tres condiciones se detecta un significativo aumento de la reabsorción tubular de sodio: hipertensos con una gran ingesta de sodio, hipertensos con reducida ingesta de potasio y pacientes con obesidad central y resistencia a la insulina.
Estudios de excreción fraccionada de sodio en algunos pacientes hipertensos primarios sometidos a una carga oral de sal, demuestran claramente un aumento de la reabsorción tubular proximal de sodio (30). El exceso de sodio y la expansión del volumen intravascular resultante, estimulan la producción y secreción en las glándulas suprarrenales y el cerebro de compuestos endógenos de acción similar a los digitálicos (ouabaína símiles). Estos son capaces de inhibir parcialmente la bomba de sodio celular (Na+/K+ATP asa), resultando en un aumento del sodio intracelular miocárdico y arterial, con aumento de la contractibilidad miocárdica y de la resistencia periférica. Paradójicamente, estimulan la misma bomba de sodio en los túbulos proximales, aumentando la reabsorción tubular y agravando de esta forma, la retención de sodio (31).
El déficit de potasio estimula a diferentes transportadores tubulares renales de sodio, aumentando la reabsorción de sodio y por lo tanto la retención del mismo (32).
En pacientes con obesidad central también existen evidencias de una mayor reabsorción proximal de sodio (33, 34), atribuida a una activación del sistema renina- angiotensina por los adipositos, a la resistencia a la insulina y particularmente, a un déficit de factores natriuréticos como del péptido intestinal GLP-1 (glucagon like peptide). Hemos demostrado en obesos insulinoresistentes, el efecto natriurético de la infusión de esta hormona (35, 36).
Aproximadamente un tercio de los pacientes obesos con resistencia a la insulina también presentan un aumento de aldosterona, la que estimula la reabsorción distal de sodio abriendo los canales epiteliales (ENaC) (37). Las células adiposas producen diferentes sustancias que estimulan la secreción de aldosterona, como algunos derivados oxidados del ácido linoleico (38).
El nefrón distal es el último segmento donde se regula el balance de sodio a través de la acción de canales epiteliales de sodio (ENaC). Estos canales se localizan en las células de los túbulos distales y colectores y se activan para reabsorber sodio por un aumento de la concentración de este catión en el líquido tubular, y por un aumento de la secreción de aldosterona. Su efecto es bloqueado con amilorida o triamtereno y con antagonistas de los receptores de aldosterona como la espironolactona. En algunos pacientes, mayoritariamente de raza negra, se describe un aumento desproporcionado de la actividad de estos canales con reabsorción exagerada de sodio (39) y normotensión al inhibirlos con amilo- rida (40) y con la combinación amilorida – espironolactona.
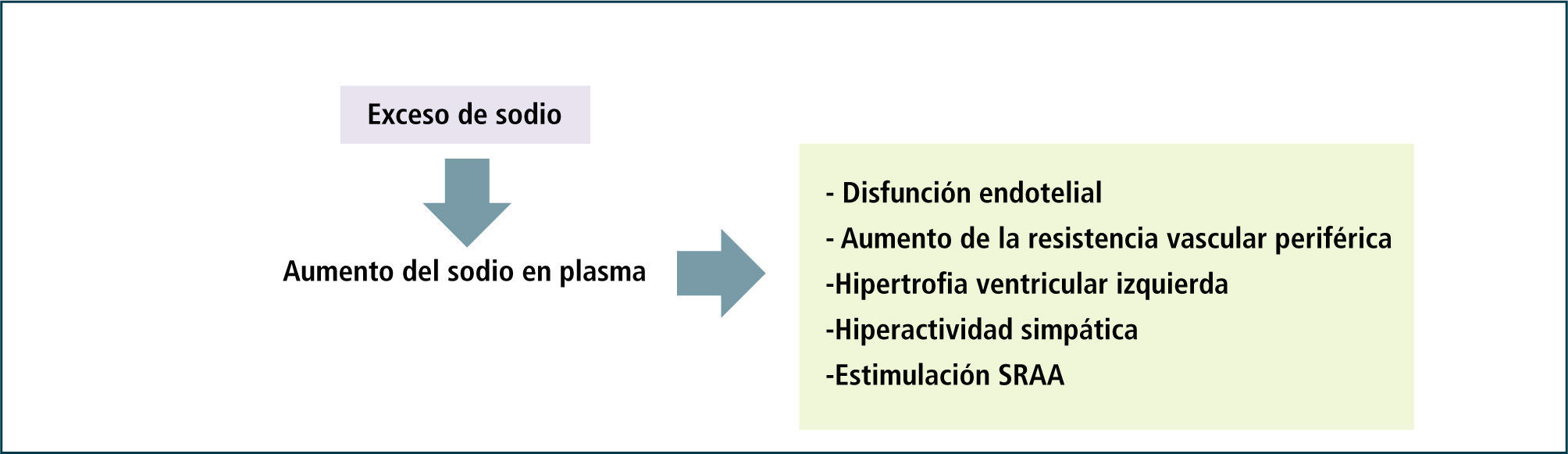
2Aumento de la concentración plasmática de sodio, disfunción endotelial y aumento de la resistencia vascular periféricaPor muchos años se consideró a los mecanismos descritos, como los más importantes para el desarrollo de hipertensión arterial dependiente del consumo de sal o hipertensión sal sensible. Sin embargo, estos pacientes también presentan concentraciones plasmáticas de sodio mayores que los normotensos, sugiriendo un efecto deletéreo directo, no dependiente de volumen. En efecto, de Wardener demostró en enfermos hipertensos concentraciones plasmáticas de sodio 1.5 mEq/l mayores que en normotensos (41). Aumentos crónicos del sodio plasmático del orden de 3 mEq/l, estimulan la actividad del sistema simpático desencadenando hipertensión (42). Incrementos aún menores inducen hipertrofia ventricular izquierda y de las células musculares lisas arteriales, además de aumentar la expresión de los receptores de angiotensina II (43). Datos de estudios recientes efectuados en cultivos de células endoteliales vasculares, demuestran una franca disminución de la producción de óxido nítrico y alteraciones estructurales (rigidez y aumento de volumen) de las células al aumentar la concentración de sodio en el medio de cultivo (44). Además, la retención de sodio aumenta las concentraciones de dimetil L-arginina asimétrica, sustancia que inhibe potentemente la síntesis de óxido nítrico endotelial (45). Pequeños incrementos del sodio plasmático también elevan las concentraciones de este catión en el líquido céfaloraquídeo, desencadenando una hiperestimulación simpática y activación del sistema renina-angiotensina hipotalámico (41) (Figura 6). El exceso de sodio y el déficit de potasio se potencian en el daño endotelial debido al reemplazo intracelular de potasio por sodio alterando la funcionalidad del endotelio (32). Todos estos efectos, son sin duda, parte de una agresión constante al endotelio vascular; inducen un aumento de la resistencia arterial periférica e hipertensión (Figura 7).
No hay que olvidar la confluencia de otros factores de disfunción endotelial como el aumento del tono simpático en obesos y en pacientes con síndrome de apnea obstructiva del sueño (34, 46, 47), dislipidemia, tabaco, sobrepeso, obesidad, resistencia a la insulina e hiperuricemia entre otros (48, 49).
3Disminución de la capacidad de almacenamiento del sodio osmóticamente inactivoEl organismo se defiende de la exagerada ingesta de sodio, aumentando su eliminación renal, por cierto limitada, y almacenando el exceso en la piel, en el sistema linfático subcutáneo, en cartílagos y huesos. (50, 51). El sodio almacenado de esta forma, se encuentra unido a glicosaminoglicanos y por lo tanto, no arrastra agua transformándose en sodio osmóticamente inactivo (52). Este gran compartimiento permite “guardar” el exceso de sodio. Sin embargo, este verdadero reservorio disminuye con la edad y con la menopausia, siendo una de las causas de la mayor incidencia de hipertensión sal sensible en las personas mayores de 50 años (12).
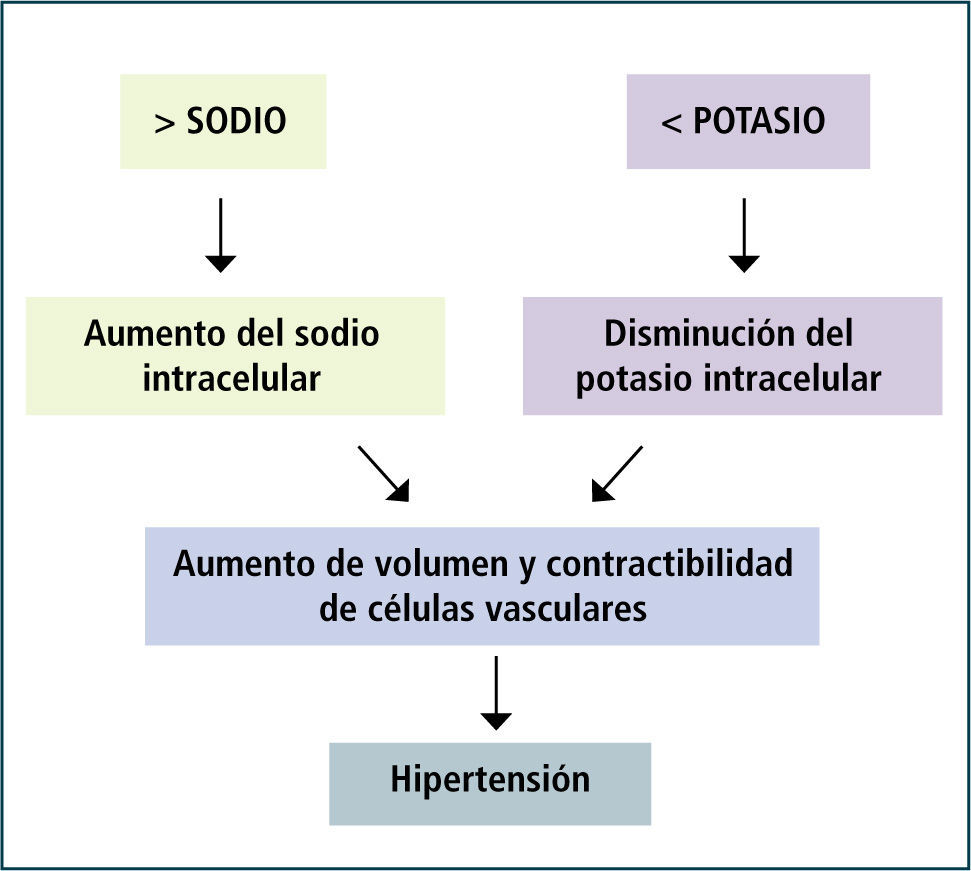
Mecanismos de hipertensión por déficit de potasioLos mecanismos son complejos e incluyen disfunción endotelial, aumento del estrés oxidativo, inhibición de la bomba de sodio de las células musculares lisas de arterias y arteriolas con aumento del sodio intracelular y vasoconstricción secundaria, disminución de sustancias vasodilatadores (kalicreína, óxido nítrico y prostanoides), aumento del tono simpático y estimulación del sistema renina- angiotensina- aldosterona (32).
Fundamentalmente, el potasio celular es reemplazado parcialmente por sodio, alterando la tonicidad y el volumen de las células. También, el déficit de potasio estimula a diferentes transportadores renales de sodio como la bomba Na+/K+/ATP asa y el intercambiador Na+/H+ para retener sodio. El exceso de sodio, aumenta la concentración tubular de sodio en el nefrón distal abriendo los ENaC con lo que se promueve la eliminación urinaria de potasio, acentuando el déficit (32).
Lamentablemente, el potasio plasmático no refleja el contenido total de potasio y por lo tanto, no es útil como referencia, a excepción de concentraciones mayores de 5.5mEq/l que obligan a revisar ingesta, medicamentos retenedores de potasio y función renal.
Recomendaciones generalesLos hábitos alimentarios descritos, facilitan el desarrollo de hipertensión sal sensible, por lo tanto, se requiere de un gran esfuerzo para estimular un cambio en la relación sodio / potasio de la dieta, el que consiste en disminuir el consumo de sodio y aumentar el de potasio. En el estudio de Durán la ingesta promedio de sodio fue de 4.7g al día y la de potasio alcanzó a sólo 2.4g (14). La primera meta es estimular una dieta balanceada que promueva un consumo de sodio y potasio en una proporción de 1:1 y revertir la relación de 2:1 estimada para la población chilena (Opinión de expertos: Fundación de Hipertensión de Chile). A largo plazo, se recomienda disminuir el consumo de sodio y mantenerlo entre 1.2 y 2.3g al día (3.0 – 5.8g de sal), teniendo la precaución de disminuir el consumo de sodio con la edad, debido a la mayor incidencia de hipertensión sal sensible a medida que envejece la población (Opinión de expertos: Blood Pressure Canada; National High Blood Pressure Education Program, USA) (11) (Tabla 3). Se sugiere además, duplicar el aporte de potasio a por lo menos 4.7g diarios (11). Para lograr estas metas se requiere de un gran programa educativo, políticas globales para disminuir la adición de sodio a los alimentos procesados y un etiquetado exacto del contenido de sodio y potasio en ellos, para que el consumidor pueda elegir los más convenientes.
Recomendaciones Generales De Ingesta De Sodio Según Edad
| Edad | Sodio | Sal |
|---|---|---|
| < 50 años | 1.6g | 3.8g |
| 50 – 70 años | 1.3g | 3.2g |
Recomendaciones generales de ingesta de sodio según edad. También es recomendable un aumento del consumo de potasio a 4.7g. Tomado de: Whelton PK et al. Primary prevention of hypertension: clinical and public health advisory from the National High Blood Pressure Education Program. JAMA 2002; 288:1882–88.
El autor declara no tener conflictos de interés, en relación a este artículo.