La radioterapia es la aplicación de radiaciones ionizantes para el tratamiento del cáncer, incluyendo la paliación del dolor y de otros efectos nocivos tumorales, y también de algunas enfermedades benignas. El efecto principal de la radiación es el daño del ADN que condiciona la muerte de las células cancerosas. La radioterapia presenta hoy avances tecnológicos importantes en la generación, precisión y calidad de la irradiación. Se describe el proceso que debe seguir un paciente para su tratamiento y los efectos adversos que puede producir la irradiación de los diferentes territorios del cuerpo.
Radiotherapy is used for cancer treatment, including palliation of pain and other harmful tumor effects, through the application of ionizing radiation to the sick tissues. The principal consequence of the ionizing radiation is DNA damage that results in tumor cell death. Radiotherapy presents today important technological advances in generation, precision and quality of irradiation. The patient’s treatment process is described including the side effects produced by the irradiation of different parts of the body.
La radioterapia es la aplicación de radiaciones ionizantes con el fin de eliminar un crecimiento celular anormal o desregulado. Su efecto se produce mediante la transferencia de energía en forma de ondas electromagnéticas o partículas, que producen un cambio químico, ionización, cuyo efecto principal es la ruptura del material genético de las células, ADN, conducente a detener la multiplicación celular y producir su muerte (1).
La sensibilidad o respuesta a la radiación es diferente para los diferentes tejidos, sean éstos tejidos sanos o tumorales. La diferencia en la respuesta tisular a la radiación genera una ventana terapéutica que permite eliminar el tejido tumoral, minimizando el daño a los tejidos sanos (2).
Los avances tecnológicos han permitido localizar la radiación, depositar la energía, en forma precisa, lo que equivale a colocar quimioterapia en alta dosis directamente en el tumor (3).
La radioterapia se utiliza como tratamiento curativo en tumores localizados loco-regionalmente (4). Se usa también como tratamiento adyuvante y neo adyuvante de la cirugía, radioterapia post y pre operatoria respectivamente y de igual forma con la quimioterapia. Además la radioterapia en algunos casos se emplea simultáneamente con la quimioterapia, en forma concomitante, sensibilizando las células tumorales al efecto de la radiación, potenciando su eliminación. La radioterapia se utiliza en los cuidados paliativos para calmar el dolor y otros síntomas que pueden alterar la calidad de vida de los pacientes (5). Por último la radioterapia también tiene un rol en cuidado de algunas lesiones benignas (6).
La radioterapia se puede aplicar de diferentes formas. La más utilizada es la teleterapia, que consiste en aplicar radiación desde fuera del paciente mediante una máquina que produce la irradiación. Otra forma es colocar fuentes de radiación directamente en el tumor, braquiterapia. Por último la radiación puede administrase mediante moléculas cargadas con isotopos radioactivos que se fijan al tejido tumoral dañándolo selectivamente (7).
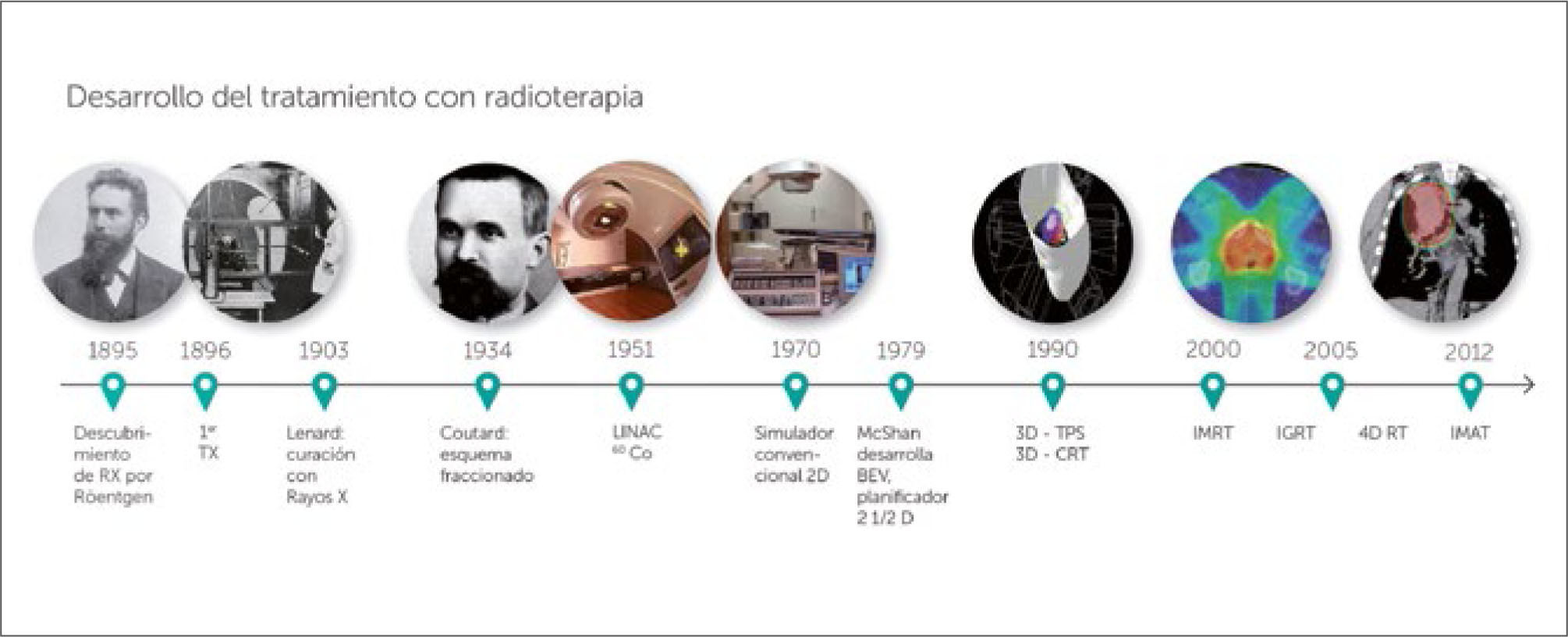
Generación de la radiaciónAspectos históricosLos equipos generadores de radiación, teleterapia, han sufrido una evolución importante. Inicialmente se fabrican equipos de Rayos X de baja energía, ortovoltage, que tiene baja penetración en los tejidos. Posteriormente se fabrican equipos de alta energía, los aceleradores lineales y las bombas de cobalto. La bomba de cobalto utiliza el isotopo radiactivo cobalto 60 para producir rayos gama de 1.25 megavolts. El auge de la maquina cobalto se debió a que era mecánicamente sencilla y barata. En la actualidad ha sido remplazada por los aceleradores lineales, máquinas muy superiores en energía, ductibilidad y precisión. Los aceleradores lineales pueden tener múltiples energías de rayos x, las más usadas son la combinación de 6 y 18 megavolts, haces de electrones para la terapia superficial y una gran precisión mecánica que le permite depositar la energía donde se necesita (Figura 1).
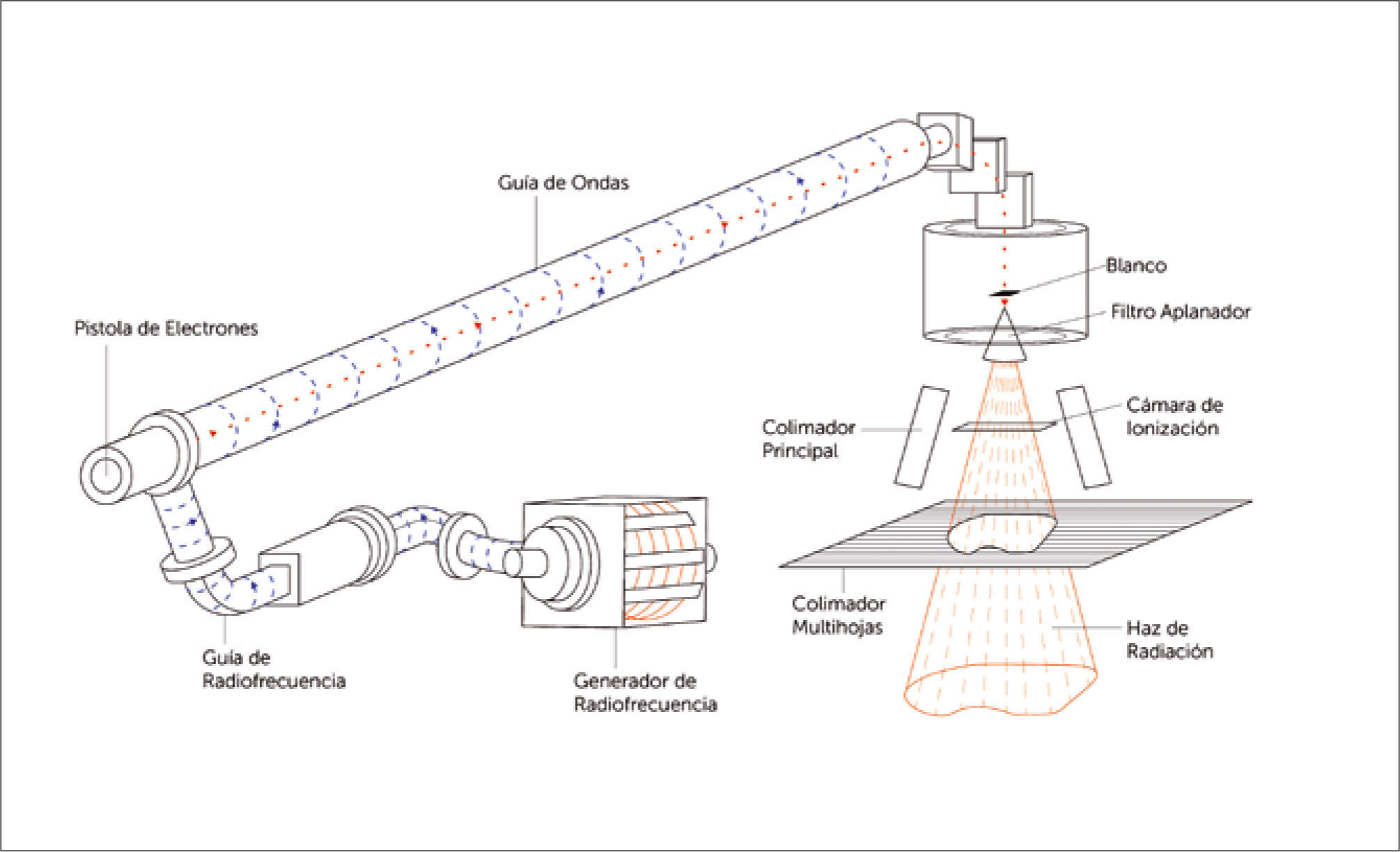
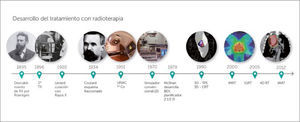
Aspectos técnicosEl acelerador lineal genera rayos X acelerando electrones en una guía de onda al vacío, los electrones son producidos en el extremo de la guía de ondas por un filamento, pistola de electrones y son acelerados por microondas avanzando hasta chocar con en blanco de tungsteno generando los rayos X. Los rayos X son dirigidos por un sistema de colimación que deja una ventana de apertura variable que permite la salida del haz de radiación (Figura 2). La forma de la ventana se modifica para adoptar formas irregulares mediante un colimador multilaminar. El colimador multilaminar desliza hojas de láminas delgadas para generar con precisión la forma de ventana requerida (8) (Figura 3). El acelerador lineal cuenta con mecanismos de control de calidad, los que miden la dosis producida y las características del haz, simetría y planicidad, permitiendo entregar una radiación segura (9). Por último, se ha agregado al acelerador lineal sistemas de radiografías portales digitales que permiten verificar el alineamiento del blanco a tratar y corregir automáticamente la posición de la mesa si es necesario (Figura 4).
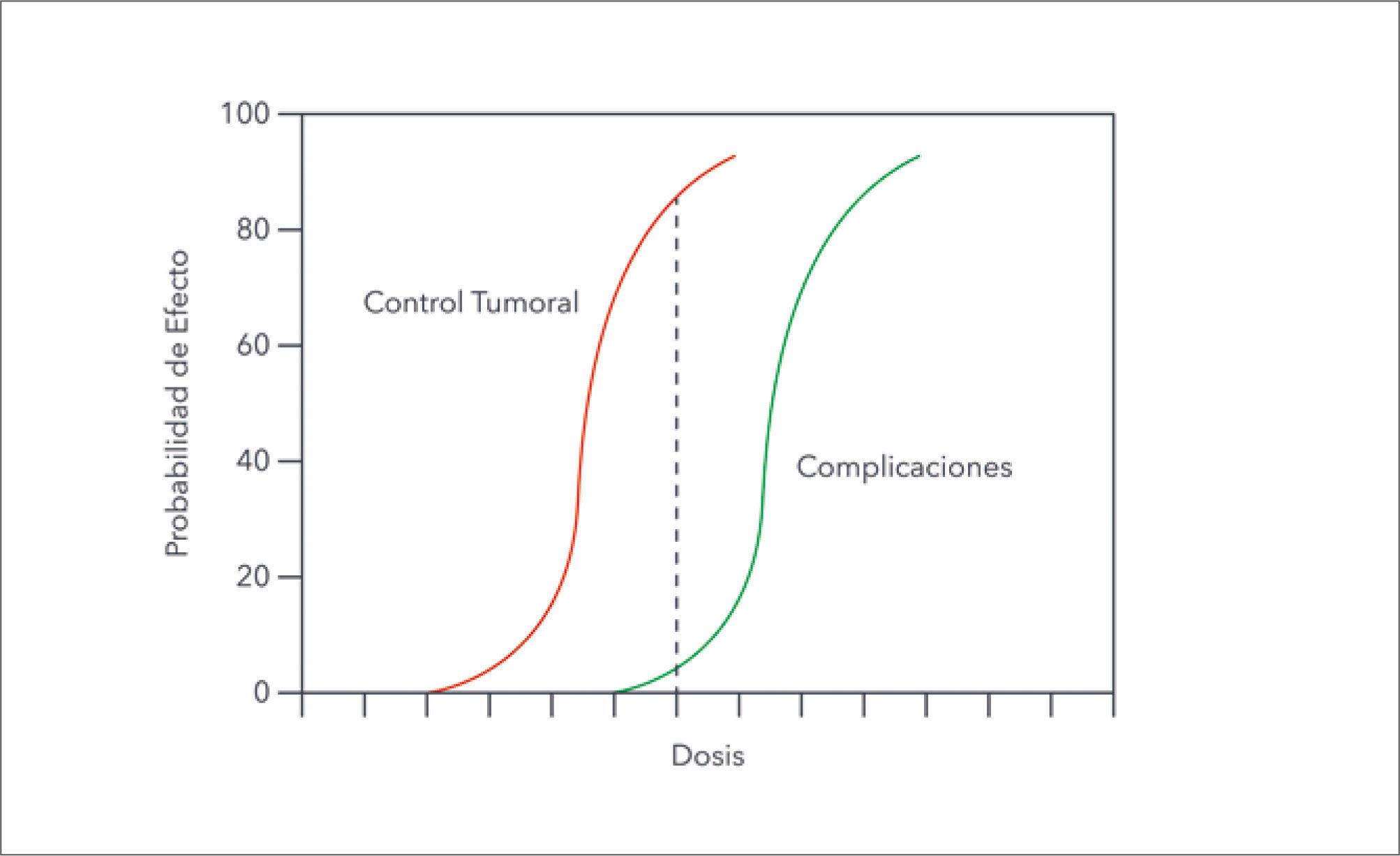
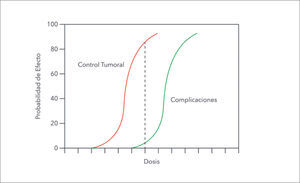
Historia de la radioterapiaAspectos radio-biológicos de la radioterapiaÍndice o ventana terapéuticaLa respuesta a la injuria causada por la radiación es diferente para los distintos tejidos. En general las células tumorales se comportan como tejidos de crecimiento rápido a diferencia de la mayoría de los tejidos normales que son de crecimiento lento. Esto genera curvas de respuesta a la radiación, probabilidad de control tumoral y probabilidad de complicación del tejido normal, que mientras más lejos se posicionen mayor es la probabilidad de control tumoral y menor la posibilidad de daño del tejido normal (Figura 5). Si las curvas se aproximan o cruzan, el daño al tejido normal es similar al de las células tumorales. La ubicación de las curvas depende del tipo celular tumoral y del tejido sano adyacente (1).
La dosis de radiación se mide en Gy y corresponde a la cantidad de energía absorbida por el tejido (jules/Kg). La dosis total de un tratamiento y el número de fracciones en que se divide su aplicación son factores fundamentales del efecto radioterapéutico. La muerte celular causada por radiación tiene un relación que no es lineal con el tamaño de la fracción. A una misma dosis total de radiación, la radiación aplicada en pocas fracciones, dosis/fracción grande, produce mayor muerte celular que si es entregada en muchas fracciones, dosis/ fracción pequeña. Por otra parte, la respuesta al tamaño de la dosis/ fracción es diferente para el tejido tumoral que se divide rápidamente que para el tejido sano que se divide lentamente. La dosis/fracción pequeña protege más al tejido sano que al tumoral, aumentando la ventana terapéutica, mayor muerte celular tumoral y protección del tejido sano. Esta es la base del fraccionamiento utilizado en la clínica, donde se utilizan muchas fracciones pequeñas entregadas diariamente a lo largo de semanas, hasta alcanzar la dosis total. La evaluación de la dosis total sin considerar la dosis/fracción no tiene sentido y para poder comparar los diferentes fraccionamientos se ha diseñado el concepto de dosis biológica equivalente.
El fraccionamiento excesivo lleva a que el tiempo total de tratamiento se prolongue y a la repoblación de las células tumorales disminuyendo el control tumoral. La prolongación del tiempo total de tratamiento por suspensión de días de terapia por diferentes causas puede en algunos casos disminuir el control tumoral.
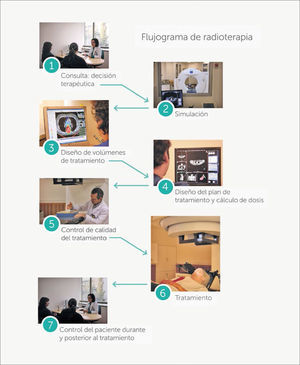
El flujo del tratamiento con radiación1ConsultaLa evaluación para radioterapia se inicia con la consulta al radio-oncólogo como parte de la evaluación multidisciplinaria, en la que se revisa el diagnóstico y la etapificación de la enfermedad, se determina la necesidad de exámenes adicionales y se diseña el curso de tratamiento que puede incluir la combinación de radioterapia, quimioterapia y /o cirugía. Aproximadamente dos tercios de los pacientes se benefician de radioterapia en algún momento de su curso de tratamiento y la mayoría con intensión curativa. (Figura 6).
Si se decide que el paciente requiere radioterapia es citado para su simulación.
2SimulaciónEl desafío para lograr un tratamiento efectivo comienza con la obtención de imágenes que permitan definir espacialmente la localización y extensión del tumor, la que se suma el examen físico que es especialmente útil para definir la extensión en áreas imagenológicamente no visibles, como la extensión tumoral en la mucosa.
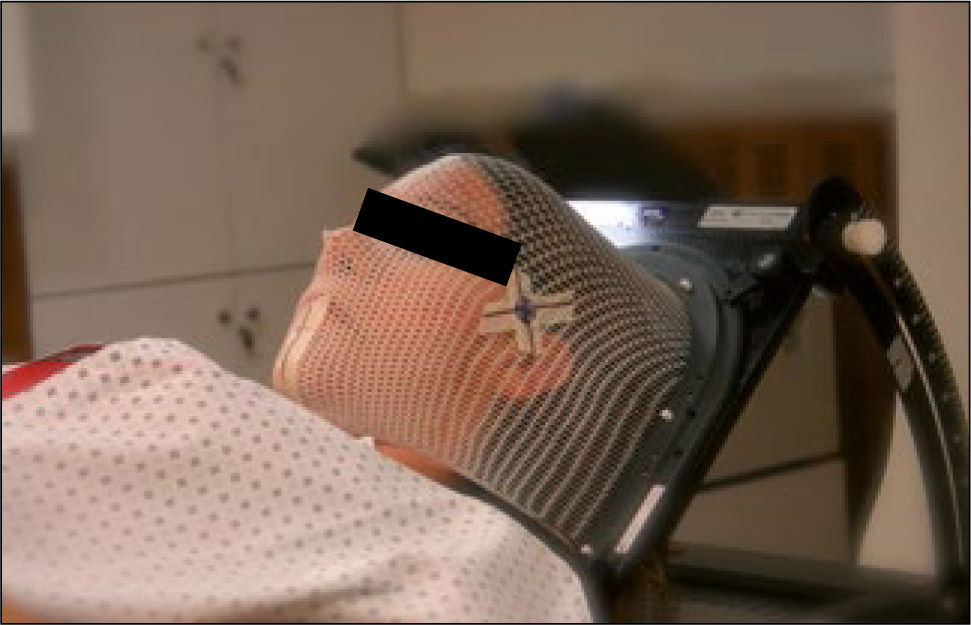
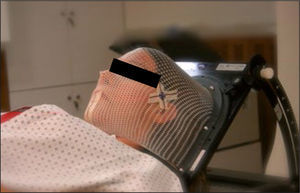
La primera acción de la simulación es inmovilizar al paciente en una posición que permita su reproducción a lo largo de todo el tratamiento y además permita optimizar el acceso de los haces de radiación para una localización anatómica determinada. Esto se logra utilizando un TAC-simulador, que es un tomógrafo con una gran apertura para el paso del paciente, open board, lo que permite el posicionamiento óptimo. Para el posicionamiento e inmovilización se emplean elementos de fijación estándar o personalizados como las máscaras de plástico termolábil o los colchones de vacío, dependiendo del caso en particular (Figura 7). Para la optimización anatómica, por ejemplo en el caso de irradiación a pelvis, se posiciona el paciente en posición prona, boca abajo, en una colchoneta especial, bellyboard, que permite que el abdomen cuelgue desplazando el intestino por gravedad fuera de la pelvis.
Una vez posicionado el paciente, se toman las imágenes de TAC y se marca el paciente para poder alinearlo en la máquina de tratamiento. Dependiendo de la localización puede adquirirse diferentes series: sin contraste, con contraste endovenoso, con otros contrastes, en inspiración y espiración, con vejiga llena o vacía, etc. (Figura 8).
3PlanificaciónaDefinición de volúmenes de tratamiento
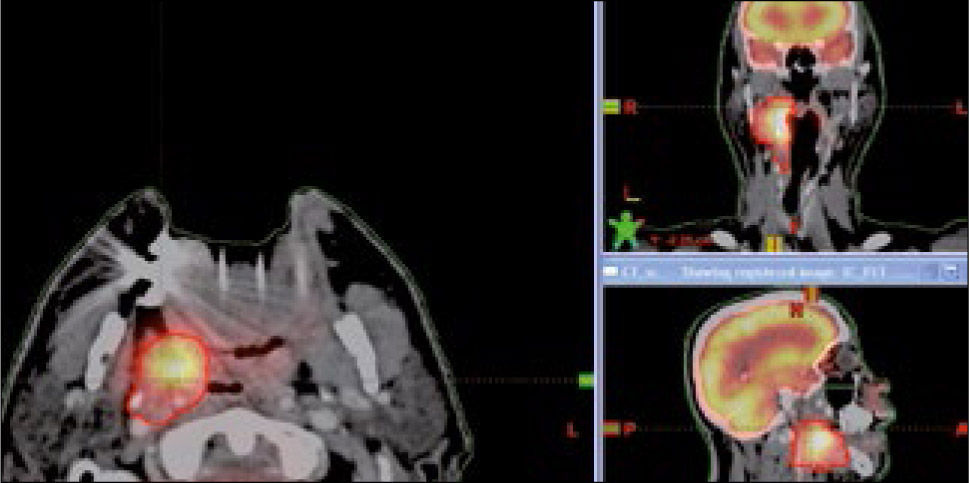
Para la planificación deben usarse todas las formas de imágenes, TAC, RNM, PET-CT, que permiten mejorar la visualización del tejido tumoral y su relación con el tejido normal. Las diferentes formas de imagen son fusionadas a la imagen del TAC-simulador para permitir una correlación espacial óptima.
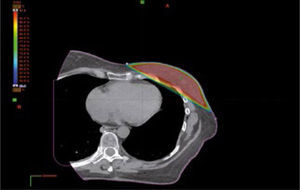
Las imágenes en conjunto con el examen físico son utilizadas por el radio-oncólogo para definir el tumor, volumen blanco llamado GTV (gross tumor volumen) y los órganos a riesgo que son los órganos sanos que están próximos al tumor. El radio-oncólogo debe definir además la extensión subclínica del tumor, no visible en las imágenes, llamada CTV (clinical target volumen) lo que requiere de criterio clínico del médico que debe tomar en consideración la correlación anátomo-patológica, las vías de diseminación basadas en la localización y tipo histológico, el drenaje linfático y los patrones de recidiva. Al CTV se le agrega un margen que toma en consideración los movimientos internos del cuerpo y las incertezas del posicionamiento diario, llamado PTV (planning target volumen) (10) (Figura 9).
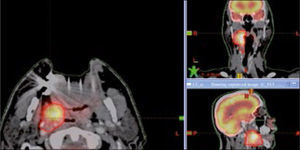
Las imágenes de RNM son especialmente útiles en la definición anatómica de los tumores del sistema nervioso central, cabeza y cuello, próstata y partes blandas (11). El PET-CT aporta información funcional, lo que permite definir áreas que requieren mayor dosis y áreas que se deben proteger. El PET-CT es especialmente útil en el cáncer pulmonar donde el TAC no puede diferenciar el tumor de la atelectasia permitiendo proteger el pulmón sano y además localizar el compromiso ganglionar del mediastino y definir las zonas que requieren radiación (12).
Las imágenes del TAC-simulador sin contraste son utilizadas para el cálculo de la distribución de dosis ya que generan un mapa de densidad electrónica que permite cuantificar la absorción de radiación para cada tejido. Esto es especialmente crítico en zonas de gran heterogeneidad como por ejemplo los pulmones.
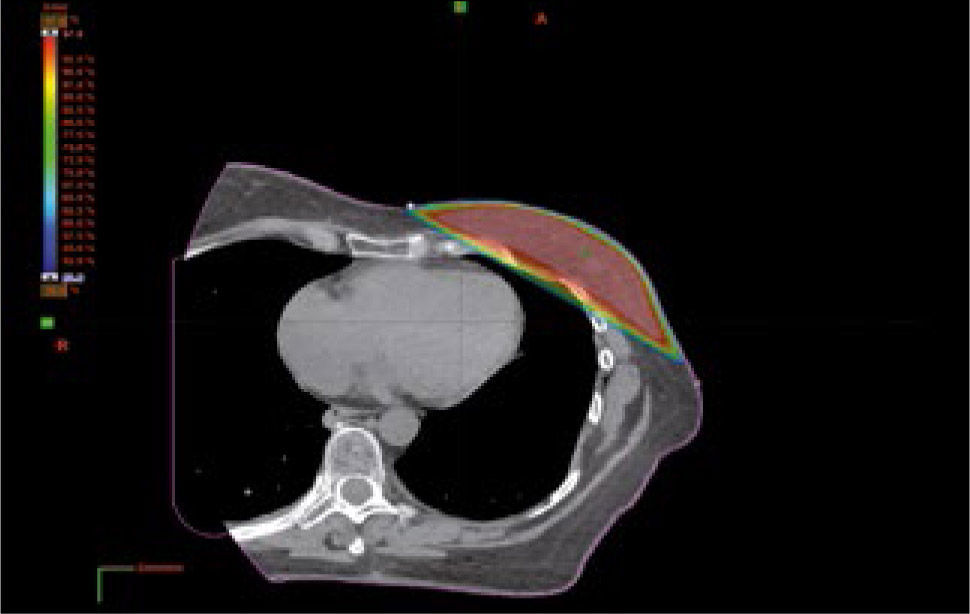
bDiseño y cálculo del tratamientoPara diseñar el plan de radioterapia se utiliza un sistema computarizado de planificación. Inicialmente el radio-oncólogo define el volumen de tratamiento y los órganos a riesgo que debe proteger, la dosis total y el fraccionamiento y los límites de dosis a los órganos a riesgo. Esta información se le entrega al equipo de dosimetría y física para que desarrolle el plan. Al hacer el plan se optimiza la posición, el número, la dirección, la forma, la energía y la proporción de dosis para los haces o campos de radiación. El planificador calcula la distribución de dosis y presenta el resultado en forma gráfica sobre los volúmenes dibujados o en forma matemática mediante un histograma dosis volumen. La optimización del plan es un proceso iterativo entre el radio-oncólogo y el equipo de dosimetría hasta alcanzar el plan adecuado para el tratamiento (Figura 10).
La radioterapia 2D utiliza campos simples, tradicionalmente paralelos opuestos que son conformados al volumen de tratamiento mediante el colimador multilaminar o mediante la fabricación de bloques. La radioterapia 2D permite solamente tratamientos sencillos y se utiliza para tratamientos paliativos.
La radioterapia 3D-CRT (3D conformal radiotherapy) emplea múltiples campos con la forma del blanco dibujada en el colimador multilaminar, en general son cuatro a siete haces, con el fin de lograr que la distribución de la dosis envuelva el volumen blanco.
La radioterapia por modulación de intensidad, IMRT, utiliza múltiples incidencias de haces de radiación, cada incidencia dividida mediante el colimador multilaminar en varios segmentos, que tienen diferentes intensidades de dosis lo que produce una haz con intensidades variables llamado fluencia. Un sistema computarizado que utiliza algoritmos de cálculo inverso genera la configuración de cada segmento para que al ser sumados produzcan una distribución de dosis muy precisa. La mayor precisión en la distribución de la irradiación con IMRT permite aumentar la dosis en los tejidos blancos y dar mayor protección a los órganos a riesgo. Además IMRT permite depositar diferentes dosis en distintas partes del volumen de tratamiento (13) (Figura 9).
cSistemas de Registro y verificaciónLa alta complejidad de los tratamientos de radioterapia hace indispensable el uso de sistemas computarizados que registren la información generada en el planificador, la lleven a la máquina de tratamiento y verifiquen que cada uno de los parámetros planificados sea reproducido. Para una máxima precisión cada variable es indexada y el sistema de verificación no permite el tratamiento si está fuera de rango. Por último el sistema de registro permite revisar los parámetros con que se hizo cada aplicación de radiación.
4TratamientoEl paciente es posicionado en la mesa de tratamiento en la misma posición en que fue simulado. Se toman radiografías de verificación digitales con el acelerador lineal y se corrige la posición si es necesario. Para la verificación del posicionamiento se compara radiografías generadas por el TAC de simulación con las tomadas en el acelerador y mediante un sistema computarizado se alinean indicando cuál es la corrección en la posición de la mesa. Este procedimiento se conoce como radioterapia guiada por imágenes (IGRT) (14).
La aplicación de la radiación se reproduce diariamente a lo largo del tratamiento.
5Control durante y después de la radioterapiaA lo largo del tratamiento los pacientes son evaluados periódicamente por el radio-oncólogo. Los controles permiten verificar que el tratamiento se esté llevando a cabo de acuerdo al plan además de diagnosticar y tratar efectos adversos si estos ocurren. Los controles deben continuar después del término de la terapia para evaluar los resultados y tratar efectos adversos tardíos, que pueden aparecer años después de la radioterapia.
Efectos adversos de la radiaciónLos efectos adversos de la radiación pueden ocurrir durante el tratamiento o inmediatamente después, efectos agudos (Tabla 1), o pueden aparecer meses o años después, efectos tardíos (Tabla 2). Los efectos agudos en general desaparecen sin dejar secuelas en cambio los efectos adversos tardíos son permanentes.
Tabla de efectos agudos, durante la radioterapia e inmediatamente después
| Región | Síntomas |
|---|---|
| Generales | • Cansancio, poca energía. • Poco apetito. |
| Piel | • Eritema. • Hiperpigmentación. • Ulceración. |
| Cerebro | • Caída del cabello. • Cefalea. • Náuseas – Vómitos. • Somnolencia |
| Cabeza y cuello | • Mucositis, Ulceración de mucosa, dolor para comer. • Sequedad bucal. • Alteración del sabor. • Disfonía. |
| Tórax | • Neumonitis – tos seca, fiebre, disnea. • Esofagitis. • Disfagia. |
| Abdomen | • Náuseas, vómitos • Distensión abdominal. • Diarrea. |
| Pelvis | • Diarrea. • Cistitis, dolor al orinar. • Aumento de frecuencia de orina. |
Efectos tardíos
| Región | Síntomas |
|---|---|
| Cerebro | • Alteración memoria tempranas. • Disminución capacidad intelectual. • Edema cerebral. |
| Cabeza y cuello | • Daño a dentadura secundario a sequedad y falta de higiene. • Disfagia. • Rigidez cuello. • Linfedema submentoniano: papada. |
| Tórax | • Fibrosis pulmonar. • Disminución de capacidad pulmonar. • Estenosisesofágica. |
| Abdomen | • Distensión abdominal. • Intolerancia a alimentos. • Diarrea frecuente. • Ulceración gástrica. • Insuficiencia renal. • Insuficiencia hepática. • Obstrucción intestinal. |
| Pelvis | • Distensión abdominal. • Intolerancia a alimentos. • Diarrea frecuente. • Cistitis, hemorrágica. • Rectitis hemorrágica. • Obstrucción intestinal. |
Los efectos adversos en los órganos sanos dependen del órgano y la cantidad de volumen irradiado, de la dosis total, la dosis/fracción diaria y el tiempo transcurrido entre las fracciones. Los efectos adversos de la radioterapia ocurren solo en la zona del cuerpo que ha recibido irradiación.
Para facilitar el análisis del daño producido por la radiación los órganos han sido agrupados en órganos con estructuras paralelas, órganos en línea y órganos mixtos. Los órganos en paralelo tienen múltiples unidades funcionales iguales y si una parte es dañada el resto, mediante la reserva funcional, es capaz de mantener la función del órgano. Los efectos tardíos de los órganos en paralelo son dependientes de la proporción del volumen del órgano irradiado y son ejemplo de éstos el hígado y el riñón. En cambio en los órganos en serie cada unidad funcional es crítica para su función. Los efectos tardíos son dependientes de la dosis máxima en cada segmento, la que si es sobrepasada puede interrumpir su función, son ejemplo de éstos la médula espinal y el intestino. Los órganos mixtos tienen ambos componentes y ejemplo de éstos es el cerebro.
La tolerancia a la radiación es propia para cada persona dependiente de los mecanismos de reparación del daño. Los radioterapeutas han estudiado y diseñado tablas que permiten estimar los riesgos de daño por radiación para los diferentes órganos para una población promedio (15,16). El tratamiento con radiación debe balancear el control del cáncer con el daño a los tejidos sanos.
Efectos adversos más comunesPielEl uso de aceleradores lineales de alta energía ha disminuido la irradiación de la piel, evitando los efectos adversos. En los casos en que la irradiación debe ser superficial, los efectos agudos más frecuentes son el eritema, que evoluciona a hiperpigmentación, y en los casos que la dosis recibida es más alta se puede producir descamación seca y luego ulceración. La piel se regenera entre una a cuatro semanas con curaciones con suero fisiológico y cubriéndolas con crema humectante. Los efectos adversos tardíos en la piel son la fibrosis, acartonamiento de la piel y celular subcutáneo, sequedad, hiperpigmentación y telangectasias.
Sistema nerviosoLa irradiación del cerebro puede generar aumento de la presión intracraneana por edema cerebral, el que habitualmente ya está presente causado por la lesión tumoral. El edema cerebral produce cefalea y si es profuso náuseas, vómitos y se pueden acompañar de somnolencia, déficits neurocognitivos, motores y sensoriales. Se trata con corticoesteroides que se dosifican de acuerdo a la intensidad de los síntomas. Los efectos adversos tardíos de la irradiación a todo el cerebro son las alteraciones neurocognitivas, que son más intensas en los niños, produciendo retardo mental. La irradiación focal a dosis altas puede producir necrosis con proliferación vascular anormal que se manifiesta por edema cerebral intenso y se trata con corticoesteroides, antiangiogénicos y eventualmente cirugía que remueve el foco de necrosis.
Los efectos adversos tardíos de la irradiación de la médula espinal pueden ser transitorios o irreversibles y dependen de la dosis total, tamaño de dosis/fracción y largo de la médula irradiada. La alteración más frecuente es la mielopatía transitoria, signo de Lhermitte, que ocurre 2 a 4 meses después del tratamiento, que consiste en la sensación de un shock eléctrico a lo largo de la columna irradiado a las piernas y que puede ser desencadenado por la flexión de la cabeza. Las molestias pasan espontáneamente y se piensa se deben a un proceso de desmilinización. La lesión permanente de la médula es muy rara y las molestias se inician 9 a 15 meses después del tratamiento con aparición de parestesias y alteraciones sensoriales que progresan hasta producir parálisis distal al sitio de la lesión.
Cabeza y cuelloEn el tratamiento del cáncer de cabeza y cuello se irradia diferentes órganos sanos adyacentes al tumor y su drenaje linfático, los que tienen diferentes sensibilidades a la radiación. Los efectos adversos agudos más frecuentes son la mucosistis, inflamación y ulceración de la mucosa con posible sobreinfección, que genera dolor que dificulta la alimentación con baja de peso. Al mismo tiempo ocurre pérdida del sabor de los alimentos, disminución de la saliva, primero el componente acuoso quedando una secreción ligosa, adherente, difícil de eliminar que causa náuseas. Además se puede agregar dificultad para tragar por inflamación del músculo constrictor de la faringe, disfonía por irradiación de la laringe y cambios en la piel por ser el drenaje linfático superficial. Estos síntomas aumentan en forma importante si se trata con radio-quimioterapia concomitante. El uso de radioterapia por modulación de intensidad, IMRT, permite una mejor protección de los órganos a riesgo disminuyendo los efectos de la radiación especialmente los tardíos. Los efectos adversos tardíos son la sequedad bucal que condiciona una pérdida de la protección dental por la saliva y daño severo a la dentadura, si no es cuidada y fluorada regularmente (17). La sensibilidad de la mucosa y el sabor pueden mantenerse alterados, la fibrosis del músculo constrictor de la faringe puede alterar la deglución, en el cuello se produce fibrosis y linfedema que puede requerir drenaje linfático.
TóraxLa irradiación pulmonar -dependiendo de la dosis y volumen- puede producir una neumonitis como efecto adverso agudo. Esta se manifiesta por tos seca, fiebre, dolor torácico y dificultad respiratoria, y una radiografía de tórax que muestra una neumonitis en la zona irradiada, sin que exista otra causa que la explique. El tratamiento es con corticoides en dosis altas y que deben disminuirse muy gradualmente en meses. La fibrosis pulmonar es el efecto tardío de la irradiación y produce alteración en las pruebas funcionales del pulmón.
La irradiación del esófago produce en forma aguda disfagia y sensación de obstrucción al ingerir alimentos. Durante el tratamiento es necesario que la alimentación sea blanda, con trozos pequeños o papilla de forma de no traumatizar la mucosa ya inflamada por la radiación. Es necesario agregar analgésicos para permitir la deglución. Los efectos adversos tardíos del esófago son alteración de la motilidad y la disminución del calibre esofágico por fibrosis que en ocasiones puede llegar hasta la obstrucción del esófago. En estos casos el uso de dilataciones endoscópicas periódicas puede ser necesario para recuperar el lumen esofágico.
La irradiación del corazón se ha minimizado, utilizando técnicas avanzadas de radioterapia torácica con el fin de evitar los efectos tardíos como la pericarditis y especialmente la enfermedad coronaria que ocurre 10 a 15 años después del tratamiento y se suma a los factores de riesgo habituales de la enfermedad, tabaco, hipercolesterolemia, historia familiar, obesidad e hipertensión.
Abdomen y pelvisLos órganos más vulnerables a la radiación en la cavidad abdominal son el intestino y el colon. En la fase aguda la manifestación inicial es el aumento de la frecuencia y la disminución de la consistencia de las deposiciones, que progresa hasta un cuadro de diarrea. La irradiación del estómago produce náuseas que pueden acompañarse de vómitos. Los síntomas se inician una hora después de recibida la radiación por el estómago y debe prevenirse con profilaxis antiemética previa (18). Los efectos tardíos en el tubo digestivo pueden ser diarrea crónica, dolor abdominal, baja de peso, sangramiento y obstrucción intestinal. La introducción de mejores técnicas de radiación ha permitido que las complicaciones tardías se presenten hoy con baja frecuencia (19).
La enfermedad hepática por radiación depende del volumen de hígado irradiado por sobre el umbral de daño. Se manifiesta por dolor en hipocondrio derecho, hepatomegalia y ascitis. La anatomía patológica muestra característicamente enfermedad veno-oclusiva de la vena central. La enfermedad hepática por radiación es hoy extremadamente rara (20).
La nefropatía por radiaciones también es muy poco frecuente por la preocupación del radio-oncólogo de proteger los riñones. En el caso de ser necesaria la irradiación parcial de los riñones es necesario evaluar que la función renal de la parte que no se irradia sea normal. La manifestación del daño renal por radiación puede manifestarse muchos años después del tratamiento.
Agradecimiento:
Francisco Besa Vial por el diseño gráfico.
ConclusiónLa radioterapia ha tenido avances trascendentales que han permitido aumentar el número de pacientes tratados exitosamente y disminuir al mismo tiempo las complicaciones.
El equipo de radioterapia formado por radio-oncólogos, físicos médicos, tecnólogos médicos, auxiliares de radioterapia y enfermeras trabaja empleando todos los avances tecnológicos para crear el mejor plan de tratamiento para cada paciente. Los equipos y los planes de tratamiento son sometidos a estrictos controles de calidad. La terapia se reproduce diariamente vigilada por el sistema de registro y verificación con los más altos estándares de calidad. La estricta adherencia a estos procesos permite conseguir el mejor resultado para cada paciente. (21).
El autor declara no tener conflictos de interés, con relación a este artículo.