Las drogas son sustancias químicas que pueden interferir con el sistema inmune y a veces conducen a reacciones inusuales y severas. Éstas pueden amenazar la vida, requerir hospitalizaciones prolongadas o dejar secuelas significativas. Cerca del 2% de las reacciones cutáneas inducidas por fármacos se consideran graves. Estas son el angioedema, el shock anafiláctico, el síndrome de Stevens-Johnson (SSJ), la necrolisis epidérmica tóxica (NET), y el síndrome de hipersensibilidad (DRESS), entre otros. Requieren atención especial ya que los síntomas clínicos son heterogéneos y pueden imitar diferentes enfermedades, lo que lleva a retardar el diagnóstico correcto.
Drugs are chemicals that can interfere with the immune system and may sometimes lead to unusual and severe reactions. These can be life threatening, requiring prolonged hospitalization or have significant sequelae. About 2% of drug-induced skin reactions are considered serious. They are angioedema, anaphylactic shock, the Steven-Johnson syndrome (SJS), toxic epidermal necrolysis (TEN), and hypersensitivity syndrome (DRESS), among others. They require special attention because clinical symptoms are heterogeneous and can mimic different diseases, leading to a delay in the correct diagnosis.
Las reacciones adversas a medicamentos (RAM) según la OMS son cualquier efecto dañino y no intencionado de un fármaco, que es utilizado en el ser humano a dosis adecuadas para el tratamiento o la prevención de una enfermedad. Se clasifican como tipo A, cuando los efectos secundarios son predecibles debido a la acción farmacológica de la droga, o del tipo B cuando la reacción no es predecible, ya sea por que es idiosincrática (causada por una predisposición individual) o secundaria a una reacción de hipersensibilidad alérgica o pseudoalérgica (1, 2).
El 20% de las todas las RAM son del tipo B y son las causantes de las reacciones severas en piel, que se discutirán en este artículo.
EpidemiologíaLos datos sobre la incidencia de RAM en la población general son escasos, debido a la falta de estudios de vigilancia post comercialización. La mayoría se obtiene de estudios en pacientes hospitalizados, donde se estima que uno de cada 1.000 pacientes presenta una reacción medicamentosa grave (3).
Los cuadros de anafilaxia mortal a la penicilina intramuscular y la reacción anafilactoide a medio de contrate radiológico tienen una incidencia aproximada de 1/50.000 pacientes (4). Otras RAM con altísima mortalidad son la Necrolisis Edidérmica Tóxica (NET) y el Sindrome de Stevens Johnson (SSI). La incidencia aproximada de NET es de 0.4 a 1.2 casos por millón de personas al año y la del SSJ entre 1 a 6 casos por millón de personas al año (3).
Se desconoce la incidencia global del Sindrome de Hipersensibilidad (DRESS), pero se calcula que aparece en 1/1.000 a 1/10.000 pacientes que toman anticonvulsivantes y/o sulfonamidas (3, 4). La pustulosis exantemática aguda generalizada (PEAG) tiene una incidencia de 1 a 5 casos/ millón al año (4).
Los factores de riesgo para desarrollar una reacción de hipersensibilidad pseudoalérgica a drogas son: sexo femenino, edades extremas, predisposición inmunogenética (genotipos HLA-droga específicos), polifarmacia y enfermedades concomitantes (infecciones virales por VIH o Epstein-Barr, enfermedades autoinmunes como el lupus eritematoso o defectos en el metabolismo hepático) (2, 5-7). La condición de atopia no aumenta el riesgo de RAM, pero si condiciona una mayor severidad. La dosis y duración del tratamiento, asi como la administración intermitente pueden aumentar el riesgo de sensibilización y la severidad de los síntomas (1).
Cualquier droga puede inducir una RAM severa. En un estudio chileno, los principales fármacos implicados en reacciones medicamentosas en piel fueron los analgésicos, anti-inflamatorios no esteroidales (AINE), los que actúan en el sistema nervioso central y los antibióticos (8).
FisiopatologíaLas drogas son capaces de interactuar con el sistema inmune, generando diversos tipos de reacciones no solo en la piel, sino también en hígado, pulmón, riñón y otros órganos (1).
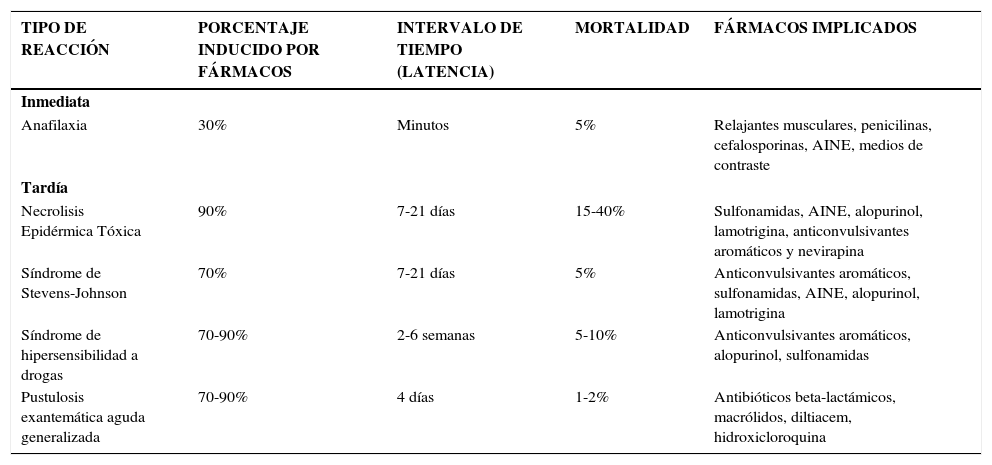
Las reacciones de hipersensibilidad inmediata son aquellas que ocurren dentro de la primera hora de exposición a la droga y corresponden a los cuadros de urticaria, angioedema, anafilaxia y shock anafiláctico (ver Tabla Nº 1).
Características de las reacciones medicamentosas severas en piel
| TIPO DE REACCIÓN | PORCENTAJE INDUCIDO POR FÁRMACOS | INTERVALO DE TIEMPO (LATENCIA) | MORTALIDAD | FÁRMACOS IMPLICADOS |
|---|---|---|---|---|
| Inmediata | ||||
| Anafilaxia | 30% | Minutos | 5% | Relajantes musculares, penicilinas, cefalosporinas, AINE, medios de contraste |
| Tardía | ||||
| Necrolisis Epidérmica Tóxica | 90% | 7-21 días | 15-40% | Sulfonamidas, AINE, alopurinol, lamotrigina, anticonvulsivantes aromáticos y nevirapina |
| Síndrome de Stevens-Johnson | 70% | 7-21 días | 5% | Anticonvulsivantes aromáticos, sulfonamidas, AINE, alopurinol, lamotrigina |
| Síndrome de hipersensibilidad a drogas | 70-90% | 2-6 semanas | 5-10% | Anticonvulsivantes aromáticos, alopurinol, sulfonamidas |
| Pustulosis exantemática aguda generalizada | 70-90% | 4 días | 1-2% | Antibióticos beta-lactámicos, macrólidos, diltiacem, hidroxicloroquina |
Según la clasificación de Gell y Coombs, son del tipo I y están mediadas por anticuerpos IgE. Este anticuerpo es específico a uno o varios epítopes del medicamento y es capaz de unirse a los receptores Fcϵ ubicados en la superficie de los mastocitos durante la primera exposición a la droga. Si el paciente se reexpone al mismo medicamento, se generan nuevas IgE específicas, que se adhieren a los receptores y su entrecruzamiento desencadena la liberación inmediata de los gránulos del mastocito, que contienen histamina, triptasa y factor activador de plaquetas. Estos compuestos denominados aminas vasoactivas, actúan en receptores de los vasos sanguíneos, produciendo vasodilatación, extravasación de plasma e hipotensión. En la piel la extravasación de plasma produce edema; si éste afecta la dermis superficial, se manifiesta como roncha u habón y si se localiza en la dermis profunda, tejido subcutáneo o submucoso, clínicamente se observa como angioedema. También actúan en las fibras musculares lisas provocando bronconstricción y cólicos intestinales.
El mastocito activado puede liberar en forma tardía leucotrienos y prostaglandinas que serían responsables de las reactivaciones de urticaria o broncoespasmo.
Algunos medicamentos como los medios de contraste, opiáceos y ácido acetilsalicílico producen la degranulación directa de los mastocitos, constituyendo reacciones pseudoalérgicas o anafilactoides, ya que no hay una sensibilización previa (9).
Las reacciones de hipersensibilidad de tipo tardío, son las que aparecen después de una hora, habitualmente varios días a semanas después del inicio del fármaco.
Pertenecen a este grupo la NET, SSJ, DRESS y PEAG (ver Tabla Nº 1). Todas son reacciones mediadas por células o de tipo IV, de la clasificación de Gell y Coombs. Recientes avances demuestran que en estas reacciones, los linfocitos T droga-específicos, reconocen a las drogas/haptenos a través de su receptor (TCR) vía interacción con el HLA y posteriormente liberan diversas citoquinas y quemoquinas, que conducen a los diferentes fenotipos clínicos (1, 10).
Así, la necrosis cutáneo-mucosa y la formación de ampollas que se observa en el SSJ y NET, se deberían a una reacción citotóxica mediada por linfocitos T CD4 y CD8 (+). Éstos liberan enzimas como perforinas y granzimas y factor de necrosis tumoral que conducen a la apoptosis o muerte de los queratinocitos. Otro mecanismo descrito en la NET, es el aumento de una molécula particular conocida como Fas ligando, la cual al unirse a los receptores de muerte celular o Fas presentes en la superficie del queratinocito, induce su apoptosis (4).
En el DRESS están involucrados los linfocitos T helper 2, que secretan las interleuquinas 4 y 5, inductoras de la eosinofilia en sangre y órganos como la piel. Este mecanismo también está descrito en los exantemas morbiliformes por drogas.
Las lesiones pustulares de la PEAG, se deberían a la presencia de numerosos neutrófilos, los cuales estarían atraídos a la piel por potentes quimiotácticos, como la interleuquina 8, secretada por linfocitos T helper 1 y 2 (1, 4).
Otros mecanismos no inmunológicos descritos en SSJ, NET y DRESS son las alteraciones en el metabolismo de drogas. La deficiencia de enzimas epóxido hidroxilasas, que degradan los grupos arilaminos presentes en los anticonvulsivantes aromáticos (fenitoína, carbamazepina y fenobarbital) y sulfonamidas, genera metabolitos intermedios reactivos, que interactuarían con el sistema inmune (11).
ClínicaLos signos y síntomas de las RAM severas en piel son variados, dado los múltiples mecanismos fisiopatológicos involucrados, por lo que es necesario reconocer aquellos que alertan sobre estas reacciones (ver Tabla Nº 2).
Síntomas y signos de alerta de una reacción medicamentosa severa
| REACCIÓN DE HIPERSENSIBILIDAD INMEDIATA |
|---|
|
| REACCIÓN DE HIPERSENSIBILIDAD TARDÍA |
|
Entre el 15 al 23% de la población sufrirá un episodio de urticaria en algún momento de su vida, siendo en menos del 10% de los casos debido a una droga (3).
La importancia de la urticaria y del angioedema radica en su posible relación con la anafilaxia, que conlleva una alta mortalidad (4).
Casi todos los fármacos pueden producir urticaria, siendo el periodo de latencia (sensibilización inicial) de 7 a 14 días después de administrado (9).
La urticaria se caracteriza por pápulas o placas eritematosas, pruriginosas y evanescentes (ronchas u habones), que duran individualmente menos de 24 hrs., afectan cualquier parte de la superficie corporal y pueden o no estar asociadas a angioedema.
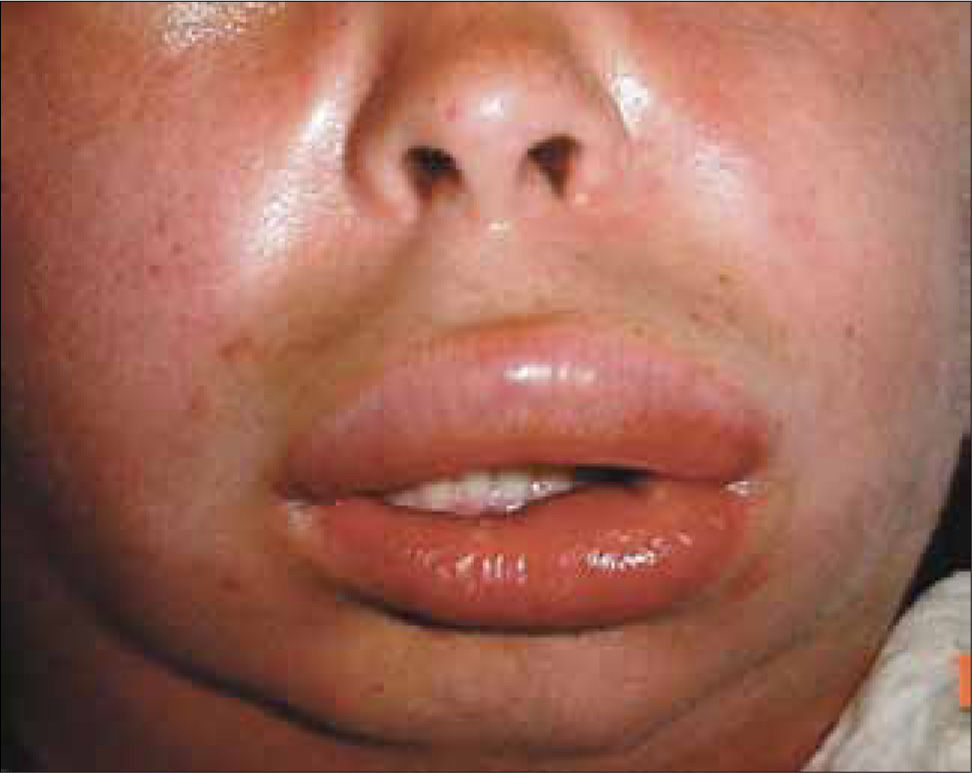
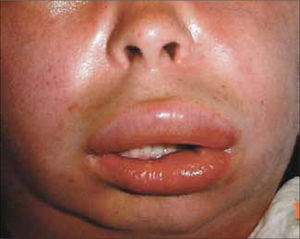
El angioedema se presenta como un área edematosa de gran tamaño, profunda y mal definida, que se localiza en zonas de mayor distensión como labios, párpados o mucosas (Figura 1).
El cuadro de mayor gravedad es la reacción anafiláctlca. Esta se presenta en individuos previamente sensibilizados, a los pocos segundos después de la administración endovenosa del fármaco o a los pocos minutos después de la oral. Comienza con prurito palmo-plantar y de cuero cabelludo, enrojecimiento de la cara y del tronco, luego aparece edema perioral y periocular, dificultad respiratoria, disfonía y/o disfagia. Puede estar seguido del shock anafiláctico, producto de un colapso cardiovascular, con taquicardia e hipotensión. El 60% de la mortalidad en estos casos, se debe a la asfixia provocada por el edema laríngeo y broncospasmo (1, 2).
En el diagnóstico diferencial de la urticaria y angioedema por medicamentos, deben considerarse otras causas de urticaria aguda como: alimentos, aditivos, infecciones especialmente en los niños, estímulos físicos, picaduras de himenópteros y contacto con látex, entre otros. La urticaria vasculítica se manifiesta con fiebre, artralgias y ronchas purpúricas que duran más de 24 a 36 hrs. Ocasionalmente las lesiones iniciales del eritema multiforme pueden parecer de tipo urticariforme, sin embargo éstas siempre tienen un centro violáceo y son fijas. El angioedema solo, sin asociación con urticaria, debe distinguirse del angioedema idiopático o hereditario y del loxocelismo cutáneo edematoso. Finalmente en reacciones anafilácticas recurrentes, debe sospecharse una mastocitosis sistémica.
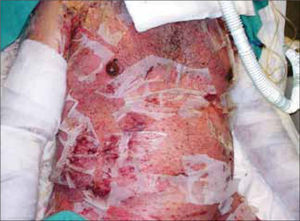
Necrolisis Epidérmica TóxicaEs la RAM más severa en piel por su altísima mortalidad. En el 90% de los casos está inducida por drogas, siendo éstas similares a las que causan el SSJ (12). Otras causas son las inmunizaciones y algunas infecciones como el Mycoplasma pneumoniae.
Tiene una latencia de una a tres semanas y su inicio es extremadamente agudo.
Se caracteriza por fiebre alta, odinofagia y ardor ocular, 1 a 3 días antes de que aparezca el compromiso cutáneo. Éste consiste en una erupción de máculas eritematosas, de bordes poco definidos y con centro violáceo (tipo target o dianas atípicas), las que en un plazo de horas o pocos días coalescen, formando extensas áreas de piel muy dolorosa, de aspecto grisáceo secundario a la necrosis epidérmica y que terminan por desprenderse en láminas, dejando la piel denudada.
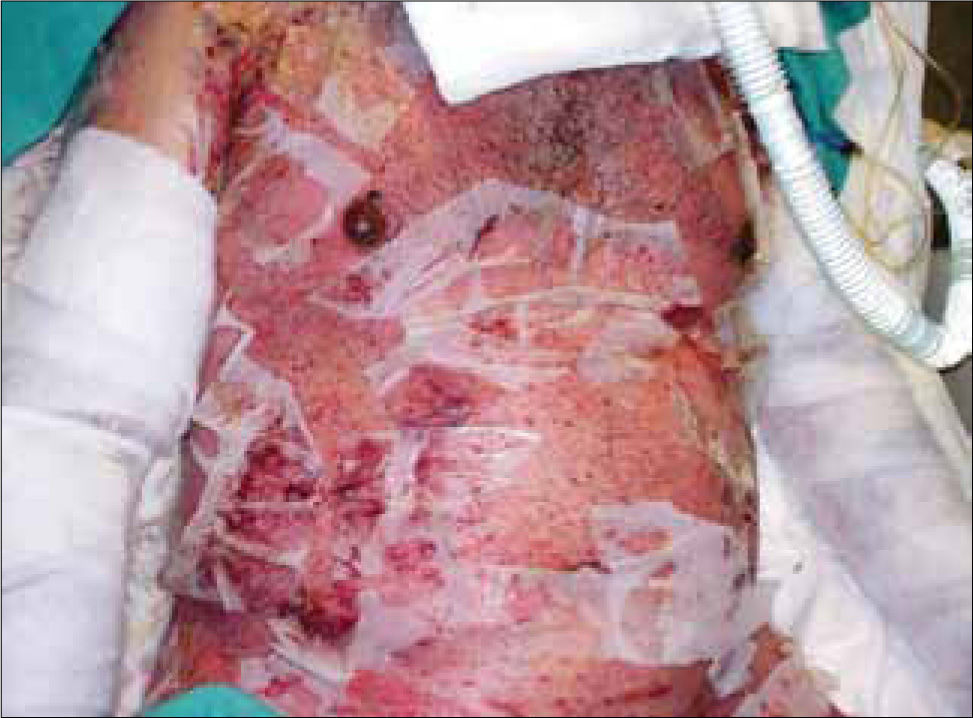
El compromiso cutáneo es mayor del 30% de la superficie corporal y suelen estar afectadas las mucosas (conjuntivas, boca, tráquea, bronquios, tracto genitourinario y gastrointestinal) (Figura 2). Aproximadamente un tercio de los afectados muere debido a infecciones secundarias, alteraciones hidroelectrolíticas y complicaciones cardiopulmonares o renales (4). Los pacientes que sobreviven presentan graves secuelas cutáneas y de mucosas.
Los diagnósticos diferenciales son el síndrome de la piel escaldada estafilocócica, en el cual las ampollas son superficiales y no existe compromiso de mucosas ni órganos, la enfermedad injerto versus huésped aguda grado IV, en la que se forman ampollas cutáneas pero sin la extensa necrosis de piel propia del NET, también con quemaduras térmicas y enfermedades ampollares autoinmunes.
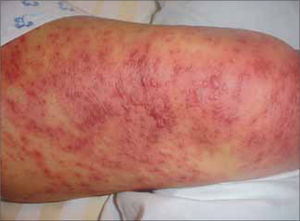
Síndrome de Stevens-JohnsonEs una enfermedad mucocutánea grave, poco frecuente, que en más de la mitad de los casos es producida por drogas, otras causas son las infecciones por Mycoplasma pneumoniae, virus e inmunizaciones (13).
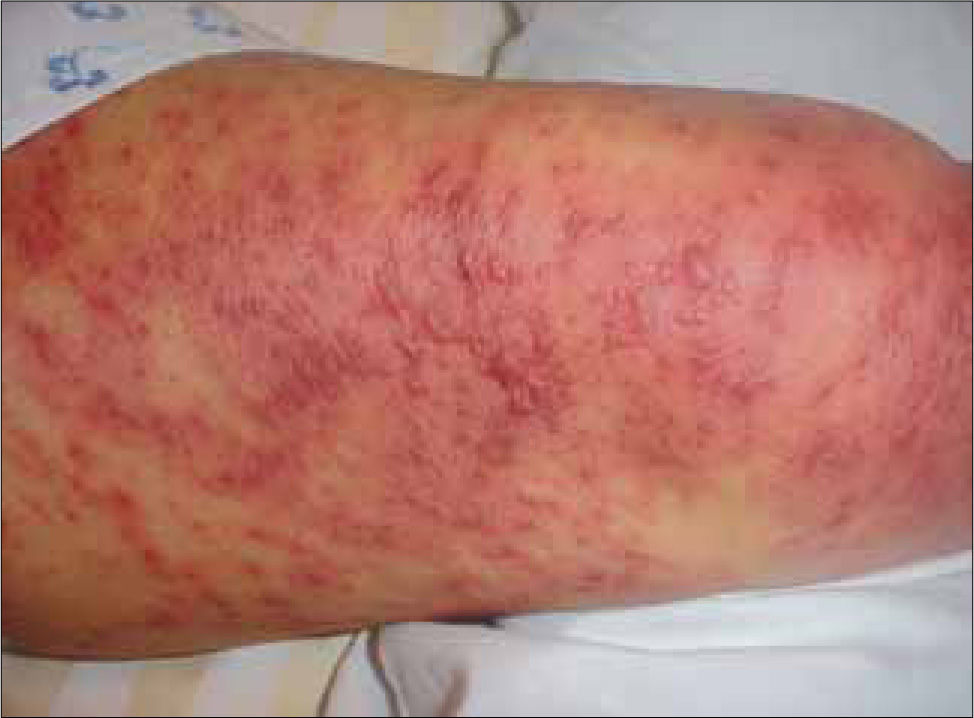
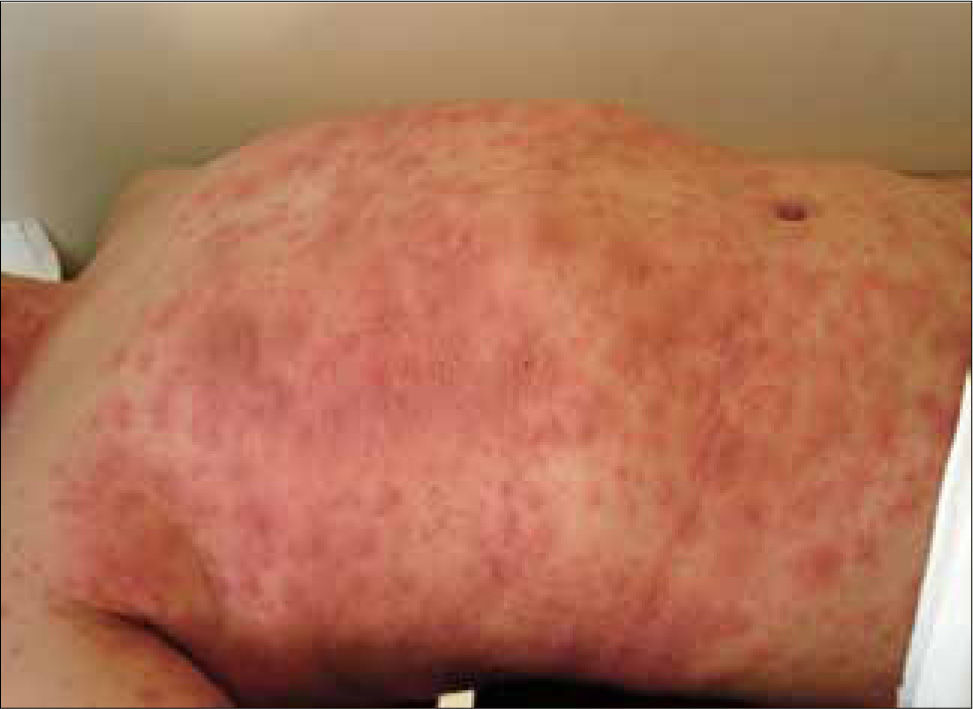
Afecta habitualmente a adultos jóvenes y el periodo de latencia es una a tres semanas. El inicio es similar a una infección respiratoria alta. Luego aparecen múltiples máculas rojo-violáceas en tronco y extremidades, tipo diana con una zona central más oscura, en la que posteriormente se puede formar una ampolla o costra, traduciendo el daño epidérmico (Figura 3). Típicamente se comprometen dos o más mucosas, con formación de erosiones y costras hemáticas especialmente en los labios y cavidad oral y conjuntivitis exudativa a nivel ocular. Puede existir la afección de otros órganos como pulmón e hígado y el cuadro suele durar 4 a 6 semanas (14).
Ante un SSJ es fundamental descartar infecciones, en especial por Myco-plasma, ya que las lesiones cutáneas pueden ser idénticas a las producidas por drogas. El eritema multiforme causado por el virus herpes simple se caracteriza por lesiones cutáneas en diana o target verdaderas, que se ubican sólo en las extremidades, rara vez se afecta más de una mucosa y puede ser recurrente (15).
A diferencia del NET, en el SSJ la superficie de piel afectada, es por una definición de consenso, menor al 10% y no ocurre el desprendimiento extenso de láminas de epidermis necrótica. Sin embargo existe un síndrome de sobreposición de ambas entidades, que compromete entre el 10 al 30% de la superficie corporal (14, 16).
Otros diagnósticos diferenciales son la enfermedad de Kawasaki en niños por el compromiso de los labios, erupción medicamentosa fija múltiple y las enfermedades ampollares autoinmunes (pénfigo paraneoplásico), dermatosis IgA lineal (por drogas), entre otros.
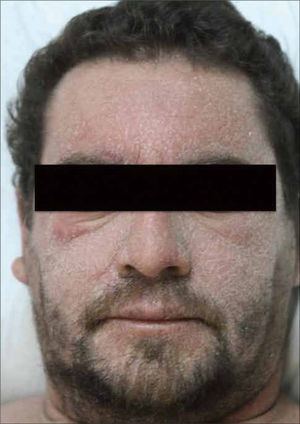
Síndrome de hipersensibilidad a drogas o erupción por drogas con eosinofilia y síntomas sistémicosEs una reacción severa a drogas que cursa con compromiso cutáneo, hematológico y de órganos sólidos (17). En su etiopatogenia se menciona la reactivación de infecciones por virus herpes humano 6 y 7, Epstein-Barr o citomegalovirus (18).
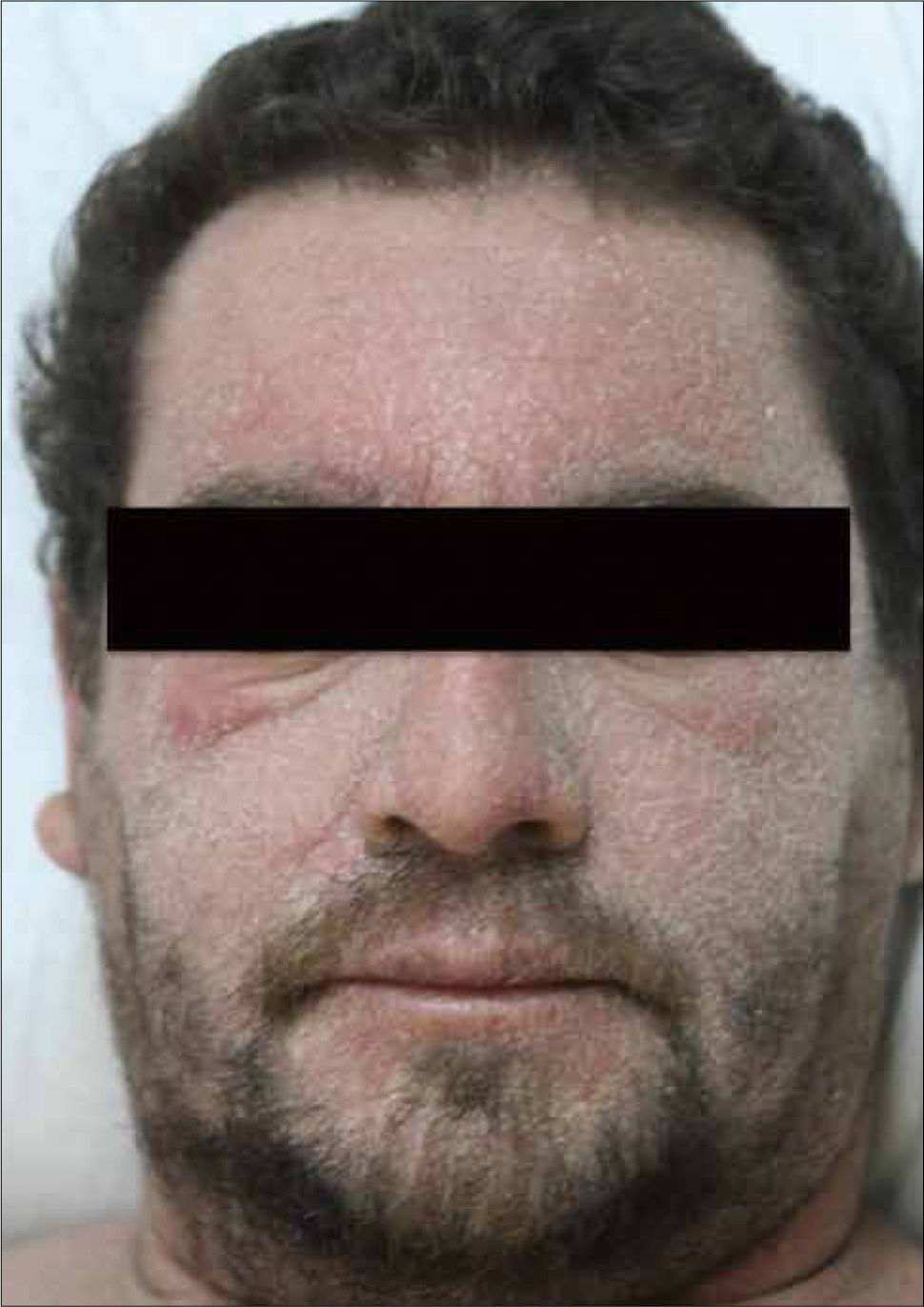
Presenta un período de latencia largo, de 2 a 6 semanas, tras lo cual el paciente comienza con fiebre y un exantema máculo-papular eritematoso y pruriginoso en cara, tronco y extremidades superiores, que se torna en una dermatitis exfoliativa con edema facial y periorbitario, que son característicos (Figura 4). Aparecen linfoadenopatías generalizadas, eosinofilia y linfocitosis atípica.
El compromiso inflamatorio de uno o varios órganos aparece una semana después de iniciado el rash y comprenden hepatitis anictérica, nefritis, neumonitis, miocarditis, encefalitis o meningitis aséptica (4).
El síndrome de hipersensibilidad a anticonvulsivantes sería un subtipo de DRESS, en el cual el principal órgano afectado es el hígado, produciéndose una hepatitis fulminante, que da cuenta de una alta mortalidad (11, 19). Los diagnósticos diferenciales son los exantemas virales, especialmente la mononucleosis infecciosa y exantemas morbiliformes o angioedema por drogas. Otras condiciones que se le parecen son el síndrome de hipereosinofilia idiopático, linfomas y pseudolinfomas.
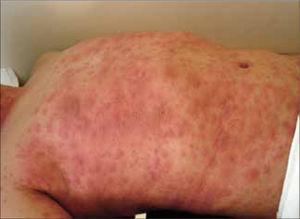
Pustulosis Exantemática aguda Generalizada (PEAG)Es una rara erupción cutánea producida en el 70- 90% por drogas, se describen también infecciones virales por enterovirus o contacto con mercurio y otras sustancias.
Su latencia es corta, menos de cuatro días en individuos previamente sensibilizados y posee una menor tasa de mortalidad en comparación a las otras RAM descritas.
Clínicamente los pacientes presentan fiebre alta, compromiso del estado general y un exantema súbito de tipo pustular, que afecta la cara y los pliegues del cuerpo, que a las horas se generaliza. Las pústulas son estériles, superficiales, no foliculares, de 1 a 3 mm de diámetro y se presentan sobre piel eritematosa y edematosa (Figura 5). Existe ardor y prurito (20). Generalmente no se afectan las mucosas y se resuelve en una a dos semanas, después de suspendido el fármaco. En el laboratorio se aprecia neutrofilia con leve eosinofilia y a veces disfunción renal.
El diagnóstico diferencial es con la psoriasis pustular aguda, siendo difícil distinguirlas, ya que la PEAG suele presentarse en pacientes con antecedentes de psoriasis. Otras afecciones que pueden simularla, son las erupciones acneiformes por fármacos, la NET y el DRESS que ocasionalmente presentan pústulas, pero éstas son aisladas y de tipo folicular. La foliculitis bacteriana en raras ocasiones se presta a confusión. Otras RAM severas en piel comprenden las vasculitis y los cuadros de eritrodermia.
DiagnósticoEs de suma relevancia conocer los antecedentes de reacciones alérgicas a medicamentos previas del paciente o sus familiares, enfermedades concomitantes, el período de latencia entre la administración del fármaco y la aparición de las lesiones y establecer el tipo de reacción cutánea para poder identificar y retirar precozmente el fármaco responsable.
Los análisis de rutina muestran alteraciones inespecíficas en las RAM cutáneas, aunque permiten descartar el compromiso de otros órganos. Algunos hallazgos que orientan a RAM severas son eosinófilos >1000 / mm3, linfocitosis, linfocitos atípicos y perfil hepático alterado (11).
En casos de NET y/o SSJ con fiebre, tos y síntomas constitucionales, se debe realizar una radiografía de tórax y serología IgM e IgG y/o PCR para Mycoplasma pneumoniae. Si hay lesiones erosivas en mucosa oral o genital, se sugiere PCR para virus herpes simple (14).
La biopsia de piel permite identificar diferentes patrones de inflamación secundario a la acción de drogas, sin embargo ninguno es específico para una droga en particular (21). Además es útil en todas las RAM cutáneas para descartar los diagnósticos diferenciales. En el SSJ y NET la histología ayuda al diagnóstico, observándose en ambas queratinocitos necróticos en la epidermis, degeneración vacuolar de la capa basal, ampollas a nivel subepidérmico y extravasación de eritrocitos, sin vasculitis. El compromiso del acrosiringio orienta a drogas (14, 21, 22). En la NET a diferencia del SSJ, existe una necrosis completa de la epidermis y la aparición en la dermis de un infiltrado linfocítico denso, constituye un criterio de peor pronóstico (23). Por otra parte en lesiones de tipo ampollar, los estudios con inmunofluorescencia directa de piel perilesional, permiten descartar enfermedades ampollares autoinmunes.
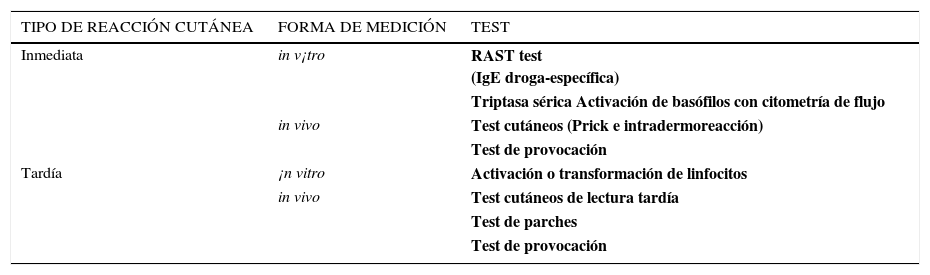
Laboratorio auxiliarLos test disponibles para identificar la droga responsable varían dependiendo del tipo de reacción de hipersensibilidad. Son realizados por inmunólogos en un centro clínico de alta complejidad y comprenden test in vivo e in vitro (ver Tabla Nº 3).
Test diagnósticos para reacciones de hipersensibilidad a drogas
| TIPO DE REACCIÓN CUTÁNEA | FORMA DE MEDICIÓN | TEST |
|---|---|---|
| Inmediata | in v¡tro | RAST test (IgE droga-específica) |
| Triptasa sérica Activación de basófilos con citometría de flujo | ||
| in vivo | Test cutáneos (Prick e intradermoreacción) | |
| Test de provocación | ||
| Tardía | ¡n vitro | Activación o transformación de linfocitos |
| in vivo | Test cutáneos de lectura tardía | |
| Test de parches | ||
| Test de provocación |
En las reacciones de hipersensibilidad inmediata se utilizan el prick test y el test intradérmico, que son de primera línea en el diagnóstico de reacciones a beta-lactámicos (24). Deben ser realizados con cautela ya existe el riesgo de provocar reacciones anafilácticas, en menos del 8% de los casos (1).
El test in vitro más usado es el RAST test, que mide el anticuerpo IgE específico a una determinada droga, es seguro, pero está disponible sólo para algunos fármacos (beta-lactámicos, sulfas, anestésicos, AINE e insulina, entre otros). Su sensibilidad es baja (42-75%), pero su especificidad es algo mayor (67-83%) (24). Otros test in vitro son la triptasa sérica, especialmente útil en las reacciones anafilácticas por anestesia general (25) y el BAT. Éste mide la activación de basófilos mediante citometría de flujo, su sensibilidad y especificidad es variable según la droga estudiada (24).
Las reacciones de hipersensibilidad tardías son más difíciles de evaluar, dado la variedad de mecanismos fisiopatológicos. Los test de provocación oral están contraindicados en NET y SSJ (26). En cuanto a los test in vitro, no están bien estandarizados y se emplean en investigación, como son el test de activación y proliferación de linfocitos, medición de diversas citoquinas y marcadores de citotoxicidad, entre otros (27).
Finalmente para identificar sujetos en riesgo de desarrollar RAM severas de tipo tardío, se está usando la farmacogenética. Ésta relaciona determinados alelos del HLA con drogas específicas, entre ellas abacavir, nevirapine, anticonvulsivantes aromáticos y alopurinol. El test disponible en nuestro país es el HLA-B*5701 para abacavir (7).
TratamientoEn todas las RAM severas es fundamental la hospitalización inmediata, identificar la droga según el tipo de reacción y su retiro precoz, ya que esto influye notoriamente en la sobrevida de los pacientes (16). Si existe polifarmacia, se deben suspender todos aquellos medicamentos que no sean absolutamente imprescindibles.
Las reacciones anafilácticas y el angioedema severo con compromiso de vía aérea asociado o no a urticaria, constituyen una emergencia médica. Está indicado el uso de epinefrina 0.3-0.5 ml de una dilución 1:1000 subcutánea, repetida cada 15 a 20 min, corticoides (betametasona o hidrocortisona) y antihistamínicos H1 (clorfenamina maleato) endovenosos inicialmente hasta estabilizar al paciente y luego oral por 1 a 3 semanas (9).
No existe un tratamiento específico para la NET ni el SSJ, por lo que en ambos son imprescindibles las medidas se soporte y las condiciones asépticas para prevenir infecciones secundarias (habitualmente por Staphylococcus aureus o Pseudomona aeruginosa) que aumentan la mortalidad. Se deben tomar cultivos bacterianos y micóticos seriados de piel, mucosas y esputo. Algunos centros utilizan antibióticos profilácticos (vancomicina y amikacina) y otros se rigen según los cultivos (14).
La fiebre se trata con medidas físicas para evitar el uso de AINE. El cuidado de las mucosas se realiza con suero fisiológico y aplicación de ungüentos antibióticos (mupirocina). La evaluación oftalmológica es esencial para evitar secuelas oculares como opacidad corneal y sinequias de las conjuntivas. El manejo de las ampollas se basa en el uso de apósitos especiales no adherentes (Telfa de Kendall®).
En el SSJ severo, los corticoides sistémicos se utilizan precozmente, en dosis alta (metilprednisolona 2 a 2.5 mg/kg/d ev o hidrocortisona 100 mg cada 8 hrs ev) y por pocos días; su administración tardía y prolongada puede promover complicaciones infecciosas (14).
El manejo de la NET debe realizarse en una unidad de cuidados intensivos o de quemados. Es básico corregir el desbalance hidroelectrolítico, manejo del dolor con fentanil, anticoagulación, soporte nutricional y metabólico. Está contraindicado el debridamiento precoz y agresivo de la piel necrótica, ya que la necrosis es superficial y no interfiere con la reepitelización. Para la cobertura de grandes áreas de piel denudada, se han utilizado xenoinjertos, piel equivalente o sintética y membranas amnióticas (28, 29).
El uso de la inmunoglobulina G humana endovenosa en la NET, comenzó a partir del estudio de la Dra. Viard en 1998, quien demostró que los anticuerpos presentes en los preparados de estas inmunoglobulinas, eran capaces de bloquear las moléculas Fas ligando, responsables de la apoptosis de los queratinocitos (30).
La dosis empleada habitualmente es de 1 gr/kg/día por 3 a 4 días, siendo fundamental su administración precoz (se necesita chequear los niveles de IgA por riesgo de anafilaxia en pacientes con déficit de esta inmunoglobulina). Existen múltiples publicaciones de pequeñas series de casos, donde se ha demostrado que disminuye la mortalidad, siendo especialmente útil en pacientes con SIDA (31, 32). También se ha usado con éxito en el SSJ (4, 14). Otros tratamientos mencionados en la literatura son la plasmaféresis y ciclosporina A (33, 34).
El tratamiento de elección en el DRESS son los corticoides sistémicos y antihistamínicos H1, que deben ser administrados por varias semanas, debido a la alta tasa de recidiva aún después de suspendido el fármaco. Otras drogas inmunosupresoras como la ciclosporina también han sido utilizadas.
Finalmente en el tratamiento de la PEAG se emplean corticoides sistémicos, antipiréticos, antihistamínicos H1 y corticoides tópicos como la hidrocortisona 1% por 1 a 2 semanas (4).
SíntesisLas reacciones cutáneas a drogas son una condición frecuente y en general son benignas y autolimitadas. Sin embargo, existe un pequeño grupo de reacciones altamente infrecuentes y que son extremadamente graves como la NET, SSJ, DRESS y las reacciones anafilácticas, que amenazan la vida del paciente y representan un gran desafío terapéutico.
Considerando que cada día aumentan los fármacos disponibles y que muchas RAM están condicionadas por la genética, la cual varía según la localización geográfica, es importante que cada país mantenga un centro de farmacovigilancia. Esto ayudará a determinar qué drogas son las que con mayor frecuencia producen reacciones de hipersensibilidad severas.
El tratamiento de las reacciones mencionadas en este artículo, requiere de un apoyo multidisciplinario, siendo fundamentales la hospitalización precoz y el retiro de la droga sospechosa de acuerdo al tipo de reacción de hipersensibilidad. Los corticoides sistémicos y antihistamínicos son los más empleados. La inmunoglobulina humana ha demostrado ser de utilidad especialmente en casos de NET y en algunos SSJ, aunque faltan estudios controlados. Su administración precoz es esencial, antes de que se produzca la necrosis completa de toda epidermis.
Los avances realizados en los últimos años en la farmacogenética permitirá disminuir el riesgo de RAM severas, lo que sumado a la identificación de los recientes mecanismos involucrados en las reacciones de hipersensibilidad retardada, ayudará al desarrollo de mejores técnicas diagnósticas y drogas que puedan bloquear mediadores inflamatorios específicos.
La autora declara no tener conflictos de interés, en relación a este artculo.