La resonancia magnética cardiovascular (RMC) es una técnica de imágenes establecida en la evaluación de pacientes con miocardiopatías. El aspecto más relevante de la RMC es la caracterización tisular para la identificación de la fibrosis mediante las imágenes de realce tardío con gadolinio (RTG). El patrón de RTG es de utilidad para el diagnóstico de la etiología en miocardiopatías. Además, la presencia de RTG se asocia con pronóstico adverso. En este trabajo se evalúa el valor pronóstico del RTG en pacientes con miocardiopatía hipertrófica (MCPH) y en pacientes con miocardiopatías dilatada. En pacientes con MCPH, la cuantificación del RTG identifica pacientes con alto riesgo de muerte súbita y disfunción ventricular. En pacientes con miocardiopatía dilatada, el RTG se asocia con incremento de los eventos como muerte y hospitalización. Por otro lado, la presencia de RTG identifica pacientes que se beneficiarán con la colocación de cardiodesfibrilador implantable, sobre todo aquellos pacientes con fracción de eyección mayor a 35%, con miocardiopatía dilatada isquémica o no isquémica. En pacientes que se evalúa la terapia de resincronización, la ubicación del gadolinio identifica las área del sitio de implante del catéter para optimizar los resultados. Por último, el desarrollo del mapeo de T1 identifica formas incipientes de fibrosis difusa intersticial que podría tener impacto en identificar pacientes en riesgo en etapas más precoces.
Cardiovascular magnetic resonance (CMR) is an establish technique for evaluation of cardiomyopathies. The most relevant feature of CMR is the tissue characterization of myocardial fibrosis by late gadolinium enhancement (LGE) sequences. The pattern of LGE is useful to identify several causes of cardiomyopathies. The presence of LGE is associated with adverse clinical outcomes.In patients with hypertrophy cardiomyopathy (HCM), the quantification of LGE is associated with arrhythmic events and ventricular dysfunction.In patients with dilated cardiomyopathy, LGE is associated with adverse clinical outcomes.The presence of LGE identifies patients that might benefit with the implantable cardioverter defibrillator, especially in patients with left ventricular ejection fraction >35% and ischemic or non ischemic dilated cardiomyopathy. In addition, in patients selected for resynchronization therapy, the LGE pattern and distribution identify the best site of implantation of resynchronization catheter to optimize results. The development of T1 mapping sequence allows assessment of diffuse interstitial fibrosis that appears to be associated with adverse outcome in early stages of cardiomyopathy disease.
La resonancia magnética cardiovascular (RMC) es una técnica de imágenes establecida en la evaluación de miocardiopatías y diversas patologías cardiacas (1). Las imágenes de RMC pueden evaluar la estructura y la función cardiaca y estimar la composición tisular determinando la presencia en el miocardio de fibrosis, edema o infiltración grasa. Las imágenes de RMC no utilizan radiación y tienen carácter tomográfico lo que permite obtener imágenes en cualquier plano y optimizar la cuantificación de los hallazgos. Uno de los aspectos más originales y destacables de la RMC es la determinación de la fibrosis a través de las imágenes de realce tardío con gadolinio (RTG) (2). La determinación de la fibrosis extendió las aplicaciones de la RMC para evaluar pacientes con infarto de miocardio, determinar la viabilidad miocárdica y evaluar miocardiopatías de origen no isquémico (3,4). Diversas guías de práctica clínica han resumido las indicaciones actuales más establecidas en diversos escenarios clínicos. Los escenarios clínicos más comunes de la RMC consisten en la evaluación de pacientes con enfermedad coronaria e infarto de miocardio previo, pacientes con insuficiencia cardiaca, enfermedades congénitas, enfermedades valvulares y enfermedades del pericardio (1,3-5) (ver Figuras 1 a 3). En la Tabla 1 se resumen las principales indicaciones de la RMC en pacientes con insuficiencia cardíaca y miocardiopatías (1,6). En este artículo se revisarán las nuevas aplicaciones y el desarrollo de nuevas modalidades diagnósticas de la RMC en relación con la determinación de la fibrosis en diversas miocardiopatías.
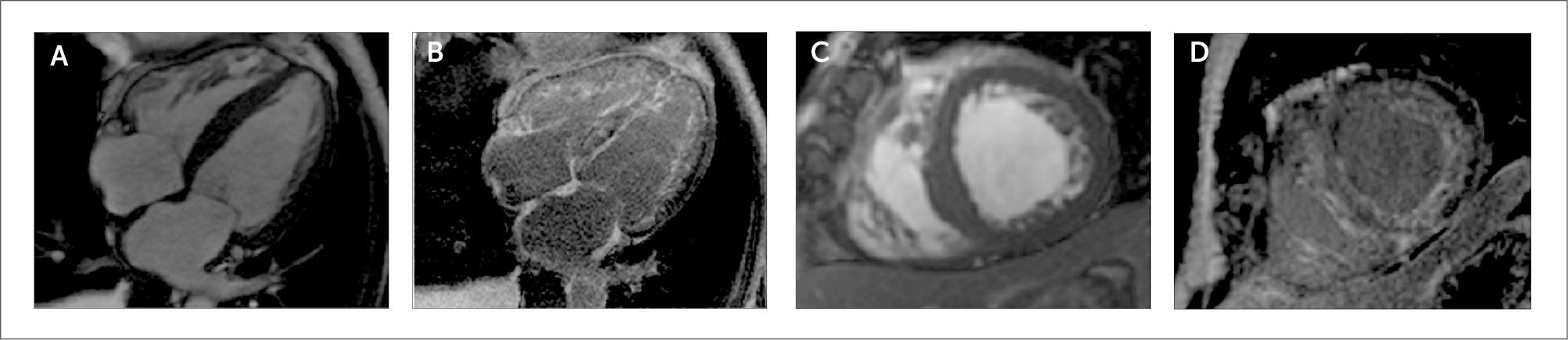
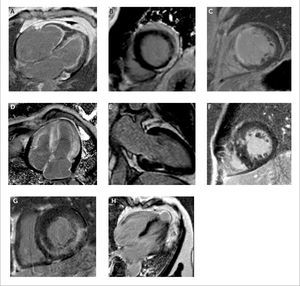
Patrones de realce tardío con gadolinio (RTG) en diversas miocardopatías
(A) Pacientes con endomiocardiofibrosis con RTG subendocardico difuso con compromiso del ventrículo derecho e izquierdo. Observe la obliteración de la región apical del ventrículo derecho.
(B) RTG con patrón subepicárdico característico de miocarditis.
(C) RTG con patrón subendocárdico y transmural compatible con infarto de miocardio.
(D) RTG con patrón subendocárdico difuso y con compromiso del ventrículo derecho y ambas aurículas. Se observa anulación del pool sanguíneo con una imagen gris oscura de las cavidades cardiacas. Los hallazgos son compatibles con amiloidosis cardiaca.
(E) RTG con patrón focal intramiocárdico relacionado con sarcoidosis.
(F) RTG con patrón intramiocárdico relacionado a miocardiopatía hipertrófica septal asimétrica obstructiva.
(G) RTG con patrón intramiocárdico a predominio del segmento inferolateral basal característico de la enfermedad de Fabry.
(H) Aneurisma apical con RTG transmural en paciente con enfermedad de Chagas. Ref. 1.
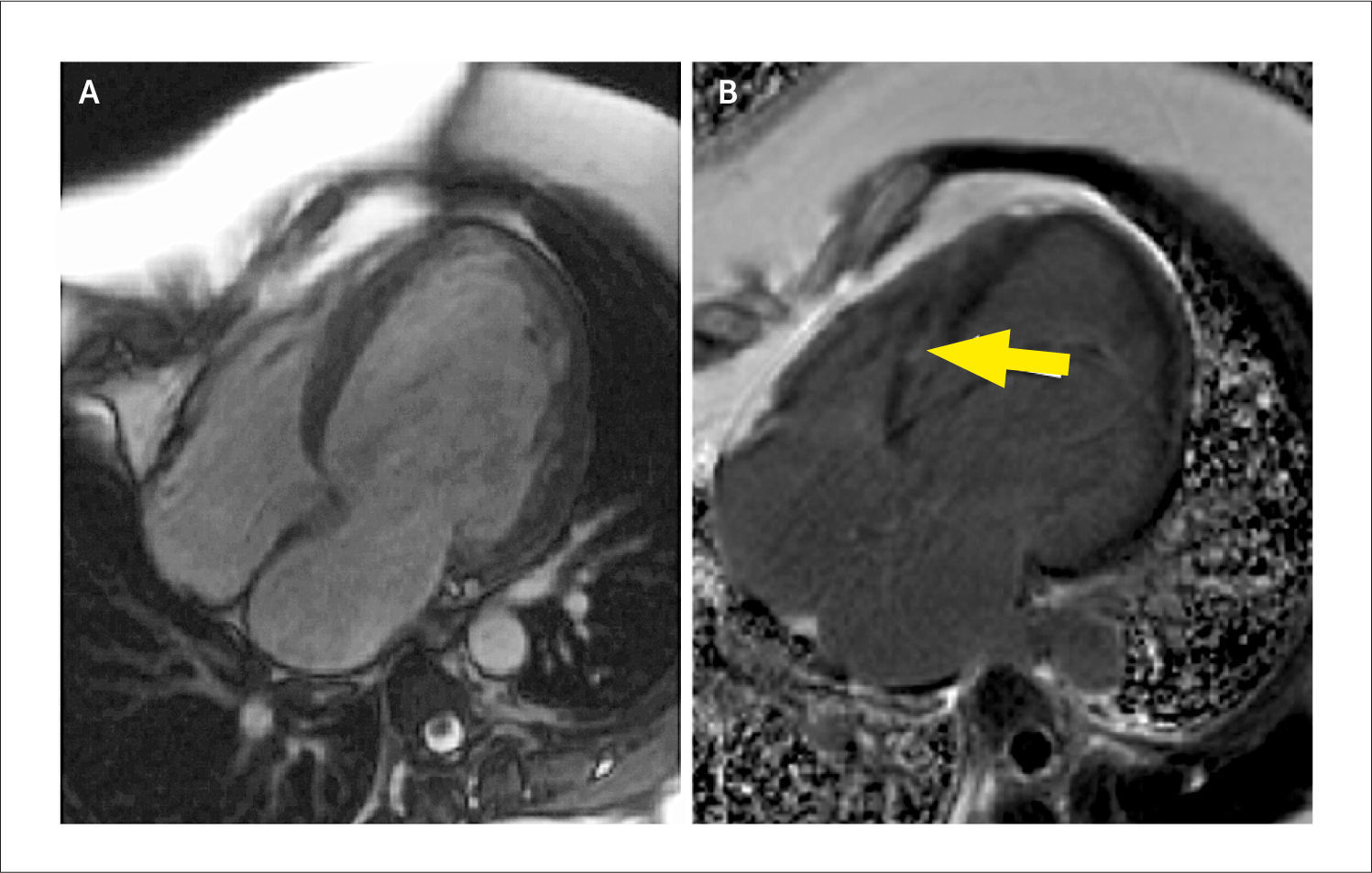
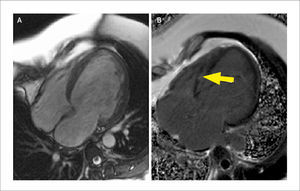
Paciente con amiloidosis
Imagen de cine de cinerresonancia en vista 4 cámaras y eje corto a nivel medial donde se observa un incremento difuso de los espesores (a, b). Respectivas imágenes de RTG (c, d) donde se observa realce de gadolinio subendocardico (flechas en d) con anulación del pool sanguíneo hallazgos característicos de la amiloidosis cardíaca.
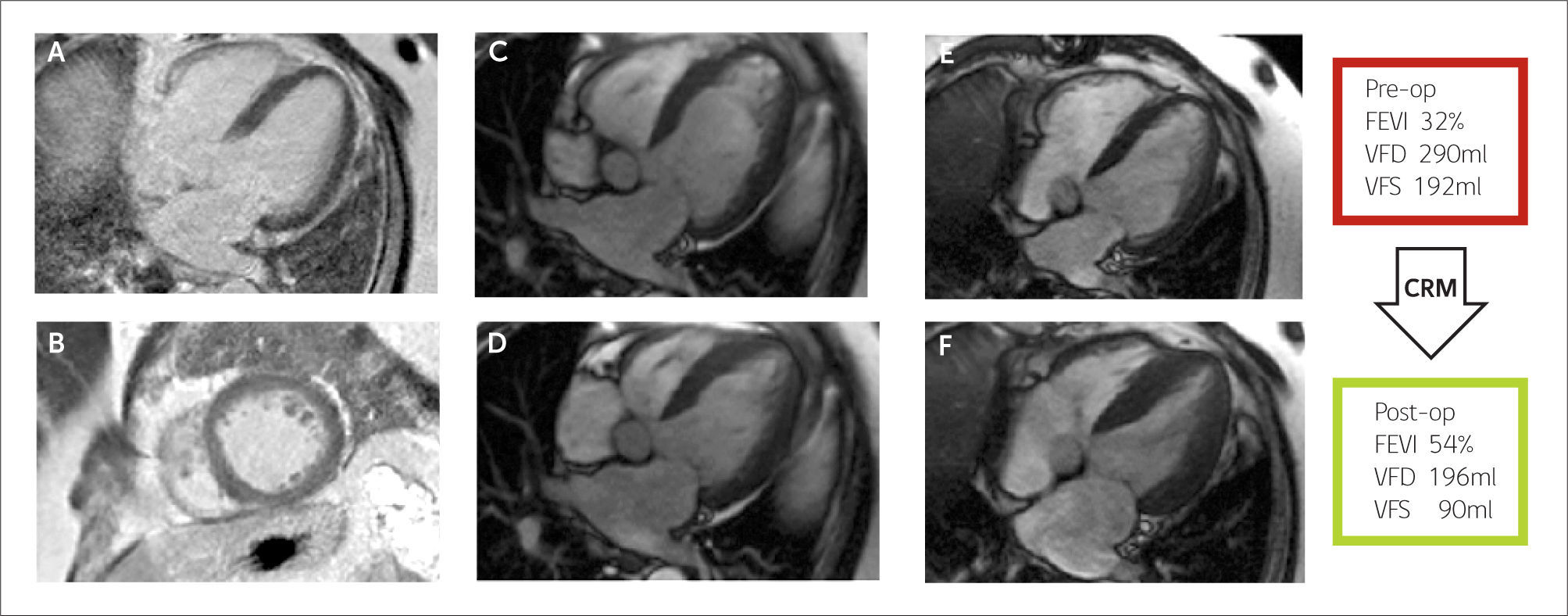
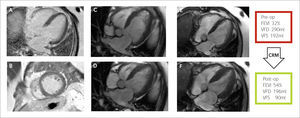
Estudio de viabilidad
Imágenes de RTG en vista de 4 cámaras (A) y eje corto (B) a nivel basal donde se observa un miocardio negro, viable, sin signos de infarto de miocardio previo. Imágenes de cinerresonancia previo a la cirugía en vista de cuatro cámaras en fin de diástole (C) y fin de sístole (D). Imágenes de cinerresonancia posterior a la cirugía en vista de cuatro cámaras en fin de diástole (E) y fin de sístole (F). Se observa una mejor motilidad global y reducción de los volúmenes respecto a la RMC previa a la cirugía de revascularización.
CRM = Cirugía de revascularización miocárdica, FEVI = Fracción de eyección del ventrículo izquierdo, Post-op=postoperatorio, Pre-op= preoperatorio, VFD= volumen de fin de diástole del ventrículo izquierdo, VFS = volumen de fin de sístole del ventrículo izquierdo.
Indicaciones principales de la resonancia magnética cardiaca en pacientes con insuficiencia cardiaca
| Recomendaciones de RMC en pacientes con IC | Recomendación | Evidencia |
|---|---|---|
| Evaluación de función y estructura cardiaca en pacientes con mala ventana acústica o con cardiopatías congénitas complejas | I | C |
| Recomendado caracterización tisular en sospecha amiloidosis, sarcoidosis, Chagas, Fabry, no-compactada, y hemocromatosis | I | C |
| RMC con gadolinio en miocardiopatía dilatada para distinguir origen isquémico o no isquémico | IIa | C |
IC= insuficiencia cardiaca, RMC= resonancia magnética cardiaca.
Las técnicas de evaluación de fibrosis por RMC impulsaron la incorporación de la RMC en la práctica clínica. Las imágenes de RTG constituyen una técnica no invasiva para estimar la fibrosis del miocardio (7). La fibrosis del miocardio es un elemento esencial en el proceso patogénico de varias miocardiopatías (8). A diferencia de otros tejidos, el miocardio tiene una limitada capacidad de regeneración ante una noxa, mientras que el proceso de reparación se lleva a cabo mediante el desarrollo de fibrosis. En etapas iniciales la fibrosis es compensadora, manteniendo la estructura y funcionalidad del corazón. Sin embargo, con el tiempo, la fibrosis lleva al incremento de las presiones de llenado, disfunción diastólica, apoptosis y disfunción ventricular (9). Existen dos tipos de fibrosis, la intersticial que consiste en una fibrosis difusa que no se puede identificar en las secuencias de RTG y una fibrosis de reemplazo o focal donde los miocitos son reemplazados por tejido fibroso que se puede identificar en las secuencias de RTG (8). La fibrosis focal se identifica en las imágenes de RTG como un área blanco brillante en el miocardio mientras que el miocardio normal aparece negro. El gadolinio es un agente extracelular de contraste que se acumula en el espacio intersticial sin ingresar dentro de los miocitos. El principio de las secuencias de RTG se basa en que la fibrosis del miocardio resulta en un incremento del espacio intersticial y enlentecimiento de la cinética de intercambio del gadolinio entre el espacio intersticial y el sistema vascular, por lo que se acumula gadolinio en el intersticio generando imágenes blanco-brillantes.
Las imágenes de RTG permiten identificar áreas de miocardio infartado y determinar el monto de miocardio viable (10). Las imágenes de RTG demostraron ser predictivas de la recuperación funcional después de los procedimientos de revascularización y son capaces de detectar pequeños infartos (11). También, la fibrosis detectada en las imágenes RTG está presente en las miocardiopatías no isquémicas. El patrón de fibrosis en las imágenes de RTG demostró ser útil para el diagnóstico de las causas específicas en diversas miocardiopatías (3). Por ejemplo, la miocarditis tiene un patrón de fibrosis subepicárdico y la amiloidosis un RTG subendocárdico difuso (3) (ver Figura 2).
VALOR PRONÓSTICO DE LA FIBROSIS DETERMINADA POR LAS IMÁGENES DE RTGRecientemente, la fibrosis identificada por las imágenes de RTG ha demostrado tener valor pronóstico en diversas miocardiopatías. Información relevante y pronóstica aporta el RTG en dos grupos de pacientes, aquellos con miocardiopatía hipertrófica (MCPH) y con miocardiopatía dilatada.
MIOCARDIOPATÍA HIPERTRÓFICAEn la MCPH, la RMC puede identificar la distribución de la hipertrofia y evaluar la presencia de fibrosis focal (Figura 4). La fibrosis es un elemento siempre presente en pacientes con MCPH y está demostrado que la fibrosis por RTG se asocia con una mayor frecuencia de arritmias ventriculares (12). Las áreas de fibrosis en contacto con el miocardio resultan en áreas de enlentecimiento del impulso cardiaco y conforman circuitos de reentrada (14). Además, la fibrosis que compromete la región apical, en la forma de aneurisma apical, combinado con la obstrucción medioventricular se asocia con mayor riesgo de muerte comparado con pacientes con obstrucción medioventricular sin aneurisma apical (hazard ratio (HR) 3.47, 95% IC 1.38-8.73; p=0.008) y de arritmias potencialmente malignas y muerte súbita (HR 5.08, 95%IC 1.97-13.05; p=0.001) (14). Otros investigadores como Burder y colaboradores evaluaron si la presencia de RTG en cualquier sector del miocardio se asociaba con mayores eventos cardiovasculares (15). Estudiaron 220 pacientes con MCPH, los siguieron con una media de 1090 días y tuvieron 22 muertes, 11 de las cuales fueron súbitas. El 67.2% de los pacientes tuvieron RTG en la RMC. Los pacientes que no tenían RTG tuvieron una tasa de mortalidad cardiaca menor comparado con aquellos con RTG (HR 4.81, p=0.035). Una de las limitaciones del valor del RTG consiste en que es muy prevalente en pacientes con MCPH (60-70% tienen RTG) por lo tanto, su valor predictivo positivo es bajo. Para resolver esta limitación Chan, Maron y colaboradores decidieron cuantificar la extensión de RTG en pacientes con MCPH con la hipótesis que a mayor cantidad de RTG mayor el riesgo de eventos (16). Estudiaron 1293 pacientes con MCPH, los siguieron en promedio 3.3 años y se observaron 33 muertes súbitas. A todos los pacientes le realizaron una RMC con gadolinio y cuantificaron la extensión del RTG por planimetría determinando la masa de miocardio con fibrosis. El RTG que compromete ≥15% de la masa del miocardio se asoció con 2 veces más riesgo de muerte súbita comparado con pacientes sin RTG o con menor extensión de gadolinio con un likelihood estimado para muerte súbita de 6% a 5 años (16). Otros investigadores encontraron asociaciones similares entre el RTG y eventos cardiovasculares en pacientes con MCPH (17-19). Estos estudios se combinaron en un meta-análisis para determinar la asociación entre RTG y eventos cardiovasculares en pacientes MCPH (20). Se incluyeron 5 estudios con 2993 pacientes con MCPH a los que se realizó un RMC con RTG. La presencia de RTG se asoció con un incremento del riesgo de muerte súbita (odds ratio (OR) 3.41; 95% IC 1.97-5.94; p<0.001), mortalidad total (OR 1.80, 95% IC 1.21-2.69; p<0.004), y mortalidad cardiaca (OR 2.93, 95% IC 1.53-5.61; p<0.001). El estudio de Chan e Isman realizó un análisis cuantitativo del RTG ajustado por otras variables para estimar el riesgo de eventos cardiovasculares. En el meta-análisis se combinaron ambos estudios y la extensión de RTG se asoció con muerte súbita (HR ajustado 1.36/10% RTG; 95% IC 1.10-1.69; p=0.005). Si bien ni las Guías Norteamericanas (21) ni europeas (22) incluyen al gadolinio en la estratificación de riesgo en pacientes con MCPH es probable que esto cambie en próximas guías ya que Maron y colaboradores en una editorial proponen incluir el análisis cuantitativo del RTG en la estratificación de riesgo para muerte súbita. En pacientes con incertidumbre en la estimación de riesgo de muerte súbita para la colocación de un desfibrilador implantable o en pacientes que no tengan factores de riesgo convencionales de riesgo de muerte súbita un RTG ≥15% de la masa del miocardio identificaría a pacientes con alto riesgo y deberían recibir un desfibrilador (23). La otra información valiosa que nos aporta la extensión de RTG es identificar a los pacientes en etapas terminales de MCPH con disfunción sistólica del ventrículo izquierdo e insuficiencia cardiaca. Los pacientes con MCPH y RTG >20% de la masa del miocardio son pacientes con alto riesgo de insuficiencia cardiaca y debe contemplarse la indicación de trasplante cardiaco (24).
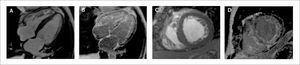
Evaluación de miocardiopatías hipertróficas
A) Imágenes de cinerresonancia en 3 cámaras donde se observa hipertrofia del septum basal (segmento anteroseptal 16mm).
B) Imagen en 3 cámaras de RTG donde no presenta realce en las imágenes RTG.
C) Imágenes de cinerresonancia en 3 cámaras donde se observa hipertrofia del septum basal (segmento anteroseptal 27mm).
D) Imagen en 3 cámaras de RTG donde presenta realce con patrón focal intramiocárdico en las imágenes RTG (flecha naranja).
De manera similar a los pacientes con MCPH, en pacientes con miocardiopatía dilatada el RTG está asociado con pronóstico adverso. Las causas de miocardiopatía dilatada son diversas incluyendo infecciones, enfermedades autoinmunes, toxinas, drogas (ej. antraciclínicos), deficiencias nutricionales y de origen idiopático. La miocardiopatía dilatada idiopática es la forma más frecuente presentado en >30% de los pacientes afección de familiares de primer grado indicando una base genética de la enfermedad (25). Más de 50 genes han sido implicados en el desarrollo de la miocardiopatía dilatada idiopática siendo el más frecuente las mutaciones del gen de titina que es una proteína estructural de las miofibrillas (26). En general, las mutaciones afectan a las proteínas de las miofibrillas intracelulares sin comprometer el intersticio. Es por esto que el 60-70% de los pacientes con miocardiopatía dilatada idiopática no presenta RTG ya que para que haya RTG se requiere la distribución del gadolinio en el espacio intersticial. A diferencia de la MCPH donde la fibrosis siempre está presente, la fibrosis en pacientes con miocardiopatía dilatada idiopática está presente en etapas más avanzadas de la enfermedad (8).
La fibrosis del miocardio está asociada con mayor dilatación y remodelado ventricular, así como desarrollo de insuficiencia cardiaca y muerte súbita (25). En un estudio se incluyeron 228 pacientes con disfunción sistólica del ventrículo izquierdo, sin historia de insuficiencia cardiaca, y sin enfermedad coronaria se les realizó una RMC en la que el 27% presentó RTG (27). Los pacientes con RTG presentaron una mayor incidencia de insuficiencia cardiaca (HR 5.23, IC 95% 2.61–10.50; p<0.001) y muerte súbita (HR 8.31, IC 95% 1.66–41.55; p=0.010) en un seguimiento de 23 meses (27). Esta asociación se evaluó en estudios de pequeñas o medianas dimensiones. En un meta-análisis que incluyó 1488 pacientes con miocardiopatía dilatada no isquémica en 9 estudios se evaluó la asociación entre fibrosis por el RTG y la muerte súbita, mortalidad total y el desarrollo de insuficiencia cardiaca en un seguimiento medio de 30 meses (28). La fracción de eyección promedio fue del 37% y la prevalencia de fibrosis en las imágenes de RTG de 38%. La fibrosis miocárdica se asoció con un incremento de 5 veces en el riesgo de muerte súbita (intervalo de confianza [IC] 95%, 5.32, 3.45–8.20, p<0.0001) y 3 veces en la mortalidad total (95%IC, 2.91, 1.1 –7.27, p=0.02) y la insuficiencia cardiaca (95%IC, 3.27, 1.94–5.51, p<0.0001) (28,31) (30). La capacidad de predicción de muerte súbita por las imágenes de RTG hizo que se explore en la selección de pacientes a la terapia de desfibrilador. Además, la determinación de la fibrosis por las imágenes de RTG tiene aplicaciones en la resincronización en pacientes con miocardiopatía dilatada.
INDICACIÓN DE DESFIBRILADOR IMPLANTABLEEn pacientes con miocardiopatía dilatada isquémica, secuela de infarto de miocardio y disfunción ventricular severa existe mayor consenso en el beneficio del cardiodesfibrilador (29). Se estima que aquellos pacientes con secuela de infarto que compromete >30% del miocardio se beneficiarían con la colocación de cardiodesfibrilador en prevención primaria (30). También la heterogeneidad de los bordes de la cicatriz fibrosa post-infarto en las imágenes de RTG está asociada con mayor riesgo de muerte súbita (31).
Por otro lado, existe controversia sobre la indicación de cardiodesfibriladores en pacientes con miocardiopatía dilatada no isquémica y deterioro severo de la función sistólica. En las guías de práctica clínica del 2012 el desfibrilador está indicado como recomendación clase I (evidencia A en pacientes con infarto previo y B en pacientes sin infarto previo) en los pacientes con deterioro severo de la función sistólica (fracción de eyección del ventrículo izquierdo <35%), clase funcional II-III, tratamiento médico óptimo y sin ocurrencia de infarto de miocardio en los últimos 40 días (1). Sin embargo, el estudio DANISH no se evidenció beneficio con la implantación de cardiodesfibriladores en pacientes con miocardiopatía dilatada no isquémica (32). Los autores concluyen, que la indicación de cardiodesfibriladores debería evitarse en pacientes con miocardiopatía dilatada no isquémica que, se sospecha, no recibirán beneficio (32). Además, existe evidencia que las descargas inapropiadas del cardiodesfibrilador se asocian con mayor mortalidad (33). Los predictores de muerte súbita actuales no son satisfactorios y uno de los mayores determinantes en la colocación de cardiodesfibriladores es la fracción de eyección.
La RMC puede colaborar en identificar pacientes que se beneficien con el cardiodesfibrilador. Los pacientes con fibrosis o necrosis en las imágenes de RTG presentaron choque apropiado del cardiodesfibrilador mientras que los sujetos con miocardiopatía dilatada sin fibrosis no presentaron choques en el seguimiento (34). En un meta-análisis se incluyeron 2984 pacientes isquémicos y no isquémico de 29 estudios que evaluaron en pacientes a los que les colocaron un cardiodesfibrilador la asociación entre la fibrosis en las imágenes de RTG y punto final arrítmico (arritmia ventricular sostenida o descarga apropiada del desfibrilador) (35). Un 44% de los pacientes presentó RTG. El punto final arrítmico ocurrió en 350 pacientes (12%), de los cuales 272 pacientes tenían RTG (21%) y 78 sin RTG (4.6%) (p<0.001). Los eventos anualizados fueron 6.9% y 1.6% en pacientes con y sin RTG (p<0.001) respectivamente. La presencia de RTG se asoció con un riesgo mayor del punto final arrítmico (OR 4.3; P <0.001). La asociación del RTG con el punto final arrítmico se mantuvo significativa en pacientes con fracción de eyección >35% (OR 5.2; p <0.001). El RTG con gadolinio podría ser un criterio de selección de pacientes para la terapia con desfibrilador de mayor exactitud que la fracción de eyección del ventrículo izquierdo (Figura 5).
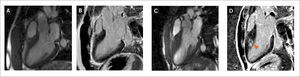
Evaluación de desfibrilador
A) Imágenes de cinerresonancia en 4 cámaras donde se observa un ventrículo izquierdo dilatado.
B) Imagen en 4 cámaras de RTG en vista de 4 cámaras donde se observa RTG en el septum interventricular basal y medial. La presencia de RTG favorece la decisión de colocar un desfibrilador implantable.
En pacientes que se evalúa la terapia de resincronización, la RMC puede aportar información sobre la distribución de la cicatriz fibrosa y grado de disincronía. El aspecto más relevante y original de la RMC es la determinación de la cicatriz fibrosa (Figura 6). Los sectores del miocardio con cicatriz fibrosa extensa no son lugares adecuados para estimular mediante los electrodos del re-sincronizador.
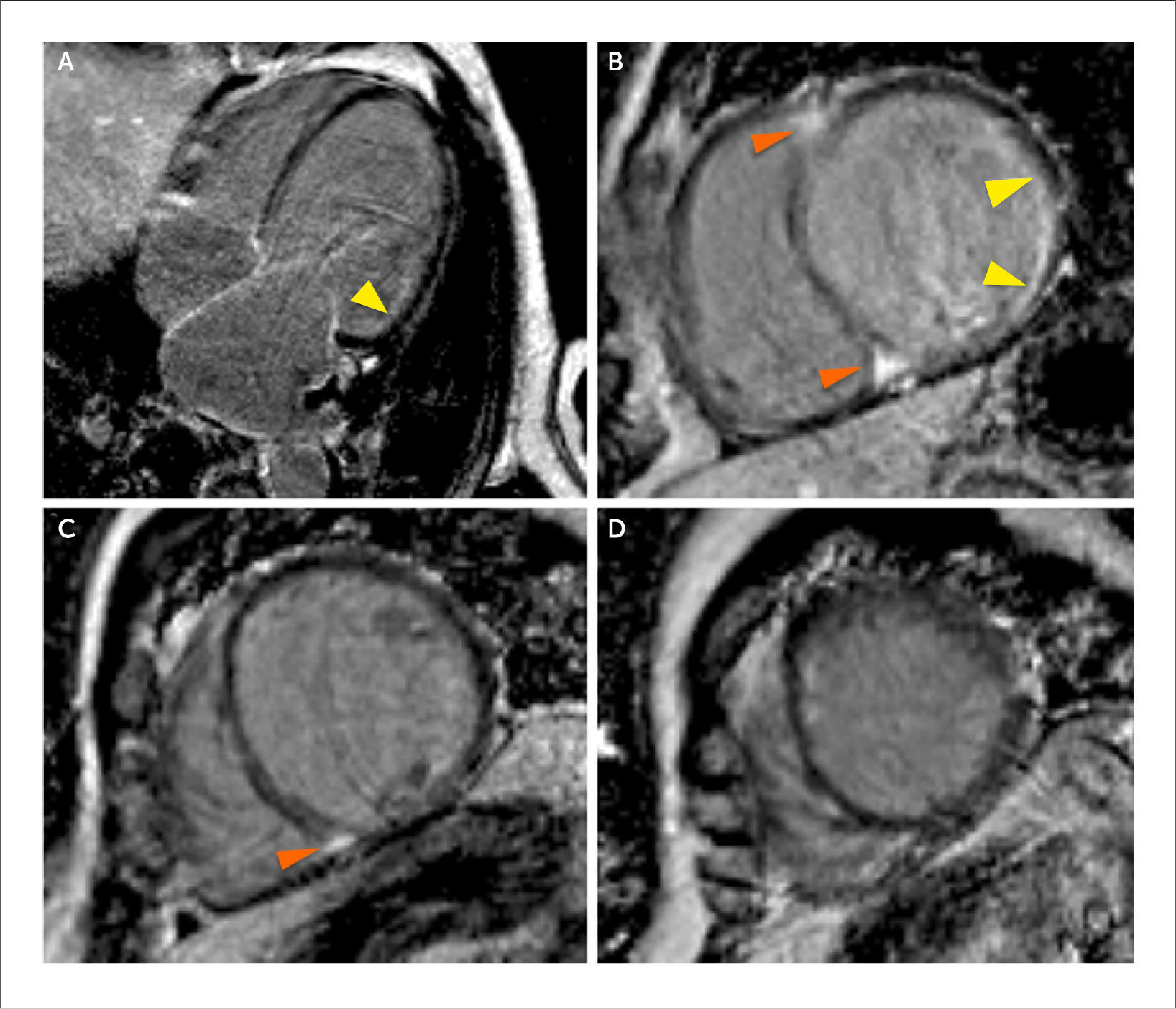
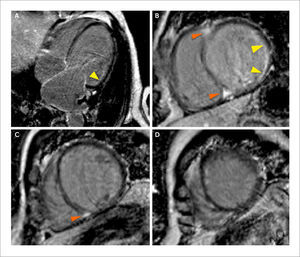
Evaluación de re-sincronizador
(A) Imágenes de RTG en vista de 4 cámaras en las que se observa un ventrículo izquierdo mayormente sin fibrosis focal (miocardio negro) con un área de RTG subendocardica no transmural en el segmento anterolateral basal (flecha amarilla).
(B) (C) (D) Imágenes de RTG en eje corto a nivel basal, medial y apical respectivamente con RTG subendocardico en el segmento anterolateral basal e inferolateral basal (flechas blancas) y RTG focal intramiocarico en el septum basal y medial (flechas naranjas). Si bien hay RTG, el patrón es subendocárdico y no trasmural lo pronostica una respuesta favorable con la resincronización.
La localización de la cicatriz fibrosa es predictiva de respuesta a la resincronización (36). Los sectores del miocardio con cicatriz fibrosa extensa no son lugares adecuados para la estimulación mediante los electrodos de resincronización ya que la cicatriz enlentece la velocidad de conducción en la región. La estimulación mediante el electrodo de resincronización en la cicatriz fibrosa se asoció a un incremento de eventos clínicos adversos en 5 veces, en términos de insuficiencia cardiaca y muerte súbita, comparado con aquellos que fueron estimulados en miocardio sin cicatriz fibrosa (37). También tienen menos probabilidades de beneficiarse con la terapia de resincronización los pacientes con infarto que involucran los segmentos inferior basal e inferolateral basal, ya que la necrosis esta próxima al sitio de colocación de los electrodos de resincronización en especial en aquellos pacientes con infarto transmural extenso en dicha región (37-41). La colocación guiada del electrodo de re-sincronizador evitando las áreas de cicatriz parece ser el abordaje más racional en estos pacientes. En un estudio de 100 pacientes se combinó la información de la RMC para detectar cicatriz fibrosis y el speckle tracking por ecocardiografía para identificar áreas con mayor retardo en la contracción en el miocardio sin cicatriz (42). El lugar de óptimo para el implante del electrodo fue el área sin cicatriz con mayor retardo en la contracción. Aquellos pacientes en los que el implante de éste se realizó en el lugar óptimo, tuvieron una respuesta adecuada en el 93% de los casos, mientras que, cuando el implante fue discordante tuvieron una respuesta adecuada sólo en el 33% (p<0.006) (42).
Otra estrategia recientemente propuesta en pacientes con cicatriz fibrosa es la utilización de electrodos en donde se estimula en ambos extremos de la cicatriz, incrementando la respuesta a la resincronización (43).
FIBROSIS DIFUSAExisten nuevos avances de la identificación de fibrosis. El RTG identifica la fibrosis focal mientras que las recientes técnicas de mapeo de T1 pueden identificar fibrosis difusa del miocardio que representa fibrosis en estadio más precoz (27). La técnica de mapeo de T1 trabaja midiendo la relajación de T1 de manera absoluta en toda la imagen midiendo la señal en cada uno de los pixeles que componen la imagen. La relajación de T1 será más rápida a mayor concentración de gadolinio, la cual será mayor si el miocardio presenta mayor grado de fibrosis intersticial. La relajación de T1 se puede medir sin inyección de gadolinio siendo posible la evaluación de la fibrosis intersticial en pacientes con contraindicación para la inyección de gadolinio (Ej. Pacientes con insuficiencia renal crónica). Se utilizan secuencia modificadas tipo Look-Locker inversión time (MOLLI) que consiste en series de imágenes eco-gradiente obtenidas con diferentes tiempos de inversión que permiten estimar el tiempo de relajación (T1) en cada uno de los pixeles que componen la imagen en una sola apnea (44). La fibrosis difusa medida con secuencias de mapeo de T1 se asoció con mayor taquicardia ventricular no sostenida en el Holter o muerte súbita abortada en sujetos con MCPH y CDI (45). Con estas técnicas, es posible estimar el volumen celular total y el volumen de matriz total en el miocardio. En pacientes con diabetes el volumen de matriz extracelular (o fibrosis difusa) se asoció con mayor riesgo de muerte y hospitalización por insuficiencia cardiaca (46).
CONCLUSIONESLa RMC es una técnica de imágenes ya consolidada para la evaluación de miocardiopatías. El aspecto más original y destacable de la RMC es la determinación de la fibrosis a través de las imágenes de RTG. Los patrones de RTG son de utilidad para el diagnóstico etiológico de las miocardiopatías. El RTG se asocia con pronóstico adverso en la MCPH y miocardiopatía dilatada. Determinar la extensión del gadolinio es crítico para identificar pacientes con MCPH con alto riesgo de muerte súbita. La fibrosis del miocardio que compromete más del 15% del miocardio se asocia con mayor riesgo de eventos arrítmicos y muerte. También la extensión del gadolinio se asocia con el desarrollo de insuficiencia cardiaca en pacientes con MCPH. En pacientes con miocardiopatía dilatada el RTG se asoció con pronóstico adverso. El RTG identifica pacientes con mayor riesgo de eventos arrítmicos que se podrían beneficiar con el implante de un desfibrilador, particularmente en aquellos con fracción de eyección superior a un 35% y miocardiopatía dilatada isquémica o no isquémica. La extensión y ubicación del RTG permite identificar pacientes que podría beneficiarse con procedimientos de resincronización. Por último, las técnicas de fibrosis difusa identifican estadios más precoces de fibrosis y podría ser de utilidad para estratificar el riesgo de los pacientes en etapas precoces de las miocardiopatías. Por todas estas razones, la RMC se ha incorporado a la evaluación y manejo clínico de pacientes con miocardiopatías.
El autor declara no tener conlictos de interés, en relación a este artículo.