Las trombofilias son un grupo de enfermedades que favorecen la formación de trombosis, tanto arteriales como venosas, y han sido asociadas con diferentes complicaciones durante el embarazo, entre las cuales podemos mencionar: aborto recurrente, preclampsia, restricción de crecimiento intrauterino y muerte fetal in útero, entre otras. Recientemente, se ha sugerido una asociación entre trombofilias e infertilidad. Las mutaciones de la enzima Metilentetrahidrofolato Reductasa (MTHFR) y de Leiden se encuentran con mayor frecuencia en pacientes con infertilidad de causa desconocida, al compararlas con grupos controles. Durante la etapa de estimulación ovárica diversas trombofilias han sido vinculadas con la aparición de sindrome de hiperestimulación ovárica severo. Por último, las pacientes con historia de falla recurrente de implantación, luego de múltiples ciclos de fertilización in Vitro, demuestran una mayor prevalencia de trombofilias que las pacientes con éxito en dichas terapias. Este artículo presenta una revisión de las publicaciones relevantes que abordaran los distintos aspectos de la relación entre trombofilias e infertilidad hasta agosto de 2009. El objetivo es describir los estudios utilizados y sus implicancias en el manejo de la pareja infértil.
Thrombophilias are a group of conditions that favor the genesis of arterial/venous thrombosis. Several complications throughout pregnancy have been associated with trhombophilias, including recurrent spontaneous abortion, preeclampsia, intrauterine growth restriction and fetal demise. Recently, an asociation has been sugested between infertility and thrombophilias, involving diferent aspects of the infertile couple therapy. MTHFR and Leiden mutations can be found more frecuently in patients with diagnosis of unknown infertility when compared with control groups. During ovarian estimulation, thrombophilias have been linked with severe ovarian hiperstimulation syndrome. Furthermore, patients with recurrent implantation failure after in vitro fertilization therapy show a higher rate of thrombophilias than patients with succesful IVF therapy. A review of the relevant publications concerning the topic thrombophilia and infertility until august 2009 is presented in this article. The aim of this article is to describe the results of the studies and its relevance in the infertile couple treatment.
Las trombofilias son un grupo heterogéneo de condiciones asociadas a un mayor riesgo de aparición de trombosis arteriales y/o venosas. Se clasifican en hereditarias o congénitas y en adquiridas, que son aquellas que se desarrollan en algún momento de la vida.
Las trombofilias actúan mediante una alteración funcional o estructural de algún factor relacionado con el proceso de coagulación, que aumenta la predisposición a la formación de trombosis. Pueden actuar alterando, tanto los sistemas anticoagulantes, como procoagulantes, favoreciendo un estado procoagulante.
Hoy, las trombofilias no son consideradas como una enfermedad propiamente tal, sino que se piensa en ellas como un factor de riesgo. Por lo tanto, es frente una situación que aumente el riesgo de trombosis (por ejemplo: reposo prolongado, uso de anticonceptivos o embarazo), donde estas condiciones pueden manifestarse, con la aparición de trombosis en diversos sectores del organismo.
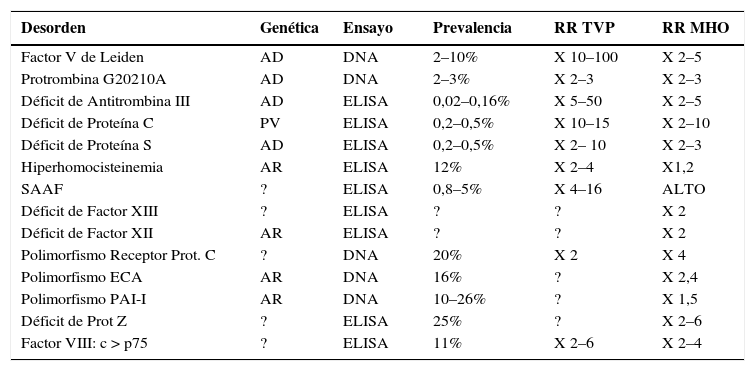
Dentro de las trombofilias hereditarias podemos mencionar, en orden de frecuencia: Resistencia a la proteína C activada, Mutación de la Metilentetrahidrofolato reductasa (MTHFR) C677T o A1298C, mutación del gen de la protrombina G20210A, deficiencia de proteína S, deficiencia de proteína C, deficiencia de proteína Z y deficiencia de Antitrombina III. En los últimos años han aparecido exámenes diagnósticos para trombofilias emergentes como: mutación del inhibidor del activador de plasminógeno tipo 1 (PAI-1), alteraciones de factores XII, XIII, polimorfismo del gen de la enzima convertidora y exceso de factor VIII (ver Tabla N° 1). Con respecto a las trombofilias adquiridas, debemos destacar al sindrome de anticuerpos antifosfolípidos, que es una enfermedad adquirida del sistema inmunológico. La persona afectada produce autoanticuerpos, los que, mediante mecanismos no bien aclarados, producirían alteraciones en la cascada de coagulación, favoreciendo un estado procoagulante (1, 2).
Durante los últimos años ha aumentado la percepción acerca de la existencia de una relación entre trombofilias e infertilidad. Esto es apoyado por un número creciente de publicaciones que describen una asociación entre ambas entidades. Recientemente se ha sugerido una relación causal entre infertilidad de causa desconocida y trombofilias, sobre todo en algunos casos de trombofilias congénitas (3). Por otro lado, también se ha vinculado a las trombofilias en algunas de las complicaciones de la terapia de reproducción asistida, como el sindrome de hiperestimulación ovárica (SHEO). Finalmente, existe evidencia que apoya una relación entre tombrombofilias y fallas implantacionales en pacientes sometidas a Fertilización in vitro (FIV) o microinyección intracitoplasmática de espermatozoides (ICSI), lo que apoyaría un rol causal de las trombofilias en las fallas de las terapias de reproducción asistida. Durante el siguiente artículo describiremos la evidencia que apoya la relación entre infertilidad y trombofilia en los siguientes aspectos: sindrome de hiperestimulación ovárica, infertilidad de causa no precisada y falla implantacional recurrente, luego de terapias de fertilización in vitro o ICSI (Tabla 1).
Características clínicas de las trombofilias
| Desorden | Genética | Ensayo | Prevalencia | RR TVP | RR MHO |
|---|---|---|---|---|---|
| Factor V de Leiden | AD | DNA | 2–10% | X 10–100 | X 2–5 |
| Protrombina G20210A | AD | DNA | 2–3% | X 2–3 | X 2–3 |
| Déficit de Antitrombina III | AD | ELISA | 0,02–0,16% | X 5–50 | X 2–5 |
| Déficit de Proteína C | PV | ELISA | 0,2–0,5% | X 10–15 | X 2–10 |
| Déficit de Proteína S | AD | ELISA | 0,2–0,5% | X 2– 10 | X 2–3 |
| Hiperhomocisteinemia | AR | ELISA | 12% | X 2–4 | X1,2 |
| SAAF | ? | ELISA | 0,8–5% | X 4–16 | ALTO |
| Déficit de Factor XIII | ? | ELISA | ? | ? | X 2 |
| Déficit de Factor XII | AR | ELISA | ? | ? | X 2 |
| Polimorfismo Receptor Prot. C | ? | DNA | 20% | X 2 | X 4 |
| Polimorfismo ECA | AR | DNA | 16% | ? | X 2,4 |
| Polimorfismo PAI-I | AR | DNA | 10–26% | ? | X 1,5 |
| Déficit de Prot Z | ? | ELISA | 25% | ? | X 2–6 |
| Factor VIII: c > p75 | ? | ELISA | 11% | X 2–6 | X 2–4 |
En esta revisión se realizó un búsqueda en Pubmed y Medline de todos los artículos relevantes usando los términos: trombofilia, infertilidad, falla implantacional, FIV fallido y sindrome de hiperestimulación ovárica hasta el 31 de agosto del 2009. Se encontraron 28 artículos (referencias 3 a la 12 y 14 a la 31), que abordan los distintos aspectos de la relación entre trombofilias e infertilidad. A continuación se describe el detalle de los estudios utilizados y sus implicancias en el manejo de la pareja infértil.
Sindrome de hiperestimulación ovárica y trombofiliasEl uso de las técnicas de reproducción asistida ha aumentado considerablemente en los países desarrollados durante el último tiempo. Hoy en día estos procedimientos dan cuenta de un 4.2% de los nacimientos en Europa y del 1% de los nacimientos en Estados Unidos (4, 5). Asociado a la estimulación ovárica con gonadotrofinas, existen reportes de complicaciones tromboembólicas, ya sean venosas o arteriales, la mayoría de las cuales están relacionadas con el sindrome de hiperestimulación ovárica (5).
La asociación entre niveles elevados de estradiol y fenómenos tromboembólicos es conocida y proviene de estudios epidemiológicos de anticonceptivos orales (5, 6). Con la estimulación ovárica se logra un nivel elevado de estradiol plasmático. Luego de la estimulación con gonadotropinas y en el momento previo a la aplicación de hCG se calcula que el nivel de estradiol aumenta entre 20 y 50 veces el nivel basal. Este aumento de estradiol produce diversos cambios en los factores de coagulación, que promueven un estado de hipercoagulabilidad.
En estudios longitudinales, realizados en pacientes sometidas a hiperestimulación ovárica controlada, se ha demostrado un aumento en los niveles de los factores de Von Willebrand, Factor VIII y fibrinógeno. Además, se ha podido observar un aumento en la resistencia a la proteína C activada y niveles bajos de antitrombina III, proteína C y S. Otras alteraciones descritas en estos estudios incluyen una disminución en los marcadores de trombolisis, como el activador del plasminógeno tisular (tPA) y el inhibidor del activador del plasminógeno I (PAI-1). Todo esto contribuye a la creación de un estado protrombótico (5).
El riesgo de presentar una trombosis durante un ciclo de Fertilización in vitro se estima entre 0,08 y 0,11%, 10 veces el nivel basal de riesgo de una mujer en edad reproductiva y similar al riesgo reportado durante el embarazo. Cuando está presente el sindrome de hiperestimulación ovárica, sin embargo, este riesgo aumenta de 20 a 40 veces (12). Como se mencionó anteriormente, existen múltiples reportes de casos con complicaciones tromboembólicas durante la terapia de reproducción asistida. La mayoría de estos episodios son de tipo venoso y ocurren luego de la inducción de ovulación. Estos episodios están asociados a sindrome de hiperestimulación ovárica en un 78% de los casos, si bien la presentación del episodio de trombosis fue después de la resolución clínica del SHEO. Al realizar un estudio de trombofilias a las pacientes que presentaron una complicación tromboembólica durante la estimulación ovárica, el 40% (25 de 63 pacientes) resultó portadora de una alteración. Las trombofilias más frecuentemente encontradas en este grupo son la mutación del factor V de Leiden y la mutación de la protrombina 20210A (5).
El SHEO es una de las complicaciones más complejas asociadas a la terapia de inducción de ovulación. Se trata de una respuesta exagerada a la estimulación de la ovulación. Su forma severa ocurre en el 0,8 a 2% de las mujeres sometidas a hiperestimulación ovárica con gonadotropinas exógenas, siendo raro en ciclos de estimulación con otros agentes como el Citrato de Clomifeno. Los altos niveles de estrógenos y un número aumentado de folículos al momento de la inducción de ovulación son factores predisponentes para desarrollar un SHEO. La característica principal de esta condición es un aumento de la permeabilidad capilar, que resulta en paso de fluidos del intra al extravascular, creando un tercer espacio y produciendo hipotensión, ascitis y hemoconcentración (7).
Si bien, la etiología del SHEO es compleja y permanece en muchos aspectos no aclarada, sabemos que el factor proangiogénico VEGF (vascular endothelial growth factor) juega un papel importante en su patogénesis. Dicho factor aumenta la permeabilidad capilar, explicando el traspaso de fluidos al espacio extravascular que existe en este sindrome. De hecho, el aumento en los niveles de VEGF durante la terapia de reproducción asistida es un marcador para el desarrollo de SHEO y sus niveles, tanto plasmáticos como en líquido ascítico, se correlacionan con la severidad clínica del SHEO. Además de aumentar la permeabilidad capilar el VEGF-A es responsable del aumento de expresión de factor tisular, un importante activador de la cascada de la coagulación. Esto explicaría, en parte, el estado protrombótico presente en esta condición (4).
El estado de hipercoagulabilidad y las complicaciones tromboembólicas han sido asociadas a pacientes con sindrome de hiperestimulación ovárica severo. Posibles factores contribuyentes al riesgo de trombosis son el aumento de viscosidad sanguínea, producto de la depleción intravascular de fluidos, como también, alteraciones en los factores de coagulación, como el aumento del factor tisular descrito anteriormente. Sin embargo, una explicación integral y satisfactoria de los eventos fisiopatológicos que relacionan el SHEO con fenómenos tromboembólicos permanece por el momento fuera de nuestro alcance.
Hoy es aceptado que esta condición genera un riesgo aumentado de trombosis, razón por la cual parte del tratamiento de este sindrome incluye terapia anticoagulante. Existen reportes de pacientes con formas graves de trombosis asociados a terapias de inducción de ovulación y SHEO. No obstante, la prevalencia de trombofilias en pacientes con SHEO severo es desconocida. Recientemente se ha propuesto que existe una mayor prevalencia de trombofilias en el grupo de pacientes con SHEO severo y se ha descrito que la realización de estudio de trombofilias en este grupo, y el consiguiente tratamiento de ellas, podría prevenir importantes complicaciones tromboembólicas (3). Estudios retrospectivos realizados en población checa, demuestran que las complicaciones tromboembólicas ocurren principalmente en los casos de SHEO severo y que se puede observar una mayor prevalencia de mutación de factor V de Leiden y de mutación de MTHFR C677T homocigoto al compararlos con un grupo control (8, 9, 10). Un estudio realizado por Dulitzky y cols el 2002 evaluó la prevalencia de trombofilias en un grupo de 20 pacientes que presentaron SHEO severo, comparándolas con un grupo control de 41 pacientes sometidas a estimulación ovárica que no presentaron SHEO. Las trombofilias estudiadas fueron las mutaciones de Leiden y MTHFR C677T, déficit de proteínas C, S y antitrombina III y anticuerpos antifosfolípidos. Los resultados demostraron una mayor prevalencia de trombofilias (85%) versus el grupo control (26,8%). Las trombofilias con mayor frecuencia en la población de mujeres con SHEO severo fueron déficit de antitrombina III y proteína S, observándose también una mayor tendencia en la prevalencia de la mutación MTHFR C677T en dicho grupo. El mismo grupo de investigadores analizó el problema desde la perspectiva inversa, analizando el riesgo de presentar SHEO al ser portador de una trombofilia. El grupo de pacientes portadoras de la mutación MTHFR C677T demostró una aumento en el riesgo de desarrollar SHEO severo en 5 veces (11). Estos hallazgos, sin embargo, son debatidos por otros grupos de investigadores que demuestran igual prevalencia de trombofilias en pacientes con y sin SHEO (12). En la Tabla N° 2 se puede observar el resumen de los trabajos que estudian la relación entre trombofilias y SHEO.
Es posible pensar que existe cierta asociación entre el SHEO y los fenómenos tromboembólicos y que la prevalencia de trombofilias podría estar aumentada, sobre todo en el grupo de pacientes con SHEO severo que presentan complicaciones tromboembólicas. Este hecho apoya la realización de un estudio de trombofilias en pacientes con formas severas de esta condición, para identificar las pacientes en riesgo de dichas complicaciones y, de esta forma, tomar las medidas de prevención adecuadas.
Si bien, existe poca información que apoye el uso rutinario de tromboprofilaxis durante la estimulación ovárica en las terapias de reproducción asistida, esta debiera estar dirigida a pacientes con trombofilias demostrada, sobre todo aquellas de alta fuerza trombogénica (deficiencia antitrombina III, Homocigoto mutación Leiden o protrombina y anormalidades combinadas) (13) o bien en pacientes con antecedentes de un SHEO o de episodios de trombosis venosas previa (Tabla 2).
Resumen de estudios que asocian sindrome de hiperestimulación ovárica y trombofilias
| Estudio | Población | Conclusión |
|---|---|---|
| Dulitzki et al, 2002 (11) | 20 pacientes con SHEO severo vs 41 pacientes que no presentaron SHEO luego de estimulación. | 85% de trombofilias (Def. Antitrombina III, prot C y S, Mutación de factor V de Leiden y MTHFR) vs 26,8% en grupo control. |
| Fábregues et al, 2004 (12) | 20 pacientes con SHEO severo vs 40 pacientes que no presentaron SHEO luego de estimulación y 100 controles. | Sin diferencias en la prevalencia de trombofilias en los 3 grupos. |
| Mára et al, 2004 (9) | Estudio retrospectivo de pacientes sometidas a IVF en un peridodo de 7 años. | Frecuencia de tromboembolismo en grupo de pacientes con SHEO es de 4,1 % vs 0,11 % en grupo control. |
| Machac et al, 2005 (8) | 30 pacientes con SHEO vs grupo control. | Mayor prevalencia de mutación de factor V de Leiden en grupo de SHEO. |
| Machac et al, 2006 (10) | 50 pacientes con SHEO vs 93 pacientes que no presentaron SHEO luego de estimulación y 196 controles. | Sin diferencias en la prevalencia de trombofilias en los 3 grupos. |
SHEO: sindrome de estimulación ovárica.
Se considera infértil a una pareja que al cabo de 12 meses de coito sin protección no ha logrado concebir. Esta condición aqueja al 10–15% de las parejas. La causas pueden se de origen materno, paterno o mixto. Sin embargo, luego de un estudio etiológico acabado, entre un 15 a un 30% de los pacientes quedaran en el grupo de infertilidad de causa desconocida (3). El tratamiento en estos casos es, por lo tanto, empírico y va desde la observación y cambios de hábitos de vida hasta terapias de reproducción asistida con fertilización in vitro o ICSI. Además, si bien este grupo de pacientes tiene menor posibilidad de embarazo espontáneo, su probabilidad es mayor a 0, por lo que este grupo podría tratarse del extremo bajo de la distribución normal de la fertilidad, sin necesidad de mediar un defecto específico. Otra posibilidad es que, al menos, parte de este grupo presente alguna alteración que, por el momento o por falta de elementos diagnósticos, no pueda ser pesquisada. Recientemente se ha propuesto una relación entre infertilidad de causa desconocida y trombofilias.
En un estudio realizado recientemente, en el cual se comparó la frecuencia de 9 polimorfismos genéticos entre 92 pacientes con infertilidad de causa desconocida y un control de 60 mujeres fértiles, se demostró una mayor prevalencia de mutaciones de la MTHFR C677T (35%) versus el grupo control (22%) (14). Otro grupo de investigadores comparó la prevalencia de distintas trombofilias en un grupo de 32 parejas infértiles, comparándolas con un grupo de 130 mujeres con historia de aborto recurrente. Las trombofilias estudiadas fueron la mutación del factor V de Leiden, de la MTHFR y de la protrombina (15). Los investigadores pudieron demostrar una asociación estadísticamente significativa entre la mutación del factor V de Leiden y de la MTHFR (p:0,001 y p:0,02 respectivamente). Lo interesante respecto de la relación entre la mutación de la MTHFR e infertilidad de causa desconocida, es que pareciera ser independiente de los niveles de homocisteína pesquisados en este grupo de pacientes. Así lo demuestra un estudio de 31 pacientes con diagnóstico de infertilidad de causa desconocida o aborto recurrente, portadoras de la mutación MTHFR C677T y A1298C, en el cual se demostró niveles aumentados de homocisteína en 1 sola paciente. Todas las pacientes recibieron suplementación con ácido fólico 4mg/día. La tasa de embarazo mayor a 16 semanas de este estudio fue de 61%, en comparación a la tasa de embarazo previo a la suplementación que fue de 10% en este grupo. Los autores sugieren que la suplementación con acido fólico podría tener un rol importante en estas pacientes, incluso con niveles normales de homocisteína (16).
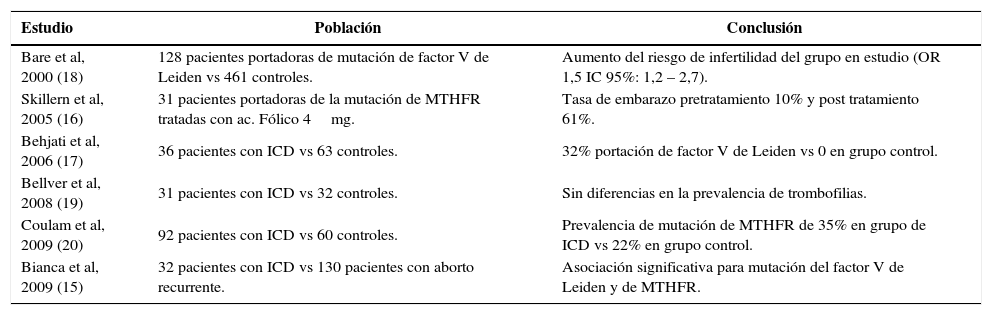
En el año 2006, Behjati y cols, observaron la prevalencia de trombofilias en un grupo de 36 pacientes iraníes con infertilidad de causa no precisada, comparándolas con un grupo de 62 pacientes fértiles. Las trombofilias estudiadas fueron las mutaciones del factor V Leiden, de la MTHFR y de la protrombina. El 32% de las pacientes infértiles demostraron ser portadoras de la mutación del factor V de Leiden versus 0 en el grupo control (17). Se observó un aumento del riesgo de infertilidad (OR 1,5 IC 95%: 1,2 – 2,7) en un estudio caso-control, comparando 128 pacientes heterocigotas para la mutación del factor V de Leiden versus 461 controles (18). En la tabla 3 se puede observar el resumen de los trabajos que estudian la relación entre trombofilias e infertilidad de causa desconocida.
Resumen de estudios que asocian infertilidad de causa desconocida y trombofilias
| Estudio | Población | Conclusión |
|---|---|---|
| Bare et al, 2000 (18) | 128 pacientes portadoras de mutación de factor V de Leiden vs 461 controles. | Aumento del riesgo de infertilidad del grupo en estudio (OR 1,5 IC 95%: 1,2 – 2,7). |
| Skillern et al, 2005 (16) | 31 pacientes portadoras de la mutación de MTHFR tratadas con ac. Fólico 4mg. | Tasa de embarazo pretratamiento 10% y post tratamiento 61%. |
| Behjati et al, 2006 (17) | 36 pacientes con ICD vs 63 controles. | 32% portación de factor V de Leiden vs 0 en grupo control. |
| Bellver et al, 2008 (19) | 31 pacientes con ICD vs 32 controles. | Sin diferencias en la prevalencia de trombofilias. |
| Coulam et al, 2009 (20) | 92 pacientes con ICD vs 60 controles. | Prevalencia de mutación de MTHFR de 35% en grupo de ICD vs 22% en grupo control. |
| Bianca et al, 2009 (15) | 32 pacientes con ICD vs 130 pacientes con aborto recurrente. | Asociación significativa para mutación del factor V de Leiden y de MTHFR. |
ICD: infertilidad de causa desconocida.
Por otro lado, el grupo de Bellver y cols, en al año 2008, comparó la prevalencia de trombofilias en un grupo de 31 pacientes con infertilidad de causa desconocida y las comparó con un grupo de 32 pacientes fértiles. Las trombofilias estudiadas fueron las deficiencias de antitrombina III, proteína S y C, Mutaciones de MTHFR, factor V de Leiden y protrombina, y anticuerpos anticardiolipinas. Los investigadores no encontraron diferencias significativas entre ambos grupos (19).
El mecanismo por el cual la trombofilia estaría implicada en la infertilidad no es claro. Uno de los mecanismos propuestos es una falla temprana en la implantación, con múltiples embarazos no pesquisados, que se manifestarían en la práctica como infertilidad (15). Otros mecanismos propuestos tendrían relación con el metabolismo del ácido fólico (20) o con posibles anormalidades en la meiosis, produciendo alteraciones cromosómicas en pacientes con mutación de la MTHFR (21).
Lamentablemente los estudios que relacionan trombofilias e infertilidad de causa desconocida carecen de poder estadístico, lo que se debe a la baja prevalencia de estas condiciones. Tomando en cuenta la baja frecuencia de estas condiciones se necesitarían alrededor de 1000 pacientes para un estudio 1 a 1, caso control y lograr significancia estadística. Por lo tanto, si bien la evidencia demuestra una leve asociación entre trombofilias e infertilidad de causa desconocida, es necesario contar estudios de mayor tamaño para poder apoyar la realización de un estudio de trombofilias completo al enfrentar una paciente con infertilidad de causa desconocida. Por el momento sólo podemos sugerir el estudio de estas condiciones en pacientes en las que además de infertilidad de causa no conocida hay una historia familiar o personal de trombosis sin explicación.
Rol de las trombofilias en FIV fallidasDurante los últimos 25 años se han logrado grandes avances respecto de los protocolos hormonales de estimulación ovárica, mejorando la calidad de los embriones que hoy se transfieren en ciclos de fertilización in vitro o ICSI. Sin embargo, estos avances no han logrado mejorar la tasa de implantación en estos procedimientos. Hoy en día son las bajas tasas de implantación las que han frenado el progreso en los ciclos de FIV/ICSI. Se estima que no más del 15% de los embriones transferidos se implantarán, en comparación con la tasa de implantación en una concepción natural, que es de un 20% (3). La falla recurrente de implantación es hoy en día la principal causa por la que las mujeres deban completar varios ciclos de FIV/ICSI sin lograr embarazo. Esta situación, probablemente explicaría casos de infertilidad desconocida, en los cuales la falla de implantación ocurre previo a la detección clínica de embarazo. Más aún, algunos in vestigadores creen que el aborto recurrente de causa desconocida podría compartir las causas que se describen para este grupo (22). Los posibles mecanismos que se han postulado para explicar este defecto implantacional involucran causas genéticas, hormonales, inmunológicas como también trombofilias, tanto hereditarias como adquiridas.
La asociación entre trombofilias y falla implantacional en ciclos de FIV/ICSI ha sido sugerida luego de estudios que demuestran una mayor prevalencia de trombofilias en grupos de pacientes sometidas a estos procedimientos. En al año 2000, Glueck y cols describen el caso de un paciente sometida a 10 procedimientos de FIV, logrando 1 recién nacido vivo, en la cual se demostró portación de 2 defectos trombofílicos: Polimorfismo PAI-I 4G–4G y déficit de proteína S (23). Posteriormente, en el año 2001, Grandone y cols compararon la prevalencia de las mutaciones del factor V de Leiden y de la protrombina G20210A en un grupo de 18 pacientes con antecedentes de fracaso de FIV luego de 3 ciclos con un grupo de 24 pacientes que tuvieron éxito luego del primer ciclo y un tercer grupo de 214 mujeres que concibieron en forma espontánea. Los resultados demostraron un 27% de trombofilias en total en el grupo de 3 FIV fallidos, 6% en el grupo de embarazo espontáneo y 0 en el grupo que logró embarazo luego de un ciclo de FIV (24). Otro estudio que apoya la relación entre trombofilias y falla implantacional es el realizado el 2008 por Bellver y cols en el cual se comparó un grupo de 26 pacientes con falla implantacional con 32 pacientes fértiles. La mayor prevalencia de resistencia a la proteína C en el grupo en estudio fue estadísticamente significativa, observándose también una tendencia en cuanto a la mayor prevalencia de anticoagulante lúpico en el grupo de falla implantacional (18).
La mayor cohorte de pacientes en las que se estudió la prevalencia de trombofilias en pacientes sometidas a FIV/ICSI fue reunida por el grupo de Martinelli y cols el año 2003. En dicho estudio se reunieron 234 pacientes que tuvieron al menos un ciclo de FIV/ICSI comparándose con un grupo de 234 pacientes que concibieron en forma natural. Las mutaciones del factor V de Leiden, Protrombina G20210A y MTHFR C677T demostraron tener una similar prevalencia en ambos grupos, con excepción de la mutación del factor V de Leiden que demostró una pequeña diferencia no estadísticamente significativa. Los autores argumentan que es posible que un número mayor de pacientes pudiese lograr significancia estadística (25). Sin embargo, al analizar en detalle la experiencia de Martinelli, podemos observar tres aspectos muy importantes a considerar: 1) Que en la cohorte de pacientes infértiles está conformada por una combinación de causas tan disímiles, como factor masculino y anormalidades ovulatorias o endometriosis, 2) El estudio abarca solo a 162 pacientes (se excluyen las que se embarazan) y, si bien, existe estratificación de las pacientes, según el número de ciclos fallidos, sólo el 3 % de las pacientes tenía antecedentes de 3 FIV fallidos y el 11% de 2 o más fracasos y 3) Sólo se estudian tres trombofilias. De esta forma, en nuestra opinión, este estudio no permite clarificar si las trombofilias son más frecuentes en pacientes con falla implantacional recurrente o en otras formas de infertilidad.
Más recientemente, el grupo de Azem y cols reunió 45 pacientes con historia de 4 o más fracasos en FIV/ICSI, comparándolas con un grupo de 44 mujeres con concepción espontánea y un grupo de 15 pacientes que lograron embarazo luego de 1 intento de FIV/ICSI. El grupo en estudio fue también separado según la causa de infertilidad (la infertilidad de causa desconocida dio cuenta del 47% del grupo en estudio). Las trombofilias estudiadas en este caso fueron las mutaciones de MTHFR homocigota, protrombina y factor V de Leiden, además de los déficit de proteína C, S y antitrombina III. Los resultados demuestran una prevalencia de trombofilia en el grupo estudiado de 44% versus un 18% en el grupo de concepción espontánea y un 20% en el grupo con un intento exitoso de FIV/ICSI. Lo interesante de este trabajo es que el grupo de infertilidad desconocida presentó una prevalencia de trombofilias de 62%. Los autores concluyen que existe una relación entre falla implantacional recurrente y trombofilias, especialmente en el grupo de infertilidad de causa desconocida (26).
Uno de los estudios más citados en relación a la asociación entre trombofilias y fracasos en ciclos de IVF/ICSI es el realizado por Qublan y cols el año 2006, en el cual 90 mujeres con historia de al menos 3 ciclos de IVF/ICSI fracasados fueron comparadas con 90 mujeres que lograron concebir luego del primer ciclo y 100 mujeres que concibieron en forma natural. Las trombofilias analizadas en ese caso fueron: mutación del factor V de Leiden, de protrombina y de MTHFR, deficiencias en factores S, C o antitrombina III y anticoagulante lúpico. Los grupos en estudio eran comparables en cuanto a las causas que motivaron la fertilización asistida. El 68,9% del grupo en estudio presentó al menos una trombofilia, comparado con el 25,6% y el 25% en los otros dos grupos respectivamente. Las trombofilias más frecuentes fueron mutación del factor V de Leiden y mutación de MTHFR. Otro punto interesante de dicho estudio fue que la combinación de 2 o más trombofilias se observó en el 35,6% en el grupo control versus el 4% y 3% en los otros 2 grupos (27). Muy recientemente, este mismo grupo evaluó el impacto de la intervención con heparina en 83 pacientes portadoras de al menos una trombofilia y con historia de 3 o más IVF fallidos. Las pacientes fueron randomizadas en 2 grupos: intervención con heparina de bajo peso molecular o placebo. Las tasas de implantación, de embarazo y de recién nacido vivo del grupo que recibió heparina fueron 20,9%, 31% y 23,8% respectivamente, en comparación con 6,1%, 9,6% y 2,8% que presentó el grupo control. Luego de esta experiencia los investigadores sugieren el uso de heparina en los casos de pacientes con trombofilia demostrada y fracasos repetidos en ciclos de reproducción asistida (28).
Existen otros estudios que apoyan la relación entre trombofilias combinadas y falla implantacional. Ejemplo de esto es lo presentado por el grupo de Coulam y cols el año 2006, respecto de la asociación de trombofilias combinadas en grupos de pacientes con fracasos frecuentes de IVF. En este caso, 42 pacientes con múltiples fracasos en ciclos de IVF/ICSI fueron comparadas con 20 pacientes fértiles. Además de encontrar un mayor prevalencia de mutación del PAI-I, los investigadores observaron una mayor prevalencia de trombofilias combinadas en el grupo en estudio, al compararlo con el grupo control (74% vs 20%) (29).
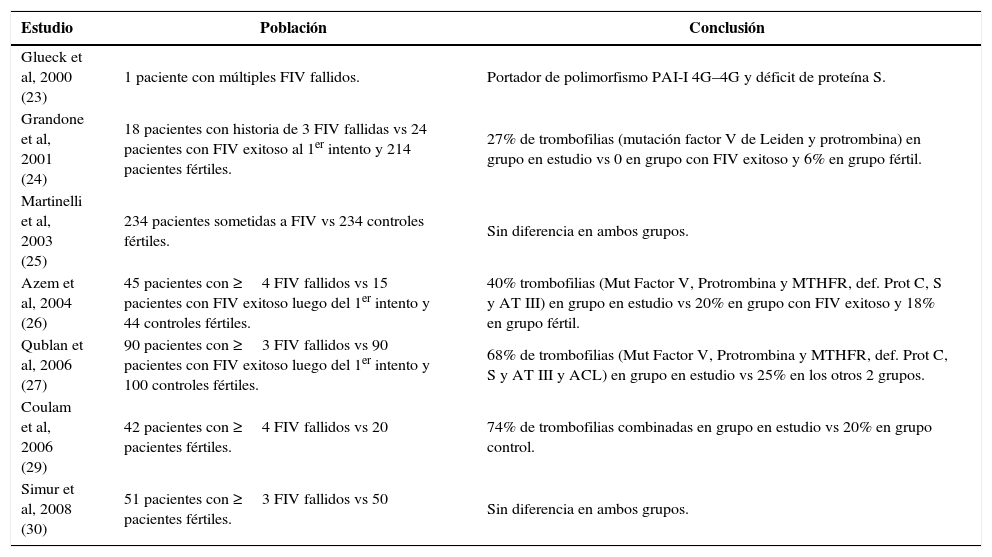
En oposición a lo anteriormente expuesto, el grupo de Simur y cols el año 2008, no encontró diferencias en la prevalencia de trombofilias, al comparar un grupo de 51 mujeres con historia de 3 o más ciclos de FIV/ICSI fallidos versus un grupo de 50 mujeres que concibieron en forma espontánea (30). Las trombofilias estudiadas en esa oportunidad fueron las mutaciones del factor V de Leiden, protrombina y MTHFR. En la Tabla 4 se puede observar la prevalencia de trombofilias en pacientes con falla implantacional descrita en los distintos estudios.
Resumen de trabajos que asocian falla implantacional y trombofilias
| Estudio | Población | Conclusión |
|---|---|---|
| Glueck et al, 2000 (23) | 1 paciente con múltiples FIV fallidos. | Portador de polimorfismo PAI-I 4G–4G y déficit de proteína S. |
| Grandone et al, 2001 (24) | 18 pacientes con historia de 3 FIV fallidas vs 24 pacientes con FIV exitoso al 1er intento y 214 pacientes fértiles. | 27% de trombofilias (mutación factor V de Leiden y protrombina) en grupo en estudio vs 0 en grupo con FIV exitoso y 6% en grupo fértil. |
| Martinelli et al, 2003 (25) | 234 pacientes sometidas a FIV vs 234 controles fértiles. | Sin diferencia en ambos grupos. |
| Azem et al, 2004 (26) | 45 pacientes con ≥4 FIV fallidos vs 15 pacientes con FIV exitoso luego del 1er intento y 44 controles fértiles. | 40% trombofilias (Mut Factor V, Protrombina y MTHFR, def. Prot C, S y AT III) en grupo en estudio vs 20% en grupo con FIV exitoso y 18% en grupo fértil. |
| Qublan et al, 2006 (27) | 90 pacientes con ≥3 FIV fallidos vs 90 pacientes con FIV exitoso luego del 1er intento y 100 controles fértiles. | 68% de trombofilias (Mut Factor V, Protrombina y MTHFR, def. Prot C, S y AT III y ACL) en grupo en estudio vs 25% en los otros 2 grupos. |
| Coulam et al, 2006 (29) | 42 pacientes con ≥4 FIV fallidos vs 20 pacientes fértiles. | 74% de trombofilias combinadas en grupo en estudio vs 20% en grupo control. |
| Simur et al, 2008 (30) | 51 pacientes con ≥3 FIV fallidos vs 50 pacientes fértiles. | Sin diferencia en ambos grupos. |
ICD: infertilidad de causa desconocida.
Intentando buscar una nueva perspectiva en el acercamiento del problema respecto de la relación entre trombofilias y falla implantacional el grupo de Rudick y cols, el año 2009, buscó el impacto que tenía la mutación del factor V de Leiden en 182 mujeres con infertilidad que ingresaron al programa de fertilización asistida. De las 182 mujeres estudiadas, se pesquisaron 3 pacientes con la mutación en cuestión. Sorprendentemente, al analizar los resultados luego de 1 ciclo de IVF/ICSI en ambos grupo se observó que el grupo portador de la mutación del factor V de Leiden presentó mejores tasas de implantación y una tendencia hacia una mejor tasa de embarazo. El bajo número de la muestra, sin embargo, dificulta la obtención de conclusiones con significancia estadística. Los investigadores concluyen que existe una asociación positiva entre la mutación del factor V de Leiden y embarazo y no recomiendan su pesquisa rutinaria en grupos sometidos a FIV/ICSI (31). En la Tabla 4 se puede observar el resumen de los trabajos que estudian la relación entre trombofilias y falla implantacional.
Existen múltiples estudios que han intentado aclarar la asociación entre trombofilias y falla implantacional en ciclos de IVF, sin embargo estos estudios carecen de homogeneidad en cuanto los grupos de estudio, ya que algunos no hacen diferencia respecto al número de ciclos fallidos, otros no separan según la causa que motiva la terapia de reproducción asistida y ninguno menciona si la transferencia se realiza con embriones congelados o frescos. Más aún, las trombofilias estudiadas difieren dependiendo del estudio. Tomando en cuenta esto, a excepción del estudio de Simur, si comparamos los grupos de pacientes con múltiples fallas en ciclos de IVF/ICSI, se logra observar una mayor prevalencia de trombofilias asiladas o combinadas en este grupo y sobretodo cuando la indicación del ciclo de tratamiento fue infertilidad de causa desconocida. Es por esto que consideramos adecuado el estudio de trombofilias en el grupo de pacientes con 3 o más fallas en ciclos de IVF. En vista de la evidencia expuesta, si bien preliminar (aunque de buen diseño), parece una opción razonable ofrecer a este grupo de pacientes tratamiento con heparina de bajo peso molecular durante el tratamiento de IVF/ICSI, con el objetivo de mejorar las tasas de implantación y embarazo (Tabla 4).
ConclusionesDel análisis de los trabajos expuestos se desprende que la relación entre trombofilias e infertilidad es difícil de abordar dado la baja prevalencia de estas condiciones. Por otro lado, los estudios que plantean esta relación son heterogéneos en su diseño y presentan una casuística limitada, lo que dificulta su comparación. Sin embargo, existe evidencia preliminar que apoya una asociación entre ciertas trombofilias y algunos problemas puntuales en relación a la pareja infértil. Esta asociación es más evidente en los casos de infertilidad de causa desconocida, en los casos de fracasos múltiples en terapias de FIV/ICSI y en el SHEO. Es por esto que nos parece adecuado el considerar el estudio de trombofilias en pacientes con infertilidad de causa desconocida, fracaso recurrente de FIV/ICSI y SHEO severo, como también ofrecer tromboprofilaxis en casos de estimulación ovárica en pacientes con trombofilias de alto poder trombogénico o en aquellas pacientes con antecedentes de trombosis venosa previa. El uso empírico rutinario de terapia anticoagulante en FIV/ICSI no es apoyado por la literatura.
Los autores declaran no tener conflictos de interés, en relación a este artículo.