El shock hemorrágico es la principal causa de muerte en el trauma, la principal causa de muertes potencialmente prevenible y una de las principales causas de muerte en la población menor de 44 años. La hemorragia masiva puede producir inestabilidad hemodinámica, disminución de la perfusión tisular, daño de órganos y muerte. Los principales objetivos de la resucitación son restaurar el volumen sanguíneo circulante y detener la hemorragia, mientras se activan los protocolos de manejo de la hemorragia masiva. Si bien el método óptimo de resucitación no ha sido claramente establecido, el uso de fluidos intravenosos y productos sanguíneos son elementos esenciales del manejo. Los defectos hemostáticos son frecuentes en la hemorragia masiva y evolucionan rápidamente. Se recomienda el uso precoz de plasma fresco congelado y plaquetas para prevenir el mecanismo dilucional de la coagulopatía, y el manejo agresivo de ésta una vez establecida. Finalmente, el manejo posterior a la emergencia incluye los cuidados intensivos para una monitorización estricta y el manejo de las eventuales complicaciones sistémicas, como la falla multiorgánica.
Hemorrhagic shock is the leading cause of death after injury, the major cause of potentially preventable deaths and one of the leading cause of death in young people. Massive hemorrhage may lead to hemodynamic instability, decreased tissue perfusion, organ damage, and death. The main goals of resuscitation are to restore circulating blood volume and to stop the source of hemorrhage, while the major hemorrhage protocols must be immediately declare. Although the optimal method of resuscitation has not been clearly established, the use of intravenous fluids and blood products are the key aspects of the management. The haemostatic defects are common in massive hemorrhage and trauma, and are likely to evolve rapidly. The early use of fresh frozen plasma and platelets is recommended to prevent the dilutional mechanism, and if the haemosthatic defect is established, it should be aggressively treated. Finally, further management includes intensive therapy to closely monitoring and management of any systemic complications, as multiorganic organ damage.
El shock hemorrágico es uno de los tipos más frecuentes de shock y una de las principales causas de muerte en pacientes quirúrgicos y en pacientes de trauma. A pesar de los avances en el conocimiento y manejo del sangrado masivo, el shock hemorrágico da cuenta de la mayoría de las muertes potencialmente prevenibles, del 80% de las muertes intraoperatorias y de la mitad de las muertes en el 1er día de hospitalización después de un trauma. A su vez, el trauma es la principal causa de muerte a edades entre 1 y 44 años (1-3).
El manejo del shock hemorrágico requiere una aproximación multidisciplinaria y un trabajo en equipo coordinado. La hemorragia masiva puede sobrepasar todos los mecanismos compensadores, llevando a la isquemia tisular, falla de órganos, isquemia miocárdica y muerte, siendo fundamental el Inmediato soporte vital para el buen resultado de la intervención. El presente artículo pretende entregar los conceptos básicos de fisiopatología y manejo del shock hemorrágico, con especial énfasis en las recomendaciones clínicas actuales y la necesidad de un enfrentamiento protocolizado.
DefinicionesEntendemos por shock aquel estado patológico de hipoperfusión tisular e hipoxia celular, caracterizado por el aporte insuficiente de oxígeno y otros sustratos metabólicos esenciales para la integridad celular y el adecuado funcionamiento de órganos vitales. En el shock hemorrágico la hipoxia celular es desencadenada por la hipovolemia secundaria a la hemorragia, con caída del retorno venoso y gasto cardiaco (GC). La mantención de este estado provocará una falla orgánica múltiple y shock irreversible de no mediar una oportuna y adecuada reanimación (4).
Aporte de oxígeno a los tejidos. El transporte de oxígeno (O2) desde la atmósfera hasta las células, para su utilización mitocondrial, requiere indemnidad de los sistemas respiratorios y cardiovasculares e indemnidad de la microcirculación, responsable del flujo sanguíneo capilar en las vecindades de la célula. El oxígeno se transporta principalmente unido a la hemoglobina (Hb), con una muy pequeña fracción disuelta en el plasma. La concentración de O2 arterial (CaO2) es de alrededor de 20ml de O2 por cada 100ml de sangre, y está determinada por la concentración de hemoglobina, la saturación arterial de O2 (SaO2) y la presión parcial arterial de O2 (PaO2), como lo muestra la ecuación I. El producto del CaO2 por el GC define el aporte de O2 a los tejidos o DO2 (ecuación II). Sólo un 20 a 30% del O2 aportado se capta para su utilización y consumo (ecuación III). El porcentaje de extracción de O2 (EXO2) es ajustable, pudiendo aumentar en casos de caída del DO2, como en casos de anemia o hipodébito, ambas presentes en el shock hemorrágico, siendo uno de los mecanismos compensadores para asegurar un consumo de O2 (VO2) constante (5). El miocardio, que en condiciones normales funciona con una alta tasa de EXO2 cercana al 80%, es la excepción a este principio.
Fases del shock hemorrágico. La hemorragia puede producir todos los grados de shock, desde disminuciones leves del GC hasta su caída total, con shock irreversible y muerte. Clínicamente, el shock hemorrágico puede subdividirse en diferentes fases: controlado, no controlado y progresivo-irreversible. En el shock controlado los mecanismos compensadores o la detención de la hemorragia se han logrado antes del colapso cardiovascular. En caso contrario estaremos en presencia de una fase no controlada de shock, definida por hipotensión (presión arterial sistólica 9<0mmHg) que persiste después de 10 minutos de estabilización y manejo inicial (intubación orotraqueal, aporte de fluidos y vasoactivos adrenérgicos) (6). El shock hemorrágico progresivo es aquel estado de vasoconstricción prolongada que finalmente se transforma en un shock vasodilatado, en el que participa la activación de canales de K+ sensibles a ATP, la liberación de óxido nítrico por la isoforma inducible y la depleción de los niveles de vasopresina (7).
La progresión del estado patológico conduce habitualmente al estado de shock mixto, frecuente en el trauma severo. Una vez que el colapso llega a un nivel crítico, independiente de su mecanismo inicial, “el propio shock produce shock”. La isquemia tisular de órganos nobles contribuye a una disminución mayor del GC y así un círculo vicioso que perpetúa y agrava el cuadro clínico. La disminución de la perfusión tisular explica el metabolismo celular anaeróbico y la mayor producción de ácido láctico con acidosis metabólica, depresión miocárdica y desarrollo de disfunción multiorgánica. El daño endotelial junto con la agregación celular deteriora la microcirculación, favorece la disfunción de órganos y puede conducir a coagulación intravascular diseminada. En casos avanzados se asocia una disfunción mitocondrial con dificultad en la utilización celular del O2, descrito primariamente en el shock séptico (8). El sistema circulatorio puede recuperarse si el grado de hemorragia no supera cierta cifra crítica. Superado este valor el sistema se vuelve irreversible (4).
Evaluación clínica y clasificación de la hemorragia. El volumen sanguíneo estimado promedio del adulto representa el 7% del peso corporal (o 70mL/kg de peso), lo que para un adulto de 70kg significa 5L. Los pacientes pediátricos tienen un volumen sanguíneo estimado de 8-9% del peso corporal, y los lactantes un 9-10% del peso. La estimación del volumen sangrado suele ser difícil y requiere integrar diferentes parámetros resumidos en la Tabla 1. Los signos clásicos de shock hemorrágico se hacen evidentes después de una pérdida sanguínea total de un 15 a un 20%, comenzando con una disminución del GC seguido por la disminución de la presión arterial media (PAM). El uso de sangre se hace necesario cuando el sangrado excede el 30% de la volemia (hemorragia clase III) (9). El diagnóstico de shock hemorrágico es clínico y suele ser evidente. La presencia de hipotensión arterial asociada a signos de hipoperfusión periférica y visceral certifican la sospecha (Tabla 2) (10). Una PAM inferior a 50mmHg se asocia a una caída del flujo sanguíneo a los distintos órganos. Los sistemas compensatorios logran mantener la presión arterial sistémica con pérdidas de hasta un 30 a 35%. Si la hemorragia supera esta magnitud, la compensación neuroendocrina es sobrepasada y la resucitación no logra la estabilización cardiovascular, se desencadena la fase no controlada o progresiva del shock hemorrágico. La disminución de la PAM disminuye la presión de perfusión coronaria y finalmente se produce isquemia miocárdica y paro cardiaco (6). De no mediar una intervención terapéutica, la probabilidad de sobrevida es baja con pérdidas hemáticas superiores a un 35-45% de la volemia.
Clasificación de la hemorragia
| CLASE | ||||
|---|---|---|---|---|
| PARÁMETRO | I | II | III | IV |
| Sangrado (ml) | 7<50 | 750−1500 | 1500−2000 | >2000 |
| Sangrado (%) | <5 | 15−30 | 30−40 | >40 |
| FC (lpm) | <100 | >100 | >120 | >140 |
| Presión arterial | Normal | Disminuida | Disminuida | Disminuída |
| FR (rpm) | 14−20 | 20−30 | 30−40 | >35 |
| Diuresis (ml/hr) | >30 | 20−30 | 5−15 | negativo |
| Síntomas SNC | Normal | Ansiedad | Confusión | Letargo |
| FC: frecuencia cardiaca; lpm: latidos por minuto; FR: frecuencia respiratoria; rpm: respiraciones por minuto; SNC: sistema nervioso central. | ||||
Indicadores de hipoperfusión
A) HIPOPERFUSIÓN GLOBAL:
|
B) HIPOPERFUSIÓN REGIONAL:
|
Sin intervención terapéutica, la sobrevida es poco probable con pérdidas hemáticas superiores a un 35-45% de la volemia.
Mecanismos compensadores. La primera respuesta a la pérdida sanguínea es un intento de formación de un coágulo en el sitio de la hemorragia. A medida que la hemorragia progresa se desencadena una respuesta de estrés que produce vasoconstricción de arteriolas y arterias musculares y aumento de la frecuencia cardiaca, buscando mantener la presión de perfusión y el gasto cardiaco. Esta respuesta neuroendocrina de estrés es caracterizada por la activación de tres ejes fisiológicos, relacionados entre sí de manera amplia y compleja: El sistema nervioso simpático, la secreción de vasopresina por la neurohipófisis y la estimulación del eje renina-angiotensina-aldosterona (RAA).
Los reflejos simpáticos son estimulados con la pérdida de sangre a través de baroreceptores arteriales y cardiopulmonares. La respuesta se produce dentro de 30 segundos de iniciada la hemorragia. El aumento de la frecuencia cardíaca ayuda a mantener el GC y la vasoconstricción intensa mantiene la presión arterial debido al aumento de la resistencia vascular sistémica, siendo especialmente intensa en piel, vísceras y riñón. Hay venoconstricción refleja que ayuda a mantener las presiones de llenado. La vasoconstricción no compromete la circulación coronaria ni cerebral debido a la eficiente autoregulación local de corazón y cerebro, que logra mantener el flujo sanguíneo a estos órganos si se mantiene una PAM superior a 60 ó 70mmHg. La circulación placentaria es también un lecho con escasa respuesta vasoconstrictora (4, 11).
La activación del eje RAA mantiene la vasoconstricción sistémica. El riñón experimenta una caída del flujo sanguíneo renal con disminución de la filtración glomerular y retención de agua y sodio. La pituitaria posterior libera vasopresina, que además de conservar agua a nivel renal, es un potente vasoconstrictor. En dosis superiores a las necesarias para efecto antidiurético la vasopresina actúa como un vasoconstrictor periférico no adrenérgico, estimulando directamente el receptor V1 del músculo liso (11).
La adenohipófisis secreta ACTH, que junto con angiotensina estimula la secreción de aldosterona por la corteza adrenal. Vasopresina y aldosterona preservan sodio y agua a nivel renal, lo que toma 30 minutos en tener efecto. El sistema respiratorio responde con hiperventilación secundaria a la anemia, hipoxia y acidosis metabólica. Los sistemas compensatorios a largo plazo se resumen en movimiento de albúmina hacia los capilares, aumento de la secreción proteica hepática y estimulación de la eritropoyesis (11).
En la paciente embarazada las dos principales causas de shock hemorrágico son la hemorragia obstétrica y el trauma. La hemorragia obstétrica persiste como un problema relevante a pesar de la disminución en la mortalidad materna de las últimas décadas, y el trauma es la principal causa de muerte en mujeres jóvenes, dando cuenta del 20% de las muertes maternas de causa no obstétrica. Los cambios anatómicos y fisiológicos del embarazo pueden alterar la evaluación clínica inicial y el manejo de la paciente. Las causas más importantes de hemorragia obstétrica por su gravedad son placenta previa, desprendimiento de placenta normoinserta, rotura uterina, adherencia anormal de placenta, inercia uterina y traumatismo obstétrico. Considerando el riesgo inminente del binomio materno-fetal, toda hemorragia anteparto o intraparto debe ser inmediatamente evaluada, estableciendo en forma oportuna el diagnóstico y manejo definitivo (12-15).
Manejo del shock hemorrágicoLa sobrevida del paciente con shock hemorrágico depende del tiempo que ha permanecido en shock, de forma análoga a lo descrito para paciente con sepsis y shock séptico (16), para lo que se han sugerido diferentes estrategias de manejo (2, 17). Los objetivos de la reanimación circulatoria serán:
1) Restaurar de forma inmediata el volumen sanguíneo circulante con adecuada capacidad de transporte de O2 y
2) El tratamiento definitivo de la causa, detener la hemorragia (18, 19). Para el primer objetivo, se ha utilizado tradicionalmente el aporte agresivo de fluidos intravenosos para lograr la pronta restauración de la perfusión tisular. Si bien esto ha permitido salvar muchas vidas, en ciertos casos el manejo es más complejo y controvertido (3, 6). Actualmente parece ser que pacientes con hipotensión moderada se podrían beneficiar de una reanimación con fluidos “controlada”, retardando el aporte agresivo de líquidos hasta lograr la hemostasia quirúrgica. La resucitación excesiva con fluidos antes de la hemostasia quirúrgica podría aumentar aún más el sangrado y ensombrecer el pronóstico (9). Se ha sugerido reanimar con fluidos hasta lograr un pulso radial palpable, descartado el traumatismo cerebral asociado en que se recomienda presiones sistólicas sobre 110mmHg. Si bien algunos pacientes en hemorragia masiva pueden exsanguinarse inmediatamente, otros podrían disminuir el sangrado transitoriamente, dando tiempo a la solución quirúrgica definitiva. A diferencia, en pacientes en shock hemorrágico severo en que la hemorragia es masiva, no controlada y eventualmente exsanguinante, el uso precoz y agresivo de sangre, plasma fresco congelado (PFC), plaquetas y cristaloides/coloides es mandatorio (3).
Para el logro del segundo objetivo, la recomendación actual es realizar una cirugía precoz dirigida a controlar el sangrado en forma transitoria. Dilatar la cirugía en espera de una solución definitiva aumentaría los riesgos de coagulopatía, acidosis e hipotermia, la llamada “triada letal” en el trauma (3).
Para el éxito de la reanimación del shock hemorrágico es fundamental el aspecto organizacional, lo que incluye disponer de protocolos de acción en cada centro asistencial, que definan los roles de cada miembro del equipo médico y las pautas a seguir frente a la emergencia (2). Deberá haber un jefe de equipo y se deberá contar con la participación de intensivistas, anestesiólogos, cirujanos, radiólogo intervencionista, hematólogo, médicos obstetras y matronas en caso necesario, enfermeras y personal de colaboración debidamente entrenados, banco de sangre y laboratorio de urgencia.
El concepto de transfusión masiva es de limitada utilidad práctica. Arbitrariamente se define como la reposición de más de 1 - 1.5 volúmenes sanguíneos en forma aguda o dentro de las primeras 24 horas. Los altos volúmenes de transfusión tienen morbilidad propia, entre ellas la coagulopatía secundaria, alteraciones del potasio plasmático y trastornos ácido-base, respuesta inflamatoria sistémica, hipotermia e intoxicación por citrato, entre otras.
Alto riesgo de shock hemorrágico. Existen cuatro condiciones clínicas que alertan sobre el alto riesgo de hemorragia masiva y shock hemorrágico:
- •
Pacientes que serán intervenidos de cirugía mayor con grandes pérdidas de volumen (cirugía hepática, gran cirugía traumatológica y de ortopedia, cirugía cardiaca y vascular mayor, neurocirugía, etc).
- •
Pacientes obstétricas (especialmente el diagnóstico prenatal de acretismo placentario).
- •
Pacientes que han sufrido un trauma y se avisa de su traslado al centro asistencial.
- •
Pacientes que serán intervenidos quirúrgicamente y que presenten una condición médica que afecte la coagulación (ejemplo: hemofilia).
En estas condiciones se alertará a todo el equipo médico involucrado y se activará preventivamente los protocolos de acción frente a la hemorragia masiva. A su vez, los pacientes serán inmediatamente monitorizados tomando todas las precauciones descritas.
Algoritmo de manejo (2) (Figura 1)A) Intervención inmediata. Si se recibe un paciente traumático sin previo aviso, las acciones inmediatas a seguir serán:
- •
Detener mediante la hemorragia externa, mediante compresión, torniquetes o chalecos hemostáticos (antishock).
- •
Evaluar al paciente y tratar.
- •
Gatillar los protocolos de acción frente a la hemorragia masiva.
- •
Pasar al siguiente nivel de cuidados médicos.
Si enfrentamos a un paciente en paro cardiaco secundario a shock hemorrágico, la estrategia inicial será la resucitación cardiopulmonar (20, 21) junto al control inmediato de la hemorragia y la resucitación circulatoria. Si el paciente está conciente y tiene pulso periférico palpable la presión arterial es adecuada. Asegurada la oxigenación con FiO2 alta y adecuada ventilación, el traslado inmediato a un centro de trauma para el control de la hemorragia junto a la resucitación agresiva con fluidos intravenosos y la transfusión de productos sanguíneos, son los elementos claves para limitar al máximo el tiempo de isquemia tisular y mejorar la sobrevida de estos pacientes.
B)Manejo y estabilización inicialAccesos venosos. La pronta obtención de accesos de gran calibre, periféricos o centrales, son condición esencial e imprescindible para el éxito de la reanimación, para lo cual uno o dos miembros del equipo de emergencia deberán buscarlos de inmediato. Al menos dos accesos periféricos 16G, o idealmente 14G, de preferencia en la extremidad superior. Los catéteres centrales (vía yugular interna o subclavia) de gran calibre, 8 Fr, son la condición ideal en la reanimación. Su limitación es que requiere un médico altamente entrenado, toma más tiempo que el acceso periférico y tiene riesgo de complicaciones graves. Como alternativa a los accesos periféricos son el acceso por vena yugular externa (punción de baja complicación y en ocasiones bastante rápida de obtener) y el acceso femoral con técnica de Seldinger. Si aún no se consiguen accesos venosos se puede recurrir a una denudación quirúrgica femoral de urgencia o eventualmente un acceso intraóseo (este último de menor frecuencia de uso en el shock hemorrágico del adulto).
Toma de exámenes e inicio de la reposición de volumen.Inmediatamente puesta la vía venosa, se debe obtener muestras sanguíneas para exámenes de laboratorio de urgencia, entre ellos: clasificación de grupo y Rh con pruebas cruzadas, hemograma, hematocrito (Hto) y Hemoglobina (Hb), recuento de plaquetas, tiempo de protrombina (TP) y de tromboplastina parcial (TTPK), fibrinógeno, recuento de leucocitos, función hepática y electrolitograma (ELP). Una muestra de gases arteriales (GSA) es esencial para descartar acidosis metabólica y cuantificar la función ventilatoria. La toma de muestra no debe dilatar la inmediata administración de líquidos intravenosos. El Hto-Hb es un mal indicador de pérdida sanguínea en la fase aguda, con estabilización de su valor entre 4 a 48 horas después de producida la hemorragia.
Monitorización. La monitorización básica consiste en un monitor electrocardiográfico (ECG), presión arterial no invasiva (PANI), pulsioximetría (SpO2) y catéter vesical para débito urinario. Si se dispone de los recursos necesarios, se recomienda instalar una línea arterial para presión arterial continua y toma de exámenes tan pronto como sea posible, sin interrumpir las maniobras de estabilización. Se puede utilizar un teflón 20G en arteria radial o humeral, o un catéter por Seldinger en arteria femoral.
Reanimación con fluidos. En una hemorragia masiva las prioridades son restaurar el volumen sanguíneo circulante y la concentración de hemoglobina. Es importante restablecer la perfusión de órganos, pero no es necesario lograr una PAM normal en esta etapa. Si la hemorragia es exsanguinante, se debe administrar de inmediato sangre de banco de stock grupo 0 Rh-negativo, sin esperar pruebas cruzadas. Si la condición clínica lo permite, se transfundirá sangre después de realizada las pruebas cruzadas. En la hemorragia masiva se recomienda la administración precoz y balanceada de glóbulos rojos/sangre total, PFC y plaquetas (3).
Una unidad de sangre contiene un volumen de 500ml con un 40% de Hto, y una de glóbulos rojos contiene 300ml con un Hto de 70%. Ambas poseen una capacidad equivalente de mejorar el transporte de O2. La transfusión se iniciará con 2 unidades de concentrado de glóbulos rojos en casos de pérdida sanguínea menor a 1500ml, pues se evita la administración de mediadores de la respuesta inflamatoria presentes en el plasma. Son de gran utilidad los equipos de infusión rápida, que permiten administrar líquidos entibiados a 37 grados en flujos de hasta 600ml por minuto a través de un acceso periférico 14G. Todas las preparaciones de hemoderivados se deben administrar con filtros de macrogoteo, que disminuyen la probabilidad de reacciones febriles transfusionales y daño pulmonar.
Junto al uso de sangre, la mantención de la volemia se logrará con el aporte agresivo de soluciones cristaloides y/o coloidales guiado por la condición clínica del paciente. A modo orientativo, se comienza de inmediato con 20 a 40ml/kg de peso de cristaloides tratando de lograr una PAM de 60 ó 70mmHg. Es habitual reponer cristaloides y coloides en una relación de 2 - 3 : 1, en forma paralela a la transfusión de hemoderivados tanto como sea necesario. Se repondrá 3ml de cristaloides por cada ml de pérdida hemática estimada. Actualmente no se ha demostrado beneficio con el uso de coloides sobre cristaloides en pacientes traumáticos, por lo que en estos pacientes serán los cristaloides los fluidos altamente recomendados en la reanimación. (3, 22). Los cristaloides pueden ser cloruro de sodio 0.9%, solución Ringer/ Ringer-Lactato o solución cristaloide Plasmalyte®. El sodio es el principal componente osmóticamente activo. Se distribuyen en el espacio extracelular y no permanecen mucho tiempo en el vascular, sólo un 20% al cabo de una hora. Son de utilidad en la hemorragia aguda como primer recurso. Al mismo tiempo se infundirán soluciones coloidales, cuya capacidad de expandir el vascular es mayor que la de los cristaloides. Los coloides más usados son las gelatinas, almidón o Hidroxyethyl Starch (Voluven®), Dextrán® y albúmina humana. Los solutos osmóticamente activos son sustancias de mayor peso molecular y que permanecen en el vascular por más tiempo, 4 a 6 horas para las gelatinas y hasta 24 horas para el almidón al 6%. Presentan algunos efectos adversos, como reacciones anafilácticas o reacción antígeno-anticuerpo (gelatinas, albúmina, Dextrán®, almidón en menor grado), disfunción renal con alteración de la coagulación (Dextrán®) y riesgo de acumulación intravascular con volúmenes transfundidos excesivos (albúmina, almidón) (3, 18). En pacientes de trauma se ha utilizado con éxito las soluciones cristaloides hipertónicas con cloruro de sodio al 7.5%, cuya principal ventaja es expandir el vascular con volúmenes 3 a 4 veces superior al volumen infundido, debido al paso de líquido desde los espacios intersticial e intracelular hacia el vascular. El efecto adverso más temido es la mielinolisis central pontina (destrucción de Vaina de Mielina en el tronco del encéfalo). Se recomienda un volumen de 4mL por kilo de peso corporal (22, 23).
Capacidad de transporte de O2. El objetivo de la reanimación es mantener un adecuado DO2 que asegure el VO2 mínimo, y esto es posible con niveles bajos de Hb siempre que exista normovolemia, con adecuado GC, SaO2 y PaO2. En una condición de hipovolemia, el aporte insuficiente de O2 será por hipoperfusión más que por CaO2 disminuido. La anemia aguda normovolémica es bastante bien tolerada, no así la hipovolémica, que se asocia a bajo flujo y metabolismo anaeróbico. No hay un único valor de Hb como umbral para transfundir hemoderivados. La práctica clínica actual acepta un nivel de Hb entre 7-8g/dl en pacientes críticos sin evidencia de hipoxia tisular. Sin embargo, se recomienda mantener una Hb de 10g/dl en pacientes con sangrado activo, ancianos o pacientes en riesgo de isquemia miocárdica (9, 24). El nivel de hemoglobina no debiera ser el único parámetro en la decisión de transfusión, sino más bien priorizar los parámetros fisiológicos basados en signos y síntomas de mala oxigenación global (lactato sanguíneo y saturación de O2 en sangre venosa mixta) o regional (saturación regional de oxígeno cerebral, ECG) (25, 26).
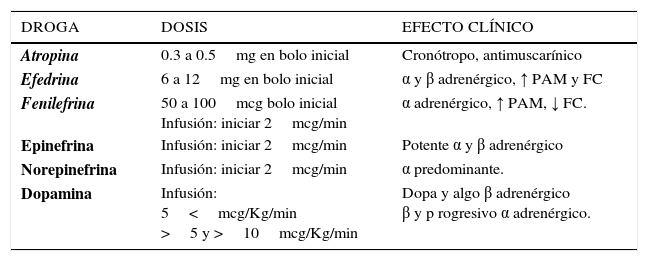
Drogas vasoactivas (DVA). El uso de DVA tiene su papel junto a la reposición inicial de fluidos. Usados complementariamente, las primeras ayudan a elevar la PAM mientras se da tiempo a los líquidos administrados a que normalicen la volemia. En el contexto de una hemorragias exsanguinantes o masivas, con paro cardiaco inminente, los vasopresores se hacen imprescindibles con el objetivo de elevar presión de perfusión y mantener el flujo a órganos nobles como corazón y cerebro (19). Los fármacos más usados en esta etapa, administrados en bolos intravenosos, son adrenalina, atropina, efedrina y fenilefrina. La primera aproximación es usar fármacos en bolos intravenosos y titular la respuesta. Si no se logra elevar la PAM con el aporte de fluidos será necesaria la infusión continua de un vasoactivo con efecto alfa predominante (como noradrenalina, en ocasiones asociado a adrenalina), y disminuir sus dosis de infusión tan pronto como la presión arterial lo permita, para limitar la hipoperfusión e isquemia tisular con desarrollo de disfunción multiorgánica posterior. En pacientes de trauma no se recomienda el uso de vasopresores en la etapa precoz de la reanimación (22). Sus dosis y efectos se resumen en la Tabla 3. En los últimos años se ha utilizado como droga vasoconstrictora los análogos de vasopresina, arginina vasopresina y terlipresina, especialmente en casos de shock hemorrágico no controlado (6, 27). Su uso se basa en la amplificación farmacológica de la respuesta neuroendocrina de estrés. Debido a la distribución de sus receptores, la vasoconstricción es menos intensa en corazón, pulmón y cerebro. La evidencia actual no permite establecer guías para su utilización, considerándose un fármaco de rescate en el shock hemorrágico no controlado que no responde a la terapia convencional.
Vasoactivos en shock hipovolémico
| DROGA | DOSIS | EFECTO CLÍNICO |
|---|---|---|
| Atropina | 0.3 a 0.5mg en bolo inicial | Cronótropo, antimuscarínico |
| Efedrina | 6 a 12mg en bolo inicial | α y β adrenérgico, ↑ PAM y FC |
| Fenilefrina | 50 a 100mcg bolo inicial Infusión: iniciar 2mcg/min | α adrenérgico, ↑ PAM, ↓ FC. |
| Epinefrina | Infusión: iniciar 2mcg/min | Potente α y β adrenérgico |
| Norepinefrina | Infusión: iniciar 2mcg/min | α predominante. |
| Dopamina | Infusión: 5<mcg/Kg/min >5 y >10mcg/Kg/min | Dopa y algo β adrenérgico β y p rogresivo α adrenérgico. |
Detención definitiva del sangrado. Usualmente se logra con la intervención quirúrgica de urgencia, dirigida a detener el sangrado en forma estable más que a una cirugía definitiva (3). La embolización de la arteria sangrante guiado por angiografía es una alternativa a la cirugía en casos particulares. Puede detener definitivamente el sangrado con la limitante de la disponibilidad del recurso. En situaciones de trauma severo o lesiones muy complejas, en que la cirugía no logra detener ni controlar el sangrado, se utilizará apoyo farmacológico para ayudar al control médico de la hemorragia, como se menciona posteriormente.
Herramientas de soporte. Se debe disponer de técnicas de imagen de urgencia con el apoyo del médico especialista para el diagnóstico, manejo y eventual resolución definitiva del sangrado. La ecocardiografía es de gran utilidad en el diagnóstico y manejo de pacientes en shock o con descompensación hemodinámica aguda de riesgo vital, ya sea mediante ecocardiografía de superficie (transtorácica) o transesofágica. Es aplicable en medicina de urgencia, cuidados intensivos y pabellón quirúrgico, con evaluación inmediata al “lado de la cama del enfermo” y sin necesidades de traslados. En forma no invasiva, o mínimamente invasiva, aporta una información rápida y muy completa del estado cardiovascular del paciente y permite conducir las maniobras de reanimación. Podemos obtener información acerca del estado de la volemia y descartar condiciones asociadas que deban ser diagnosticadas y tratadas oportunamente, como la presencia de taponamiento cardiaco, embolía pulmonar, infarto masivo y cualquier patología cardiaca severa subyacente. Su principal limitación es poder disponer del recurso, que incluye la máquina de ecocardiografía y el médico especialista entrenado en la técnica (28-30).
El uso de los recuperadores de sangre, Cell saver, han sido de gran utilidad en la disminución de la transfusión de sangre autóloga, permitiendo recuperar la sangre perdida para readministrarla al paciente luego del adecuado proceso de lavado y filtrado. Forma parte del manejo avanzado de pacientes quirúrgicos en centros especializados.
Prevención de hipotermia. Debe hacerse énfasis en la mantención de la normotermia, tanto como sea posible. Grados variados de hipotermia se asocian a efectos adversos y menor efectividad en la reanimación del shock hemorrágico. La coagulopatía asociada a hipotermia se explica por disfunción plaquetaria, menor actividad de los factores de coagulación e inducción de fibrinolisis (3, 31, 32). Los líquidos a administrar deben ser entibiados. El paciente debe ser cubierto con mantas de algodón fácilmente disponibles, elevar la temperatura del pabellón y, si es posible, utilizar medios de calentamiento activo como los métodos de convección (uso de aire a temperatura controlada).
Equilibrio Ácido-Base. El shock suele ir de la mano con grado variables de acidosis metabólica, frecuentemente inducida por el exceso de administración de NaCl e hipoperfusión. La acidosis potencialmente altera todos los procesos de la coagulación, plaquetas, factores, degradación de trombina, fibrinolisis. La mejor manera de evitarla o corregirla es asegurar la normovolemia y el DO2, normalizando el flujo sanguíneo a los tejidos. En casos de acidosis severa, con pH<7.2, se administrará bicarbonato de sodio, habitualmente 100 a 150 mEq. Las precauciones con la administración de bicarbonato son: Hipercapnia, hipocalemia, sobrecarga de volumen y sobre corrección de la acidosis. La hipocalcemia e hipomagnesemia se presentan con frecuencia en la transfusión masiva y deben ser monitorizadas y corregidas. La hipocalcemia se precipita por el efecto quelante del citrato utilizado en la sangre de banco como anticoagulante, especialmente con el uso de altas velocidades de transfusión. Se utiliza gluconato de calcio y sulfato de magnesio en dosis iniciales de 1g y 2g, respectivamente. Las altas velocidades de transfusión de sangre de banco también debe alertar sobre la producción de hipercalemia secundaria (2, 3).
Tromboprofilaxis. La tromboprofilaxis venosa estándar deberá iniciarse tan pronto como la hemostasia se haya normalizado y el sangrado haya sido controlado, dado que los pacientes desarrollan rápidamente un estado protrombótico posterior a la hemorragia masiva (2).
C)Reanimación en segunda etapa o avanzadaJunto con la estabilización inicial, el paciente deberá ser reevaluado permanentemente en forma clínica y de laboratorio. Es importante el color de la piel, frecuencia cardiaca, PAM, llene capilar, diuresis y nivel de conciencia. El objetivo será restablecer la perfusión de órganos, normalizar la presión arterial, la oxigenación, el estado ácido-base y la temperatura. Se requerirá el calentamiento activo para evitar y corregir la hipotermia. La coagulopatía secundaria debe ser anticipada, prevenida y corregida agresivamente. El riesgo de que los pacientes con shock hemorrágico desarrollen una disfunción multiorgánica es alta y está directamente relacionada al grado y duración de la hipoperfusión e isquemia tisular, así como también deberá vigilarse la evolución del shock hemorrágico a estados de shock mixto o shock séptico (33). En esta fase los pacientes deberán ser trasladados a una unidad de cuidados críticos para su observación estricta, monitorización invasiva y manejo multidisciplinario.
Coagulopatía en hemorragia masivaLa coagulopatía en el shock hemorrágico es multicausal, evoluciona rápidamente y su manejo debe ser guiado por la condición clínica y los exámenes de laboratorio. Existe al menos dos mecanismos de producción, la coagulopatía dilucional y la coagulopatía de consumo. La injuria tisular, la hipoperfusión, hipotermia y acidosis agravan el cuadro (3). El factor dilucional compromete las plaquetas circulantes y los factores de coagulación.
Se produce después de altos volúmenes de infusión, especialmente con el uso de concentrado de glóbulos rojos, cristaloides y coloides, e insuficiente transfusión de PFC y plaquetas. La coagulopatía de consumo debe sospecharse en pacientes obstétricas con desprendimiento de placenta, politraumatizados, en el contexto de sepsis y en bypass cardiopulmonar prolongado en cirugía cardiaca. Estos pacientes podrán tener diátesis hemorrágica en ausencia de factor dilucional. Puede haber activación de las vías anticoagulantes, disfunción plaquetaria e hiperfrinolisis.
Pruebas de laboratorio. Los niveles de fibrinógeno (de Clauss) 1<g/L o TP/TTPK >1,5 veces el valor normal diagnostican una falla hemostática y son predictivos de sangrado microvascular. Los niveles de fibrinógeno son más sensibles que el TP/TTPK para el diagnóstico de coagulopatía dilucional. En hemorragia masiva se requiere corregir a niveles superiores a 1,5g/L. Un recuento plaquetario de 50 mil se asocia a sangrado microvascular. Debe mantenerse niveles >75mil plaquetas/mm3. El TP es un examen poco sensible en la hemorragia masiva. Usualmente se corrige dentro de 1,5 veces su valor normal. El INR tampoco es un examen adecuado en la hemorragia masiva. El TTPK se recomienda mantenerlo en valores bajo 1,5 veces el valor normal. Las pruebas de laboratorio de hemostasia y recuentos celulares debe repetirse cada hora en casos de hemorragia no controlada. Aún así, la presencia de sangrado microvascular y diátesis clínica es un marcador de falla hemostática independiente del laboratorio y debe ser tratada agresivamente (2).
Prevención. La evidencia actual apoya el uso precoz de PFC y plaquetas en la hemorragia masiva para evitar la coagulopatía dilucional (2, 3, 34, 35). Si un médico experimentado anticipa un sangrado de más de 1 volemia se recomienda transfundir PFC en dosis de 15ml/kg sin retardo, requiriéndose dosis mayores según evaluación clínica. A su vez, un recuento plaquetario de 75 mil se considera adecuado en este escenario. Luego de la transfusión de más de una volemia queda el 35 a 40% de las plaquetas circulantes, y luego de 1.5 volemias la trombocitopenia severa se manifestará con coagulopatía clínica de no mediar la transfusión (2).
Tratamiento. En el contexto de shock hemorrágico asociado a coagulopatía clínica o exámenes que demuestren hemostasia alterada (fibrinógeno 1<g/l o TP/TTPK >1,5 veces el valor normal), se deberá infundir PFC en dosis más altas, al menos 30mL/kg como primera línea, asociado a crioprecipitados. Se transfundirá plaquetas (1 unidad / 10kg peso) para mantener en un recuento de al menos 75 mil. Se debe monitorizar constantemente: TP, TTPK, recuento de plaquetas, y ELP (2).
Se utilizará ácido tranexámico como antifibrinolítico ante la sospecha de hiperfibrinolisis, frecuentemente asociada a los pacientes de trauma, hemorragia obstétrica y cirugía mayor. La fibrinolisis acelerada puede identificarse por laboratorio mediante el dímero-d o productos de degradación del fibrinógeno. Otros métodos, como la tromboleastografía, son de limitada disponibilidad. Se utilizará ácido tranexámico en dosis de 1g administrado en 10 min, seguido de 1g cada 8hrs. No se utiliza en pacientes con hemorragia subaracnoidea (2).
En la última década se ha introducido en la clínica el Factor VII activado recombinante (rFVIIa), utilizado con éxito en el tratamiento de la hemorragia masiva que no responde al tratamiento convencional (2, 35, 36). Se debe considerar su uso en cada caso particular en condiciones de hemorragia no controlada y riesgo vital. Es habitualmente administrado junto al ácido tranexámico. Para aumentar la eficacia del rFVIIa se recomienda: Hto >24% (un Hto bajo contribuye a la coagulopatía) (3); plaquetas >50mil/mm3; corregir acidosis (pH ≥ 7,2); fibrinógeno >1g/L; evitar hipotermia. Dosis de 60 - 120mcg/kg parecen ser suficientes. Su principal complicación es la trombosis arterial.
Otros fármacos. Los concentrados de factores de coagulación suelen ser guiados por hematología ante pacientes con déficit congénitos de factores, como los casos de hemofilia o enfermedad de von Willebrand. En pacientes que reciban drogas que interfieran con la coagulación, se corregirá específicamente el efecto de cada fármaco. El efecto warfarina se revertirá con concentrado de complejo protrombínico (si está disponible) o con PFC más vitamina K iv en dosis de 5 a 10mg. La heparina estándar se revertirá con protamina, comenzando con 25 a 50mg (1mg de protamina revierte 100 U de heparina). La heparina de bajo peso molecular es sólo parcialmente revertida con heparina, y los nuevo inhibidores directos de la trombina y factor Xa (fondaparinux) no pueden ser revertidos. El uso profiláctico de aspirina se asocia a bajo riesgo de sangrado, y su efecto puede revertirse con transfusión de plaquetas. A diferencia de la aspirina, el uso de P2Y12 antagonistas, clopidrogel, se asocia a un alto riesgo de sangrado y es sólo parcialmente revertido con plaquetas (2).
ComentariosEl shock hemorrágico continúa siendo una causa importante de muerte, especialmente en gente joven.
Su gravedad requiere de un enfoque institucional protocolizado y multidisciplinario.
Si bien el mecanismo inicial es fácilmente identificable, la hemorragia masiva se transforma rápidamente en una injuria sistémica.
Los objetivos de la reanimación son la pronta detención del sangrado y la restitución del volumen sanguíneo circulante, disminuyendo el tiempo de isquemia tisular, el compromiso multiorgánico y el riesgo de muerte. Una vez lograda la estabilización inicial, el pronto traslado del paciente a un centro especializado, es esencial para el manejo definitivo y la mejoría del pronóstico.
La práctica clínica acepta un nivel de Hb entre 7-8g/dl en pacientes críticos sin evidencia de hipoxia tisular. Sin embargo, se recomienda mantener una Hb de 10 g/dl en pacientes con sangrado activo, ancianos o pacientes en riesgo de isquemia miocárdica.
Se recomienda el uso precoz de plasma fresco congelado y plaquetas frente a la hemorragia masiva para disminuir el riesgo de coagulopatía dilucional.
El manejo de la coagulopatía secundaria requiere una continua evaluación clínica y de laboratorio. Su manejo debe ser agresivo, con reposición de productos sanguíneos hasta lograr mejoría clínica y de laboratorio. Se debe mantener un recuento de plaquetas de 75mil/mm3, TP/TTPK en niveles menores a 1,5 veces el valor normal y niveles de fibrinógeno de al menos 1,5g/dl.
En la hemorragia sanguínea no controlada y de riesgo vital se considerará el uso de rFVIIa para el control médico de la hemorragia.
El éxito de las maniobras de resucitación dependerán del tipo de injuria y estado del paciente, el tiempo de hipoperfusión tisular y de la inmediata aplicación del protocolo de acción frente a la hemorragia masiva.
El autor declara no tener conflictos de interés, en relación a este artículo.