El Síndrome Hepatorenal (SHR) es una insuficiencia renal aguda funcional y reversible, que se desarrolla en pacientes con cirrosis hepática descompensada o en insuficiencia hepática aguda severa. La característica principal del SHR es la intensa vasoconstricción renal causada por la interacción entre alteraciones hemodinámicas a nivel sistémico y portal. El aumento del volumen intravascular y un prolongado tratamiento con fármacos vasoconstrictores pueden revertir la falla renal en un porcentaje significativo de pacientes. El SHR Tipo 2, el más frecuente, generalmente presenta una evolución lenta y un mejor pronóstico que el SHR Tipo 1. La terapia vasoconstrictora con terlipresina asociado a albúmina es el tratamiento de elección en pacientes con SHR. A pesar del avance en las diferentes estrategias terapéuticas, el pronóstico a largo plazo es aún pobre y depende generalmente del grado de reversibilidad de la enfermedad hepática asociada o del acceso al trasplante hepático. En la presente revisión se discutirán los avances más recientes en el diagnóstico, patogénesis y tratamiento del SHR.
The Hepatorenal Syndrome (HRS) is a functional and reversible form of acute renal failure, which develops in decompensated cirrhosis or acute liver failure. The distinctive hallmark feature of HRS is the intense renal vasoconstriction caused by interactions between systemic and portal hemodynamics. Increasing intravascular volume and prolonged treatment with vasoconstrictors drugs reverses renal failure in a significant proportion of patients. Type 2HRS, the most frequent, generally follows a slower course and has a better prognosis than Type 1HRS. Vasopressor therapy with terlipressin plus intravenous albumin is the medical treatment of choice for patients with HRS. Despite improvements in the therapeutic strategies, long term prognosis is still poor and generally depends on the degree of reversibility of the underlying liver disease or access to liver transplantation. In the present review, the most recent advances in diagnosis, pathophysiology, and treatment of HRS are discussed.
El Síndrome Hepatorenal (SHR) es una causa funcional reversible de daño renal agudo o subagudo que ocurre principalmente en pacientes con cirrosis hepática y ascitis, aunque también ha sido descrito en pacientes con insuficiencia hepática aguda o hepatitis alcohólica (1). La anormalidad más importante en la circulación sistémica es la hipotensión arterial debido a una marcada disminución de la resistencia vascular sistémica total. El SHR se caracteriza por un deterioro de la función renal, hiperactividad de los sistemas nervioso simpático y renina-angio-tensina-aldosterona, lo que lleva a una severa vasoconstricción renal con una disminución de la velocidad de filtración glomerular.
El SHR ocurre en cerca del 5–10% de los pacientes cirróticos con ascitis hospitalizados (2). Un estudio prospectivo que incluyó 229 pacientes cirróticos con ascitis, mostró que este se desarrolló en un 18 y 39% de los pacientes a 1 y 5 años respectivamente, siendo el riesgo mayor en pacientes con hiponatremia y valores elevados de renina plasmática (3). La incidencia de SHR en pacientes con hepatitis alcohólica aguda severa e insuficiencia hepática aguda fulminante es de un 30 y 55% respectivamente (4, 5). La presencia de un SHR representa un mal pronóstico, con una mortalidad que puede alcanzar hasta un 90% a las 10 semanas y con una resolución espontánea que ocurre sólo en un 3.5% de los pacientes (3). La presencia de ascitis a tensión resistente a diuréticos, hiponatremia severa y coagulopatía deben ser considerados factores de riesgo del SHR (6). El score de enfermedad hepática en estadio final (del inglés, MELD) es un sistema de puntaje de severidad de enfermedad hepática crónica que utiliza exámenes de laboratorio (bilirrubina sérica, creatinina y protrombina) para predecir la sobrevida de estos pacientes. Estudios han señalado que en pacientes cirróticos con ascitis, el score de MELD es concordante con el riesgo de presentar un SHR, de tal manera que valores de MELD (Model for End Stage Liver Disease) > 18 deben ser considerados en el desarrollo de esta complicación (6).
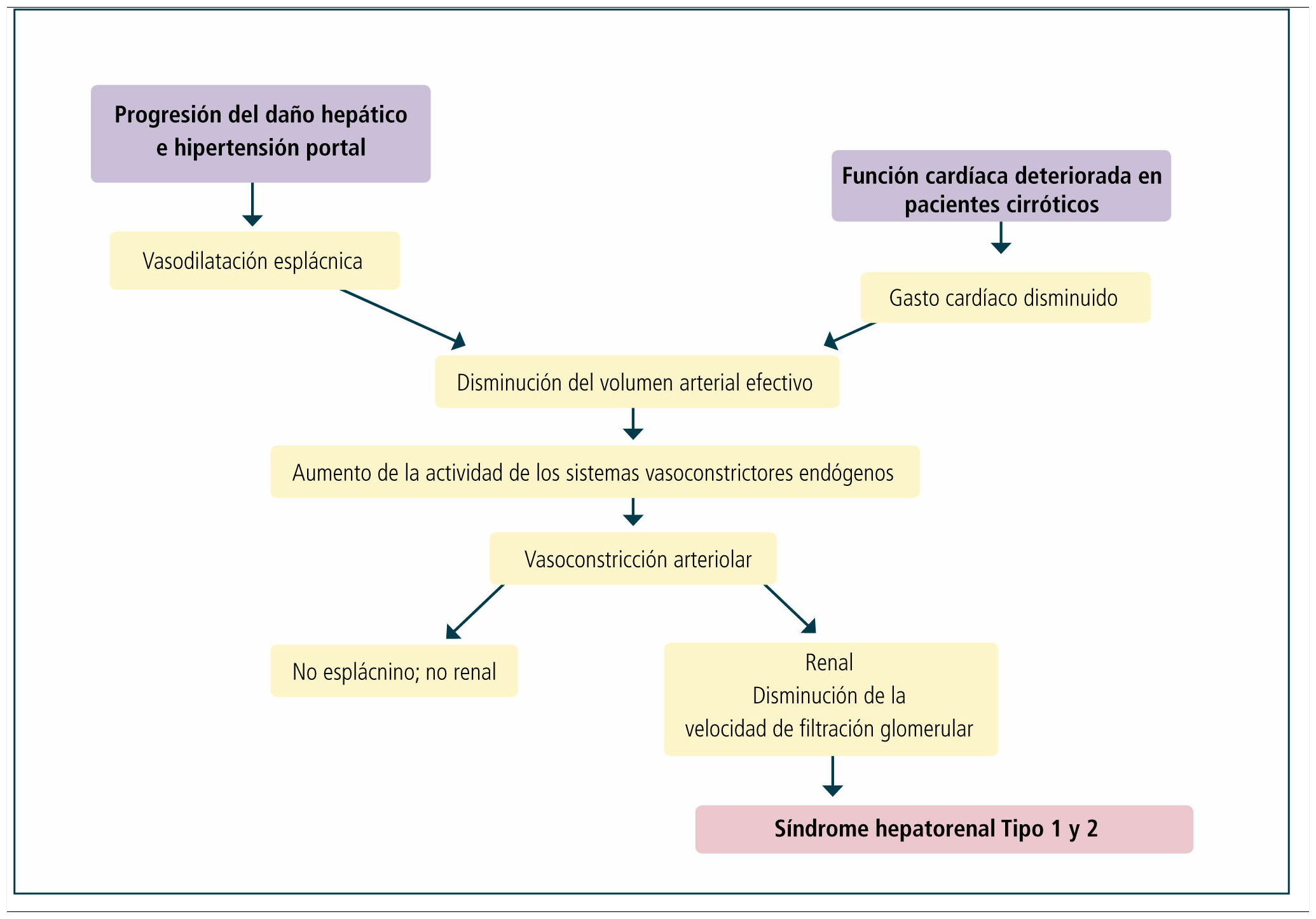
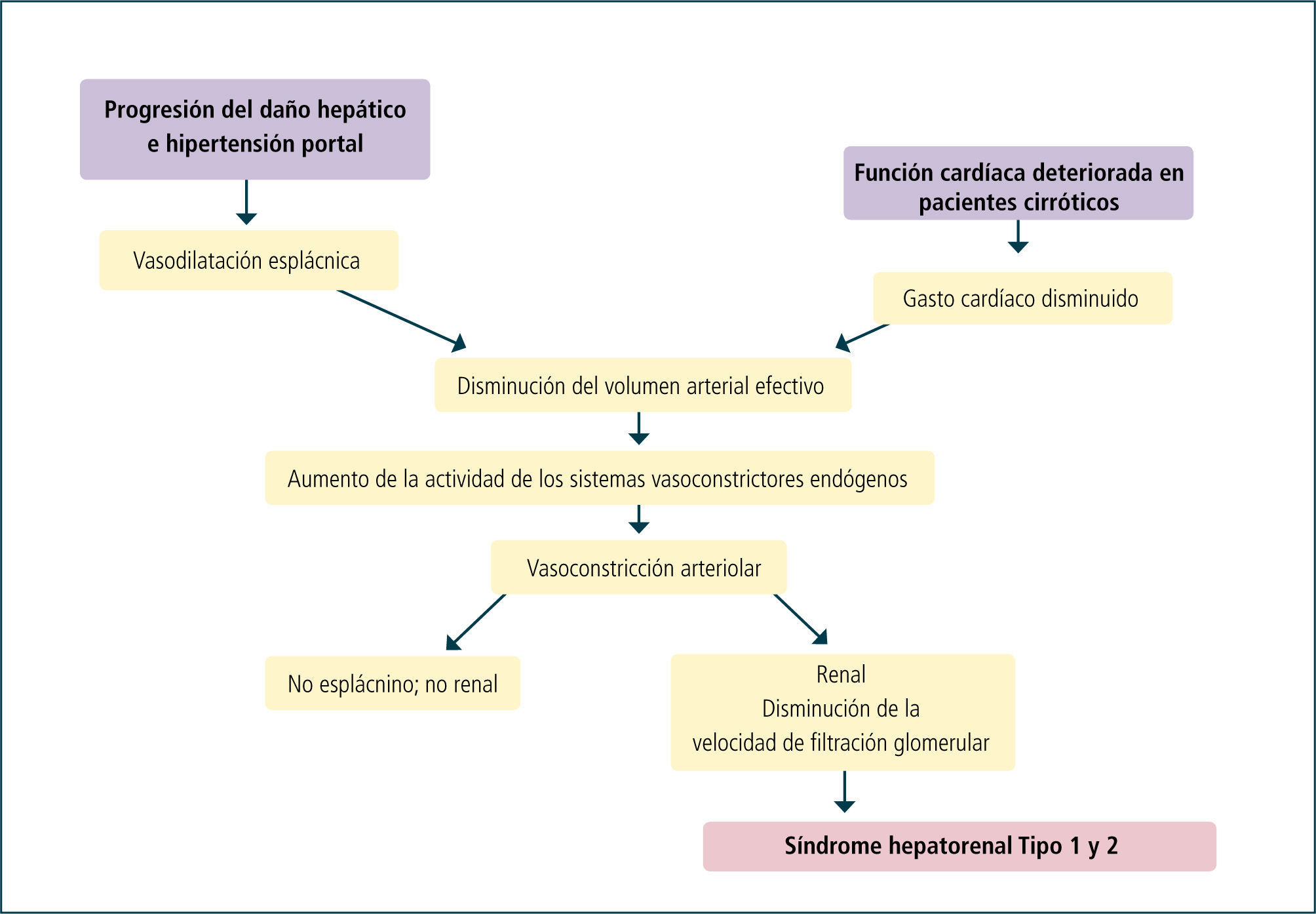
PatogénesisLa vasoconstricción renal es la alteración fisiopatológica más característica del SHR (1, 7). Sus mecanismos aún no son bien comprendidos, siendo probablemente multifactorial, donde destaca la presencia de alteraciones en la función cardiovascular y actividad de mecanismos vasoactivos sistémicos y renales. A nivel sistémico existe una severa hipotensión arterial, debido a la marcada vasodilatación a nivel de la circulación esplácnica, la cual está relacionada con la presencia de hipertensión portal sinusoidal. Por otra parte a nivel renal existe una marcada vasoconstricción.
La hipótesis de la vasodilatación arterial es la explicación más aceptada en la patogénesis del SHR (Tabla 1) (8). Esta teoría señala que el SHR es el resultado de sistemas vasoconstrictores (sistema nervioso simpático y sistema renina-angiotensina) que actúan sobre la circulación renal producto de una respuesta homeostática a la disminución de la presión a nivel arterial. Estudios han demostrado que esta hipotensión arterial es debida a la marcada vasodilatación en la circulación esplácnica, la que está relacionada con un aumento en la producción y liberación local de sustancias vasodilatadores, particularmente óxido nítrico, péptido relacionado con el gen de la calcitonina y endocanabinoides, dado por el estrés endotelial y posiblemente por la translocación bacteriana (9). Como resultado del aumento de la actividad de los sistemas vasoconstrictores, la perfusión renal y la filtración glomerular están disminuidas, aunque la función tubular es preservada por lo menos en los estadios iníciales. Esta vasoconstricción renal es potenciada por la disminución de los vasodilatadores locales, como lo evidencian los bajos niveles urinarios de prostaglandinas E2 y kalikreínas y aumento de los vasoconstrictores locales, como leucotrienos e isoprostanos (10, 11). La severa vasoconstricción no sólo afecta a la circulación renal, sino también a la circulación cerebral, intestinal y de las extremidades (12, 13). La disminución de la función cardiaca, principalmente en pacientes con SHR tipo 1, también contribuye a una disminución de la presión arterial (14). Adicionalmente en fases tardías se estimula el sistema arginina-vasopresina, lo que lleva a retención de agua y por lo tanto a una hiponatremia dilucional.
Aunque en el SHR existe una disfunción renal sin daño histológico, estudios han mostrado algunos cambios en la estructura renal como expansión mesangial, adelgazamiento de la pared glomerular, depósito de material electrodenso en la pared capilar y reflujo tubuloglomerular. Sin embargo, estas alteraciones son inespecíficas en el SHR y se han descrito en cuadros de hipotensión arterial e isquemia, entre otros.
Cuadro clínicoGeneralmente el SHR ocurre en estadios finales de la cirrosis hepática cuando estos pacientes han desarrollado alguna de las complicaciones como la presencia de ascitis. En este grupo de pacientes se ha señalado que la presencia de una marcada retención renal de sodio e hiponatremia, son factores de riesgo en el desarrollo de SHR (3). No existen características clínicas específicas del SHR, por lo que los pacientes que presenten esta complicación tendrán las características de una enfermedad hepática avanzada e hipertensión portal con eritema palmar, telangiectasias aracniformes, circulación venosa abdominal, ictericia, encefalopatía, ascitis, oliguria, hiperbilirrubinemia, disminución de la protrombina y trombocitopenia. La presencia de ascitis es una característica en todos los pacientes que desarrollan un SHR y su ausencia descarta a esta complicación como causa de una falla renal, siendo necesario evaluar otras etiologías (principalmente prerenal). Los pacientes con SHR presentarán además hipotensión arterial, taquicardia, aumento del débito cardiaco, oliguria (< 500ml/24 horas), retención de sodio urinario (Sodio urinario < 10mEq/L) e hiponatremia.
Factores precipitantesEl SHR se puede desarrollar espontáneamente o estar en relación a la presencia de factores que pueden afectar el sistema circulatorio como es el caso de las infecciones bacterianas, principalmente la peritonitis bacteriana espontánea y las paracentesis evacuadoras con volúmenes > a 5 litros sin expansión de plasma (albúmina) (15, 16). El SHR se ha descrito hasta en el 15% de los pacientes que se han realizado paracentesis evacuadoras sin reposición de albúmina. Las infecciones bacterianas, incluyendo la peritonitis bacteriana espontánea, precipitan aproximadamente el 20–30% de los SHR (15, 16). El desarrollo de falla renal es frecuente en pacientes cirróticos que presentan una hemorragia digestiva, sin embargo en estos casos, la insuficiencia renal está dada por la presencia de un factor prerenal o la presencia de necrosis tubular aguda (17). Algunas veces el daño hepático agudo, sobreimpuesto a una cirrosis, puede conducir a una falla hepática y un SHR. Este daño hepático puede ocurrir por una hepatitis aguda viral, por fármacos, isquemia hepática, reactivación del virus hepatitis B, sobre o coinfección por virus hepatitis D. La identificación precoz de los factores precipitantes es importante, porque estos pueden ser prevenibles o tratables con terapias específicas.
Tipos de síndrome hepatorenalEl diagnóstico de SHR se basa en un aumento en la concentración plasmática de creatinina y/o nitrógeno ureico. Estos aumentos pueden ser en algunos pacientes muy rápidos y severos, mientras en otros más lentos y con valores moderados. Estos dos patrones de progresión de la falla renal sumados a la presencia de factores precipitantes definen dos tipos de SHR, tipo 1 y 2 (1). En el SHR tipo 1, la función renal se deteriora rápidamente con un aumento de la creatinina que alcanza valores > 2.5mg/dl (221umol/L) en menos de dos semanas, una velocidad de filtración glomerular < 20ml/min, donde los pacientes generalmente presentan signos de falla orgánica múltiple. El promedio de sobrevida de los pacientes que desarrollan un SHR tipo 1 sin un tratamiento adecuado es de dos semanas (1, 18). Aquellos pacientes que presenten aumentos de la creatinina lentos y graduales con valores de creatinina < 2.5mg/dl son considerados como SHR tipo 2. En estos pacientes la falla renal se desarrolla sin un factor precipitante y tienen una mayor sobrevida. Este grupo presentará igualmente los signos de enfermedad crónica, siendo una característica la presencia de ascitis refractaria (1). Los pacientes con SHR tipo 2 están predispuestos a desarrollar un SHR tipo 1 en relación a la presencia de factores precipitantes o sólo al empeoramiento de la falla hepática. Los mecanismos de esta progresión son desconocidos. A pesar de los criterios diagnósticos mencionados, estudios han encontrado que el SHR puede ser subdiagnosticado hasta en el 60–70% de los casos incluso en Centros Terciarios, principalmente en pacientes que desarrollan falla renal intrínseca, sepsis activa, enfermedad renal inducida por drogas y necrosis tubular aguda (19, 20).
Además de los SHR tipo 1 y 2, algunos autores han definido otros dos tipos de SHR (6). El SHR tipo 3 se refiere a la presencia de SHR en pacientes que presentan una enfermedad renal coexistente por lo que no cumplen los criterios clásicos de SHR. Este grupo de paciente no ha sido incluido en los estudios que han evaluado las diferentes estrategias terapéuticas para el SHR. El SHR tipo 4 ocurre en pacientes con insuficiencia hepática aguda. El SHR se suma al ya pobre pronóstico del daño hepático agudo, especialmente cuando está relacionada al paracetamol. Se piensa que los mecanismos patogénicos en este grupo de pacientes son similares a la de los pacientes con SHR tipo 1.
Además de la insuficiencia renal, los pacientes con SHR presentarán una marcada retención de sodio y agua. El balance positivo de sodio resultará en un aumento del volumen extracelular, el que se manifestará clínicamente por una ganancia de peso, mayor edema y ascitis. El sodio plasmático es generalmente < 130mEq/L, dado el deterioro que existe en la excreción de agua libre a nivel renal por la acción de la vasopresina. Si el sodio plasmático es mayor de 135mEq/L, el diagnóstico de SHR es improbable y otras causas de insuficiencia renal deben ser planteadas. La hiperkalemia es generalmente moderada y es debida al uso de diuréticos ahorradores de potasio (espironolactona). La presencia de acidosis metabólica es infrecuente, salvo en pacientes que presenten un cuadro de sepsis asociado. El sodio urinario generalmente es < 10mEq/L.
Estudios han demostrado que hasta un 80% de los pacientes con SHR precipitados por sepsis pueden tener una disfunción adrenal (21). Esta disfunción adrenal puede ser importante en los mecanismos hemodinámicos del SHR tipo 1 ligado a sepsis y en la respuesta arterial hacia los vasoconstrictores endógenos.
Función cardiovascularLa función cardiovascular se encuentra severamente afectada en pacientes con SHR (14, 22). La resistencia vascular sistémica se encuentra disminuida a pesar de la activación de sistemas vasoconstrictores como la renina-angiotensina y el sistema nerviosos simpático. El gasto cardiaco puede estar aumentado, normal o reducido, dependiendo del estadio de la enfermedad. Sin embargo, pacientes con SHR tipo 1 presentarán principalmente un gasto cardiaco disminuído, probablemente por la miocardiopatía asociada a la cirrosis hepática. La presión arterial es generalmente baja, pero estable.
Función hepáticaEn general los pacientes que desarrollan un SHR presentan características propias de una enfermedad hepática avanzada, siendo la mayoría pacientes Child-C. El Score MELD en pacientes con cirrosis y ascitis es paralelo al riesgo de desarrollar SHR. Los pacientes con ascitis y MELD cercanos a 10 tienen un 8 y 11% de riesgo de desarrollar un SHR al año y 5 años respectivamente (2). Si el MELD es de 18, cerca del 40% de los pacientes presentarán un SHR dentro del año (23). Pacientes con SHR tipo 1 presentarán valores MELD mayores que los pacientes tipo 2 (18). La falla renal asociada a la insuficiencia hepática aumenta la susceptibilidad a las infecciones en este grupo de pacientes.
DiagnósticoEs importante considerar que la mayoría de los episodios de insuficiencia renal en pacientes con enfermedad hepática no está relacionada con el SHR. Aunque es conocido que la creatinina sérica puede subestimar la velocidad de filtración glomerular en pacientes cirróticos, ésta sigue utilizándose para estimar la función renal en estos pacientes (1). El valor de la creatinina sérica en cirróticos es generalmente entre 0.6 u 0,8mg/dL y un aumento > 1.4mg/dL refleja una disminución considerable de la velocidad de filtración glomerular (1, 7). Un aumento de la creatinina sérica en pacientes con cirrosis hepática es suficiente para investigar la posibilidad de un SHR. Existe consenso que una creatinina sérica > 1.5mg/dL permite plantear el diagnóstico SHR (1, 7). El nitrógeno ureico sanguíneo no debe ser utilizado en el diagnóstico del SHR, dado que sus valores se pueden ver afectados por la malnutrición de los pacientes cirróticos, hemorragia gastrointestinal y consumo de proteínas. Debido a que no existe un test específico para el SHR, su diagnóstico requiere la exclusión de otras condiciones que puedan provocar una insuficiencia renal en pacientes cirróticos, como es el caso de factores prerenales, shock, tratamiento con fármacos nefrotóxicos y enfermedades del parénquima renal (1, 7). La falla renal aguda prerenal debido a pérdidas gastrointestinales (diarrea o vómitos) o renales (sobredosis de diuréticos), deben ser descartadas en la anamnesis. Si la falla renal es secundaria a un déficit de volumen, ésta mejorará después de eliminar la causa precipitante y con un adecuado aporte de volumen. La presencia de shock antes del inicio de una falla renal descarta el diagnóstico de SHR y debe plantear la presencia de una necrosis tubular aguda. El diagnóstico de shock séptico es difícil, dado la hipotensión arterial que los pacientes cirróticos presentan, razón por la cual la infección siempre debe tenerse presente y el diagnóstico de SHR sólo debe realizarse en estos pacientes una vez que la infección este totalmente resuelta. Los pacientes cirróticos presentan un elevado riesgo de desarrollar insuficiencia renal secundaria al uso de antiinflamatorios no esteroidales o aminoglicósidos, por lo tanto estos fármacos junto a los medios de contraste deben ser utilizados con criterio en estos pacientes y ser considerados como causa de daño renal previo al diagnóstico de SHR (24). Finalmente, los pacientes cirróticos también pueden desarrollar enfermedades del parénquima renal como el caso de las glomerulonefritis asociadas a la hepatitis B, C o el alcoholismo crónico (nefropatía por IgA) (25). La presencia de proteinuria y/o hematuria deben ser consideradas al momento de evaluar a estos pacientes.
Bardi y cols. han postulado que el índice renal evaluado por ecotomografía con índice renal podría ser importante en el diagnóstico y pronóstico del SHR. En su estudio, que incluyó 48 pacientes cirróticos, el grupo con SHR presentó valores de índice renal mayores que aquellos cirróticos sin SHR y que el grupo control (0.78+0.11; 0.65+0.05; 0.58+0.05 respectivamente con un p < 0.001), señalando que un índice renal > 0.78 podría sugerir el desarrollo y pronóstico del SHR en pacientes cirróticos, si otras condiciones que producen vasoconstricción renal son excluídas (26).
Los criterios determinados por el Club Internacional de Ascitis permiten el diagnóstico del SHR en pacientes con cirrosis hepática (Tabla 2) (1). Destaca que en aquellos pacientes con falla renal y un cuadro infeccioso asociado en ausencia de shock séptico, el diagnóstico de SHR puede ser considerado. Por otra parte, la expansión del volumen plasmático debe ser realizado con albúmina más que con soluciones salinas. Finalmente los criterios menores han sido eliminados, dado su escasa ayuda al momento de definir el diagnóstico de SHR.
Criterios diagnósticos del síndrome hepatorenal.
Criterios Mayores:
|
Criterios Menores:
|
El SHR es la complicación fatal más importante en pacientes cirróticos, ya que la mitad de ellos fallecerá dentro de las dos semanas del diagnóstico (18). Los pacientes con SHR tipo 1 presentan un peor pronóstico que aquellos con un SHR tipo 2, con una sobrevida promedio de aproximadamente sólo una a dos semanas, versus seis a siete meses en los tipo 2. La sobrevida en pacientes con SHR tipo 1 es independiente del MELD, sin embargo en pacientes con SHR tipo 2, la sobrevida si es dependiente del MELD, de tal manera que aquellos con un MELD < 20 presentaran una sobrevida mayor que el grupo con un MELD > 20 (18).
TratamientoSíndrome Hepatorenal Tipo 1Recomendaciones generalesA diferencia de los pacientes con SHR tipo 2, los cuales pueden ser manejados en forma ambulatoria, los pacientes con SHR tipo 1 deben ser hospitalizados en una Unidad de Cuidados Intensivos, para evaluar de manera cercana los parámetros hemodinámicos, renales, infecciosos, etc. En caso de hiponatremia < 125mEq/L, debe indicarse una restricción de agua libre, con volúmenes de aproximadamente 1000cc. y se debe evitar las soluciones salinas para no empeorar la ascitis. Los diuréticos ahorradores de potasio deben ser suspendidos, dado el riesgo de provocar una hiperkalemia severa. En todos los pacientes se deben determinar las características citoquímicas del líquido ascítico, para descartar la presencia de peritonitis bacteriana espontánea, así como deben descartar otros posibles focos de infección que puedan empeorar el pronóstico de estos pacientes. Un adecuado y precoz uso de antibióticos de amplio espectro puede mejorar la sobrevida de estos pacientes. Todos los pacientes deben ser evaluados con el fin de definir la posibilidad de un trasplante hepático ortotópico. La función adrenal debe ser determinada en todos los pacientes con SHR tipo 1 y si se detecta insuficiencia suprarrenal, el uso de esteroides en dosis de stress puede mejorar la sobrevida de estos pacientes. La administración de albúmina intravenosa es fundamental para mantener el volumen intravascular con una efectividad que es superior a las soluciones salinas. Sin embargo, dos estudios randomizados para evaluar la efectividad de terlipresina más albúmina versus albúmina sola, han demostrado que albúmina sola es ineficaz en el tratamiento de pacientes con SHR (27, 28).
VasoconstrictoresEl uso de vasoconstrictores es actualmente la mejor estrategia para el manejo médico del SHR. Aunque los resultados han sido en general promisorios, debe considerarse que el número de pacientes incluídos es pequeño y que algunos de estos estudios presentan diferencias en los criterios de inclusión. La racionalidad de su uso es mejorar la circulación al provocar una vasoconstricción a nivel esplácnico y de esta manera aumentar la presión a nivel arterial sistémico, disminuir la actividad de los sistemas vasoconstrictores endógenos y aumentar el flujo renal efectivo. Los principales vasoconstrictores utilizados son los análogos de la vasopresina (principalmente terlipresina) y los agonistas α-adrenérgicos (adrenalina y midodrine). Estos actúan sobre los receptores V1 y los receptores α-1 adrenérgicos, respectivamente, los que se encuentran presentes en las células musculares del endotelio vascular. En la mayoría de los estudios, estos fármacos han sido asociados a albúmina para aumentar el volumen plasmático efectivo. Fabrizi y cols han señalado que el uso de terlipresina y albúmina es capaz de mejorar la función renal y revertir el SHR en aproximadamente un 50% de los casos (29). Por otra parte, Nazar y cols. han sugerido recientemente que los niveles de bilirrubina (mayor o menor de 10mg/dL) y un aumento precoz en la presión arterial media (mayor de 5mmHg), pueden predecir la respuesta al tratamiento con terlipresina más albúmina en pacientes con SHR tipo 1 (30). Las dosis de terlipresina recomendadas son aumentadas de manera progresiva iniciándose con 1mg iv/4–6 horas hasta alcanzar una dosis máxima de 2mg/4–6 horas después de dos días si es que no se ha producido una respuesta a esta terapia, definida como una reducción de la creatinina > 25% de los valores pre-tratamiento (Tabla 3) (31). Este esquema terapéutico debe ser mantenido por un período mínimo de 3–5 días y hasta un máximo de dos semanas.
Protocolo de tratamiento del síndrome hepatorenal con terlipresina o noradrenalina
| Terlipresina Dosis inicial: 1mg. iv cada 4 horas. Si la creatinina plasmática no ha disminuido > 25% del basal, aumentar la dosis hasta 2mg cada 4 horas. o |
| Noradrenalina Dosis inicial: Infusión de 0.1ug/Kg/min. iv. Si la presión arterial media no aumenta más de 10mmHg aumentar la dosis 0.05ug/Kg/min. cada 4 horas, hasta una dosis máxima de 0.7ug/Kg/min. |
| Albúmina Se debe asociar a noradrenalina o terlipresina. Administrar albúmina con el objetivo de mantener una presión venosa central de 10 – 15cm. de H2O, con una dosis máxima de 100mg/día. |
La respuesta a este tratamiento se caracteriza por una marcada disminución de la creatinina, aumento del volumen urinario, aumento en la excreción de sodio urinario, mejoría de la hiponatremia y disminución de los niveles de renina y aldosterona. Aquellos pacientes que responden en términos de mejoría de la función renal, presentan un aumento en la sobrevida, comparado con el grupo que no responde (promedio de sobrevida de 70 vs 13 días, respectivamente). Es importante mencionar que este aumento en la sobrevida es leve y aunque exista una respuesta en este grupo de pacientes, la indicación de trasplante como prioridad debe ser aún mantenida independiente de una mejoría del MELD. Hasta un 5–15% de los pacientes pueden presentar una recidiva del SHR una vez suspendido el tratamiento con terlipresina. En estos casos el reinicio de este fármaco es generalmente efectivo. Aunque aproximadamente un 30% de los pacientes puede presentar algún evento adverso a este fármaco, la mayoría de estos casos requerirán una disminución de la velocidad de infusión de terlipresina (29). Dentro de estos eventos adversos destaca la presencia de dolor abdominal, arritmias autolimitadas, necrosis cutánea, broncoespasmo, eventos isquémicos y diarrea. Estos fármacos no deben ser indicados en pacientes con insuficiencia hepática terminal, carcinoma hepatocelular intratable o la presencia de alguna contraindicación para su uso (Tabla 4). Dentro de las limitaciones de la terlipresina destaca la falta de respuesta en un 40–45% de los pacientes con SHR, alta frecuencia de recurrencia y su elevado costo.
Contraindicaciones para el uso de vasoconstrictores en pacientes con síndrome hepatorenal
| Paciente > 70 años. |
| Enfermedad coronaria. |
| Miocardiopatias – Arritmias. |
| Insuficiencia Cardiaca. |
| Hipertensión arterial. |
| Enfermedad cerebrovascular. |
| Enfermedad vascular periférica. |
| Insuficiencia respiratoria. |
| Asma. |
| Enfermedad hepática terminal. |
| Hepatocarcinoma avanzado. |
Los agonistas α-adrenérgicos (noradrenalina y midodrine) son una alternativa a la terlipresina, ya que tendrían una efectividad similar con un costo económico menor (31–34). Alessandria y cols. mostraron que en 22 pacientes cirróticos, noradrenalina y terlipresina asociada a albúmina logró revertir un porcentaje similar de casos de SHR tipo 1 (70% y 83% respectivamente) (31). Sin embargo, la recurrencia al suspender esta terapia llegó hasta un 50%. Dado que el 50% de estos pacientes presentaban una creatinina basal < 2mg/dL, se requieren nuevos estudios para poder determinar la efectividad de noradrenalina en pacientes con SHR más severos. Eslarian y cols. demostraron que el uso de midodrine (dosis máxima de 15mg tres veces al día) en conjunto con octreotide (dosis máxima de 200ug tres veces al día), se asoció a una disminución de la mortalidad y una mayor incidencia de reducción de la creatinina a valores < 1.5mg/dl versus el grupo placebo (33). Recientemente, Skagen y cols. han confirmado la efectividad de midodrine, octreotide y albúmina como terapia asociada en el manejo de los pacientes con SHR tipo 1, siendo una terapia puente para el trasplante hepático (34).
Ginès y cols. han demostrado que la infusión local de misoprostol (análogo sintético del PGE2), no modifica la velocidad de filtración glomerular ni la excreción de sodio, por lo que no están indicados en el tratamiento del SHR (35). N-acetilcisteína podría disminuir la vasodilatación esplácnica al disminuir la producción local de oxido nítrico. En un estudio que incluyó 12 pacientes con SHR, N-acetilcisteína fue capaz de aumentar el clearence de creatinina, el volumen urinario y la excreción urinaria de sodio, sin alterar la presión arterial sistémica. Sin embargo estudios con un mayor número de pacientes permitirá demostrar su efectividad (36).
Shunt intrahepático portosistémico transyugular (TIPS)El TIPS es teóricamente una terapia atractiva para el manejo del SHR, dado que puede disminuir de manera significativa la presión a nivel portal y el flujo de sangre a nivel esplácnico, factores que son claves en su patogenia. Sin embargo, debe considerarse que al aumentar el retorno venoso puede agravar aún más la disfunción cardíaca que presenta este grupo de pacientes. Estudios han sugerido que el uso de TIPS efectivamente podría mejorar la función renal y el filtrado glomerular, y disminuir la actividad del eje renina-angiotensina y del sistema nervioso simpático en pacientes cirróticos con SHR (37, 38). Sin embargo, estos han excluído pacientes con historia de encefalopatía, Child-Pugh > 12 o bilirrubina > 5mmHg, características que se encuentran en la mayoría de los pacientes con SHR tipo 1. La mejoría en la función renal post instalación de un TIPS es lenta y efectiva en aproximadamente un 60% de los pacientes (37). Pacientes con SHR y un MELD > 18 no deben ser candidatos a TIPS, dado que el tiempo de sobrevida promedio en este grupo de pacientes es de sólo dos a tres meses. En suma, el TIPS sería una mejor alternativa en pacientes con cirrosis hepática Child A o B, quienes evolucionan con un SHR tipo 2 que no responde al tratamiento con vasoconstrictores y albúmina.
Otras Estrategias TerapéuticasEl uso de soporte hepático extracorpóreo o hígado artificial (MARS: molecular adsorbent recirculating system), sólo debe ser considerada como una estrategia de soporte transitoria para el paciente crítico en espera de realizar el trasplante hepático. La terapia de reemplazo renal (hemodiálisis) ha sido utilizada en pacientes con SHR tipo 1, especialmente en candidatos a trasplante hepático, como terapia de soporte en espera del trasplante (39). La experiencia clínica muestra que la mayoría de los pacientes con SHR tipo 1 no toleran la hemodiálisis y pueden incluso desarrollar episodios de hipotensión arterial, hemorragias e infecciones que empeoran el pronóstico de estos pacientes. La diálisis con uso de albúmina extracorpórea mejora la función renal y sobrevida en pacientes con SHR, sin embargo los resultados requieren la confirmación con estudios que incluyan un mayor número de pacientes. En un estudio reciente que incluyó seis pacientes cirróticos con ascitis refractaria y SHR tipo 1 que no respondieron a la terapia vasoconstrictora, MARS fue ineficaz en mejorar las alteraciones hemodinámicas y la función renal a pesar de una disminución en los niveles de oxido nítrico (40). Pese a estos resultados, en una experiencia nacional, Contreras y cols. mostraron que la diálisis con albúmina MARS fue efectiva como puente para el trasplante hepático en tres pacientes con insuficiencia hepática fulminante, uno de ellos con SHR previo al inicio de esta terapia (41).
Otras estrategias han sido evaluadas en pacientes con SHR con resultados desalentadores. Tezosentan, un antagonista no selectivo del receptor de endotelina, podría deteriorar la función renal y disminuir el volumen urinario en pacientes con SHR tipo 2 (42). Dopamina no debe ser utilizada en pacientes con SHR dado que disminuye la presión arterial e incrementa la presión portal. A igual que la dopamina, los inhibidores de la enzima convertidora de angiotensina debido a su efecto sobre la filtración glomerular no deben ser recomendados en el tratamiento del SHR.
Trasplante hepáticoEl trasplante hepático es el tratamiento de elección en pacientes cirróticos con SHR tipo 1. Numerosos estudios han demostrado resolución del SHR y una prolongada sobrevida en este grupo de pacientes post trasplante hepático. Sin embargo, el principal factor limitante del trasplante en este grupo de pacientes es la elevada mortalidad que existe en la lista de espera, debido a la combinación de una escasa expectativa de sobrevida y el tiempo de espera prolongado para realizar el trasplante. Dado que los pacientes con SHR poseen un score de MELD elevado (en parte dado por el aumento de la creatinina), el uso de este score permite reducir la mortalidad por tiempo de espera y mortalidad en este grupo de pacientes. La regresión del daño renal previo al trasplante permitirá mejorar la morbimortalidad posterior al trasplante. Estudios han demostrado en un grupo de pacientes con SHR tratados con vasoconstrictores antes del trasplante, que aquellos que respondieron a esta terapia tuvieron una morbimortalidad postrasplante que no difería de pacientes cirróticos trasplantados sin SHR (43). El uso de trasplante combinado hígado-riñón también ha sido realizado en pacientes con SHR, sin embargo los resultados no son mejores que los obtenidos en pacientes que habían recibido sólo el hígado (44). El trasplante hígado-riñón debería ser la elección sólo en pacientes con SHR tipo 3 (SHR más una falla renal intrínseca).
Post trasplante hepático, la velocidad filtración glomerular puede persistir alterada y hasta un 35% de los pacientes podrá necesitar de hemodiálisis. Dado que el tacrolimus y la ciclosporina, inmunosupresores de uso habitual en pacientes trasplantados de hígado, pueden contribuir a la alteración de la función renal, se ha sugerido diferir la administración de estos fármacos hasta que la función renal se haya recuperado, generalmente a las 48–72 horas post trasplante. A diferencia de los pacientes con SHR tipo 1, los resultados del trasplante hepático son más alentadores en pacientes con SHR tipo 2 debido a la ausencia de factores precipitantes, evolución más prolongada de este cuadro y la menor insuficiencia renal que presentan.
PrevenciónDos tipos de estrategias han sido sugeridas para prevenir el desarrollo de SHR en pacientes con cirrosis hepática. La primera es el uso de albúmina para prevenir el deterioro de la función circulatoria que frecuentemente ocurre en pacientes cirróticos con peritonitis bacteriana espontánea. En este grupo de pacientes, la administración de albúmina en dosis de 1.5g/kg ev al momento del diagnóstico de la peritonitis bacteriana y 1g/Kg ev a las 48 horas junto a los antibióticos, mejora la función circulatoria y disminuye el riesgo de desarrollo de SHR, en comparación al grupo tratado sólo con antibióticos (10% en el grupo con albúmina vs 33% en el grupo sin tratamiento con albúmina) (45). La segunda estrategia para prevenir el desarrollo de SHR ha sido la inhibición de citokinas inflamatorias relacionadas con productos bacterianos, particularmente el factor de necrosis tumoral-α, o la descontaminación intestinal selectiva, para suprimir el efecto negativo de la translocación bacteriana (46). En pacientes con hepatitis alcohólica, el uso de pentoxifilina 400mg tres veces al día (inhibidor del FNT-α), ha demostrado disminuir el desarrollo y mortalidad del SHR (8 y 24% respectivamente), con respecto al grupo control (35 y 46% respectivamente) (47). Recientemente, un estudio randomizado, controlado y doble ciego, confirmó que pentoxifilina fue más efectiva que prednisona en el tratamiento de pacientes con hepatitis alcohólica severa (48). Finalmente, Fernández y cols., mostraron que en 68 pacientes cirróticos con proteínas en líquido ascítico < 1.5g/dL y con al menos dos de los siguientes criterios: Child-Pugh > 9, bilirrubina sérica > 3mg/dL, creatinina sérica > 1.2mg/dL, nitrógeno ureico > 20mg/dL o sodio plasmático < 130mg/dL, el uso de norfloxacino (400mg/día) era asociado con un bajo riesgo de desarrollar SHR, comparado con el grupo control que recibió placebo (28 versus 41%) (23). Sin embargo, se requieren mayores estudios para determinar el papel exacto de estas estrategias en la prevención del SHR en pacientes cirróticos.
Síndrome hepatorenal tipo 2El tratamiento de los pacientes con SHR tipo 2 está basado en una restricción de la ingesta de sal (40–80mmol/día de sodio) y paracentesis evacuadoras con reposición de albúmina para el manejo de la ascitis refractaria (10gr/L de ascitis extraído). Si existe una hiponatremia < 125mEq/L, se debe restringir el consumo de líquidos a 1.000cc/día. El TIPS puede ser considerado en el tratamiento de pacientes cirróticos sin gran encefalopatía que desarrollen una ascitis refractaria. Además, los pacientes deben recibir profilaxis para prevenir cuadros de peritonitis bacteriana espontánea y evitar otros eventos precipitantes que puedan desencadenar un SHR tipo 1. Alessandria y cols. demostraron recientemente que midodrine en dosis de 7.5 a 12,5mg tres veces al día no fue efectivo en prevenir la recurrencia del SHR tipo 2 en 10 pacientes que habían respondido al uso de terlipresina (49). Por este motivo, todos los pacientes con SHR tipo 2 deberían ser evaluados frente a la posibilidad de un trasplante hepático. Debido a la disminución del gasto cardiaco, algunos autores han sugerido que los antagonistas de los receptores β deberían ser descontinuados durante el SHR (6). Vasodilatadores como los inhibidores de la enzima convertidora, nitratos, y prazosin deben ser descontinuados en este grupo de pacientes. Dado que las clasificaciones tradicionales han excluido a los SHR tipo 3 y 4, no existen estudios que hayan evaluados las estrategias referidas anteriormente en estos pacientes. Sin embargo, es probable que pacientes con SHR tipo 4 puedan ser tratados de manera similar al grupo con SHR tipo 1.
En conclusión, el SHR es una causa funcional de falla renal en pacientes cirróticos. En su patogénesis destaca la vasodilatación esplácnica asociada a una vasoconstricción arterial sistémica y renal. Sin tratamiento, principalmente en pacientes con SHR tipo 1, la mortalidad puede llegar hasta un 100%. En su diagnóstico se deben excluir otras causas de falla renal. Factores precipitantes como infecciones y paracentesis evacuadoras sin reposición de albúmina, deben ser considerados al momento del diagnóstico. El uso de vasoconstrictores, especialmente terlipresina, asociado a albúmina, pueden mejorar el pronóstico de estos pacientes, permitiendo que el trasplante hepático pueda ser considerado como una estrategia terapéutica definitiva.
Los autores declaran no tener conflictos de interés, en relación a este artículo.