La respuesta inflamatoria, frecuentemente asociada al parto prematuro extremo, tiene un rol relevante en el pronóstico, ya que la inmadurez propia del sistema inmune en estas condiciones impide la apropiada modulación de estos procesos, promoviendo una inflamación persistente en el tiempo con los consiguientes daños en el corto, mediano y largo plazo. Objetivo: revisar los mecanismos inmunológicos en el prematuro extremo, los efectos en los sistemas de mayor relevancia y nuevas perspectivas terapéuticas.
Inflammatory response, frequently associated with extreme preterm birth, has a relevant role in outcome, since immaturity of immune system, in such conditions, does not allow an appropriate modulation of these processes leading to sustained inflammation, to secondary damage and thus promoting short-medium- and long-term sequelae. Objective: to review immunological mechanisms involved in extreme prematurity, their effects on the most relevant systems and new therapeutical approaches.
Acorde a lo visto en la revisión anterior, la inmadurez inmunológica en el prematuro extremo tiene diferentes efectos sobre los diversos sistemas. La ineficiencia defensiva frente a agresores infecciosos se ve sobrepasada por reacciones inflamatorias descontroladas ante la incapacidad de modular y/o limitar dichas respuestas, pudiendo generar un efecto sostenido en el tiempo, capaz de continuar generando daños de severidad variable en órganos y tejidos, y las consiguientes secuelas posteriores.
En esta segunda parte, se profundizará en los efectos multisistémicos del síndrome inflamatorio perinatal, de cuyos casos muchos se originan a partir de la respuesta inflamatoria fetal (síndrome de respuesta inflamatoria fetal, SRIF)1 y otros en el post natal temprano.
2Síndrome de respuesta inflamatoria fetal (SRIF)El SRIF, inicialmente descrito en fetos que iniciaban trabajo de parto prematuro asociado a ruptura prematura de membranas (RPM), se caracteriza por una activación inmune sistémica1.
Se pensaba que la presentación de antígenos en el feto desarrollaba tolerancia inmune y que sus linfocitos eran hiporreactivos, pero nueva evidencia demuestra capacidad de montar una respuesta inmune innata y, hasta cierto grado, adaptativa. En el trabajo de parto prematuro (TPP) hay activación de monocitos, neutrófilos e incremento de mediadores inflamatorios, como IL-6, proteína C reactiva (PCR) e IFN-γ. La proporción de Th1 es mayor en neonatos infectados expuestos por mayor tiempo a RPM previo al trabajo de parto2.
Hoy se plantea el “modelo de daño” como mecanismo fetal inicial de respuesta inflamatoria, en el cual habría un reconocimiento de patrones moleculares de daño (DAMPs, por sus siglas en inglés), restos de microorganismos y tejidos del huésped, por los receptores de reconocimiento de patrones (PRR, por sus siglas en inglés). Este modelo contradice el clásico paradigma de “lo ajeno versus propio”. La reacción inmune se desencadenaría en respuesta a señales de tejidos dañados, más que a antígenos externos3. Los receptores “Toll-like” (TLR), de la familia de los PRR, pueden reconocer patrones moleculares asociados a patógenos (PAMP) y DAMP4.
En condiciones de madurez, la primera respuesta frente a la injuria es el sistema inmune innato que cuenta con varios mecanismos de protección frente a los microorganismos. Las superficies epiteliales y endoteliales generan una barrera física, inmunomodulan y producen péptidos antimicrobianos, como las proteínas SP-A y SP-D del surfactante pulmonar, capaces de opsonizar, remover células necrótico-apoptóticas y participar en la resolución de la inflamación5.
En segunda instancia, los PRR permiten reconocer el PAMP, desencadenando la respuesta inflamatoria que se inicia con la activación del NF-kB como consecuencia de la unión del TLR con el antígeno3. Este factor promueve la expresión de genes proinflamatorios, incrementando la producción de citoquinas, quimioquinas y estructuras proteicas con acción antimicrobiana. Así, es posible reconocer citoquinas con efectos antiinflamatorios: IL-10, IL-11, IL-13, TGF-β; y proinflamatorias: IFN-γ, IL-1, IL-12, TNF-α, IL-4, IL-56.
La interacción entre estos componentes inmunitarios lleva finalmente a inducción del TPP.
En el SRIF hay un evento fisiopatológico primordial: funiculitis y vasculitis coriónica (corioamnionitis), condicionantes de la activación endotelial productora de daño orgánico fetal y responsable del incremento de reactantes de fase aguda y neutrófilos en líquido amniótico. Esta inflamación intraamniótica, aún sin presencia de microorganismos, lleva a RPM y TPP. Estos eventos iniciales desencadenan una reacción inflamatoria amplificada que condicionará un alto riesgo de morbimortalidad neonatal con patologías como la sepsis neonatal precoz/tardía y consecuencias de largo plazo como displasia broncopulmonar y parálisis cerebral7.
3Síndrome inflamatorio perinatal (SIP)El SIRF y corioamnionitis son muy importantes causas de inflamación sistémica postnatal, pero no las únicas. Acciones médicas también contribuyen a este proceso, incluso en recién nacidos prematuros de causa estrictamente materna. Ejemplos de estas actividades son la reanimación neonatal con fracción inspirada de oxígeno (FiO2) alta que incrementa las especies reactivas de O2 (ROS) y se relaciona con mayor mortalidad8 a otras lesiones pulmonares inducidas por ventilación mecánica que constituyen un riesgo importante para el desarrollo de displasia broncopulmonar (DBP)9. Estas situaciones se analizarán más adelante. El SIP puede tener su origen en condiciones prenatales o postnatales.
4DiagnósticoLos criterios para el diagnóstico del SRIF basados en demostrar la presencia de citoquinas de inmunidad innata en cordón umbilical, principalmente IL-6 con un valor de corte de 11pg/ml10, podría ser aplicado en el diagnóstico postnatal del SIP.
La proteína C reactiva (PCR) es un marcador de fase aguda y es utilizada para determinar la presencia de inflamación sistémica. Su síntesis es hepática en respuesta a IL-6. Considerando que esta última no está ampliamente disponible, medir concentraciones de PCR es una buena opción diagnóstica, más aún hoy, que se cuenta con una modalidad de alta sensibilidad estandarizada11. Existe una fuerte correlación entre los valores de PCR e IL-6 en la identificación de sepsis neonatal con una sensibilidad aproximada de 70% y especificidad de 75%12. Múltiples estudios confirman la correlación entre marcadores inflamatorios: PCR, IL-6 y procalcitonina, por lo que el desafío es estandarizar valores para un diagnóstico precoz y mejor pronóstico11.
Respecto al uso del hemograma en el diagnóstico del SIP, los marcadores que entregan más información son recuentos bajos de leucocitos y neutrófilos (glóbulos blancos menor a 7000 y recuento absoluto de neutrófilos (RAN) menor a 1000 a las 4 horas de nacimiento), pero ninguno es muy sensible. Se debe considerar, además, la edad gestacional y otros índices hematológicos en su interpretación, lo que podría aumentar la sensibilidad diagnóstica de estos marcadores13. Dada esta limitación, existen nuevos métodos diagnóstico en proceso, incluso expresión de genes específicos asociados a infección14.
5Compromiso multisistémico fetalEl SIP originado en el ambiente intrauterino (SRIF), conlleva graves consecuencias a corto, mediano y largo plazo. Incrementa el riesgo de morbimortalidad neonatal, síndrome de distrés respiratorio (SDR), sepsis, neumonía, hemorragia intraventricular, leucomalacia periventricular, enterocolitis necrotizante, retinopatía óptica del prematuro (ROP) y displasia broncopulmonar1.
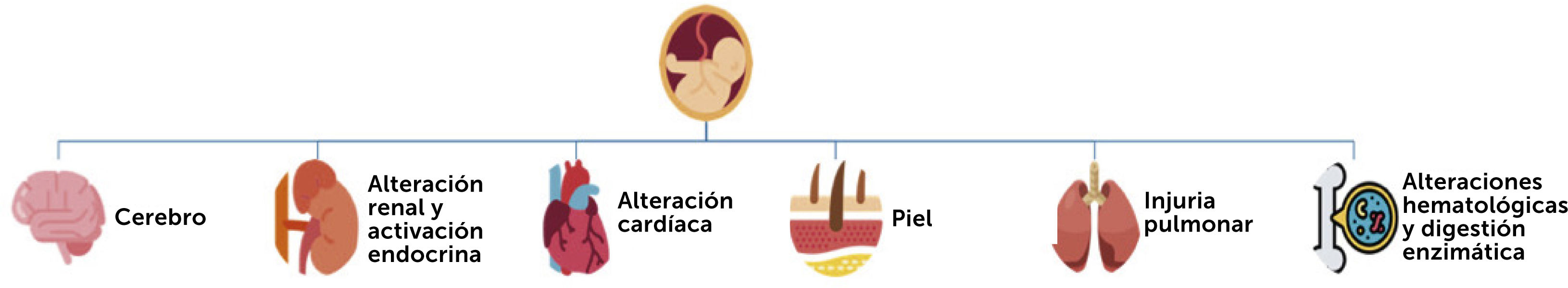
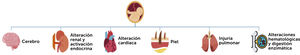
De esta manera, existe un compromiso multisistémico (Fig. 1) tanto in útero, como en el periodo post natal. Sin embargo, la información mayoritaria proviene de estudios en modelos animales por las limitaciones asociadas a los estudios en humanos16
Por la intensidad de los fenómenos inmunopatológicos involucrados y la importancia en la diseminación de los eventos inflamatorios a diferentes órganos y sistemas, iniciaremos el análisis con el aparato respiratorio.
5.1Sistema RespiratorioEn el ambiente intrauterino, el feto aspira líquido amniótico a través de los movimientos respiratorios, mecanismo a través del cual, en casos con infecciones intraamnióticas, se ha encontrado presencia de glóbulos blancos y microorganismos en fluido traqueobronquial, lo que sugiere que líquido amniótico inflamado/infectado llega al tracto respiratorio distal17. De esta manera, la inflamación intrauterina se asocia a desarrollo de enfermedad pulmonar crónica -displasia broncopulmonar (DBP)- donde se ha demostrado que fetos con corioamnionitis tienen elevada concentración de IL-1β en aspirado broncopulmonar, orientando a que la exposición a mediadores inflamatorios y microorganismos son predisponentes al desarrollo de DBP. Dentro de los factores postnatales que desencadenan o incrementan la respuesta inflamatoria están los asociados a intervenciones ventilatorias18
- 1.
Volutrauma
- 2.
Barotrauma
- 3.
Atelectrauma
- 4.
Toxicidad por hiperoxia: estrés oxidativo
Volutrauma: Volúmenes corrientes (VT) excesivamente altos dan como resultado una sobredistensión alveolar y lesión de la periferia pulmonar. Se caracteriza por una respuesta inflamatoria, con activación de la vía de señalización de NF-κB, IL-1β, IL-6, IL-8, TNF-α, proteína inflamatoria macrofágica (MIP-2) y moléculas de adhesión celular intercelular.
Barotrauma: Producido por altas presiones durante la ventilación y aumenta las concentraciones de MIP-2 e IL-1β.
Atelectrauma: Se define como una lesión pulmonar causada por altas fuerzas de cizallamiento en la apertura cíclica y el colapso de unidades pulmonares. Provoca ruptura de las adherencias membrana-citoesqueleto, empeorando la lesión pulmonar.
Estrés oxidativo: niveles elevados de O2 inspirado provoca daño por especies reactivas (ROS).
Finalmente, se ha resumido todos estos factores bajo el concepto de biotrauma que describe la liberación de mediadores inflamatorios por daño asociado a las estrategias ventilatorias (ventilator-
induced lung injury, VILI por sus siglas en inglés) y pueden producir daño en pulmón y tejidos distales19,20.
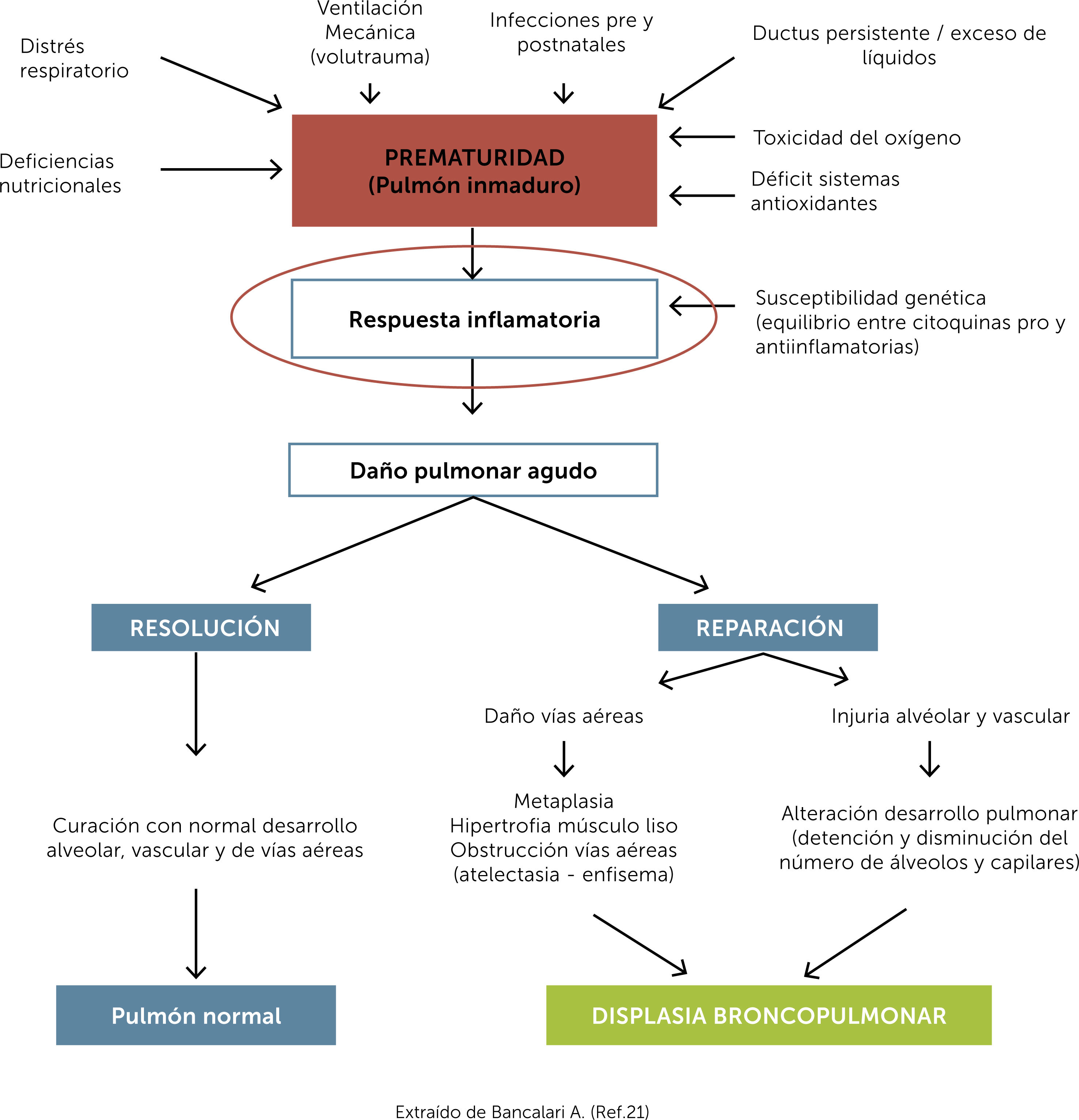
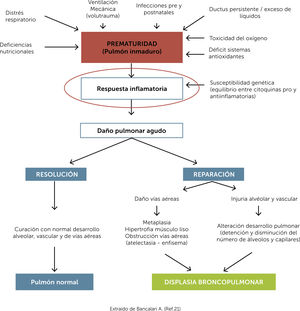
La suma de todos estos factores, prenatales y postnatales, pueden llevar a una respuesta inflamatoria inadecuadamente modulada, por la escasez antioxidante de los sistemas enzimáticos y por la inmadurez de los mecanismos de autorregulación inmunitaria (Fig. 2).
Patogénesis displasia broncopulmonar. Extraído de Bancalari A. (Ref.)21.
El ductus arterioso persistente (DAP), podría también contribuir a la producción de mediadores inflamatorios, observando un incremento en reactantes de fase aguda (PCR), en prematuros sin infección, además de incremento en la actividad de la ciclooxigenasa-1 y aumento en la producción de prostaglandina E-2 y radicales libres. Todo esto contribuye a su persistencia, así como el efecto en el tejido pulmonar descrito en la Fig. 2.20,21
De esta manera, el biotrauma inducido por la ventilación mecánica, especies reactivas de oxígeno y la infección, pre y/o post natal, pueden en conjunto llevar a altas concentraciones de citoquinas proinflamatorias (IL-1β, IL-6, IL-8, TNF-α), no sólo capaces de producir daño local, sino también una inflamación persistente en el tiempo que continúa deteriorando órganos y sistemas22.
La alteración en la arquitectura broncopulmonar puede ocurrir como consecuencia de eventos prenatales o post natales. En los primeros, existe amplia evidencia en modelo animal expuestos a mediadores proinflamatorios intraamnióticos, en los que se ha observado disminución en la expresión del factor de crecimiento endotelial vascular (VEGF) en tejido pulmonar, importante en la alveologénesis, incremento en la síntesis de colágeno y significativo incremento en las citoquinas proinflamatorias mencionadas. Un aumento en la expresión de IL-17 podría ser la causa de esa respuesta inflamatoria descontrolada23.
La inflamación postnatal también juega un papel importante en la patogenia de la DBP. Varios factores tienen un efecto significativo sobre la cascada proinflamatoria. El más importante es el biotrauma. Así, modelos de ventilación no invasiva se asociaron con menor inflamación, lo que se debe intentar desde el primer día, ya que una tormenta temprana de citoquinas promueve el desarrollo de la enfermedad pulmonar crónica24.
Todos estos eventos mencionados pueden llevar a un aumento en la apoptosis y disminución en la proliferación celular, lo que genera menor número de alvéolos, de mayor tamaño y adelgazamiento de los septos alveolares. A esto se suma una regulación decremental (down-regulation) en la expresión de elastina y otros genes involucrados en el desarrollo vascular (factor de crecimiento endotelial vascular A, factor de crecimiento endotelial receptor 2, y óxido nítrico sintetasa endotelial). El resultado final es la inhibición del desarrollo de la microvasculatura, aumento en el grosor del endotelio vascular predisponiendo a hipertensión pulmonar. La principal citoquina proinflamatoria en la injuria pulmonar es IL-1β25.
De esta manera, en el FSIP el pulmón produce cuantiosos mediadores proinflamatorios, los cuales son llevados a diferentes sistemas y órganos pudiendo generar daño en lugares alejados de la lesión primaria, los que se revisarán a continuación.
5.2Sistema renalNo existe mucha evidencia sobre los eventos inflamatorios en el riñón del prematuro. La oliguria sería la manifestación clínica de la respuesta inflamatoria en tejido renal en los niños de pretérmino. En modelo animal con ovejas prematuras expuestas a inflamación intrauterina inducida por LPS, se demostró reducción del número de nefrones, pero no un menor tamaño renal. Esto explicaría los efectos producidos por la indometacina y podría predisponer a hipertensión arterial en la edad adulta26.
En pacientes con infección intraamniótica se suele ver oligohidramnios y, a menor cantidad de líquido amniótico, mayor concentración de IL-6, IL-1, TNF-α y otras citoquinas proinflamatorias en plasma fetal, lo que demostraría una respuesta inflamatoria27.
5.3TimoSe ha observado una involución del timo asociado a la inflamación/infección intraamniótica, al comparar con fetos sanos en evaluaciones ultrasonográficas. Esto se explicaría por depleción de timocitos asociado a apoptosis del tejido linfoide inducido por glucocorticoides, en la primera fase de la respuesta inflamatoria o, como efecto de las citoquinas28.
5.4Glándulas suprarrenalesEl SRIF genera un estrés en el feto. Se ha demostrado una correlación significativa entre la concentración plasmática de cortisol en el feto y el nivel de IL-6, así como un aumento en la relación cortisol/dehidroepiandrosterona (DHEA). El incremento en el cortisol fetal se ha asociado a inicio de trabajo de parto prematuro, espontáneo y por RPO. El aumento de la relación cortisol/DHEA, es un marcador de estrés importante con implicancias de largo plazo, por el rol de los glucocorticoides en la programación metabólica temprana29.
5.5PielEs otro sistema comprometido en el SIP. En modelo animal con corioamnionitis inducida, se observó infiltrados leucocitarios en la dermis superficial, la mayoría eran neutrófilos, linfocitos e histiocitos.
En caso de fetos con corioamnionitis, la inmunorreactividad de TLR-2 en piel fue más marcado que en aquellos sin esta condición. Sin embargo, la inmunorreactividad TLR-4 en piel fetal se expresó de manera constitutiva, independientemente de la presencia de infección. Se ha observado un aumento importante de la expresión de TLR en piel de niños nacidos prematuramente, asociados a infección, y un significativo infiltrado inflamatorio mononuclear en la unión dermoepidérmica. Esto demuestra que la piel del prematuro tiene receptores capaces de reconocer PAMPs y, así, sería parte de la respuesta inmune innata30.
5.6Sistema cardiovascularEl crecimiento y desarrollo de la célula miocárdica continúa hasta el nacimiento, y se podría interrumpir por la inflamación, por cambios en el transcriptoma del tejido cardíaco fetal31. Habría evidencia que sugiere una asociación entre parto prematuro y síndrome metabólico en la edad adulta con hipertensión arterial, diabetes tipo 2 y accidente cerebrovascular32. Esto ocurriría por la exposición del corazón y vasos inmaduros a un medio proinflamatorio, lo que podría producir modificaciones epigenéticas con la consiguiente alteración en los genes relacionados con el desarrollo cardíaco y, además, cambios en la actividad de los factores de transcripción relacionados con la inflamación crónica y aterosclerosis posterior33. Los procesos inflamatorios desempeñan un papel importante en la patogenia de la hipertensión pulmonar y, además, tienen efectos directos sobre la estructura y función del miocardio en prematuros. Por lo tanto, podrían constituir importantes factores en la remodelación estructural del miocardio y en la consiguiente pérdida de función en la edad adulta34.
5.7Sistema hematopoyéticoComo respuesta a la inflamación sistémica perinatal, en líneas celulares hematopoyéticas se produce neutrofilia, que ocurriría por elevación en la concentración de factor estimulante de colonias granulocitarias (G-CSF) y activación del sistema monocito-neutrófilo. La neutropenia, observada en algunos casos, podría explicarse por consumo. El incremento en el recuento de glóbulos rojos nucleados estaría relacionado con el aumento de IL-635.
5.8Sistema digestivoEl tubo digestivo en prematuros es altamente vulnerable por la inmadurez de las barreras mucosas, ineficacia de las células del sistema inmune, motilidad reducida, concentraciones bajas de IgA secretora y péptidos antimicrobianos, alto riesgo de disbiosis y sobrecrecimiento bacteriano. La isquemia crónica, en caso de retraso del crecimiento intrauterino (RCIU) severos, uso de antibióticos, nutrición parenteral y exposición a mediadores de inflamación sistémica, pueden contribuir a la disbiosis y favorecer complicaciones agudas en cuadros inflamatorios, como en la enterocolitis necrosante36. La microbiota intestinal y sus metabolitos pueden influir en las funciones inmunitarias y la homeostasis inmunitaria tanto dentro del intestino como de forma sistémica. La permeabilidad intestinal y la translocación bacteriana son contribuyentes importantes de la inflamación persistente y, si no se logra la indemnidad de la barrera, podría persistir un estímulo inflamatorio conducente a complicaciones de largo plazo, como un retraso del crecimiento, síndrome de mala absorción y mayor riesgo de autoinmunidad, como la enfermedad inflamatoria intestinal37,38.
5.9Sistema nervioso centralEl cerebro del prematuro responde de manera diferente a las noxas en relación con los recién nacidos de término. La inflamación sistémica materna durante el embarazo u otras exposiciones en momentos vulnerables, pueden afectar gravemente el desarrollo del sistema nervioso central.
En la neuroinflamación participan microglías, astrocitos y células inmunes del sistema periférico que migran al tejido cerebral después de una disfunción de la barrera hematoencefálica. Se producen citoquinas proinflamatorias que inducen la activación, migración y proliferación de linfocitos T citotóxicos y células natural killer (NK). Como consecuencia, se produce daño tisular, especialmente en la sustancia blanca, esto explicaría la alta susceptibilidad del prematuro extremo a secuelas neurológicas y parálisis cerebral39. En modelo animal, se ha visto una incrementada migración de neutrófilos, mayor producción de quimioquinas y alteración de la barrera hematoencefálica en respuesta al aumento de IL-1β40.
Un rol crucial desempeñan las células microgliales, participando de manera muy importante en la regulación de la apoptosis neuronal, neurogénesis, formación, poda, maduración sináptica41 y mielinización de axones42. En términos de función inflamatoria, las células microgliales muestran una gran cantidad de receptores para citoquinas, quimioquinas, así como para DAMP, PAMP y factores de matriz extracelular43. La microglía activada se transforma en células similares a macrófagos que tienen la capacidad de fagocitosis, proliferación y migración hacia las áreas de lesión44. En el líquido cefalorraquídeo (LCR) de los recién nacidos con encefalopatía hipóxico-isquémica perinatal, se encontraron niveles significativamente elevados de marcadores inflamatorios derivados de la microglía y se relacionaron causalmente con el daño de la sustancia blanca neonatal que conduce a la parálisis cerebral espástica45.
Otra célula relevante es el astrocito. Suelen ser importantes para la homeostasis antiinflamatoria y la modulación de la microglía. Sin embargo, después de estímulos microgliales específicos pueden convertirse en células desencadenantes de una cascada inflamatoria al liberar citoquinas que inducen daño cerebral, contribuyendo a la inflamación persistente en el cerebro46.
Hay evidencia que sugiere que una alteración inmunológica en tubo digestivo se asocia con alteraciones neurocognitivas. El componente nervioso entérico es capaz de liberar distintas moléculas de señalización reguladoras de procesos inflamatorios locales y sistémicos. La interacción intestino-SNC a través de factores neurales, endocrinos, metabólicos e inmunológicos se conoce como el “eje intestino-cerebro”, pero muchos de los mecanismos son aún desconocidos. Sin embargo, procesos inflamatorios intestinales pueden afectar el desarrollo neurológico47,48. En la enterocolitis necrosante del prematuro, caracterizada por intensa inflamación y eventual necrosis del intestino, translocación bacteriana, anatomía intestinal inmadura y aumento de la expresión de mediadores proinflamatorios, se suele ver un mayor deterioro del neurodesarrollo y lesiones cerebrales en la resonancia magnética47,49.
6Manejo del síndrome inflamatorio perinatalLas estrategias más importantes están en la identificación y tratamiento de los factores de riesgo pre y postnatal.
En casos con SRIF, se debe considerar:
- 1)
Interrupción del embarazo.
- 2)
Terapia antibiótica en gestantes con infección intraamniótica.
- 3)
Inmunomodulación de la respuesta inflamatoria.
- 4)
Combinación de las estrategias mencionadas, acorde a la evaluación de cada caso
En la decisión de interrupción del embarazo, se debe analizar el costo-beneficio de la prematuridad en relación con la inflamación/infección. En casos de ruptura prematura de membranas (RPM), la administración de antibióticos de amplio espectro prolonga el embarazo, reduce las infecciones maternas y neonatales y, además, reduce la morbilidad asociada a la prematurez, lo mismo que la betametasona50. La combinación de antibióticos e inmunomoduladores (dexametasona e indometacina) ha demostrado efectividad para erradicar la infección intraamniótica y suprimir la respuesta inflamatoria local, en modelo experimental animal51.
En cuanto al manejo postnatal, el uso de estrategias ventilatorias gentiles como el uso de presión positiva nasal continua (nCPAP, por sus siglas en inglés), ventilación con volúmenes corrientes bajos, administración de surfactante exógeno, cafeína, aminofilinas y vitamina A intramuscular ha mostrado beneficios, sin embargo, la eficacia no ha sido del todo exitosa52,53.
7Nuevas perspectivasNumerosos estudios intentan encontrar evidencia que permita modificar el curso del síndrome inflamatorio perinatal y su persistencia, principalmente desde el enfoque de la modulación de la respuesta inflamatoria. Intervenciones prenatales actualmente en estudio son:
Reducir los efectos deletéreos de una exposición prenatal excesiva a IL-1 parece ser una modalidad terapéutica segura, potente y eficaz para proteger al feto. Un antagonista específico del receptor de esta interleuquina es el péptido Anakinra, que ha mostrado resultados iniciales promisorios en ratas54, también la administración materna de células mesenquimales resultó en una reducción de la concentración cerebral fetal de IL-6 y mejor pronóstico neurológico en estos animales55.
Observaciones en hijos de madres suplementadas con vitamina D3 durante el embarazo mostraron niveles más altos de citoquinas innatas, IL-17α en respuesta a la estimulación de los linfocitos T y mayor producción de IL-10 inducida por dexametasona56.
Finalmente, se está generando evidencia en relación a la importancia en la proporción de ácidos grasos omega 6/omega 3 en sangre materna durante el embarazo y su efecto en la salud perinatal. Sin embargo, se requieren mayores estudios para evaluar si intervenciones en la dieta o suplementación con ácidos grasos omega 3, específicamente en este grupo de mujeres, puede prevenir morbilidad fetal o parto prematuro57.
Existen también, diversas líneas de investigación en un intento por intervenir en eventos postnatales, capaces de modificar la evolución y pronóstico del SIP persistente.
Una de estas es el rol del DHA (ácido docosahexanoico) en la patogenia de la DBP. En recién nacidos prematuros los niveles de DHA son similares a los de término, pero después de la primera semana de vida, disminuyen progresiva y significativamente57, lo que podría apoyar la hipótesis del beneficio de la suplementación. Sin embargo, un metaanálisis reciente sugirió que la suplementación con DHA no tendría efecto en la disminución de la DBP ni mortalidad, aunque sí, aparentemente, sobre la duración de la ventilación invasiva y no invasiva. La calidad de evidencia es baja, por lo que se requiere mayores estudios58.
Otra línea de investigación apunta a la relación de las mucosas del eje intestino-pulmón, en cuanto al microbioma y el efecto sobre el sistema inmune, lo que podría ser importante en el desarrollo de DBP. Así, se ha visto un efecto protector al alimentar con leche materna y suplementar con probióticos y una menor diversidad de cepas en niños con DBP59,60.
También se está investigando la relación intestino-cerebro–sistema inmune. Se ha observado que elevaciones sostenidas de las proteínas inflamatorias agudas durante las primeras 4 semanas de vida se asocian con un riesgo 2 a 5 veces mayor de alteraciones cognitivas y en funciones ejecutivas en el largo plazo62.
Por lo tanto, las estrategias que incluyen leche materna, pre y probióticos podrían resultar promisorias en la modulación de la inflamación persistente mediada por intestino63.
Este enfoque centrado en la modulación de la disbiosis temprana a través de probióticos, requiere un mayor conocimiento, ya que, para mejorar el resultado en prematuros, habría que reconocer distintos patrones de cepas, algo así como un “distintivo individual de microbioma inmunológico” como un biomarcador que permita desarrollar terapias específicas dirigidas a controlar este problema de largo plazo, acorde al planteamiento actual de la inflamación persistente del prematuro64.
8ConclusiónEl síndrome inflamatorio perinatal persistente del prematuro64, es un importante factor de riesgo de mortalidad y morbilidad neonatal, cuya patogenia es la inflamación. Se puede originar en el período prenatal, SRIF y, también, en el post natal, como se observa en prematuros extremos nacidos por causa estrictamente materna. Puede tener consecuencias inmediatas con afectación sistémica y, además, en secuelas más tardías: DBP, leucomalacia periventricular, enterocolitis necrotizante y ROP. En esto juega un importante rol el equilibrio entre los mediadores proinflamatorios y los antiinflamatorios, capaces de modular esta respuesta. Así mismo, entre los agentes prooxidantes y antioxidantes encargados de evitar el estrés oxidativo crónico. La inmadurez de estos sistemas compensatorios en el prematuro extremo, impiden la adecuada autolimitación de la respuesta manteniendo un nivel inflamatorio persistente en el tiempo, capaz de continuar generando daño más allá del período neonatal y, consecuentemente, secuelas que seguirán apareciendo durante la infancia.
Hay líneas de investigación intentado encontrar maneras de atenuar esta respuesta inflamatoria y conocer en profundidad la inmunología neonatal para entender específicamente las vías que llevan a perpetuar la alteración en el balance inflamatorio. Esto permitirá proponer nuevos enfoques terapéuticos.
La calidad de la evidencia aún es baja, por lo que se requiere más investigación e integración multidisciplinaria y de ciencias básicas, en un intento por visualizar estas nuevas vías de tratamiento que permitan controlar la inflamación crónica originada en el período perinatal y disminuir así la morbimortalidad asociada a este síndrome.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.
Referencias no citadas