El Síndrome de Ovario Poliquístico (SOP) es una disfunción endocrino metabólica altamente prevalente en mujeres en edad reproductiva. De etiología incierta, se manifiesta de formas muy variadas, entre las que destacan irregularidad menstrual, oligo o anovulación, hiperandrogenismo clínico, imagen ecográfica de ovario poliquístico, obesidad, insulinorresistencia e infertilidad. Por su variedad de presentación es que su definición ha requerido varios consensos y es aún hoy motivo de controversia.
La infertilidad asociada al SOP obedece a diferentes mecanismos, entre los que destacan la disfunción ovulatoria, la alteración del desarrollo endometrial, la insulinorresistencia, su impacto en la esteroidogénesis ovárica y suprerrenal y, la alta frecuencia de aborto espontáneo de primer trimestre.
El enfoque diagnóstico y terapéutico del SOP debe contemplar todos estos aspectos en forma integral para restablecer adecuadamente el ambiente endocrino-metábolico previo a un embarazo y tener en cuenta las potenciales repercusiones en el mediano y largo plazo para estas pacientes como dislipidemia, diabetes mellitus tipo 2, enfermedad cardiovascular y, cáncer de endometrio y mama.
Polycystic ovary syndrome (PCOS) is a metablic endocrine disorder highly common in women of reproductive age. Of unknown etilogy, its symptoms are varied; including menstrual disorders, oligo or anovulation, clinical hyperandrogenism, visualization of polycystic ovaries on ultrasound, obesity, insulin resistance and infertility. Due to the wide range of clinical symptoms, attempts have been made to reach consensus, however controversy remains.
Infertility associated to PCOS responds to different mecanisms such as ovulatory disorders, alterations in endometrial development, insulin resistance, impact on ovarian and suprarenal steroidogenesis and a high frequency of first trimester spontaneous abortions.
The diagnostic and therapetic approach to PCOS must consider all these factors as a whole in order to provide an adecuate endocrine-metabolic environment prior to pregnancy and to anticipate any possible medium or long-term impact in these patients, including dyslipidemia, Type II Diabetes mellitus, cardiovascular disease and endometrial and breast cancer.
El Síndrome de Ovario Poliquístico (SOP) es la alteración endocrina más frecuente de la mujer y se presenta en un 5 a 10% de la población en edad reproductiva (1–4).
Fue descrito inicialmente en 1935 por Stein y Leventhal, y caracterizado después por sus diferentes aspectos endocrinos y metabólicos asociados. Existe una heterogeneidad considerable de síntomas y signos entre las mujeres con SOP y que pueden variar en una misma persona a lo largo de su vida. Las manifestaciones clásicas y más típicas del SOP son hiperandrogenismo, anovulación crónica y obesidad. El hiperandrogenismo puede presentarse como acné, seborrea, hirsutismo y alopecia androgénica. La anovulación crónica se manifiesta con irregularidad menstrual, oligo o amenorrea e infertilidad (5).
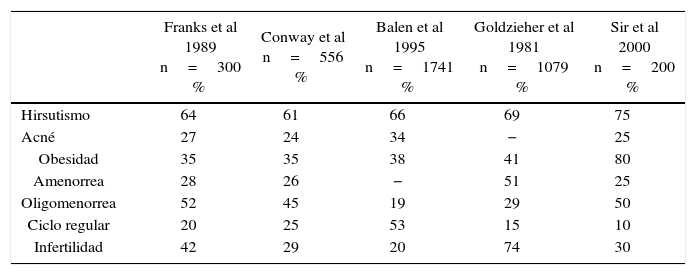
La obesidad es una manifestación clínica muy frecuente en la mujeres con SOP y por sí sola o, asociada a otras manifestaciones del SOP, condiciona riesgo y severidad adicional. La hiperinsulinemia e insulinorresistencia han sido identificadas en los últimos años como un factor patogenético central en alrededor del 50% de las pacientes con SOP y da cuenta de gran parte de las alteraciones observadas (Tabla 1).
Frecuencia de manifestaciones clínicas del síndrome de ovario poliquístico
| Franks et al 1989 n=300 % | Conway et al n=556 % | Balen et al 1995 n=1741 % | Goldzieher et al 1981 n=1079 % | Sir et al 2000 n=200 % | |
|---|---|---|---|---|---|
| Hirsutismo | 64 | 61 | 66 | 69 | 75 |
| Acné | 27 | 24 | 34 | − | 25 |
| Obesidad | 35 | 35 | 38 | 41 | 80 |
| Amenorrea | 28 | 26 | − | 51 | 25 |
| Oligomenorrea | 52 | 45 | 19 | 29 | 50 |
| Ciclo regular | 20 | 25 | 53 | 15 | 10 |
| Infertilidad | 42 | 29 | 20 | 74 | 30 |
Todos estas disfunciones endocrinas y metabólicas pueden determinar alteraciones de las distintas etapas del proceso reproductivo de la mujer y de ese modo condicionar infertilidad.
El enfoque diagnóstico y terapéutico de la pacientes con infertilidad asociada a SOP debe considerar en forma integral las alteraciones endocrinas y metabólicas para corregirlas adecuadamente y así lograr el ambiente óptimo para el desarrollo de un embarazo normal.
Definición del síndrome de ovario poliquísticoLa definición del SOP ha sido y sigue siendo hasta hoy motivo de controversia. La primera descripción del cuadro clínico del SOP fue hecha en 1935 por Stein y Leventhal, consistente en amenorrea, hiperandrogenismo, obesidad y ovarios poliquísticos aumentados de tamaño. Desde entonces se han agregado muchos otros rasgos clínicos y de laboratorio que han configurado un síndrome con muy variadas formas de presentación que incluso aparecen con ovarios normales desde el punto de vista ecográfico. Lo que genera la controversia en la definición es que el SOP puede aparecer con sus manifestaciones bioquímicas sin la presencia de ovarios poliquísticos y que un porcentaje de hasta 25% de la población cumple criterios ecográficos de SOP sin presentar el cuadro clínico. El SOP se presenta desde formas leves de hiperandrogenismo e irregularidad menstrual con o sin imagen ecográfica de ovario poliquístico, hasta cuadros de hiperandrogenismo severo, obesidad e insulinorresistencia asociados a un significativo riesgo de diabetes tipo 2 y enfermedad cardiovascular (Tabla 2).
Manifestaciones clínicas del síndrome de ovario poliquístico
Síntomas y Signos
|
Exámenes de Laboratorio
|
Efectos potenciales en largo plazo
|
La discusión principal entre los grupos de estudio del SOP se ha centrado en la incorporación del criterio morfológico del ovario (Figura 1) a la definición de consenso establecida previamente (Tabla 3). Algunos autores lo consideran necesario para la definición y para otros es suficiente sólo con los criterios endocrinos y clínicos. La última definición de consenso de la reunión del ESHRE/ASRM realizada en Rotterdam en 2003 (7), toma en cuenta este punto importante de la controversia e incorpora la morfología del ovario como criterio de evaluación. Así, sugiere que para el diagnóstico de SOP se requiere de la presencia de al menos dos de los siguientes tres criterios:
1- oligo- y/o anovulación.
2- hiperandrogenismo (clínico y/o bioquímico).
3- ovarios poliquísticos, excluidas otras etiologías.
Definición del síndrome de ovario poliquístico
Consenso del NIH (1990) (6)
|
Consenso ESHRE/ASRM (Rotterdam 2003) (7)
|
Sociedad de Exceso de Andrógenos (2006) (8)
|
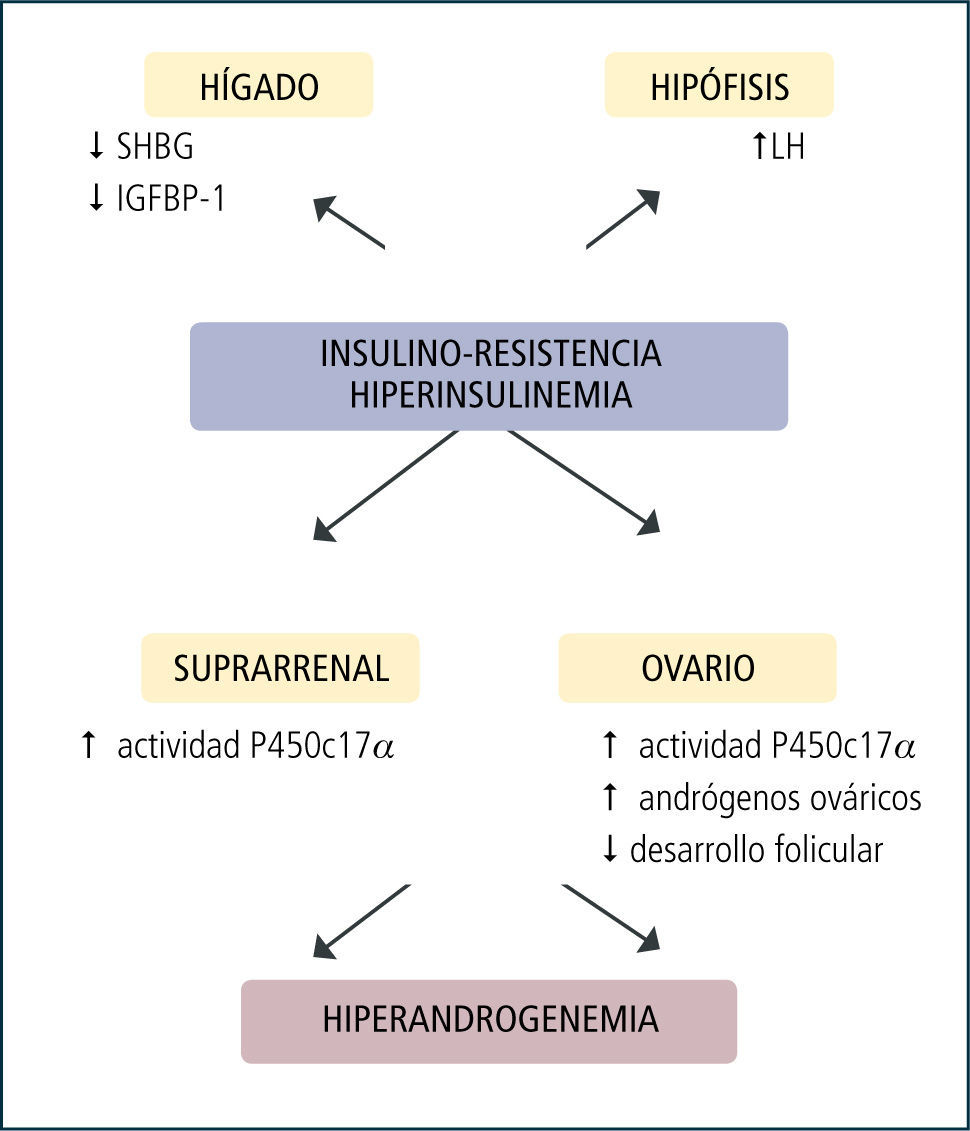
Para entender la fisiopatología del SOP, se debe considerar tanto la naturaleza de la disfunción intrínseca del ovario como las influencias externas que pueden modificar su función. Así la fisiopatología del SOP aparece como un interrelación compleja de tres alteraciones centrales que son, disfunción de la esteroidogénesis ovárica, una alteración neuroendocrina que produce hipersecreción de LH y una alteración metabólica consistente principalmente en insulinorresistencia e hiperinsulinemia (9)
Disfunción ovárica en el SOPLa presencia de ovarios aumentados de tamaño que se observa en el SOP sugiere que el ovario es el centro de la alteración endocrina y en particular del hiperandrogenismo. Ya en 1990 surgen evidencias que sugiere que una alteración de la actividad de la citocromo P450 juega un rol central en el exceso de producción de andrógenos (10). Estudios posteriores en mujeres con SOP anovulatorias y ovulatorias con hipe-randrogenemia, mostraron un aumento de la producción de androste-nediona y 17-OH progesterona cuando eran estimuladas con una dosis única de análogos de GnRH, efecto que no se observó con el estímulo con ACTH. Esto indica que la hiperandrogenemia, tanto en mujeres SOP ovulatorias como anovulatorias, es de origen predominantemente ovárico (11). También se confirmaba que la causa de hiperandrogenismo ovárico en el SOP no se debía solamente a la hipersecreción de LH, sino que se podía concluir también que el defecto intrínseco se debía a una disfunción de las células de la teca en el ovario y/o a otros estímulos externos como la insulina, el factor de crecimiento insulínico tipo 1 (insulin-like growth factor-1 o IGF-1) u otros (11).
Los estudios in vivo e in vitro confirman que las células de la teca en pacientes con SOP tienen una esteroidogénesis muy activa y proveen así de un exceso de sustrato para la actividad de aromatasa. Este mecanismo y la mayor sensibilidad folicular al estímulo de FSH, explican la tendencia a niveles altos de estradiol en todas las etapas de la maduración folicular.
El hecho de haber pacientes SOP que tienen hiperandrogenismo con niveles de LH normales ha apoyado la teoría de una desregulación de los mecanismos de feedback con las gonadotrofinas y de la participación de la insulina e IGF-1 en esta alteración. Se ha demostrado que la supresión de secreción de insulina con un análogo de somatostatina, disminuye los niveles de LH y andrógenos en mujeres con SOP, lo que sugiere que cuando coexisten hiperandrogenismo e hiperinsulinemia, es esta última la responsable de la excesiva producción de andrógenos (12).
Alteración neuroendocrinaLa alteración característica es la elevación de LH y con niveles bajos o normales de FSH. Se observa un aumento de la amplitud y frecuencia de los pulsos de LH que sería producido por aumento de los pulsos de GnRH. Se ha visto que la causa de la hipersecreción de LH no sería una alteración primaria de la regulación hipotalámica de los pulsos de GnRH, sino una alteración del feedback entre el ovario y la hipófisis (13,14). Como fue mencionado anteriormente, existe evidencia que apoya la hipótesis que esta desregulación sería mediada por los mismos andrógenos y la insulina.
Alteración metabólica en el SOPLa asociación entre resistencia a la insulina, hiperinsulinemia compensatoria y el hiperandrogenismo ha permitido comprender mejor la fisiopatología del SOP. Se han estudiado los mecanismos celulares y moleculares de la insulinorresistencia y el principal defecto corresponde a una anomalía en la traducción de la señal post-receptor de la insulina, lo que parece deberse a un defecto genético en la regulación de la fosforilación del receptor de insulina (15).
En el caso de la sensibilidad a la insulina, se observa una respuesta tejido-específica, ya que hay resistencia a su acción en tejidos como el hígado, músculo y grasa, y por otro lado, se conserva la sensibilidad a su acción en tejidos como el ovario y glándulas suprarrenales.
La hiperinsulinemia está presente hasta en un 80% de las mujeres obesas con SOP y en 30 a 40% de aquéllas con peso normal y, es el factor aislado que mejor se correlaciona con la anovulación en este síndrome (16).
A pesar de que la insulino resistencia puede ocurrir independiente del índice de masa corporal (IMC) en mujeres con SOP, la asociación con obesidad produce un impacto negativo en el metabolismo de los hidratos de carbono y puede empeorar el hiperandrogenismo y anovulación.
La evidencia sugiere también, que más que el IMC por sí solo, la distribución de grasa corporal y el tipo de obesidad son los que determinan la magnitud de la alteración metabólica y, a su vez, el riesgo de diabetes y enfermedad cardiovascular en el largo plazo (17).
La insulina actúa a diversos niveles aumentando la producción endógena de andrógenos (Figura 2). El exceso de insulina se une a su propio receptor y a receptores de IGF-1, incrementando el efecto de la LH en las células de la teca (18). A nivel del hígado, la hiperinsulinemia produce una disminución de la insulin-like growth factor-1 binding protein (IGFBP-1) y de la sex hormone binding globulin (SHGB), que se traducen en un aumento de IGF-1 y de andrógenos libres, con los consecuentes efectos a nivel cutáneo y sistémico. La insulina también puede producir aumento de andrógenos estimulando la actividad de la P450c17α a nivel ovárico y suprarenal (19, 20).
El exceso de andrógenos intraováricos es responsable de la anovulación promoviendo directamente la atresia folicular, con apoptosis de células de la granulosa y determinando así la mayor proporción del compartimento estromal del ovario, que es característica de las mujeres con SOP (21, 22).
Disfunción de la foliculogénesisSe ha podido establecer, mediante estudios ultrasonográficos y biopsias ováricas, que las pacientes con síndrome de ovario poliquístico presentan un pool de folículos en crecimiento 2 a 3 veces superior que las mujeres sanas. La histología del síndrome de ovario poliquístico se caracteriza por un aumento de folículos preantrales y antrales pequeños y un mayor reclutamiento folicular. Esta situación se acompaña además de una detención del proceso de selección folicular, lo que explica la ausencia de ovulación (23). Por lo tanto, en el síndrome de ovario poliquístico habría mayor reclutamiento y una menor selección, lo que mantiene un aumento del pool de folículos en crecimiento productores de andrógenos (24).
En los últimos años se ha propuesto que la Hormona Antimülleriana (AMH) podría constituir un marcador sérico que refleje el número de folículos en crecimiento, independiente de gonadotrofinas y por lo tanto de la reserva ovárica en cualquier momento de la vida de la mujer. Además, recientemente se ha podido establecer que las hijas de mujeres con síndrome de ovario poliquístico tienen niveles significativamente mayores de AMH en la infancia temprana, en la niñez (25) y en la peripubertad, lo que sugiere que estas niñas nacen con una masa de folículos en crecimiento aumentada por lo que es de gran relevancia establecer los factores que condicionan este fenómeno como una forma de prevenir el desarrollo de síndrome de ovario poliquístico.
Manejo de la paciente con sop con deseo de embarazoCuando se enfrenta una paciente que tiene SOP y busca embarazarse, se debe tener en cuenta los diferentes mecanismos de infertilidad asociados con este síndrome. No sólo hay que considerar la disfunción ovulatoria que es la principal causa, sino también las alteraciones del endometrio y su potencial impacto en la implantación, la insulinorresistencia e hiperinsulinemia que pueden por su lado dificultar la respuesta ovulatoria, la implantación y el desarrollo temprano del embarazo y, la alta tasa de abortos de primer trimestre asociados al SOP (Tabla 4). En la medida que se logre el adecuado control de todas las alteraciones endocrinas y metabólicas las tasas de ovulación, fecundación, embarazo normal y patología obstétrica, tienden a asemejarse a aquéllas promedio para la población normal.
Es tan importante la correlación entre el sobrepeso/obesidad y el SOP que las modificaciones de estilo de vida se han convertido en la medida de primera línea más importante en las mujeres con SOP. Se requiere implementar programas adecuados de ejercicios y dieta orientados a normalizar el peso y a recuperar una distribución de grasa corporal adecuada, que signifique una disminución de los factores de riesgo metabólico.
Los datos de la literatura son consistentes en asegurar que el solo hecho de bajar de peso tiende a mejorar significativamente los signos clínicos y de laboratorio en pacientes con SOP. Una baja de 5 a 10% de peso en un plazo de 6 meses, permite restablecer la función ovárica en hasta un 50% de las pacientes, muchas de las cuales se embarazan espontáneamente (26).
Asociado a drogas insulinosensibilizadoras como la metformina (cuando es necesario), el cambio de hábitos de vida puede tener un impacto muy significativo en las alteraciones del SOP y en muchos casos es suficiente como tratamiento de la disfunción reproductiva.
El ejercicio es importante como ayuda para bajar de peso y mejorar sensibilidad a insulina y función reproductiva. El ejercicio es más efectivo en reducir grasa visceral que subcutánea. El ejercicio aeróbico regular es más beneficioso y se debe insistir en su práctica en el largo plazo.
2Evaluación endometrialTeniendo en cuenta los desbalances hormonales secundarios a la disfunción ovulatoria del SOP, el endometrio debe ser evaluado adecuadamente previo al inicio de tratamientos con fines reproductivos. En muchas ocasiones el endometrio sometido a niveles elevados de estradiol y sin contraposición de progesterona presenta un desarrollo anormal incluyendo hiperplasia endometrial, formación de pólipos hiperplásicos y eventualmente, cáncer de endometrio.
Si la imagen ecográfica del endometrio aparece normal, en cuanto a grosor y textura no es necesario evaluaciones adicionales. En caso de encontrarse con un endometrio anormalmente grueso o con imágenes complejas en su interior, debiera tratarse con progestágenos cíclicos por un tiempo y de persistir imágenes anormales, complementar el estudio con una biopsia endometrial o histeroscopía diagnóstica.
Existe evidencia preliminar de que la hiperinsulinemia puede alterar la expresión de moléculas de adhesión en la ventana de implantación en el endometrio. Por otro lado, la disminución de la insulina con metformina permite restablecer niveles normales de glicodelina e IGFBP-1 y, mejorar vasculatura y flujo sanguíneo uterino durante la fase lútea, creando un ambiente endometrial más adecuado para la implantación y mantención de un embarazo (27, 28).
3Inducción de ovulaciónDesafortunadamente la baja de peso, dieta y ejercicio son difíciles de lograr para muchas pacientes y más aún, difícil de mantener en el tiempo. Por otro lado, existe un número de pacientes con SOP que son delgadas y que logran beneficios marginales con esas medidas. Es por este motivo que se requiere en muchos casos realizar tratamientos con drogas.
Dada la alta frecuencia de disfunción ovulatoria en pacientes con SOP y que consultan por infertilidad, la inducción de ovulación es un elemento central en el manejo.
En este mismo número de la revista hay un capítulo de inducción de ovulación, por lo que sólo mencionaré los esquemas de inducción de ovulación sin profundizar en ellos.
aCitrato de Clomifeno (CC)El CC se ha usado por mucho tiempo para tratar la infertilidad anovulatoria en pacientes con SOP. Al igual que el Tamoxifeno, su acción antiestrogénica produce un efecto estimulador indirecto de la secreción de FSH.
El uso de CC debe ser monitorizado con ecografía seriada, ya que existen pacientes muy sensibles a la droga que pueden desarrollar múltiples folículos o la formación de quistes foliculares, y otras que son resistentes a su efecto. En general, rápidamente se sabe cómo responderá una paciente y con un curso de 3 a 6 ciclos con CC se logra optimizar la respuesta a la droga. Los esquemas y dosis más usados son entre 50 y 150mg al día, por 5 días contínuos y comenzando entre los días 2 y 5 del ciclo. En términos globales, con el CC en primera línea se logra ovulación en alrededor de 80% de las pacientes, de las cuales se embaraza un 40 a 50% (35 a 40% del total de usuarias) (29, 30). El 75% de los embarazos atribuíbles al CC ocurre en los tres primeros ciclos de uso.
La discrepancia entre las tasas de ovulación y de embarazo se atribuye a los efectos antiestrogénicos del CC en endometrio y moco cervical. La monitorización ecográfica del ciclo es importante para detectar a aquellas pacientes que no responden, para evaluar el grosor endometrial y para programar la actividad sexual o inseminación intrauterina en el período periovulatorio
Como adyuvantes del tratamiento con CC se han usado la gonadotrofina coriónica humana (hCG) para reforzar o reemplazar el peak de LH. El uso de Dexametasona en dosis nocturnas permite suprimir parcialmente la síntesis de andrógenos suprarrenales y favorecer la respuesta ovulatoria a CC en pacientes con dehidroepiandrosterona sulfato elevado. La metformina como tratamiento único o combinado con CC será analizado más adelante.
bInhibidores de AromatasaSe han considerado como una alternativa al uso de CC, especialmente en aquellos casos en que aparecen efectos antiestrogénicos.
El Letrozole ha demostrado ser efectivo para inducir ovulación y lograr embarazos en mujeres SOP anovulatorias y en pacientes resistentes al uso de CC (31).
cGonadotrofinasEn pacientes que no responden adecuadamente o que en un plazo de 3 a 6 ciclos no logran embarazo, debe considerarse el uso directo de gonadotrofinas solas o en combinación con otras drogas.
El uso de gonadotrofinas requiere un manejo de alta especialidad en pacientes con SOP. Estas pacientes son especialmente complejas ya que son muy sensibles a las gonadotrofinas por tener permanentemente una cohorte numerosa de folículos sensibles a FSH. Hay que recordar que la población de folículos antrales sensibles a FSH en las mujeres con SOP es alrededor del doble de lo normal y que su desarrollo descontrolado puede llevar a ovulaciones múltiples y como consecuencia de esto presentar por un lado, embarazos gemelares y de alto número y, por otro lado, elevado riesgo de desarrollar un síndrome de hiperestimulación ovárica (SHO).
Existen diferentes esquemas de uso de gonadotrofinas y de monitorización del ciclo que están orientadas fundamentalmente a lograr ciclos mono ovulatorios. El esquema más seguro de uso es el denominado STEP UP de dosis bajas, que consiste en iniciar la estimulación con dosis bajas y aumentar con alzas pequeñas las dosis cada 7 a 10 días hasta lograr el desarrollo de un folículo dominante, evitando así el desarrollo multifolicular.
Los resultados reportados con esquema step up en dosis bajas, muestran consistentemente ciclos monoovulatorios en un 70% de los casos, con tasas de embarazo de 40% por paciente y 20% por ciclo. Además este esquema adquiere mayor relevancia por el hecho de casi no observarse casos de SHO y una tasa de embarazo múltiple < 6% (26, 32–34).
dMetforminaJunto a la baja de peso se ha hecho frecuente el uso de otras terapias cuya finalidad es mejorar la insulinorresistencia. La fuerte asociación entre insulinorresistencia y anovulación sugiere que la reducción de los niveles de insulina es de gran importancia para el tratamiento de las pacientes con SOP.
En pacientes que no logran bajar de peso con dieta o ejercicio y, en aquéllas delgadas e insulinorresistentes, está indicado el uso de drogas insulinosensibilizadoras.
De estas drogas, la más usada y estudiada es la metformina. La metformina es una biguanidina, que actúa a distintos niveles y que tendría efectos directos e indirectos sobre la función ovárica. Disminuye los niveles de glucosa plasmática favoreciendo la captación de glucosa periférica y disminuyendo la neoglucogénesis hepática. Mejora la sensibilidad a insulina a nivel post receptor en tejidos periféricos y así estimula la captación de glucosa sin afectar la secreción pancreática de insulina. A nivel hepático produce un aumento de la síntesis de SHBG y de IGFBP-1 disminuyendo por esto los niveles de andrógenos libres y de IGF-1. Existe también evidencia de que la metformina tiene un efecto directo en la producción de androstenediona y testosterona por las células de la teca, inhibiendo in vitro enzimas responsables de su biosíntesis (35).
El uso de metformina ha demostrado ser útil en pacientes obesas y delgadas con SOP. La mejoría en la sensibilidad a insulina y disminución de sus niveles circulantes que produce la metformina pueden mejorar la ovulación en el SOP disminuyendo las concentraciones intraováricas de andrógenos, normalizando la secreción de gonadotrofinas o por una combinación de éstos y otros mecanismos.
En los últimos años se han publicado muchos estudios sobre el efecto de dosis de metformina entre 1 500 y 2500mg al día en mujeres con SOP. La mayoría de los datos muestra una significativa mejoría de la sensibilidad a insulina, disminución de niveles de insulina y de andrógenos circulantes, acompañado por una disminución de LH y aumento de la SHBG. El restablecimiento de los ciclos menstruales y la recuperación de la ovulación ha sido reportada en rangos de 70 a 95% y con tasas de embarazo de 19 a 30% (36–42).
La metformina ha demostrado ser útil como droga coadyuvante o complementaria para la inducción de ovulación en las pacientes con SOP, llegando incluso a favorecer respuesta y manejo adecuado en pacientes con SOP que son sometidas a tratamientos de fertilización asistida. En general el beneficio en estas pacientes se manifiesta en cuanto a número de ciclos cancelados por mala respuesta o riesgo de hiperestimulación, número de folículos maduros aspirados, tasas de fecundación y embarazo obtenidas y por otro lado, tasas de aborto de primer trimestre semejantes a las de la población general (43, 44).
4Tratamiento quirúrgicoEl tratamiento quirúrgico para el SOP existe desde la descripción del cuadro por primera vez y entre los años 1930 y 1960 era la única alternativa terapéutica. Consistía en una cirugía abierta y en la que se resecaba hasta un 75% del volumen de cada ovario que resultaba frecuentemente en extensas adherencias pelvianas.
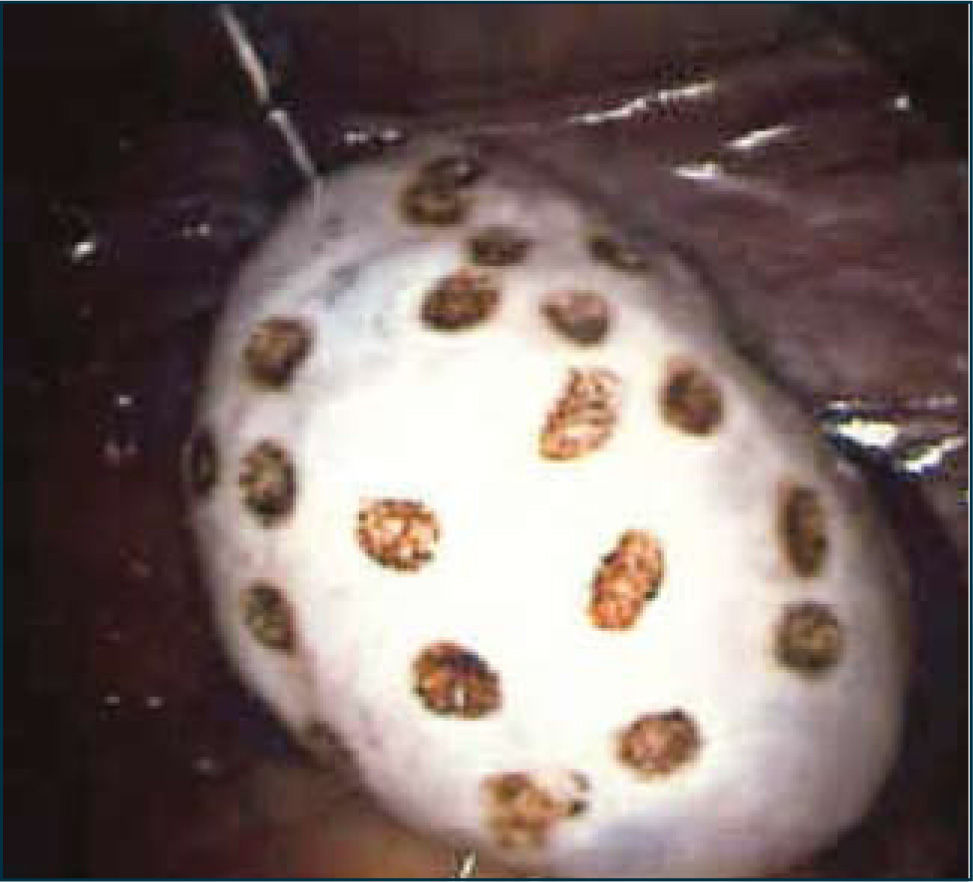
En nuestros días, la alternativa quirúrgica consiste en la punción selectiva de los ovarios con electrocoagulación o láser por vía laparoscópica (conocida también como Drilling Ovárico), que semejaría el efecto de la resección ovárica en cuña de antaño (Figura 3). Esta técnica se ha reservado especialmente para pacientes resistentes a CC o que requerían evaluación laparoscópica del factor tubo peritoneal.
Los primeros reportes con esta técnica fueron auspiciosos y mostraban una caída significativa de los niveles de LH y andrógenos, mejorando las tasas de ovulación espontánea y de embarazo. Posteriormente otros estudios muestran tasas de embarazo semejantes a las obtenidas con el uso de gonadotrofinas y sin complicaciones como embarazos múltiples ni hiperestimulación ovárica (45, 46).
Con el uso de las drogas insulinosensibilizadoras en mujeres con SOP se ha logrado mejorar significativamente el manejo de las paciente resistentes a CC que eran candidatas a drilling ovárico. Los resultados con drilling ovárico son relativamente buenos, pero debe reservarse para pacientes que son resistentes a las terapias convencionales o que serán sometidas a estudio endoscópico para evaluar otros factores de infertilidad.
Palomba et al. realizaron un estudio prospectivo randomizado en que comparan el uso de metformina con el drilling ovárico en pacientes SOP resistentes a CC y demuestran al cabo de 6 meses de seguimiento mejores tasas acumulativas de ovulación, embarazo y tasas de aborto más bajas en las pacientes que usaron metformina, además de tener un costo de tratamiento mucho más bajo (47).
5Reproducción AsistidaSi todos los tratamientos han fallado en una paciente infértil con SOP, la fertilización in vitro es la terapia indicada y con excelentes resultados.
Existen dudas respecto de la calidad ovocitaria y embrionaria en mujeres con SOP, pero debido al mayor número de ovocitos disponibles para los tratamientos las tasas de embarazo son semejantes a las de pacientes con factor tubario (48, 49).
Síndrome de ovario poliquístico y abortoVarios aspectos relacionados con el embarazo tienen una asociaciónparticular con el SOP y desde el uso de la ecografía de alta resolución en los años 1980 aparece evidencia sugerente que el aborto es más frecuente en estas pacientes.
Existe muchos estudios que han demostrado una fuerte asociación entre el SOP y aborto de primer trimestre, pero la evidencia es débil ya que son generalmente estudios retrospectivos y con números pequeños de pacientes. No hay buenos estudios prospectivos que evalúen el riesgo de aborto en estas pacientes y por esto es que la evidencia se considera insuficiente.
Balen et al (50) observaron en un grupo de pacientes de fertilización in vitro tasas de aborto de 36% en las que tenían imagen ecográfica de ovario poliquístico y 24% en las que tenían ovarios normales. Otro estudio similar en que fueron separadas las pacientes con y sin SOP previo a la fertilización in vitro, demostró tasas de aborto significativamente más altas en las pacientes con SOP comparadas con las controles (25% versus18%), diferencia que se atenuó al hacer un análisis multivariado controlando por peso y tipo de tratamiento (51). Winter et al (52) demostraron también diferencias semejantes en tasas de aborto en mujeres con y sin SOP siendo de 26% y 15% respectivamente.
De esta evidencia se desprende la necesidad de realizar estudios prospectivos que demuestren la relación de SOP y aborto.
Por otro lado, hay varios estudios que han buscado la prevalencia de ovarios poliquísticos en mujeres que consultan por aborto recurrente (53–57). En estos trabajos se observó entre un 36 y 56% de imagen ecográfica típica de ovario poliquístico en mujeres con aborto recurrente comparado con 20 a 23% en poblaciones control.
El tratamiento con metformina en pacientes con SOP e insulinorresistencia ha demostrado en algunos estudios disminuir las tasas de aborto. Es así como Glueck et al (58) reportan disminuciones de las tasas de aborto de 62% en pacientes no tratadas a 26% en aquéllas que recibieron metformina. Por su parte, otro estudio retrospectivo (59) también reporta una diferencia significativa de las tasas de aborto en pacientes con SOP no tratadas con metformina comparado con el grupo de tratamiento, siendo éstas de 41,9% y 8,8% respectivamente.
Estudios retrospectivos y observacionales han mostrado una correlación entre hipersecreción de LH y tasas reducidas de concepción y, aumento de las tasas de aborto en mujers con SOP en tratamiento de infertilidad (60–62). También existe evidencia de mayores tasas de aborto espontáneo en mujeres con LH elevada preconcepcional, independiente de diagnóstico de SOP (63). La supresión de LH con análogos de hormona liberadora de gonadotrofinas ha mostrado una disminución de las tasas de aborto en trabajos retrospectivos (64, 65) pero en otro estudio prospectivo en pacientes con aborto recurrente no mostró tal beneficio (66).
En general la evidencia que apoya este mecanismo dice que niveles mayores de 10mUI/mL se asocia con tasas aumentadas de aborto de primer trimestre.
Hay que mencionar de todos modos que la evidencia existente es considerada débil aún ya que no existen estudios prospectivos que demuestren esta asociación en forma definitiva y que en todos los trabajos hay sesgos y factores confundentes que no permiten sacar conclusions sólidas
Conclusiones- •
El SOP es una disfunción endocrino-metabólica altamente prevalente que se ve en un 5 a 10% de las mujeres en edad reproductiva.
- •
La definición de SOP ha sido controvertida, especialmente en relación a la presencia o no de la imagen característica de ovarios poliquísticos en el diagnóstico.
- •
Es un síndrome de presentación muy variable, cuyas manifestaciones más frecuentes son las alteraciones menstruales, hiperandrogenismo y obesidad.
- •
Puede presentarse como un leve hiperandrogenismo e irregularidad menstrual, hasta cuadros severos de hiperandrogenismo, obesidad e insulinorresistencia con alto riesgo de enfermedades metabólica y cardiovascular.
- •
La insulino resistencia juega un rol central en el desarrollo del síndrome en un grupo significativo de pacientes, y debe ser estudiada y manejada adecuadamente para lograr una terapia exitosa.
- •
La infertilidad asociada al SOP obedece a varios mecanismos, siendo el más frecuente la disfunción ovulatoria, sea ésta primaria o secundaria al hiperinsulinismo asociado a la insulinorresistencia.
- •
Las alteraciones del desarrollo endometrial y la alta tasa de aborto espontáneo en pacientes con SOP, deben ser evaluadas y tratadas en conjunto con el resto de las disfunciones para lograr éxito en los tratamientos.
- •
Los cambios de estilo de vida, consistentes principalmente en dieta y ejercicios deben ser incentivados permanentemente en la pacientes con SOP, ya que sus efectos no sólo son útiles para corregir alteraciones en lo inmediato sino también son fundamentales en la prevención de patología crónica como diabetes mellitus 2 y enfermedad cardiovascular.
- •
La mujer con SOP que se embaraza, debe continuar sus tratamientos generales y farmacológicos en forma estricta ya que el embarazo se asocia con exacerbación de algunos mecanismos del SOP, particularmente insulinorresistencia y riesgo de hipertensión arterial y diabetes gestacional.
- •
A pesar de no haber sido analizadas en esta revision, es importante mencionar el impacto potencial del hiperandrogenismo y la insulinorresistencia del SOP en el feto en gestación.
El autor declara no tener conflictos de interés, en relación a este artículo.