El Diagnóstico Genético Preimplantacional (PGD) se ha convertido en una herramienta de rutina para la detección de anormalidades cromosómicas o genéticas, en muchos países del mundo. Se han reportado más de 20.000 ciclos de PGD, desde su desarrollo hace más de 20 años, habiendo nacido más de 4.000 niños hasta el año 2007. En Chile, esta técnica es realizada por la Unidad de Medicina Reproductiva de Clínica Las Condes, y se realiza sólo en la variante previa a la fecundación, en donde se biopsia el primer corpúsculo polar y sólo se insemina a los ovocitos encontrados cromosómicamente sanos.
Las indicaciones más comunes para este tratamiento son: 1) evitar el aborto en pacientes con aborto recurrente sin explicación anatómica ni clínica; 2) mejorar las tasas de implantación en mujeres mayores de 37 años con antecedentes de procedimientos anteriores en los que se transfirieron embriones de buena calidad; 3) evitar el nacimiento de niños con enfermedades de origen cromosómico en mujeres mayores de 39 años.
Pre-implantational Genetic Diagnosis has become a common tool in most countries of the world. In almost 20 years since its development, it has been reported more than 20,000 cycles of PGD and till 2007, more than 4,000 children have been born. In Chile, this technique is done by the Unit of Reproductive Medicine of Clínica Las Condes. It is done only in the mode previous to fertilization. In where we study polar bodies and only chromosomically healthy oocytes are inseminated.
The most common indications for this treatment are: 1) to avoid abortions in patients with recurrent abortion without anatomical nor clinical explanation; 2) to improve implantation rates in women older than 37 years of age, with previous procedures in which good quality embryos were transferred; 3) to avoid birth of children with diseases of chromosomal origin in women over 39 year of age.
Al final de la década de los 80 un grupo de investigadores de la Unidad de Medicina Reproductiva del Hospital Hammersmith, en Londres, desarrolló una técnica denominada “Diagnóstico Genético Pre-implantacional” o PGD. Su implementación se motivó en el hecho de que los embriones detectados como anormales genética o cromosómicamente, no se deberían transferir a la madre, sino simplemente ser eliminados. El PGD involucra dos pasos: el primero es realizar una biopsia a un embrión (remoción de uno o dos blastómeros) obtenido en un procedimiento de alta complejidad en reproducción asistida. El segundo, es el estudio cromosómico del resultado de la biopsia. El grupo de Hammersmith reportó en el año 1991 (1) que la remoción durante la biopsia de hasta dos blastómeros en un embrión de ocho células (día 3 de desarrollo) no afectaba el desarrollo del embrión hasta el estadio de blastocisto (día 5 de desarrollo) ni su estado metabólico. Pero recientemente, se ha objetado esta conclusión (2), ya que si se ve afectada la capacidad de generar embarazos. Actualmente, se recomienda la biopsia de un solo blastómero.
Desde un punto de vista de la ética secular, el diagnóstico molecular de desórdenes cromosómicos o genéticos, que causan abortos, mortinatos o serias enfermedades, es ampliamente aceptado. Sin embargo, hay fuertes objeciones morales provenientes de algunas corrientes religiosas y otras objeciones legales en países donde el aborto es ilegal y se define el inicio de la vida como el momento de la fecundación. Como una alternativa a los problemas morales y legales generados, se ha planteado la posibilidad de realizar el análisis cromosómico del ovocito y no del embrión. Esta técnica se ha denominado Diagnóstico Genético del Corpúsculo Polar o PbGD y consiste en analizar el primer corpúsculo polar antes de la fecundación (3). Originalmente, esta técnica había sido descrita y usada, pero nunca realizada antes de inseminar el ovocito, sino después de 18 horas de realizada la inseminación (4–6). De esta forma, se obtenía tanto el primer corpúsculo polar como el segundo y se tenía un diagnóstico cromosómico retrospectivo. Esto permitiría reconocer los errores cromosómicos de la primera y segunda división meiótica, cubriendo casi el 90% de las aneuploidías (6). Sin embargo, este procedimiento se enfrenta a los mismos problemas morales y legales que el PGD. Por ello, en nuestros estudios posteriores, el diagnóstico se centró sólo en el primer corpúsculo polar y antes de la fecundación (3).
El corpúsculo polar es un subproducto de la ovogénesis y acompaña al ovocito después de la ovulación, ya que se encuentra atrapado dentro de la zona pelúcida. Desde el punto de vista cromosómico, el corpúsculo polar o polocito es la imagen especular del ovocito y cualquier anormalidad numérica cromosómica del polocito está reflejada también en el ovocito. De encontrarse polocitos afectados, los ovocitos correspondientes no serían inseminados y, por lo tanto, no habría embriones que desechar. Actualmente, se utiliza esta técnica en la práctica clínica en la Unidad de Medicina Reproductiva de Clínica Las Condes (3 y resultados no publicados).
El análisis de aneuploidías realizado en 92 pacientes con historias de abortos recurrentes, fallas de fecundación y/o fallas de implantación ha demostrado ser exitoso para seleccionar ovocitos, ya que las tasas de fecundación y embarazo obtenidas sugieren que no existiría daño al ovocito por el procedimiento propiamente tal. Por lo tanto, proponemos que el PbGD representa una alternativa interesante a la biopsia embrionaria, especialmente en países donde la eliminación de embriones no es aceptada.
Enfermedades genéticasEn medicina reproductiva, además de los casos de aborto recurrente o de sub-fertilidad causada por la edad de la madre, existen muchas familias con enfermedades genéticas recurrentes en cada generación. Entre las enfermedades genéticas heredables más conocidas están la Hemofilia, Fibrosis Quística, la Enfermedad de Huntington, la Enfermedad de Gaucher, la de Charcot-Marie-Thooth, el síndrome del cromosoma X frágil, la Talasemia e inclusive la enfermedad de Alzheimer. Algunas de estas enfermedades son desproporcionadamente frecuentes en algunos grupos humanos, como las talasemias entre los descendientes de griegos (7) y la enfermedad de Gaucher entre los descendientes de judíos Asquenazí (8).
La detección de una enfermedad genética en un embrión humano antes de la implantación, permite a los futuros padres la oportunidad de iniciar un embarazo libre de un desorden hereditario, que sea prevalente en su familia. Las enfermedades genéticas pueden ser transmitidas de distintas maneras a la descendencia. Se debe tener en cuenta que toda característica genética está codificada por al menos un par de genes, uno proveniente de la madre y otro proveniente del padre. Estos dos genes codifican para la misma proteína y están ubicados en la misma posición dentro del mismo cromosoma.
La herencia autosómica recesiva es una de las formas de transmitir una enfermedad genética a la descendencia, en ella, se requiere que ambos genes presenten la mutación para que se exprese. Por lo que una persona, con un solo gen alterado es un portador de la enfermedad, pero no está enfermo. Por lo tanto, si dos portadores sanos conforman una pareja, tienen una probabilidad de tener uno de cada cuatro hijos afectados con esta enfermedad. Ejemplos de enfermedades autosómicas recesivas son la Fibrosis Quística o la β-talasemia.
Una segunda forma de transmitir una enfermedad genética, es a través de la herencia autosómica dominante, donde sólo se requiere que una copia alterada de este gen, para que la persona sufra la enfermedad. Por lo que un sólo padre debe tener el gen alterado para pasarlo a su descendencia. Con esta clase de herencia, el 50% de la descendencia se verá afectada por la enfermedad. La enfermedad de Huntington y el Síndrome de Marfán son ejemplos de esta herencia.
Las enfermedades ligadas al cromosoma sexual X son el tercer tipo de forma de herencia. Cuando la enfermedad es recesiva, todos los hombres que porten la mutación se verán afectados y sólo las mujeres con ambos genes afectados también los serán. Si la madre es portadora de una mutación ligada al X tiene 50% de probabilidad de tener un hijo afectado y 50% de probabilidad de tener una hija portadora. Existen más de 400 enfermedades ligadas al cromosoma X.
La enfermedad genética heredable más común entre las personas caucásicas es la Fibrosis Quística (9). Esta enfermedad usualmente se manifiesta en la infancia del niño, causando problemas pulmonares frecuentes, dificultades intestinales, bajo crecimiento e, inclusive, la muerte temprana. Aproximadamente 1 de cada 25 personas (mujeres y hombres) en los Estados Unidos son portadores asintomáticos de esta enfermedad, por lo que son completamente sanos y pueden no tener una historia familiar con niños afectados. Si dos personas portadoras de la mutación para fibrosis quística tienen un hijo, este niño tiene una probabilidad de 1 en 4 de ser afectado. El PGD también permite el diagnóstico genético del embrión para estos y otros casos de enfermedades genéticas heredables a la descendencia. Por otra parte, actualmente, existe un método simple mediante un examen de sangre que puede identificar a los portadores de la fibrosis quística y así saber quienes pueden beneficiarse con un PGD destinado a detectar la enfermedad en el embrión.
El Síndrome del Cromosoma X Frágil es considerado la causa heredable más común de retardo mental en la población general, afectando tanto a hombres como a mujeres (10). Se le ha denominado así porque la mayor parte de los afectados presentan sitios “frágiles” en el cromosoma X, es decir, que cuando se observa un cariotipo, en el cromosoma X se observan quiebres. El retardo mental presente en los individuos afectados tiene una amplia gama, desde muy leve hasta relativamente severo. Los problemas más comunes son déficit atencional, de aprendizaje, hiperactividad, anormalidades del lenguaje o comportamiento del tipo autista. Al contrario de muchas otras enfermedades genéticas, las personas afectadas no tienen signos físicos que las identifiquen y pueden pasar desapercibidos en su familia. Se ha calculado que los portadores para este síndrome pueden ser hasta 1 de cada 625 personas en los Estados Unidos. Como esta mutación se encuentra ubicada en el cromosoma X, toda mujer portadora de la misma tiene un 50% de probabilidad de transmitírsela a cada uno de sus hijos. En cambio, un hombre portador nunca se lo transmitirá a sus hijos, pero siempre se lo transmitirá a sus hijas.
En la Tabla 1 se indican algunas enfermedades causadas por fallas genéticas o por anomalías cromosómicas presentes en la población humana, para las cuales ya existe una herramienta capaz de ser usada para detectarlas en un blastómero de embriones producidos in vitro. Se puede identificar la presencia de estas alteraciones sólo en embriones y con muy baja tasa de error. De esta forma, los embriones son seleccionados y son transferidos a la madre sólo aquellos identificados como normales (11). Actualmente, la selección de embriones portadores de una enfermedad genética, sólo puede realizarse a través del PGD. Existen dos alternativas de PGD: la que utiliza la tecnología de la reacción de polimerasa en cadena (PCR; 12) y la que utiliza la hibridación in-situ fluorescente (FISH; 13).
Algunas fallas genéticas y cromosómicas para las cuales se ha reportado el análisis por PGD, obteniéndose nacimientos o embarazos en curso
| ENFERMEDADES GENÉTICAS |
|---|
| Distrofia miotónica |
| Enfermedad de Huntington |
| Enfermedad de Charcot-Marie-Thooth |
Autosómica Recesiva:
|
Ligadas al Cromosoma X:
|
| ANOMALÍAS CROMOSÓMICAS |
|---|
| Traslocaciones recíprocas |
| Síndrome Cri du Chat (5p-) |
| Síndrome de Prader Willi (15q-) |
| Síndrome de Angelman (15q-) |
| Síndrome de Digeorge (22q-) |
| Asociación Aniridia-Tumor de Wilms (11p13-) |
Anomalías Numéricas o Aneuploidías:
|
Mediante el diagnóstico genético preimplantacional se podría, en principio, identificar todos los desórdenes genéticos, pero existen tres limitaciones prácticas: 1) El examen debe estar adaptado para usar como sustrato sólo una célula embrionaria; 2) Si no se conoce el gen responsable de la enfermedad y se debe hacer un análisis de ligamiento, este debe ser inequívocamente informativo para poder diferenciar el gen normal del gen afectado; 3) Se necesita un personal altamente calificado con equipamiento de laboratorio sofisticado.
El impacto del PGD en este tipo de afecciones sobre el éxito reproductivo es muy alto. La experiencia de los dos centros más grandes de Norte América, con miles de ciclos realizados, confirma esta observación. En los últimos años se han reducido más de 4 veces los abortos espontáneos en portadores de translocaciones y se ha reducido significativamente el número de niños afectados con enfermedades genéticas (14).
Anomalías cromosómicasLas anomalías numéricas cromosómicas o aneuploidías se presentan cuando una célula tiene un cromosoma más o uno menos. Las anormalidades numéricas cromosómicas son la mayor causa de enfermedades hereditarias, con una alta incidencia en los abortos espontáneos (15). De estas, las trisomías de los cromosomas sexuales, 21, 18, 16 y 13 representan el 50% de los abortos por anormalidades cromosómicas. Un estudio realizado en Chile (16) determinó estas frecuencias para los abortos espontáneos locales, en donde las anomalías numéricas cromosómicas presentaban una incidencia de 60%. De estas, las aneuploidías más importantes son la monosomía del X (6%) y las trisomías del cromosoma 16 (12%), 22 (5%) y 15 (3%).
A diferencia de las enfermedades genéticas, las enfermedades cromosómicas de número ocurren de novo, es decir espontáneamente. El único factor de riesgo conocido es la edad materna. Se he determinado, mediante la detección de trisomías por amniocentesis, que se incrementan de 0,6% a 2,2% entre los 35 y 40 años de edad (17). Por lo que, un análisis de aneuploidías preimplantacional debería reducir significativamente el riesgo de pacientes mayores a tener embarazos con trisomías.
La posibilidad de embarazo disminuye con la edad de la madre y esto se debería principalmente a la ocurrencia de las anomalías numéricas cromosómicas que se originan en los ovocitos, aún dentro del ovario (18). Estas anormalidades son irreversibles y ocurren en todas las mujeres, aunque son más frecuentes en mujeres mayores de 35 años (19; 20). Estos ovocitos anormales pueden ser fecundados y producirían embriones también anormales, lo que reduciría las posibilidades de embarazo. En la mayoría de los casos de aneuploidías esta condición es clínicamente inofensiva, ya que el embrión crecerá por algunos días, pero no se implantará o detendrá su desarrollo poco después de implantarse, produciéndose un microaborto, ya que la alteración cromosómica es incompatible con la vida. Pero, si la aneuploidía involucra uno de los pares 13, 18, 21, X o Y el embarazo puede proseguir normalmente hasta llegar al nacimiento. Sin embargo, el feto puede presentar serias malformaciones, junto con retardo mental e inclusive menor expectativa de vida. El más común de estos casos es el de la trisomía 21, conocido como el síndrome de Down, pero también existen los síndromes de Turner (donde hay sólo un X), Klinefelter (XXY), de Patau (con un 13 extra) y de Edwards (con un 18 extra).
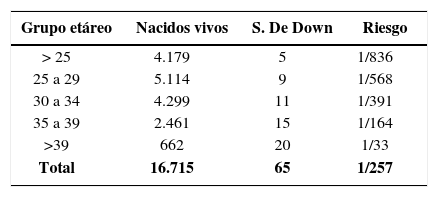
En la Tabla 2 se muestra la frecuencia de niños nacidos con Síndrome de Down (trisomías del cromosoma 21). Esta ocurre, 1 cada 836 nacimientos si la mujer es menor de 25 años y puede ser tan frecuente como 1 cada 33 nacimientos si la mujer tiene 40 años o más (21).
Como se mencionó anteriormente, en las mujeres de edad avanzada no solo aumenta la probabilidad de tener un nacimiento con un niño con una afección cromosómica, sino que disminuye su probabilidad de embarazo. La causa de esta menor tasa de implantación embrionaria sigue siendo controversial y muy discutida. Los datos provenientes de programas de ovo-donación, en donde mujeres jóvenes donan ovocitos para ser utilizados por mujeres mayores, demuestran que la capacidad para embarazarse en estas mujeres mayores no se ve afectada, ya que ellas tienen una tasa de embarazo similar a las mujeres jóvenes. También demuestran que su problema inicial es la calidad de sus ovocitos (22). A pesar de que la causa más probable de esto son las aneuploidías, se ha publicado que también podría deberse a la carencia de componentes citoplasmáticos (23, 24).
La tasa de aneuploidía embrionaria por monosomías y de triploidías es muy similar (16), mientras que, con la excepción de la monosomía del cromosoma X o del 21 (6 % y 0,3 % de los abortos espontáneos), las otras monosomías no se observan en abortos espontáneos (19). Por otro lado, se ha observado que los embriones humanos con monosomías detectadas por PGD, no desarrollan al estadío de blastocisto, con excepción de la monosomía 21 o la del X (25). Con respecto a las trisomías, no se sabe si presentan una menor tasa de implantación que los embriones normales, pero lo que si se ha determinado es que de los embarazos con trisomía 21, aproximadamente el 84% de ellos se abortan espontáneamente (26).
Por lo tanto, la hipótesis es que un análisis de aneuploidías en embriones, podría aumentar las probabilidades de éxito reproductivo en mujeres mayores.
Estudio del embrión (PGD)Los primeros procedimientos de PGD utilizaron la reacción de polimerasa en cadena (PCR) para amplificar e identificar secuencias repetidas del cromosoma Y en embriones de pacientes portadores de enfermedades ligadas al cromosoma X (1). Este procedimiento genera un alto porcentaje de error, ya que se supone un embrión “sano” es aquel que no amplifica la señal buscada. Pero si no existe amplificación, por falla en la técnica o porque se biopsia un blastómero enucleado, se cae en un error diagnóstico.
El grupo de Hammersmith, conociendo su debilidad en el diagnóstico, se asoció con el Departamento de Genética del University College of London para diseñar un método alternativo, donde se pudiera detectar tanto el cromosoma Y como el X. Se decidió cambiar por otra técnica -la hibridación in situ fluorescente (FISH)- lo que permitiría visualizar ambos cromosomas simultáneamente (27). A estas alturas, dos grupos en Estados Unidos iniciaron programas muy exitosos de PGD casi simultáneamente: uno en Nueva York (Cornell) y otro en Chicago. Actualmente existen muchos centros en casi todos los países del mundo donde se realiza PGD, junto a los procedimientos de Reproducción Asistida. Según el Consorcio para PGD de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE-PGD), el diagnóstico genético preimplantacional está disponible en más de 57 centros alrededor del mundo, que reportan sus resultados al Consorcio para darle credibilidad y confiabilidad a este nuevo procedimiento (14). Este Consorcio promueve a sus instituciones integrantes que se estudie y evalúen constantemente los resultados obtenidos, con el fin de tener un control estricto de esta técnica.
Sin embargo, a pesar de que esta técnica esta ampliamente difundida, no es un procedimiento simple, ya que se deben tener en cuenta problemas de contaminación, perdidas alélicas y mosaisismo cromosómico. Esto hace del PGD un método mucho más complicado de lo que se pensó originalmente, no obstante, es un procedimiento exitoso si se realiza en forma adecuada, pudiendo ayudar a cientos de parejas alrededor del mundo.
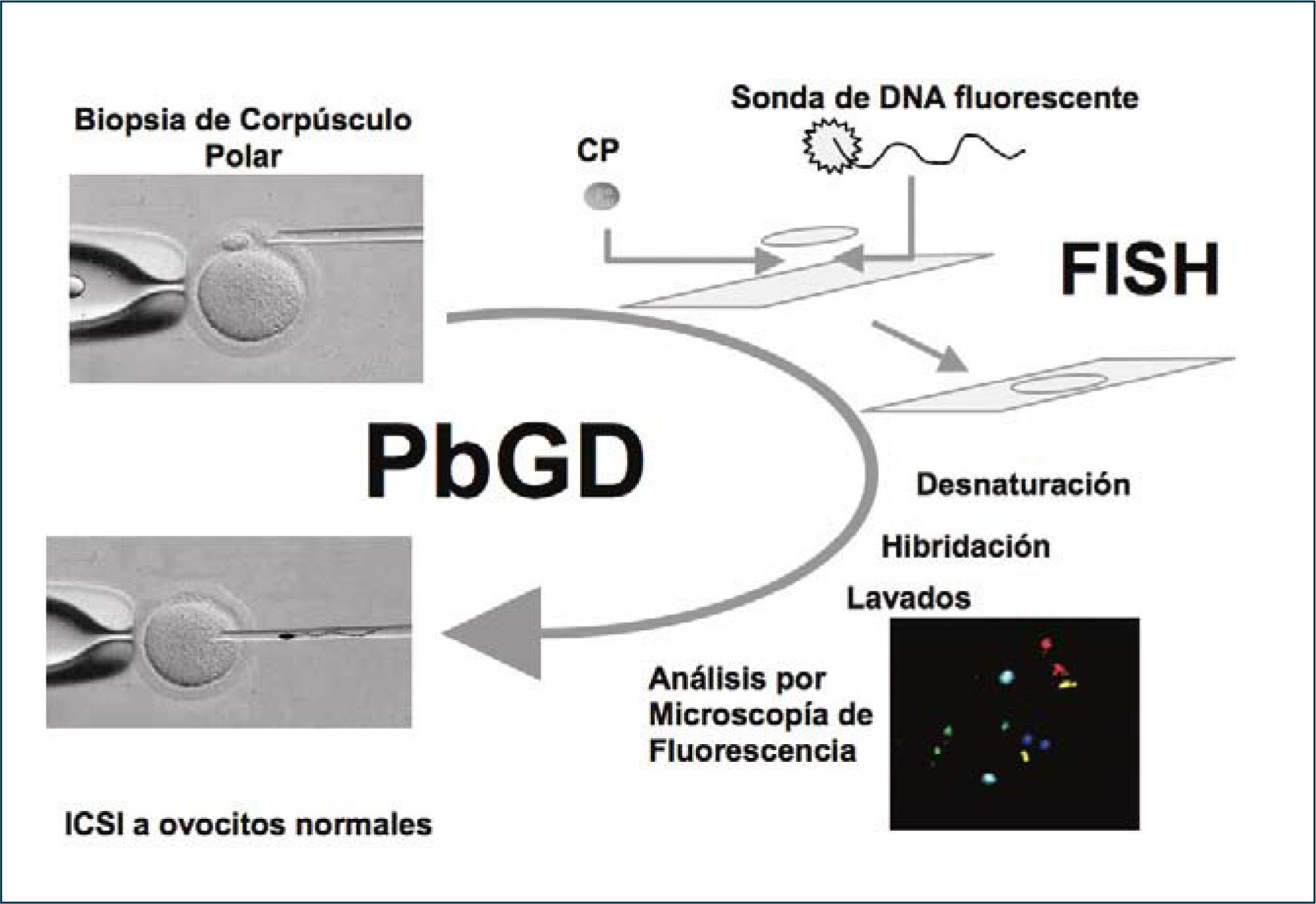
Estudio del corpúsculo polar (PbGD)El diagnóstico genético del corpúsculo polar se debe realizar a partir de un ovocito obtenido de procedimientos de fecundación in vitro, única forma de acceder a ellos. Se debe extraer el corpúsculo polar mediante una biopsia mecánica de esta célula (3). Esta célula extraída es usada para realizar el examen cromosómico. La biopsia consiste en sujetar al ovocito con una pipeta para estabilizarlo y por el otro extremo atravesar la cubierta externa o Zona Pelúcida con una pipeta muy fina y extraer el corpúsculo polar (aspirando con mucho cuidado para no dañar la célula restante, el ovocito). Este procedimiento, hecho por personas altamente capacitadas, no afecta la sobrevida del ovocito, ni impide que el embrión generado luego del procedimiento se desarrolle normalmente, se implante y se forme un individuo normal. Mientras se analiza citogené- ticamente la célula extraída, el ovocito es devuelto a la incubadora y los resultados se obtienen en unas horas. Finalmente, los ovocitos considerados sanos son inseminados, se les deja desarrollar y los embriones son transferidos al útero de la madre.
Los primeros en diseñar un método de biopsia de corpúsculo polar o “polocito” para realizar el PbGD fue un grupo en Chicago (4). El fundamento de esto, es que el ovocito y el primer corpúsculo polar son imágenes en espejo, con respecto a su carga cromosómica. La presencia de un cromosoma extra o uno de menos en el polocito, inequívocamente entrega la información con respecto al ovocito. Siendo su imagen en espejo, presentaría o carecería el mismo cromosoma, respectivamente. Resultando después de la fecundación en un cigoto trisómico o monosómico del mismo cromosoma.
Definitivamente, es un método no invasivo, ya que el polocito es un subproducto de la división meiótica, no siendo requerido para la fecundación o el desarrollo embrionario. Se ha demostrado que su remoción tampoco afecta la tasa de fecundación, tasa de clivaje ni de desarrollo a blastocisto (28). El primer polocito, producto de la meiosis I, es una célula haploide pero con una carga doble de ADN (1n 2c), es decir, con dos cromátides hermanas de los 23 cromosomas humanos. El segundo corpúsculo polar es producto de la meiosis II, luego de ocurrida la fecundación, y es una célula haploide y con una sola carga de ADN (1n1c), es decir, una sola cromátide hermana de cada cromosoma. Por lo tanto, el retiro de uno o de los dos polocitos para su análisis genético no tiene ningún efecto deletéreo en el posterior desarrollo del embrión.
También, es evidente que el polocito es biológicamente diferente a un embrión y, por lo tanto, entregan información muy diferente. Si el análisis se realiza en un ovocito y se biopsia el primer corpúsculo polar, antes de realizar la inseminación, sólo se pueden identificar marcadores maternos. Si el análisis se realiza en un cigoto y se biopsia los dos corpúsculos polares, algunas horas después de la inseminación, también se pueden identificar sólo marcadores maternos, pero tanto de la primera como de la segunda división meiótica. En cambio, si el análisis se realiza en un embrión, éste da información tanto materna como paterna, además del sexo del embrión.
La biopsia del polocito ha sido usada para el análisis de anormalidades cromosómicas (3, 5, 6), de translocaciones (29) y mutaciones puntuales (7, 9) en un gran número de ciclos. La ventaja más evidente de realizar el análisis en el Corpúsculo Polar es que alrededor del 80% de las aneuploidías autosómicas ocurren en la primera división meiótica del ovocito (3, 6). Además, el realizar esta biopsia en el primer Corpúsculo Polar permite que parejas que consideran éticamente inaceptable desechar embriones cromosómicamente anormales lo puedan hacer, pues se realiza antes de la formación del embrión. La desventaja más importante es que sólo se pude evaluar las aneuploidías maternas, las paternas quedan fuera del análisis, así como también los mosaicos y poliploidías generadas después de la fecundación. También se tiene que considerar que se está evaluando el 80% de las aneuploidías y, por lo tanto, el error es más alto si se compara con la evaluación de un blastómero.
El análisis de las aneuploidías más comunes - de los cromosomas 13, 16, 18, 21, y 22 - puede ser realizado mediante una técnica llamada FISH o hibridación in situ fluorescente (Figura 1). Esta técnica utiliza distintos marcadores fluorescentes que identifican a cada uno de los cromosomas de un color distinto. Las distintas combinaciones de colores observadas en una sola célula permiten al especialista distinguir entre una célula normal y una aneuploide.
Cabe hacer notar, que es posible que los exámenes den resultados ambiguos o ningún resultado, pero estos eventos ocurren en menos del 10% de los casos. Un mal diagnóstico significa que un ovocito anormal puede ser considerado normal, con el consiguiente riesgo de obtener un niño enfermo, o que un ovocito normal sea considerado anormal y no sea utilizado para producir un potencial embrión que sea transferido a la madre. Pero se ha determinado que la mayoría de los diagnósticos erróneos se deben a mosaisismo (30). Por lo que se estima que el PbGD presenta una confiabilidad del 90% (2, 8, 30).
Indicaciones para PbGD de aneuploidíasAunque se recomienda el diagnóstico pre-natal a todas las mujeres embarazadas mayores de 35 años, el PbGD de aneuploidías en primera instancia se debe indicar a abortadotas recurrentes y a mujeres mayores de 38 años (14), en donde se ha determinado la mayor frecuencia de embriones aneuploides (3). La evidencia del beneficio del PGD en abortadoras recurrentes originalmente fue dudoso, sin embargo, resultados posteriores han demostrado su beneficio, porque podrían producirse aneuploidías a repetición (30).
Resultados del PbGDEn Centros de Medicina Reproductiva que se consideran de referencia el número procedimientos realizados a pacientes mayores de 35 años casi siempre es más de la mitad del total de los procedimientos realizados por año. Por las evidencias descritas anteriormente (3, 5, 6), sabemos que la mayoría de los ovocitos producidos por mujeres mayores tienen aneuploidías. La posibilidad de poder utilizar la técnica del PbGD en este tipo de pacientes proveería de una herramienta poderosa para aumentar las tasas de éxito reproductivo. De hecho, los resultados obtenidos en nuestra Unidad confirman esto. Hasta la fecha, hemos realizado este procedimiento en 92 pacientes (media de edad de 38 ±5,3 años; rango de edad de 24 a 47; mediana de 40 años), tomando como criterios de inclusión el que la paciente sea mayor de 37 años, sea considerada una abortadora recurrente o que presente fallas repetidas de implantación en procedimientos de reproducción asistida. Se le ha realizado la biopsia del corpúsculo polar a 804 ovocitos de estas pacientes y se ha podido evaluar exitosamente el 83% de ellos. Mediante esta técnica se ha determinado que el 36% de todos los ovocitos evaluados son aneuploides y, por lo tanto, no se les ha inseminado.
De las 92 pacientes que se realizaron la aspiración folicular, 56 (61%) pudieron ser transferidas. Esto porque en 27 de los casos no se encontró ningún ovocito normal y en 7 de los casos, a pesar de encontrarse al menos un ovocito normal, estos no fecundaron. En dos casos se hizo criopreservación total, difiriendo la transferencia, debido a que la paciente pudo haber sufrido el síndrome de hiperestimulación. De estos dos casos, una de las dos pacientes se embarazó con la transferencia de cigotos criopreservados. Por otro lado, si tomamos en cuenta los 34 casos no transferidos, podemos describir esta población como de mujeres mayores (42,2+/−2,2 años) y con un número bajo de ovocitos analizados (4,8+/−2,5 ovocitos). El 80% son mujeres mayores de 40 años y el 60% con menos de 5 ovocitos.
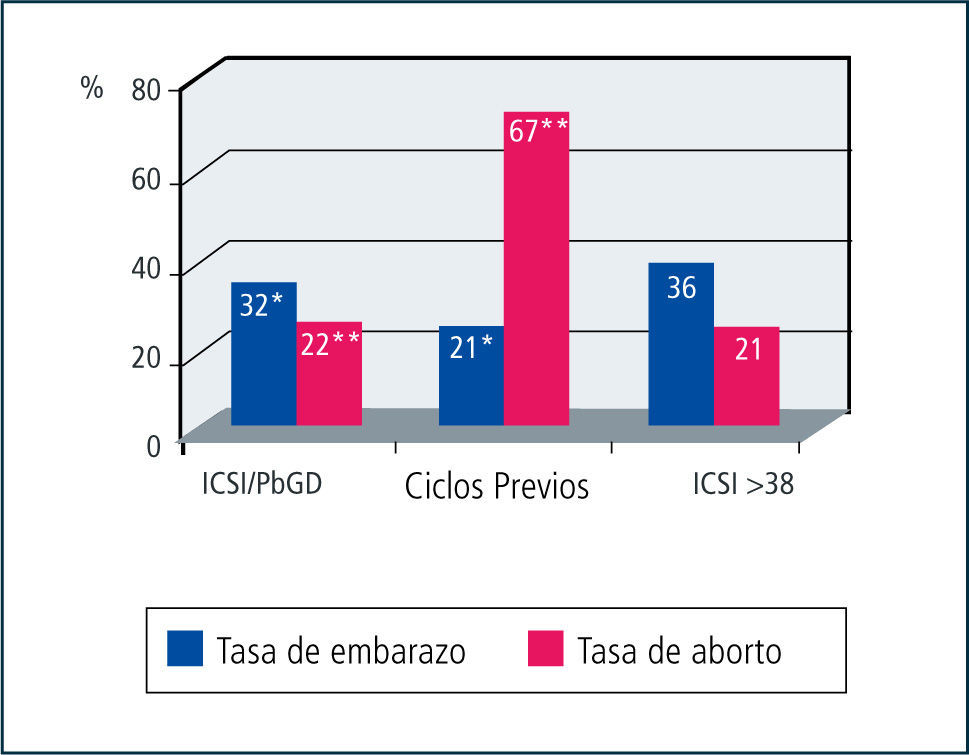
Considerando las pacientes que sí pudieron completar su tratamiento (56 transferencias), 18 pacientes lograron el embarazo clínico deseado. En la Figura 2, se muestra una gráfica en donde demostramos que el procedimiento realizado en estas pacientes fue beneficioso para ellas. Se puede apreciar que la tasa de embarazo en estas pacientes fue de 32% y que el 22% de ellas (4 de 18 pacientes) sufrieron un aborto espontáneo. Si esta población la comparamos con una población general de pacientes de 38 años o más, las tasas de embarazo y aborto son estadísticamente similares. Sin embargo, si la comparamos con ellas mismas, pero con los procedimientos que se realizaron con anterioridad, son estadísticamente muy diferentes, demostrándose que al realizar este tratamiento, mejoraron su expectativa reproductiva.
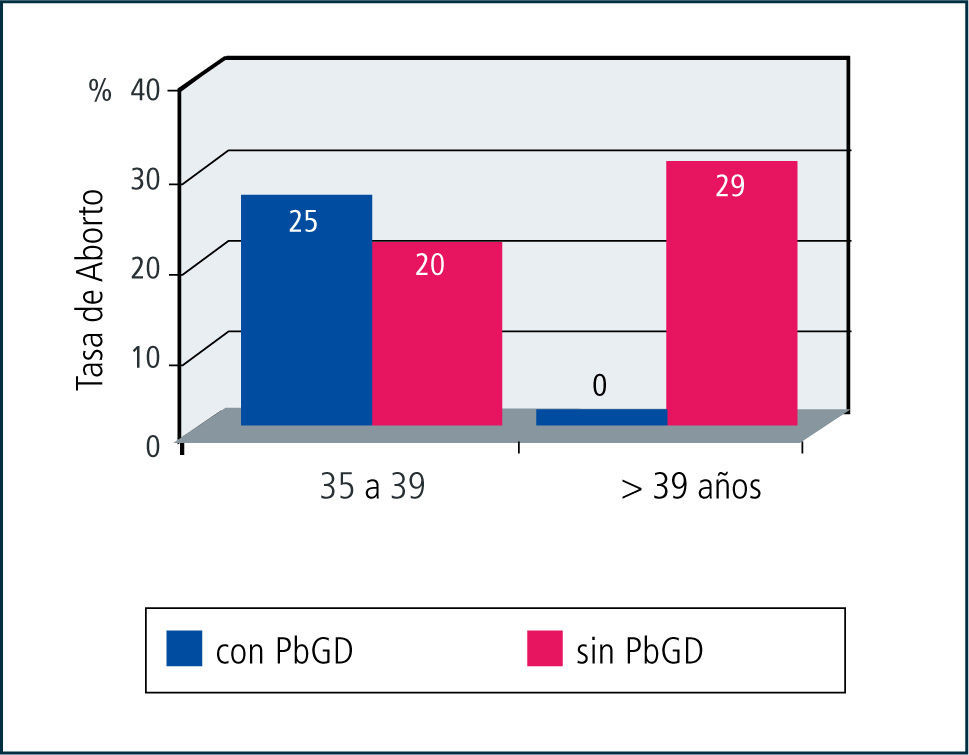
La Figura 3 muestra las tasas de aborto de las pacientes en donde se realizó PbGD, comparándola con la población general, separadas en dos grupos etáreos (sobre y bajo los 40 años). Se puede apreciar que en las pacientes menores de 40, a las cuales se les realiza el PbGD, no se aprecia una reducción en las tasas de aborto, pero en las pacientes de 40 o más años se reduce sustancialmente la tasa de aborto.
Durante los últimos años se ha podido comprobar el impacto positivo que tiene el PGD en la detección de aneuploidías y su beneficio en aumentar las tasas de embarazo. En el mundo, se ha publicado la realización de este procedimiento en más de 10mil ciclos, siendo 4 centros los que han realizado más del 80% de ellos (Chicago; Saint Barnabas, Nueva Jersey; Bolonia; Estambul). Se ha reportado que es posible duplicar la tasa de implantación si se tienen suficientes embriones para realizar el procedimiento (31, 32, 33).
En nuestra experiencia, también es posible aumentar la tasa de embarazo significativamente, siempre y cuando las pacientes tengan 7 o más ovocitos analizados. Esto, indistintamente de la edad, aunque la probabilidad de transferencia, sí se ve afectada por la edad de la mujer. La tasa de pacientes que no se transfieren en mujeres con 7 ovocitos o más analizados, es de un 22%. Este grupo de pacientes tiene una media de edad de 41,5 años (rango de edad de 37 a 44). En cambio, el grupo de pacientes transferidas presenta una media de edad significativamente menor (35,6 años; rango de edad de 27 a 43).
Si analizamos el grupo de pacientes con menos de 7 ovocitos analizados, la tasa de transferencia solo alcanza un 49%. Las pacientes que no se transfieren tienen una media de edad de 42,8 años (rango 38 a 47años). En cambio, las que sí se transfieren tienen una media de la edad de 36,1 años (rango 24 a 44 años). En este grupo de pacientes (con menos de 7 ovocitos analizados), la tasa de embarazo es muy similar a la que tendrían sin el procedimiento, pero el gran beneficio es la reducción de los abortos. No todo en Medicina Reproductiva consiste en lograr un embarazo, sino más bien proporcionar un niño sano en casa, tratando de evitar los abortos y los embarazos de alto riesgo. Por lo que determinar que una paciente no es capaz de engendrar, va a llevar que tome otras alternativas para solucionar su problema reproductivo.
La necesidad de tener suficientes ovocitos para analizar se basa en dos hechos: 1) la tasa de aneuploidía aumenta significativamente con la edad de la mujer; 2) la reserva ovárica disminuye significativamente con la edad de la mujer. Por lo tanto, cuanto mayor es la mujer menos ovocitos se podrán obtener de ella y la mayoría de ellos no serán ovocitos cromosómicamente sanos. El grupo de Chicago demostró, que en más de ocho mil ovocitos analizados de pacientes de edad avanzada, el 53,1% presentaron aneuploidías (34). El grupo de Nueva Jersey, fue más allá en las restricciones para el beneficio del PGD, afirmando que no sólo se deben tener un número adecuado de ovocitos o embriones analizables, sino que las pacientes de edad avanzada que realmente se ven beneficiadas con el aumento de la tasa de implantación son aquellas que no tienen más de tres ciclos previos fallidos de procedimientos de medicina reproductiva (31). Sin embargo, las pacientes con abortos recurrentes no se ven afectadas por el número previo de ciclos de reproducción asistida realizados (35).
Futuro del Diagnóstico Genético en Medicina ReproductivaAunque, como se ha descrito, el PGD y el PbGD son una gran herramienta para mejorar la eficiencia reproductiva de algunas pacientes, esta técnica tiene varias limitaciones que deben superarse. Actualmente, por FISH sólo se pueden analizar 5 cromosomas simultáneamente, el en mejor de los casos hasta 13 (solo en embriones y mediante la re-hibridación de las mismas metafases, con la posibilidad de que estas se deterioren con los sucesivos lavados). Existiría una técnica que permite visualizar todos los cromosomas simultáneamente: la SKY (Spectral Karyotyping Imaging). Pero esta técnica necesita de metafases bien definidas, al igual que la técnica de cario-tipificación normal. Muchos de los corpúsculos polares o blastómeros que se biopsian no están en metafase, por lo tanto, esta técnica no se podría aplicar clínicamente por el momento.
Otra alternativa, es abordar el problema a través de las técnicas de biología molecular, amplificando todo el genoma de una célula y luego cuantificando su contenido. Dos técnicas se están desarrollando para esto: la CGH (Comparative Genome Hybridization) y la QF-PCR (Quantitative Fluorescence Multiplex PCR). Se han realizado algunas series con pacientes, pero muy pequeñas hasta ahora. El inconveniente de estas técnicas es que el tiempo requerido para realizarlas es de dos a tres días, por lo que puede hacerse solo PGD y los embriones biopsiados deben ser criopreservados hasta que se obtenga el resultado. Esto hace poco práctico el método para los procedimientos clínicos. El desarrollo de la tecnología de los Micro-arrays o Chips de DNA ha sido también aplicado en medicina reproductiva. El desarrollo de micro-arrays a la medida podría proporcionar una herramienta poderosa para el diagnóstico de aneuploidías e inclusive para mutaciones genéticas específicas. Varios prototipos de micro-arrays han sido diseñados para el análisis convencional de aneuploidías y translocaciones Robertsonianas, sin embargo, esta técnica es aún experimental.
El autor declara no tener conflictos de interés, en relación a este artículo.