La enfermedad renal crónica (ERC) constituye una de las causas más frecuentes de hipertensión arterial (HTA) secundaria. Existe una nueva clasificación de la ERC basada en la presencia de un daño estructural con o sin un deterioro de la velocidad de filtración glomerular (VFG). La prevalencia de la HTA varía principalmente según la magnitud de la VFG y la etiología de la enfermedad del parénquima renal. Los mecanismos hipertensógenos primordiales son: la retención de sodio e hipervolemia, y la activación del eje renina angiotensina aldosterona. La HTA es también un factor de progresión de la ERC. La terapia se basa en la restricción de sodio, diuréticos y bloqueadores del eje renina angiotensina. Consideraciones farmacológicas y clínicas son fundamentales para un efectivo uso de esta terapia. Los objetivos son la prevención cardiovascular y renal, a través de la obtención de determinados niveles de presión arterial (PA).
Chronic kidney disease (CKD) is one of the most common causes of secondary hypertension (HTN). Currently, there is a new classification of CKD based on the presence of structural damage with or without glomerular filtration rate (GFR) deterioration. The prevalence of HTN in CKD varies mainly depending on the magnitude of the GFR and the etiology of renal parenchymal disease. Main hipertensive mechanisms are: salt retention with fluid overload, and renin angiotensin aldosterona axis activation. HTN is also a factor for CKD progression. The current therapy is based on sodium restriction, diuretics and renin angiotensin system blockers. Pharmacological and clinical precautions are essential for an effective use of this therapy. Objectives are to prevent cardiovascular and renal events, through obtaining certain blood pressure (BP) levels.
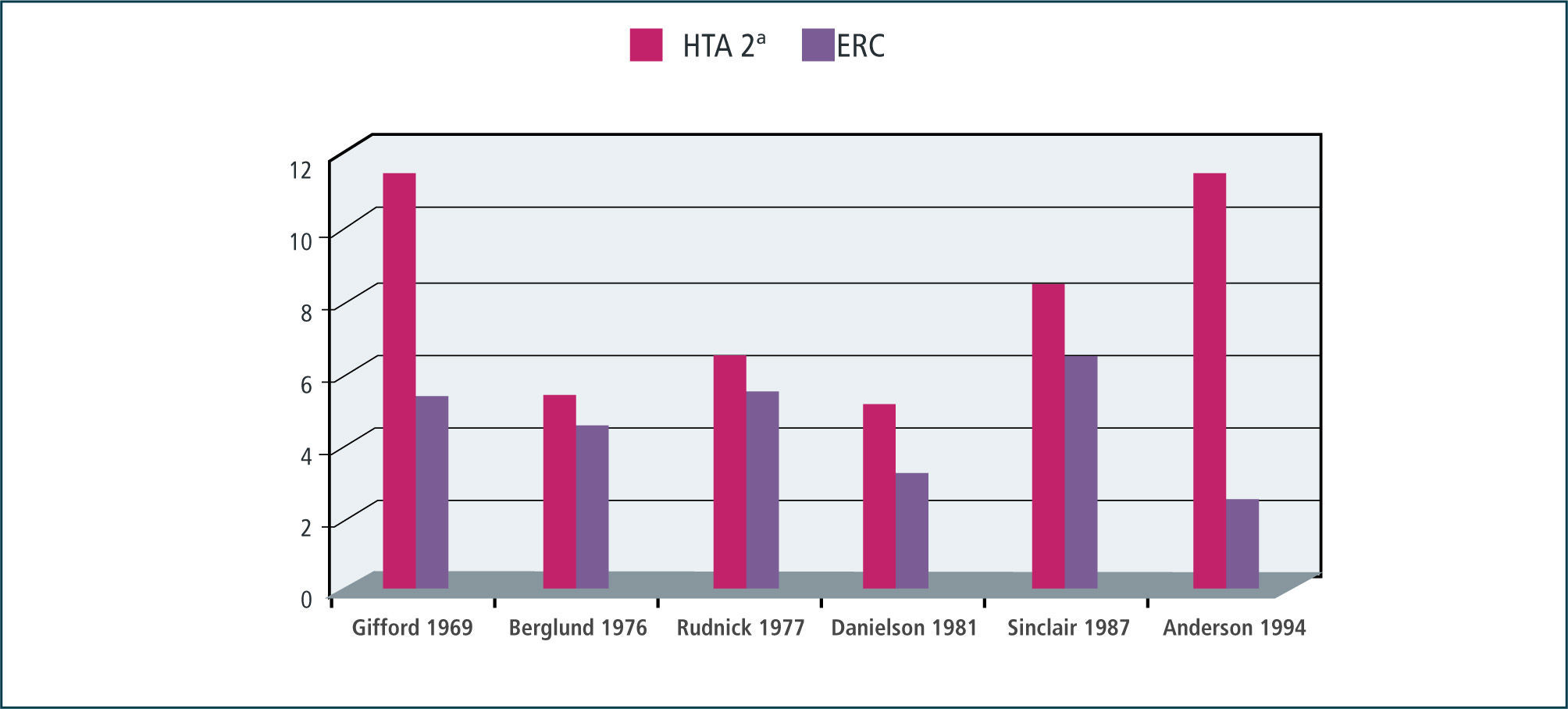
La hipertensión (HTA) de origen renal, causada por una enfermedad renal crónica (ERC), es una de las causas más frecuentes de HTA secundaria (HTA 2a), junto al hiperaldosteronismo primario y a la hipertensión renovascular. En el concepto de HTA de origen renal, o sea aquellas entidades que afectan el parénquima renal, no se incluye a la hipertensión renovascular. La prevalencia de esta forma de HTA 2a es entre un 2 a 5%, según la mayoría de los estudios de frecuencia de HTA 2a (Figura 1)(1).
Diagnóstico de ERCEn la actualidad se define ERC como: a) presencia de marcadores de daño renal por tres o más meses evidenciado por un daño funcional y/o estructural del riñón, que se manifiesta por alteraciones patológicas u otros marcadores de daño renal como alteraciones del examen de orina o en el estudio de imágenes; y/o b) disminución de la velocidad de filtración glomerular (VFG) a niveles menores de 60ml/min./1.73m2 por tres o más meses con o sin otros signos de daño renal (2).
El requerimiento de un período mínimo de 3 meses en la definición de ERC implica que las alteraciones deben ser persistentes, y conlleva que son potencialmente progresivas, y en consecuencia, con riesgo de llevar a insuficiencia renal terminal.
Para el cálculo de la VFG, se han propuesto el uso de fórmulas, para evitar los errores y molestias de la recolección de orina de 24 horas. Las fórmulas más utilizadas son: Cockcroft-Gault, y MDRD-4 (3). La fórmula MDRD-4 se originó de los datos del estudio MDRD (Modification of Diet in Renal Disease), efectuado en pacientes con una VFG disminuida. En cambio la fórmula de Cockcroft-Gault, se originó de sujetos considerados sanos con una VFG normal (Figura 2).
La fórmula que se recomienda que se utilice por su exactitud es la MDRD-4, pero que tiene la dificultad de necesitar un programa matemático para su cálculo. En cambio la fórmula Cockcroft-Gault es más sencilla de utilizar y que da un valor bastante aproximado.
En la actualidad existen múltiples posibilidades de obtener la VFG estimada según la formula MDRD-4, ya sea a través de portales Web tales como www.mdrd.com o www.medcalc.com, programas computacionales gratis disponibles para dispositivos electrónicos como www.epocrates.com, o más recientemente, informada por los laboratorios con el resultado de la creatinina plasmática.
Sin embargo, en situaciones especiales como en menores de 18 años, obesos mórbidos, desnutridos graves, vegetarianos estrictos, amputados o en aquellos con distrofias musculares, tetraplejia o paraplejia, la precisión de las fórmulas de estimación de la VFG disminuye, y en estas situaciones es recomendable la medición del clearence de creatinina de 24 horas (4).
Clasificación de la ERCLa US NKF-KDOQI (United States National Kidney Foundation-Kidney Disease Outcomes Quality Initiative) ha propuesto una clasificación de la ERC, que se ha difundido rápidamente en la comunidad médica inter nacional (2). Esta clasificación divide la ERC en 5 etapas, de acuerdo a la VFG estimada a través de las formulas de predicción, Cockcroft-Gault o MDRD (Tabla 1). Esta nueva clasificación se fundamenta principalmente en que la VFG es el mejor marcador de la función renal y no el nivel de la creatinina plasmática, y en que el riesgo de morbi-mortalidad cardiovascular (CV) aumenta en directa relación a la declinación de la VFG (5, 6). En Chile, basado en la Encuesta Nacional de Salud 2003 y en la Cuenta de Hemodiálisis Crónica, la prevalencia en mayores de 17 años de ERC en etapas 3, 4 y 5 corresponde a 5,7%, 0,2% y 0,1%, respectivamente. Los exámenes realizados en la ENS 2003 no permiten determinar la prevalencia de ERC en las etapas 1 y 2. En nuestro país, extrapolando los valores señalados en estudios de prevalencia en población estadounidense, se estima una prevalencia de ERC de un 11% en la población adulta, aproximadamente 1.000.000 de chilenos mayores de 20 años tendría ERC (4).
Causas de ERC E HTA 2aLas ERC que se pueden presentar como HTA 2a pueden ser glomerulares, túbulo-intersticiales, vasculares (arterias pequeñas intrarrenales) y post-renales (Tabla 2).
La prevalencia de la HTA varía principalmente según la magnitud de la VFG y la etiología de la enfermedad del parénquima renal.
Respecto a la VFG, la prevalencia de la HTA varía inversamente con la VFG, es decir a menor VFG mayor prevalencia. En el estudio MDRD (7) desde un 66% con una VFG de 80ml/min./1.73m2 hasta un 95% con una VFG de 12ml/min./1.73m2. En la encuesta nacional de salud de los Estados Unidos, NHANES III, la prevalencia también se relacionó inversamente con la VFG (Figura 3)(8).
En cuanto a la estructura afectada del parénquima renal, la prevalencia de HTA es más alta en las enfermedades glomerulares y de arterias pequeñas intrarrenales que en las enfermedades túbulo-intersticiales, que se estima en un 85% versus un 62,6 % (7). Esta diferencia está presente, incluso cuando la VFG está preservada (8).
Entre las entidades glomerulares, la nefropatía diabética y la glomerulone-fritis focal y segmentaria tienen la más alta prevalencia de HTA, cercana al 80%. En cambio entre las entidades túbulo-intersticiales, la HTA se encuentra con una frecuencia del 50% en los pacientes con enfermedad poliquística del adulto, pudiendo sí ser su forma de manifestación inicial (7).
También, se han identificado como factores predictores independientes de HTA en la ERC: índice de masa corporal elevado, raza negra, edad y género masculino (8).
Fisiopatología de la HTA en la ERCEn la HTA de origen renal pueden estar involucrados varios mecanismos hipertensógenos, tales como:
- a)
- b)
Aumento de la actividad del eje renina-angiotensina-aldosterona.
- c)
Aumento de la actividad del sistema nervioso autonómico simpático.
- d)
Disminución de vasodilatadores endógenos derivados del endotelio.
Sin embargo, pueden existir otros mecanismos según el estadio de la ERC, especialmente en la etapa 5, tales como: estrés oxidativo, rigidez y calcificación de los grandes vasos, aumento de la endotelina y hormona paratiroidea, y efectos de drogas como eritropoyetina. Sin lugar a dudas, los primordiales son la retención de sodio y el aumento de la actividad del eje renina-angiotensina-aldosterona.
Una de las características de la HTA de origen renal, es la pérdida del descenso nocturno de la PA, fenómeno llamado non-dipping. Este fenómeno está presente en las diversas entidades de ERC aún con VFG normal. Este patrón de PA se acentúa a medida que se reduce la VFG (9).
Efecto del descenso de la pa en la progresión de la Insuficiencia renalLa HTA y proteinuria son los dos factores, independientes, que mejor predicen la progresión de la insuficiencia renal. Diversos estudios han demostrado que el factor de mayor impacto en la progresión de la ERC es el control de la PA. Así, si se mantiene una HTA no tratada en un paciente con ERC la pérdida de función renal es mayor a 10ml/min./año. En cambio, si el control llega a niveles <130/80mmHg la pérdida de la función renal es cercana a la observada con el envejecimiento normal (10). En la Figura 4 se observa el efecto del control de la PA en la progresión de la ERC (10).
¿Cuáles son los valores de pa deseados en la ERC?Basado en guías clínicas, metanálisis y estudios clínicos randomizados, se puede concluir lo siguiente (9, 11–14): (Tabla 3)
- a)
El riesgo más bajo de progresión se observa con niveles de PAS de 110 a 119mmHg, si tiene proteinuria de ≥ 2gr./día.
- b)
El riesgo aumenta si la PAS es > 130mmHg, si tiene proteinuria ≥ de 1gr./día.
- c)
La PA deseada en aquellos con proteinuria ≥ de 1gr./día debe ser ≤ 1 25/75mmHg.
- d)
La PA deseada en aquellos con proteinuria < de 1gr./día debe ser ≤ 130/80mmHg.
- e)
La PA en sujetos > de 70 años con ERC, debe ser individualizada, y considerar particularmente la PA en posición de pie, ya que no existen suficientes estudios en esta población etaria (15). Posiblemente una PAS objetivo pudiese ser 140mmHg.
- f)
Los valores de PA ideales para el etapa 5 no están aún bien definidos.
En pacientes con ERC, en cualquiera de sus etapas, está recomendado con una grado A de evidencia la restricción de sodio en la dieta. Existen evidencias clínicas y experimentales sobre el rol primordial del sodio en la HTA de la ERC (16). La recomendación de la NKF es la reducción de la ingesta de sodio a menos de 100mEq/día, que corresponden a 2,4grs./día.
El sodio está presente fundamentalmente en la sal común y en alimentos ricos en sal o determinados conservantes, así por ejemplo:
- •
alimentos enlatados (vegetales, carnes, comidas con pasta).
- •
alimentos procesados (cecinas, embutidos).
- •
queso amarillo.
- •
cubitos concentrados.
- •
sopas (enlatadas y deshidratadas)
- •
bocadillos (palomitas de maíz, aceitunas, copos de queso, frutos secos salados, etc.)
- •
salsas y aderezos para ensaladas como la salsa de soya.
La restricción del sodio en la dieta es fundamental para evitar una “ganancia de sodio”, ya que los pacientes con ERC presentan una disminución de la agudeza para detectar alimentos salados, lo que los puede llevar a agregar aún más sal a sus alimentos (17).
El reemplazo de sal sódica por sal potásica o sales mixtas de sodio y potasio está contraindicado en pacientes con VFG < 60ml/min./1.73m2, debido al alto riesgo de hiperkalemia. En estos pacientes, no está recomendada la dieta DASH (Dietary Approaches to Stop Hypertension), que es una dieta rica en frutas, vegetales, alimentos lácteos bajos en grasas, Abra dietética, potasio (110 a 115mEq/día), calcio y magnesio, pobres en grasas totales, grasas saturadas y colesterol, y moderadamente alta en proteínas (1,4gr./Kg./día) y en fósforo (1700mgr./día) (18). Esta dieta, aunque de mayor efectividad que otras dietas en el descenso de la PA en sujetos con HTA esencial, tiene para pacientes con ERC, particularmente para aquellos con VFG < 60ml/min./1.732, los inconvenientes de un alto contenido de proteínas, potasio y fósforo, ya que lo recomendado en ERC es: 0,75gr./Kg./día, 50mEq/día y 700mgr./día, respectivamente (18–20).
Dietas de alta popularidad como la dieta Atkins para bajar de peso, tampoco están recomendadas por el alto contenido en proteínas.
La ingesta excesiva de alcohol (OH), más de 2 tragos al día, está asociada a una mayor prevalencia de HTA (21). La reducción del consumo de alcohol se asocia a una reducción de la PA de tipo dosis dependiente, similar entre no-hipertensos e hipertensos. Sin embargo, no existen estudios en pacientes con ERC, pero se considera extrapolable esta medida para estos pacientes. Se recomienda para las mujeres no excederse de un trago al día, y para los hombres no más de 2 tragos al día (22). Un trago equivale a: 340ml de cerveza, 140ml de vino o 40ml de whisky.
Finalmente, existen varios estudios sobre el beneficio de la reducción ponderal en pacientes con ERC y sobrepeso sobre la progresión de la enfermedad y sobre el control de la PA.
Terapia farmacológica de la HTA en la ERCEn primer lugar, en el tratamiento farmacológico de la HTA en la ERC, es fundamental siempre un adecuado control de la volemia, que pudiese conseguirse con la restricción de sodio (aproximadamente 80 mEq en 24 horas) en la dieta asociada o no a diuréticos. Sin embargo, en casi todos estos pacientes no se logra la restricción dietética necesaria y requieren diuréticos para el control de la volemia, mecanismo hipertensógeno predominante en la ERC.
Los diuréticos son un apoyo en los pacientes con ERC ya que: a) disminuyen la retención de sodio y agua, b) presentan un efecto aditivo en la reducción de la PA al combinarse con cualquier otro antihipertensivo, c) permiten el uso concomitante de bloqueadores del sistema renina-an- giotensina-aldosterona (SRAA) al disminuir la posibilidades de hiperkalemia, y d) pueden ser beneficiosos para el manejo de la hiperkalemia de la ERC avanzada (23).
La elección del diurético en la ERC depende de la VFG, que determina la duración del efecto y la potencia natriurética de la droga.
Tanto los diuréticos de asa (Ej.: furosemida) como los tiazídicos (Ej.: hidroclorotiazida), actúan a nivel del lumen de la célula tubular y llegan al sitio de acción por secreción tubular (túbulo proximal) a través de los transportadores de aniones orgánicos, ya que son ácidos (aniones) orgánicos. El mecanismo de secreción tubular es compartido por otros aniones orgánicos y urato, que tienden a acumularse en la ERC avanzada, participando éstos en la pérdida del efecto natriurético. La filtración glomerular de los diuréticos es mínima por su altísima unión a las proteínas plasmáticas. Eso sí, en general, la magnitud de la secreción tubular se correlaciona a la VFG. El sitio de acción de los diuréticos de asa está en el asa ascendente de Henle, que regula el 30% del sodio filtrado; y de los diuréticos tiazídicos está en el túbulo distal, que regula sólo el 3 a 5% del sodio filtrado. Así entonces, se comprende la diferente potencia natriurética entre los diuréticos de asa y tiazídicos (Figura 5) (24).
La furosemida (FS) por su metabolización y excreción renal, la duración de su efecto (normalmente de 6 horas) se prolonga a medida que disminuye la VFG en la ERC, lo que permite utilizarla más alejadamente. La hidroclorotiazida (HCTZ), que también es metabolizada a nivel renal, su efecto se prolonga desde 12 a 24 horas al decaer la VFG (23).
Basado en lo expuesto, si la VFG es < a 30ml/min. y/o el paciente tiene edema, los diuréticos tiazídicos son poco efectivos como fármaco aislado, y en consecuencia, en estas condiciones debiesen utilizarse los diuréticos de asa como furosemida en dosis efectivas y repetirse cada doce horas (13, 24).
Una particularidad es la biodisponibilidad de ambas drogas, para HCTZ un 70%, pero para FS varía entre un 10 a 90%. Esto último sugiere que en presencia de un escaso efecto natriurético, puede ser necesario aumentar la dosis de FS antes catalogar la situación como resistente a FS (13, 23).
En relación al uso clínico de los diuréticos ciertas consideraciones deben tenerse en cuenta:
- a)
En pacientes con ERC y edema, la dosis de FS debe regularse según el descenso de peso diario, cuyo objetivo debe ser no mayor de 0.5 kilo por día, llegando finalmente al “peso seco”, pero siempre controlando la PA en posición de pie.
- b)
El descenso máximo de la PA se produce después de 6 a 8 semanas de terapia diurética, debido a una disminución de la resistencia vascular periférica. Así mismo, su efecto también demora semanas en desaparecer. Finalmente, no debemos olvidar que estas drogas pueden desencadenar crisis de gota, y como sulfonamidas pueden ocasionar reacciones alérgicas y fotosensibilidad (24).
Los diuréticos retenedores de potasio como amiloride o triamterene no debiesen ser utilizados en la ERC, si la VFG es < a 30ml/min./1.73m2 o en aquellos que reciben bloqueadores del SRAA.
En segundo lugar, en aquellos con proteinuria ≥ 1gr. /día los bloqueadores tradicionales del sistema renina-angiotensina (SRA), ya sea inhibidores de la enzima convertidora (IECA) o antagonistas del receptor de angiotensina II (ARAII), han demostrado en múltiples estudios, tanto en nefropatías proteinúricas diabéticas y no-diabéticas, un beneficio en retardar la progresión de la ERC más allá del efecto producido por el descenso de la PA. Estos fármacos retardan la progresión a través de: mantener cifras tensionales adecuadas, disminuir la presión del capilar glomerular, desacelerar el proceso de fibrosis renal y disminuir la permeabilidad del capilar glomerular a las proteínas, disminuyendo así el daño túbulo-intersticial.
Su efecto protector renal se traduce clínicamente por una reducción de la proteinuria. El descenso de la PA no siempre se asocia a un descenso de la proteinuria en los estudios con IECA o ARAII, cerca de un 40% de los pacientes pueden mostrar una disociación entre los dos (15).
En estas circunstancias de ERC con proteinuria ≥ 1gr./día, el objetivo terapéutico de los bloqueadores del SRA es lograr proteinuria ≤ 500mgr./día. En condiciones de proteinuria en rango nefrótico, especialmente en rango masivo (proteinuria > 10gr./día), puede también considerarse como objetivo terapéutico, una reducción de la proteinuria en un 50%, ya que este porcentaje de reducción se asocia a un mejor pronóstico de la VFG en el largo plazo (25).
No se demostrado aún mayor beneficio con valores inferiores a 500mgr./día de proteinuria (15).
Los estudios de mayor impacto con IECA, que demostraron un efecto aditivo respecto a la PA, fueron el estudio AIPRI (ACE Inhibition in Progressive Renal Insufíciency) en que se utilizó benazapril versus placebo en 583 sujetos no diabéticos (26), el estudio Captopril Collaborative Study Group en que se comparó captopril versus placebo en 409 diabéticos con nefropatía clínica (27), y el estudio italiano GISEN, comparando ramipril versus placebo en 352 individuos no diabéticos (28).
Los estudios más trascendentes con ARAII fueron los estudios: IRMA2 (Irbesartan in Patients With Type 2 Diabetes and Microalbuminuria Study), IDNT (Irbesartan Diabetic Nephropathy Tria), y RENAAL (Reduction of Endpoints in NIDDM with the AII Antagonist Losartan). En el estudio IRMA2 se comparó irbesartan versus placebo en diabéticos hipertensos con microalbuminuria (MA), demostrándose una reducción de la MA y una menor tasa de progresión a nefropatía clínica, o sea albuminuria > 300mgr./24hrs (29). En los estudios INDT (Figura 6) y RENAAL se demostró que tanto irbesartan como losartan fueron superiores a amlodipino y placebo en reducir la proteinuria y en retardar la progresión a ERC etapa V respectivamente (30, 31).
En tercer lugar, las dos familias de bloqueadores de canales de calcio (BCC) tienen efectos diferentes sobre la proteinuria, independiente de su efecto sobre la PA. Así los BCC de tipo no-dihidropiridínicos (BCC-noDHP) como diltiazem y verapamilo, reducen la proteinuria en diversos modelos experimentales, aunque su efecto en humanos es sólo marginal. En cambio, los BCC de tipo dihidropiridínicos (BCC-DHP), ampliamente reconocidos por su potencia hipotensora, son inferiores en retardar la progresión de la ERC, como fue demostrado en el estudio IDNT, ya que pueden incrementar la proteinuria por su mayor efecto en la arteriola aferente que en la arteriola eferente. Pero, eso sí los BBC-DHP se pueden utilizar en la ERC proteinúrica y no son deletéreos, si los pacientes ya están recibiendo un ARAII como se observó en el estudio RENAAL (Figura 7) (32).
En cuarto lugar, no debe omitirse que para el control de la HTA en los estudios clínicos randomizados de ERC, cualquiera sea su etiología, se requieren en promedio tres medicamentos antihipertensivos diferentes por día, para llegar a las PA objetivos (Figura 8). Eso sí, el incremento de medicamentos debe ser de manera escalonada (10).
En quinto lugar, referente a los bloqueadores del receptor de aldosterona como espironolactona (SPL), constituyen una opción en determinadas circunstancias, siempre y cuando el nivel de potasio sea ≤ 4.5mEq/Lt, y con controles estrictos del potasio plasmático.
Diversas observaciones clínicas han demostrado que la SPL tiene un significativo efecto antihipertensivo en las siguientes circunstancias: HTA resistentes, HTA asociada a obesidad y apnea del sueño, e hiperaldosteronismo primario (33). También debe señalarse, que la SPL puede potenciar el efecto de diuréticos tiazídicos o de asa en sujetos con edema.
Por otro lado, la asociación a bloqueadores del SRA en dosis bajas de SPL (12,5 a 25mg/día) potencia el efecto antiproteinúrico de los anteriores. Esta asociación se basa en que se produce un escape de aldosterona. El escape a aldosterona consiste en un aumento de los niveles de aldosterona plasmática en el largo plazo en pacientes que reciben IECA o ARA II, a pesar de la caída inicial en la aldosteronemia. El escape de aldosterona es fisiopatológicamente importante, ya que diversos estudios clínicos y experimentales indican que la activación de su receptor por aldosterona tiene efectos deletéreos, aumentando la inflamación, la fibrosis y la proteinuria incluso en forma independiente del control de la PA. Así, la SPL en dosis bajas pudiese utilizarse en estas circunstancias, si el nivel de potasio es ≤ 4.5mEq/Lt, para potenciar el efecto antihipertensivo, antiproteinúrico o natriurético, pero con controles seriados del potasio plasmático (15).
Respecto al riesgo de hiperkalemia, éste es especialmente alto en pacientes con VFG < 30ml/min./1.73m2 que reciben terapia concomitante con bloqueadores del SRA u otra terapia que pueda elevar el potasio plasmático. En estudios clínicos randomizados con SPL, una ERC en etapas 4 y 5 se considera un criterio de exclusión. En la actualidad parece prudente no utilizar SPL por el riesgo de hiperkalemia, en pacientes con VFG ≤ 45ml/min./1.73m2 con un potasio plasmático ≥ 4.5mEq/Lt (34, 35).
En sexto lugar, los inhibidores directos de renina (IDR) como aliskiren, son una nueva herramienta para inhibir el SRA, bloqueando este sistema desde su origen. Aunque no puede desconocerse sus interesantes propiedades farmacológicas como su larga vida media (≈ 40 horas) e intenso bloqueo de la actividad de la renina plasmática, sólo tenemos hasta el año 2009 en cuanto a estudios clínicos randomizados, estudios de corto plazo (36).
En el estudio clínico randomizado AVOID (Safety and Efficacy of Aliskiren When Added to Standardized Losartan and Optimal Antihypertensive Therapy in Patients With Hypertension, Type 2 Diabetes and Proteinuria), aliskiren versus placebo, realizado en 599 pacientes con DM tipo 2 y nefropatía (índice albuminuria/creatininuria ≥ 300mg/g) tratados con losartan 100mg/día, la adición de aliskiren en dosis inicialmente de 150mg/día y luego de 3 meses de 300mg/día, mostró a los 6 meses un mayor efecto protector a nivel renal, medido como un descenso del 20% del índice albuminuria/creatininuria (37). Este efecto fue independiente del nivel de PA alcanzado. No hubo diferencias en la tasa de efectos adversos entre aliskiren y placebo. Eso sí, en este estudio no se incluyó pacientes con potasio plasmático ≥ 5.1mEq/Lt.
Aunque aún no existen recomendaciones internacionales de consenso sobre uso clínico, podemos mencionar que pudiesen recomendarse en ERC para aquellos sujetos con proteinuria persistente, mayor de 1gr./día, y potasio ≤ 5.0mEq/Lt, que: a) no toleran IECA, ARA II o espironolactona, b) no cumplen diariamente la terapia bloqueadora del SRAA, o c) refractarios a la terapia bloqueadora del SRAA.
En séptimo lugar, el bloqueo dual del SRA, o sea la asociación de IECA y ARA II, pudiese ser utilizado en ERC con proteinuria que no alcanza los niveles adecuados con un inhibidor del SRA y cuyos niveles de potasio son no superiores a 5.5mEq/Lt. Particular precaución debe tenerse en pacientes con VFG < 30ml/min.
No está recomendado el bloqueo dual del SRA de manera no escalonada, es decir comenzar el tratamiento antihipertensivo con dos drogas del SRA al mismo tiempo, luego de los resultados del estudio ONTARGET (The ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) (38) y luego de la falta de veracidad del estudio COOPERATE (Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease) (39).
En el estudio Ontarget los pacientes que comenzaron con la terapia de bloqueo dual, telmisartan 80mg/día más ramipril 10mg/día, presentaron una significativa mayor tasa de eventos renales, definidos como: necesidad de diálisis, aumento de la creatinina al doble de la basal y/o muerte, comparados con aquellos que comenzaron con ramipril 10mgr./día o telmisartan 80mg/día (HR=1.09, 95% Cl=1.011.18, p=0.037), independiente del nivel basal de proteinuria (38). Más aún, los pacientes asignados a este tipo de terapia dual tuvieron significativamente más efectos adversos, especialmente episodios de hipotensión.
En consecuencia, la terapia de bloqueo dual del SRA pudiese ser recomendada, siempre y cuando sea utilizada escalonadamente, si el paciente continúa hipertenso y con proteinuria, eso sí evitando las hipotensiones. Debemos mencionar que no existen estudios de largo plazo que avalen el uso de terapia de bloqueo dual sobre terapia única con IECA o ARA II (36).
En octavo lugar, los bloqueadores del sistema simpático pueden utilizarse en el control de la PA en la ERC, dependiendo del tipo de bloqueador y de determinadas condiciones clínicas.
Los beta bloqueadores (BB), drogas de 2a línea, han demostrado mejorar la sobrevida de pacientes con ERC en estudios observacionales, particularmente en etapas avanzadas.
En presencia de ciertas condiciones clínicas asociadas tales como cardiopatía coronaria y/o insuficiencia cardiaca están plenamente indicados (40).
En el estudio African American Study of Kidney Disease and Hipertensión (AASK) de nefrosclerosis hipertensiva en afroamericanos, metoprolol, un beta bloqueador de acción larga, demostró reducir la progresión de la ERC, pero en menor grado que los bloqueadores del SRA (41).
Eso sí en pacientes con ERC debe tenerse en cuenta la posibilidad de prolongación de su vida media, por ejemplo con atenolol en etapas 4 y 5 (34).
Los alfa bloqueadores como doxazosina pudiesen utilizarse como drogas de 3a línea, particularmente en aquellos con uropatía obstructiva baja. Pero debe recordarse, que estas drogas tienden a producir retención de sodio por su bloqueo alfa adrenérgico a nivel renal, y por lo tanto, tienen el riesgo de ocasionar insuficiencia cardíaca. En consecuencia, no debiesen utilizarse no asociados a diuréticos (42).
Un alfa y beta bloqueador como carvedilol, puede ser considerado una droga coadyuvante en presencia de insuficiencia cardíaca o como droga de 2a línea por sus propiedades antihipertensivas: bloqueo beta y alfa adrenérgico, y vasodilatador periférico.
Los bloqueadores centrales como metildopa, clonidina o moxonidina pudiesen utilizarse como drogas de 4a línea, ya que la activación simpática central constituye uno de los mecanismos hipertensógenos en la ERC, pero tienden a producir retención de sodio y sequedad bucal, lo que puede disminuir su efecto antihipertensivo.
En noveno lugar, en aquellos casos de resistencia a los diuréticos y/o de edema refractario, la asociación de diuréticos de asa y tiazídicos ha demostrado utilidad clínica, particularmente la combinación de furosemida y metolazona (43). En relación al uso de combinaciones de diuréticos debe tenerse en cuenta que la dosis deben regularse según el descenso de peso diario, cuyo objetivo debe ser no mayor de 0.5 kilo por día, ya que este tipo de terapia puede ocasionar un estado pre-renal.
Finalmente, en décimo lugar, un vasodilatador directo como minoxidil puede ser una opción en pacientes del sexo masculino refractarios a otras terapias, siempre y cuando sea asociado a diuréticos y beta bloqueadores. La hipertricosis ocasionada por esta droga dificulta su uso en mujeres.
Precauciones en el uso clínico de IECA y ARAIINormalmente se produce un alza de 10 a 20% de la creatinina dentro de los primeros 7 días de IECA y/o ARAII, pero suele estabilizarse en 4 a 8 semanas e incluso luego de semanas comienza a descender al valor basal (44). Si se produce un deterioro ≥ de 35% de la creatinina, es necesario descartar especialmente una enfermedad renovascular bilateral, hipovolemia o ingesta de AINEs. El incremento > al 35 % de la creatinina basal ocurre entre un 5 a 20% de los pacientes. Las condiciones de mayor riesgo de un deterioro ≥ de 35 % de la función renal por IECA y/o ARAII se relacionan a estados de hipovolemia y/o hipoperfusión renal como: insuficiencia cardiaca, PAM< 65 mmHg y ERC etapas III o más (45). Es muy importante recalcar que “aquellos que más se benefician con estos fármacos, son aquellos que les aumenta inicialmente la creatinina”, en consecuencia, un incremento de la creatinina no debe necesariamente ocasionar la suspensión (44). Siempre debe chequearse los niveles de creatinina y potasio a los 5 días de comenzar la terapia con IECA o ARAII (13). Frente a descompensaciones agudas con compromiso de la volemia se recomienda su suspensión temporal.
El principal efecto adverso riesgoso es la hiperkalemia (nivel de potasio plasmático > 5,5mEq/Lt) que se puede observar preferentemente en el paciente diabético y en aquellos con ERC etapas IV y V. Se ha observado que el nivel de potasio plasmático durante la terapia con IECA se correlaciona inversamente con la VFG (45). Se recomienda su medición previo y 5 a 7 días después del inicio de estos fármacos. En aquellos casos en que se desarrolla una hiperkalemia, se sugiere reducir en un 50% la dosis del IECA o ARAII, y controlar en 5 a 7 días (13). Entre las medidas preventivas eficaces se encuentran: evitar las sales de cloruro de potasio si la VFG es < 60ml/min./m2, evitar el consumo de alimentos ricos en potasio tales como melón, kiwis y plátanos, y no asociar a diuréticos retenedores de potasio ni a antiinflamatorios no esteroidales o inhibidores de la COX2 (13, 46). A menudo no valorados como medidas preventivas de la hiperkalemia son la corrección de la constipación y de la acidosis.
Aunque no muy considerados, la tos seca y el angioedema son dos de los efectos adversos más molestos para los pacientes. La frecuencia de la tos seca, según un reciente metanálisis de 29 estudios en que se reportaba como un efecto adverso, es de un 9,9% para IECA y un 3,2% para los ARA II (47). En cambio, el angioedema que es muy raro, y es casi propio de los IECA. En el estudio ALLHAT su frecuencia en aquellos Caucásicos asignados a IECA fue de un 0,3%. Desde un punto de vista clínico, es recomendable traspasarse de un IECA a un ARAII si presenta tos seca, no así si ha presentado un episodio de angioedema, ya que éstos pueden ocasionar riesgo vital (13).
Estrategia para el control de la HTA en la ERCEs sabido que el control de la PA en la ERC es difícil de lograr y que requiere habitualmente múltiples fármacos, y basado en los estudios clínicos randomizados se puede concluir que en ERC no proteinúrica se necesitarán en general 3 fármacos, pero en ERC proteinúrica 4 fármacos.
La elección de los fármacos de 1a línea, que corresponden a diuréticos y IECA o ARAII, la droga inicial dependerá de la presencia de proteinuria, que favorece el uso de IECA o ARAII. En los IECA o ARAII se debe ir titulando la dosis hasta llegar a las máximas dosis recomendadas, siempre vigilando los cambios en el potasio y creatinina.
En cambio, la elección de las drogas de 2a línea, que corresponden a BCC-DHP, BCC no DHP, y beta bloqueadores (BB), dependerá de la frecuencia cardiaca y comorbilidades. Los BBC no DHP tienen un efecto marginal en la reducción de la proteinuria.
Así entonces, en la figura 9 se muestra una estrategia de control de la PA en ERC para etapas I a IV.
Mensajes finales de la terapia antihipertensiva en ERCEl tratamiento de la HTA en el paciente con ERC, similar a cualquier otra forma de HTA, tiene siempre como objetivos disminuir la PA y reducir la morbilidad y mortalidad CV. Pero en esta forma de HTA, son también objetivos transcendentales el reducir la proteinuria y retardar la progresión de la ERC. Para lograr estos objetivos se requerirá siempre una significativa reducción en la ingesta de sodio y un número no menor de drogas antihipertensivas, habitualmente tres o más medicamentos. El uso eficaz y seguro de las drogas antihipertensivas en la ERC, requiere no sólo un control seriado de la PA, si no también un control periódico de la función renal y en especial de los niveles de potasio plasmático.
El autor declara no tener conflictos de interés, en relación a este artículo.