COVID-19 tuvo un amplio espectro de manifestaciones clínicas, desde formas asintomáticas hasta graves. Un porcentaje significativo de sujetos infectados desarrolla el síndrome de distrés respiratorio agudo (SDRA).
Objetivouso de posición prono y ventilación con liberación de presión de las vías respiratorias (APRV), para mejorar la oxigenación en un paciente con SDRA por COVID-19.
Caso clínicopaciente de 73 años, con diabetes e hipertensión arterial, presenta diagnóstico de neumonía por COVID-19 grave, que requirió uso de ventilación mecánica invasiva (VMI). En contexto de oxigenación deficiente, difícil sedación y deterioro gasométrico, se inicia APRV. Con el avance del compromiso pulmonar, las estrategias ventilatorias fueron poco fructíferas por lo que se decide utilizar prono+APRV.
Resultadosun total de 574 horas en VMI y 274 horas en prono divididos en 3 ciclos de duración. Los primeros ciclos de prono+APRV fueron relevantes en cuanto mejoras en PaO2/FiO2 (PaFi), sin embargo, a partir del tercer evento en prono, no hubo cambios significativos.
Conclusionesprono+APRV fue adecuada a los requerimientos del paciente, sin embargo, el curso clínico de la enfermedad produjo un deterioro irreversible.
COVID-19 had a wide spectrum of clinical manifestations, from asymptomatic to severe forms. A significant percentage of infected subjects develop acute respiratory distress syndrome (ARDS).
ObjectiveUse of prone position and airway pressure release ventilation (APRV) to improve oxygenation in a patient with COVID-19 ARDS.
Clinical case73-year-old patient, with diabetes and high blood pressure, presented with a diagnosis of severe COVID-19 pneumonia, which required the use of invasive mechanical ventilation (IMV). In the context of poor oxygenation, difficult sedation and blood gas deterioration, APRV is started. With the progression of pulmonary involvement, ventilatory strategies were not very fruitful, so it was decided to use prone+APRV.
Resultsa total of 574hours in IMV and 274hours in prone divided into 3 cycles of duration. The first cycles of prone+APRV were relevant in terms of improvements in PaO2/FiO2 (PaFi), however, from the third prone event, there were no significant changes.
Conclusionsprone+APRV was adequate to the patient's requirements, however, the clinical course of the disease produced irreversible deterioration.
COVID-19 tiene un amplio espectro de manifestaciones clínicas, desde formas asintomáticas hasta graves. Un porcentaje significativo de sujetos infectados desarrolla el síndrome de distrés respiratorio agudo (SDRA)1, presentando hipoxemia refractaria, y alteración de la distensibilidad del sistema respiratorio en algunos casos, siendo la respuesta inflamatoria local pulmonar uno de los desencadenantes en los casos graves que favorecen la mortalidad de la población2.
Actualmente los pacientes con SDRA grave son ventilados con bajo volumen corriente y posición prono (PP)3, incluyendo bloqueo neuromuscular (BNM) que podría llegar a causar atrofia muscular, alargando los días de ventilación mecánica invasiva (VMI) en unidades de cuidados intensivos (UCI)4. En este escenario, la ventilación con liberación de presión de las vías respiratorias (APRV) se presenta como una posible alternativa, que permitiría mantener la ventilación espontánea en el SDRA. Ésta modalidad ventilatoria+PP podrían ser beneficiosas, una combinación que hasta el día de hoy sigue siendo poco estudiada5.
APRV es una modalidad espontánea, que se caracteriza por una presión continua en la vía aérea con una breve fase de liberación intermitente, y una la relación inspiración/espiración invertida, favoreciendo el reclutamiento pulmonar e intercambio gaseoso6. Este modo ventilatorio en pacientes sin COVID-19 con SDRA ha demostrado una disminución en los requerimientos de sedación, días de ventilación mecánica y estancia en UCI. En pacientes COVID-19 se han reportado mejoras significativas entre la presión parcial de oxígeno arterial (PaO2), la fracción de oxígeno inspirado (FiO2), y la relación de ambas PaO2/FiO2 (PaFi). Sin embargo, ha sido estudiada escasamente en PP5,7, por lo que el objetivo de este estudio es presentar un reporte de caso de SDRA por COVID-19, para determinar el comportamiento gasométrico (PaFi), en relación a sesiones de prono con VMI en modalidad APRV.
Paciente y métodoPaciente de género masculino de 73 años, con un índice de masa corporal (IMC) de 22,8, físicamente inactivo, con antecedentes mórbidos de diabetes mellitus (DM) e hipertensión arterial (HTA), que inicia con fiebre, tos seca irritativa, acude a urgencias tras 7 días en su hogar. A su ingreso se realiza radiografía de tórax (figura 1) observándose infiltrados bilaterales, con examen positivo para COVID-19, parámetros inflamatorios al alza y saturación de oxígeno (satO2) de 89% al aire ambiente, que posteriormente persiste <90% a pesar de uso de oxigenoterapia convencional. (Índice de gravedad Apache II de 17 puntos al ingreso).
Se decide traslado a Unidad de Cuidados Intensivos para vigilancia y monitorización. Evoluciona de manera tórpida requiriendo VMI dentro de las primeras 24 horas en modalidad asistida controlada por volumen (AC/V) con estrategia protectora, además se realiza una maniobra de reclutamiento alveolar (MRA) ascendente en modalidad controlada por presión (PC) con una presión positiva al final de la expiración (PEEP) de 6 hasta 20 cmH2O para titular presiones, sin embargo, persiste con PaFi <150.
En contexto de oxigenación deficiente, difícil sedación y deterioro gasométrico en (AC/V), se decide inicio de APRV en posición supina (PS) (tabla 1). APRV en PS muestra mejoras hasta aproximadamente las 300 horas de VMI, luego aumenta el compromiso pulmonar con caída de PaFi <150 donde se decide prono+APRV realizando un total de 3 eventos (tabla 1).
Parámetros de inicio de la VMI en PS y eventos de PP + APRV
| Parámetros en APRV | Inicio VMI PS | Evento 1 PP | Evento 2 PP | Evento 3 PP |
|---|---|---|---|---|
| Fr. prog/Fr. total | 12/14 | 10/12 | 10/18 | 10/26 |
| Vt. espirado | 520ml | 800ml | 558ml | 528ml |
| T̊. espiratorio | 0,5s | 0,5s | 0,5s | 0,5s |
| Sens. espiratoria | 25% | 15% | 25% | 15% |
| P̊ media | 26cmH2O | 26cmH2O | 24cmH2O | 26cmH2O |
| P̊ máx./PEEP high | 33/28 | 32/28 | 32/25 | 30/28 |
| PEEP low | 8cmH2O | 12cmH2O | 10cmH2O | 12cmH2O |
| P̊ soporte | 20cmH20 | 20cmH2O | 20cmH2O | 20cmH2O |
| FiO2 | 50% | 80% | 50% | 60% |
| SatO2 pulso | 97% | 96% | 98% | 94% |
Fr: frecuencia respiratoria; Vt. espiratorio: volumen corriente espirado; T̊. inspiratorio: tiempo espiratorio (segundos); sens. espiratoria: sensibilidad espiratoria; P̊ media: presión media de la vía aérea; P máx. presión máxima de la vía aérea; PEEP high: presión final de espiración alta; PEEP low: presión final de espiración baja; P̊ soporte: presión de soporte; PP: posición prono PS: posición supino.
Las horas en VMI desde el inicio hasta el tercer evento de prono que realizó el paciente fueron de 574 horas, de las cuales se obtuvo control gasométrico entre 1 a 2 horas junto con monitorización de presión peak máxima hasta 40 cmH2O, presión media hasta 30 cmH2O, y saturación mayor o igual a 90%.
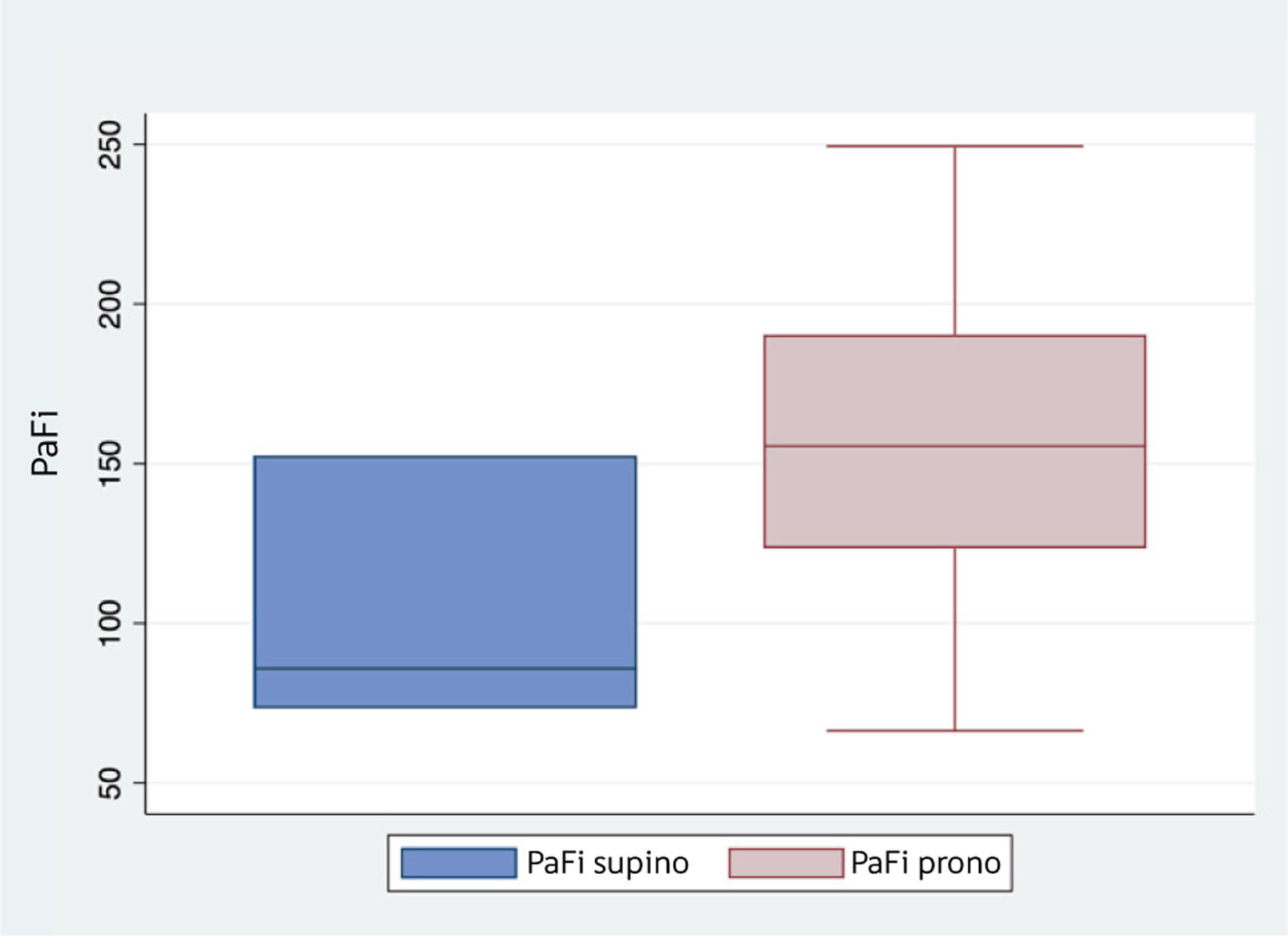
El inicio del primer evento PP del paciente fue con PaFi de 73,3 tras haber transcurrido 301,75 horas desde el inicio de la VM. Se registraron los parámetros gasométricos y ventilatorios para analizar su comportamiento durante los eventos de PP. Los datos fueron analizados con el programa STATA versión 15, las variables de interés fueron: PaFi, sesiones en PP, y horas de ventilación mecánica. La PaFi en PP resultó con una mediana de 155,52 (190,5; 123,45) considerando los tres eventos en PP (figura 2), y por cada evento que alcanzó a realizar el paciente, la oxigenación también mostró ser mayor a 150 en relación a la PaFi en PS (tabla 2).
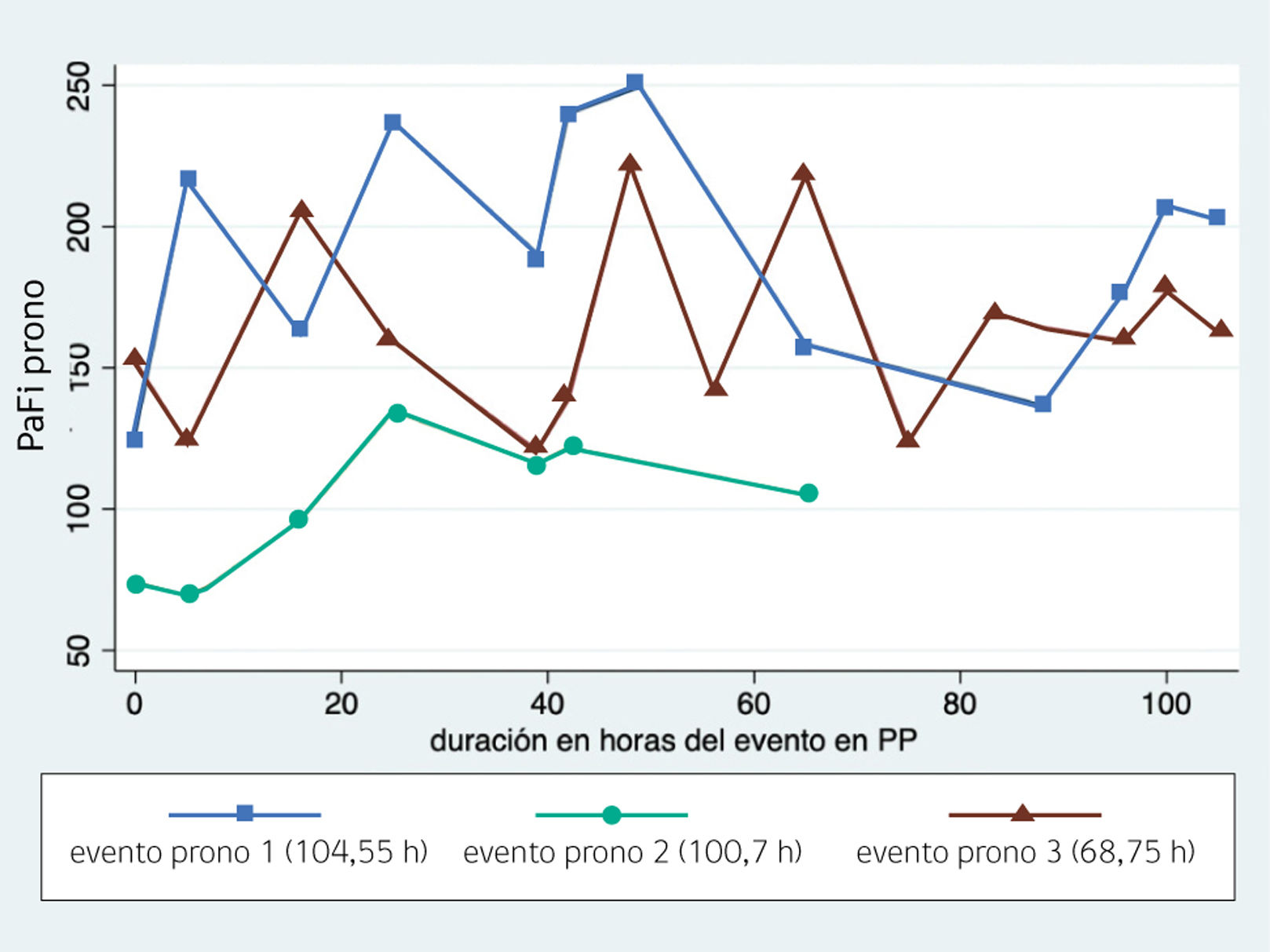
La PP tuvo un total de 274 horas, de las cuáles el mayor número de estas corresponden al evento 1 y 2, estos dos eventos en PP también corresponden a una menor cantidad de horas en VMI en relación al evento 3 (tabla 3). Las horas de VMI desde el inicio de la PP hasta el final del evento 3 muestran una caída de la PaFi a medida que van pasando las horas en VMI con high entre 28 y lo mínimo de 26 cmH2O. Las horas de mejor oxigenación para el paciente son entre las 300 y 400 horas, las cuales corresponden a los primeros eventos de PP realizados. La duración de cada evento en PP muestra el comportamiento de la PaFi en relación al tiempo de duración en horas (figura 3).
La PP ha sido utilizada en el manejo del SDRA, sin embargo, hay escasa evidencia que respalde su uso con modalidades no convencionales como APRV. Incluso hasta la fecha, la investigación sobre el uso combinado se limita a tres informes de caso, un estudio observacional prospectivo y sólo a un ensayo clínico aleatorizado (ECA)5,7,8.
APRV ha resultado provechoso en cuanto a mejoras de la oxigenación, cambios hemodinámicos y disminución de la necesidad de bloqueo neuromuscular, considerando todas las complicaciones que éste conlleva. Igualmente se ha asociado a menor tiempo en UCI, por lo tanto, inferimos una posible disminución de las complicaciones asociadas a VMI.
Nuestro paciente inició de forma temprana APRV+PS, considerando previamente el uso de ventilación convencional, sin embargo, la evolución clínica desfavorable hizo que requiriera PP, donde se mantuvo la modalidad ventilatoria con la finalidad de mantener el reclutamiento alveolar, presiones pulmonares, y no afectar la oxigenación.
Los primeros ciclos de PP en nuestro paciente fueron relevantes en cuanto a la oxigenación, ya que generaron importantes mejoras en PaFi, sin embargo, a partir del tercer evento en PP, PaFi no tuvo mejoras significativas con una PaFi de 105,4 y un total de más de 500 horas en VMI, lo que también se asocia a las comorbilidades presentadas por el paciente y la condición clínica irreversible que evolucionó a falla multiorgánica. La PP se mantuvo en los primeros dos eventos sobre las 72 horas, optando por un prono prolongado para obtener una PaFi mayor de 150. Esto no se aleja de la realidad clínica de las publicaciones de otros centros que han mostraron su experiencia en modalidad APRV+PP, al igual que el reportado por Ergün B. et al. (2023) quienes combinaron APRV+PP obteniendo resultados favorables en oxigenación, y sin cambios en mortalidad5.
¿Por qué PP+APRV?En el caso presentado hemos expuesto estas intervenciones en conjunto, y nace la pregunta ¿Por qué prono+APRV?, si bien se han expuesto algunos de los beneficios del APRV ¿cómo podemos determinar que en conjunto con PP es beneficioso? Sabemos que aún es controversial el uso de ésta modalidad ventilatoria en relación a la monitorización de la mecánica pulmonar sumado a PP, sin embargo, los beneficios de la PP son conocidos, permitiendo al pulmón una ventilación más homogénea con distribución más uniforme de la presión transpulmonar, optimizando el reclutamiento pulmonar y disminuyendo la presión cardiopulmonar, la cual es sometida a estrés frente a PEEP alto y/o disminución de la contractibilidad cardíaca9. Al utilizar la estrategia expuesta, también quisimos obtener un mayor volumen al final de la espiración, para lograr presiones transpulmonares (PTP) más positivas, requiriendo PEEP más alto, lo que se evidencia con la medición de la PTP10, no obstante, las zonas dependientes del pulmón pueden colapsar. Por consecuencia, se necesitan presiones altas para mantener el pulmón abierto y no generar daño estructural por estrés.
Si bien, el balón esofágico es una buena alternativa para medir PTP y titular PEEP más adecuada, su uso es controversial, pues no está claro si mide la presión pleural en todos sus planos, y que ésta se relacione directamente con la abertura completa de zonas colapsadas, las cuales en nuestro reporte de caso mostraban cada vez más deterioro según imágenes radiológicas y PaFi.
Con la experiencia clínica de nuestro equipo en UPC, creemos que al no poder medir con exactitud la mecánica pulmonar en APRV, la estrategia APRV+PP evitó realizar constantes MRA, siendo la opción menos deletérea a nivel pulmonar y diafragmático, evitando la sedación excesiva y el BNM, además no se presentó ningún evento adverso asociado a la VMI, a pesar del daño estructural de pulmón. Las presiones en APRV no generaron neumotórax lo cual podría haber sido lo esperado en este tipo de paciente posterior a su tercer evento de prono.
En relación al desenlace del caso, el curso clínico se tornó más complejo, llegando a la falla multiorgánica, y a nivel respiratorio los focos de vidrio esmerilado progresaron a focos de consolidación con daño estructural pulmonar, generando refractariedad a las intervenciones realizadas. Consideramos que las comorbilidades y características personales de nuestro paciente empeoraron la evolución clínica.
LimitacionesEste estudio no proporciona una evidencia robusta en la estrategia, ya que solo contó con un paciente; esto limita extrapolar la intervención a una población con similares características.
ConclusiónConcluimos que la estrategia APRV+PP fue adecuada a los requerimientos del paciente, ya que se logró mantener el pulmón en constante reclutamiento pulmonar, y protección diafragmática. Los resultados fueron exitosos desde el punto de vista gasométrico en los dos primeros eventos, sin embargo, en el tercer evento hubo deterioro clínico generalizado, similar a lo reportado en artículos con estrategia de VMI protectora+PP. La condición clínica del paciente con relación a las horas de VMI, y el inicio oportuno de una estrategia ventilatoria parece ser clave.
Es importante destacar la necesidad de un equipo multidisciplinario entrenado, considerando un amplio manejo en cuanto al uso de sedación, ventilación mecánica y personal disponible para realizar los cambios de posiciones.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones ÉticasEste reporte de caso cuenta con el consentimiento informado y autorización del paciente, quien aceptó el uso de sus datos e imágenes con fines educativos y de investigación al momento de su ingreso a la Unidad de Paciente Crítico de Clínica Indisa.
Agradecemos al equipo de Kinesiología de la Unidad del Paciente Crítico de Clínica Indisa, Chile por el constante interés de sus miembros en participar en la generación de evidencia científica.