La epidemia del Virus de la Inmunodeficiencia Humana (VIH) sumado al mayor acceso a terapias antiretrovirales (TAR) han llevado a un aumento del número y la sobrevida de pacientes que viven con esta infección.
Si bien existe una relativa facilidad para realizar el diagnóstico de un paciente con la infección crónica por VIH, existe por otro lado una relativa dificultad para realizar el diagnóstico de la infección aguda en etapas tempranas de la infección. Esta situación es de importancia desde el punto de vista de la Salud Pública por cuanto en la infección aguda es cuando se producen las viremias más elevadas y por tanto la mayor facilidad para que el sujeto sea infectante y disemine la infección viral.
The epidemic of human immunodeficiency virus (HIV) in addition to increased access to antiretroviral therapy (ART) virus have led to an increase in the number and survival of patients living with this infection.
While there is a relatively easy to diagnose a patient with chronic HIV infection, there is, on the other hand a relative difficulty in making the diagnosis of acute infection in the early stages of infection. This is important from the point of view of public health because in acute infection is when the most high viral loads occur and therefore easier for the subject is infectious and spread the viral infection.
El Virus de la Inmunodeficiencia Humana (VIH) es un retrovirus del género lentivirus causante del Síndrome de Inmunodeficiencia Adquirida (SIDA), cuadro descrito hace ya tres décadas. Se conocen dos subtipos: el VIH-1 y el VIH-2, siendo el primero el más común y de distribución mundial, mientras que el segundo es una variante menos virulenta, más prevalente en África Occidental y Central.
Se estimó que al 2011 existían 34.2 millones de personas viviendo con la infección por VIH, en comparación con 29.1 millones en 2001. En 2011 se infectaron 2.5 millones de personas y murieron 1.7 millones, lo cual marca un 22% de reducción en contagio en comparación a 2001 y una disminución del 26% en muertes en comparación a 2005. Sin embargo, estos números están marcados por una gran dispersión: África Subsahariana es la zona más afectada seguida por Europa del Este y el Caribe (1). En Chile el primer caso de VIH/SIDA se notifcó en 1984. Entre ese año y 2012 se estima que existían 39.000 personas infectadas con el VIH (2).
La necesidad para una prevención efectiva de la infección por VIH nunca ha sido mayor, revisaremos los avances para comprender los mecanismos de transmisión y la infección aguda por VIH. Los test de cuarta generación disponibles en el mundo permitirán el diagnóstico de la infección en muchos pacientes y puede conducir a instancias de nuevas terapias y oportunidades para la prevención.
Dentro de los primeros días de la adquisición del VIH ocurre una enfermedad transitoria, a veces, sintomática asociada a altos niveles de replicación del VIH y a una rápida caída de los linfocitos T CD4.
Se define como infección aguda a la presencia de altos niveles de RNA viral en plasma en presencia de un Test de Elisa negativo y/o Western Blot negativos o indeterminados (<3 bandas positivas) englobando respuesta inmune humoral, mientras que la infección temprana incluye tener documentado un plasma libre de anticuerpos al menos seis meses antes, esto último obviamente es un concepto más amplio (3).
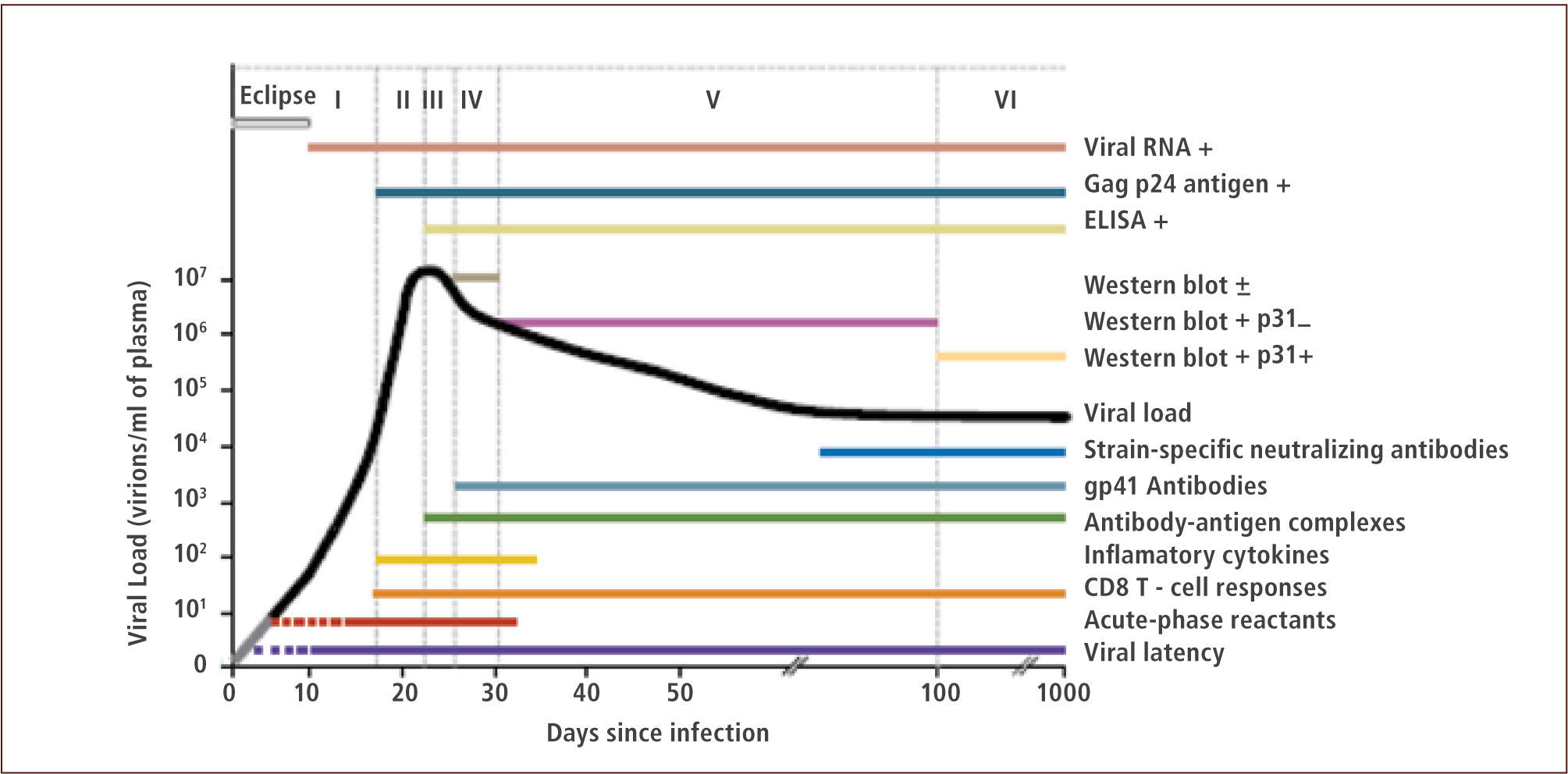
Más del 80% de los adultos infectados con VIH-1 en el mundo se debe a la exposición de superficies de mucosas al virus, el 20% restante se ha infectado por inoculación percutánea o intravenosa. El riesgo de infección asociado con diferentes rutas de exposición varía, sin importar cual sea, pero el tiempo de aparición de marcadores virales en el hospedero es generalmente uniforme y sigue un patrón ordenado. Inmediatamente después de la exposición y transmisión, el virus se replica en la mucosa, en la submucosa y drena hacia el tejido linforeticular y no puede ser detectado en plasma. Esta fase es denominada “fase de eclipse” y dura entre 7 a 21 días. Una vez que el RNA viral alcanza concentraciones de 1 a 5 copias por mililitro de plasma el virus puede ser detectado usando métodos muy sensibles de amplificación de ácidos nucleicos. En concentraciones de 20 copias por mililitro puede ser detectado por exámenes de uso clínico monitorizando así la carga viral.
Los estados que definen la infección aguda y la infección temprana están caracterizados por la secuencia de aparición de marcadores virales y anticuerpos en la sangre caracterizando así los seis estadios de la infección aguda (figura 1) (3). Los test más sensibles y de cuarta generación pueden detectar a ambos, antígenos y anticuerpos, disminuyendo el “período de ventana” (virus positivo-anticuerpo negativo) en cinco días (4). Los test para detección de RNA viral cierran esta diferencia por un adicional de siete días.
Historia natural e inmunopatogénesis de la infección por hiv 1
La aparición característica de los marcadores virales del HIV–1 en sangre evidencia una extremadamente complicada y todavía poco conocidas series de interacciones virus con las células en los tejidos.
Dadas las variadas rutas de transmisión viral (cervicovaginal, peneana, rectal, oral, percutánea, intravenosa, in útero) y las distintas morfologías histológicas encontradas en estos tejidos, no es sorprendente que existan muchos tipos de células candidatas a ser involucradas en la infección temprana. La más conocida es la ruta vaginal de transmisión a través del estudio de explantes humanos en el modelo en macaco Rhesus de la India y la transmisión vaginal del virus de inmunodeficiencia simia (SIV) (5,6).
La evidencia preponderante involucra a los linfocitos T CD4 y células de Langerhans como las primeras dianas del virus, pero las células dendríticas pueden jugar un rol importante (7). Los monocitos y macrófagos juegan un rol menos preponderante en comparación con los linfocitos T CD4.
Independiente de la ruta de infección la primera célula infectada, dentro de pocos días, converge en el sistema linforeticular del tracto gastrointestinal (8,9) (Gut Associated Lymphoid Tissue, GALT) En este tejido, en humanos y macacos, el fenotipo de muchas células productivas infectadas parece ser de CD4 en reposo carente de marcadores de activación y expresando bajos niveles de receptor de quimokinas CCR5. Muchas de estas células expresan en su superficie receptores de integrina alfa-beta y de helper tipo 17 (Th17). Estos receptores también son detectados en células de la mucosa genital, lo cual puede jugar un rol importante en la adquisición del VIH. La rápida expansión del HIV–1 primero en el GALT y luego, sistémicamente, junto con un fuerte aumento de RNA viral en el plasma, son clínicamente importantes ya que es coincidente la destrucción irreversible de los reservorios de células T helper y el establecimiento de la latencia viral (definida como la silente integración del genoma viral en el genoma de las células T en reposo; un efecto que tiene bloqueados los esfuerzos para el tratamiento curativo) (10).
En lugar de ser genéticamente homogéneos los RNA virales, incluyendo el HIV–1, son complejas mezclas de mutantes y recombinantes de genomas llamadas cuasiespecies. Estudios genéticos de las cuasiespecies del HIV–1 con infección crónica que se comparan con pacientes en infección aguda, han traído claridad acerca de la transmisión cuantitativa y cualitativa. En un evento de transmisión, el inóculo (semen, secreciones cervicovaginales, o sangre) contienen un complejo genético de cuasiespecies de virus de los cuales solo un pequeño número atraviesan las barreras de la mucosa y establecen una infección.
Un simple virión es responsable de la transmisión en un 80% en heterosexuales, en un 60% en hombres que tienen sexo con hombres y en un 40% en usuarios de drogas intravenosas. En los usuarios de drogas intravenosas se han encontrado 16 viriones responsables, lo cual obedece seguramente a la falta de barreras de mucosas (11). La primera señal de respuesta inmune frente al HIV–1 es la aparición de reactantes de fase aguda, incluyendo alfa–1 antitripsina y amiloide A sérico en tres a cinco días después de la transmisión. El aumento de la carga viral coincide con una explosión de quimokinas inflamatorias: interferón -alfa e interleukina 15 y una lluvia de macropartículas con superficie de fosfatidilserina, derivado de una célula T CD4 infectada y activada sometida a apoptosis. Estas partículas tienen propiedades inmunosupresivas (12).
Las citokinas más tempranas son producidas por la células dendríticas, pero después hay múltiples células (monocitos, macrófagos, natural killer y células T) que también producen estos mediadores.
Aunque estas citokinas mejoran la respuesta inmune antiviral, probablemente la tormenta de citokinas también contribuyen a la perjudicial activación y disminución de los CD4.
La respuesta inicial es con anticuerpos no neutralizantes y no selectivos. Los anticuerpos que neutralizan el virus transmitido son encontrados después de tres meses de la infección aguda: la respuesta inicial no neutralizante es contra la glicoproteína 41 de la envoltura, en cambio, los neutralizantes son contra la glicoproteína-120 de la envoltura (13). La primera respuesta de las células T CD8 aparece días antes del peak de viremia y el foco está en uno de tres distintos epítopes más comúnmente encontrados en las proteínas nef y gag del HIV–1. Esta primera respuesta puede seleccionar escape de mutantes (que no fueron reconocidos por las células killer CD8) con un reemplazo total de la secuencia de aminoácidos del original, apareciendo una nueva secuencia entre 10 y 21 días.
Esta respuesta inicial es seguida por una nueva respuesta de células T a otros epítopes, de los que también puede haber un escape.
Las células CD8 también pueden expresar las perforinas (una proteína asociada a citotoxicidad) lo que sugiere que pueden eliminar células infectadas. Otras respuestas de células CD8 no condicionan la aparición de mutantes o lo hacen en muy pequeño grado. Varias de estas células pueden ser funcionalmente defcientes pero muchas parecen ser efectivas en focos de regiones del virus que pueden mutar, haciéndolo menos eficiente en su replicación.
Durante la infección aguda hay una depleción irreversible de linfocitos T CD4 desde el GALT que, junto con el daño de la barrera mucosa, producen una translocación bacteriana manteniendo una respuesta inmune permanentemente activada. La rápida, precoz y masiva pérdida de células T CD4 de los órganos linfoides no se refleja en el recuento de estas células en sangre periférica y da cuenta de una débil respuesta en caso de infección aguda.
La importancia de las células CD8 está evidenciada en múltiples estudios descrita como fundamental en el control de la infección aguda y crónica del VIH–1. Estudios en macacos señalan que vacunas que estimulan la respuesta específica de CD8 contra el SIV pueden atenuar la subsecuente infección con SIV. Estos datos son consistentes en muchos trabajos que demuestran que en pacientes con ciertos tipos de HLA, especialmente HLA B57 y HLA B27, tienen un control de la viremia mejor que el promedio y una sobrevida mayor en ausencia de terapia antiretroviral (14).
En suma, la fase aguda se caracteriza por un alto nivel de carga viral con una importante depleción de células CD4, en general dependientes de la acción del virus, pero también dependientes de algunas características del hospedero, como son la respuesta inmune y factores genéticos que juegan un importante rol en la susceptibilidad, resistencia y velocidad de progresión de la infección. La más importante es la deleción de un coreceptor de entrada al linfocito T CD4 llamada quemokina CCR5. Los homocigotos para esta deleción no expresan el correceptor en la superficie celular, tienen un set-point viral menor y lenta progresión hacia SIDA. Estos homocigotos pueden ser infectadossolamente a travís de otro correceptor llamado CXCR4.
ClínicaEl tiempo entre la exposición y la enfermedad sintomática es típicamente de 2 a 4 semanas y la duración de los síntomas y signos va de unos pocos días hasta algunas semanas. Muchos infectados por el VIH presentan una enfermedad aguda similar a la gripe. Los pacientes con infección temprana suelen ser generalmente asintomáticos.
La infección aguda por VIH es un síndrome muy heterogéneo y los pacientes que presentan síntomas más agresivos o más prolongados tienden a progresar más rápidamente hacia SIDA.
Los síntomas clínicos fueron descritos en 1985 como parecidos a la mononucleosis infecciosa. Muchos síntomas y signos inespecíficos han sido descritos: fiebre en rango de 38°−40°C sumado a linfoadenopatías concomitantes a la emergencia de la respuesta inmune. Un rash generalizado también es común, la erupción típicamente ocurre 48–72 horas después de la fiebre y persiste unos cinco a ocho días siendo las áreas más afectadas la parte superior del tórax, cervical y facial y son máculas o máculo-pápulas de color rojo.
Una de las manifestaciones más distintivas, pero menos frecuentes de este síndrome, es la aparición de úlceras dolorosas en las mucosas vaginal, anal o peneana. Otros síntomas y signos frecuentes son las artralgias, faringitis, baja de peso, meningitis aséptica, mialgias, mononeuritis y trombocitopenia.
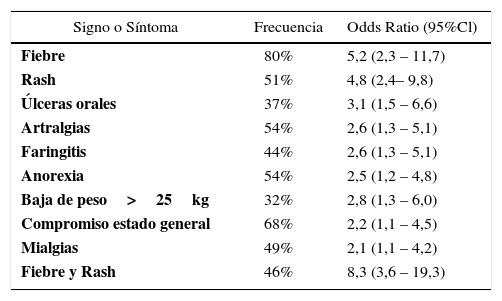
Ninguno de estos síntomas por sí solo hace el diagnóstico, es la combinación de ellos la que sugiere la posible infección aguda por el VIH (tabla 1).
Signos y síntomas principales de la infección aguda por hiv (HECHT 2002)
| Signo o Síntoma | Frecuencia | Odds Ratio (95%Cl) |
|---|---|---|
| Fiebre | 80% | 5,2 (2,3 – 11,7) |
| Rash | 51% | 4,8 (2,4– 9,8) |
| Úlceras orales | 37% | 3,1 (1,5 – 6,6) |
| Artralgias | 54% | 2,6 (1,3 – 5,1) |
| Faringitis | 44% | 2,6 (1,3 – 5,1) |
| Anorexia | 54% | 2,5 (1,2 – 4,8) |
| Baja de peso>25kg | 32% | 2,8 (1,3 – 6,0) |
| Compromiso estado general | 68% | 2,2 (1,1 – 4,5) |
| Mialgias | 49% | 2,1 (1,1 – 4,2) |
| Fiebre y Rash | 46% | 8,3 (3,6 – 19,3) |
Los signos y síntomas secundarios a la infección aguda se denominan Síndrome Retroviral Agudo.
Síndrome retroviral agudo (SRA)La enfermedad similar a la mononucleosis es la manifestación inicial de la infección por el VIH en la mitad o en los dos tercios de las personas recientemente infectadas. Cooper y colaboradores describieron este síndrome por primera vez en 1985 (15) como un síndrome similar a la mononucleosis en 11 de 12 varones que seroconvirtieron presentando anticuerpos frente al VIH. En el estudio de seguimiento, 36 de 39 varones homosexuales (92%) con infección reciente por VIH padecieron una enfermedad que recordaba al SRA durante el tiempo que las pruebas demostraban seroconversión (16). Sin embargo, también se reportó un síndrome igual a la mononucleosis en un 40% del grupo control seronegativo. En personas con el VIH infectadas vía parenteral, profesionales sanitarios expuestos a la inoculación accidental incluidos, también se han descrito cuadros similares a este síndrom (16).
La incidencia del SRA no se conoce con precisión. Los estudios retrospectivos de varones infectados con VIH muestran una baja frecuencia de enfermedad en el momento de la seroconversión. Un estudio prospectivo realizado en varones homosexuales probó una incidencia similar a la mononucleosis, del 55% en 22 personas que seroconvirtieron, frente al 21% en 44 personas del grupo control que no lo hicieron (17). En un estudio se demostró que las personas que adquieren el VIH por vía intravenosa tienen síntomas menos frecuentes que aquellos que lo contraen por la vía sexual. La mayoría de los profesionales de la salud que adquirieron el VIH por una exposición accidental presentaba el SRA posterior a la exposición.
En general, es probable que este síndrome se encuentre infranotificado e infradiagnosticado, como se puso de manifesto en dos series de pacientes en los que en un primer momento se pensó que no tenían la infección aguda por el VIH (18).
Las características clínicas del SRA son inespecíficas y variables. El inicio de la enfermedad es entre una y seis semanas tras la exposición al virus, pero tiene un valor máximo a las tres semanas. Reiteramos los síntomas más frecuentes: fiebre, sudoración, malestar general, mialgias, anorexia, náuseas, diarrea y faringitis no exudativa. Muchos pacientes notifican la presencia de cefalea, fotofobia y meningismo. Dos tercios de ellos pueden tener exantema troncular, susceptible de ser maculopapular, similar a la roséola o urticariforme. Las biopsias cutáneas son inespecíficas, con infiltrados linfocíticos perivasculares e infiltrados de células mononucleares en la dermis (19). Una minoría de enfermos presenta síntomas neurológicos además de meningitis linfocitaria, entre los que se encuentran la encefalitis, neuropatía periférica, polineuropatía ascendente (síndrome de Guillain Barré).
La exploración física revela a menudo la presencia de linfadenopatía cervical, occipital o axilar, exantema, o con menos frecuencia hepatoesplenomegalia. En algunos casos aparecen ulceraciones aftosas en la boca que pueden afectar al esófago. Asimismo se ha señalado la presencia de Candidiasis esofágica durante la seroconversión. Por lo general los síntomas se resuelven entre 10 a 15 días.
En los pacientes con SRA se ha mostrado la presencia de neumonías por P. Jirovecii, meningitis criptocócocica y esofagitis candidiásica. Esto se debe posiblemente a la disminución de linfocitos T CD4 que suele acompañar a la infección aguda por VIH. El laboratorio muestra una disminución total de linfocitos, elevación de la velocidad de sedimentación globular, prueba negativa de anticuerpos heterófilos, aumento de concentraciones de transaminasas y fosfatasas alcalinas.
Con respecto a los fenotipos, se observa la presencia de un patrón característico: inicialmente disminuye la cifra total de linfocitos, incluidos los CD4 y CD8, al cabo de algunas semanas la población de CD4 y CD8 empieza a aumentar, el crecimiento del número de células CD8 es mayor que el de los CD4 y la proporción CD4/CD8 se invierte y permanece invertida por toda la enfermedad aguda, debido sobre todo al exceso de células CD8.
En un 75% de los pacientes con infección primaria por el VIH se puede detectar el antígeno p24 y en el LCR durante las dos semanas siguientes a la exposición, coincidiendo a menudo con el inicio de los síntomas. El ARN del VIH es el marcador mas sensible ya que se encuentra muy elevado en los enfermos con la infección aguda (figura 1).
El diagnóstico diferencial del SRA se debe realizar con otras enfermedades como mononucleosis infecciosa, gripe, hepatitis viral, sarampión, rubéola, virus herpes simple (VHS) infecciones por citomegalovirus y con la sífilis secundaria.
La evaluación de los pacientes que presentan la enfermedad compatible con SRA debe incluir una historia detallada y cuidadosa a fin de detectar factores de riesgo y pruebas de laboratorio para descartar la presencia de mononucleosis, sífilis.
El tratamiento de la infección aguda puede disminuir la carga viral y estimular la respuesta de CD4 y CD8 específicas del VIH, pero su instauración es controvertida y en la actualidad se deja para algunos grupos de pacientes: enfermedad sintomática severa, compromiso neurológico y coinfección con hepatitis.
Manejo la infección agudaEl cuidado médico tiene tres responsabilidades con respecto a la infección aguda (3):
- 1.
Detección: los test de IV generación tienen la capacidad de detectar fases tempranas de la infección aguda y las estructuras establecidas de pesquisa y retención permitirían una rápida asociación con los servicios de salud de aquellos que sean detectados. Igualmente importante es la consejería que se debe ofrecer lo más posible en orden a reducir la gran diseminación, debido a que estos pacientes son potencialmente muy infectantes por su alto nivel de carga viral.
- 2.
Prevención secundaria: es fundamental aunque es muy difícil llegar a la notificación de partners sexuales como medio de prevención secundaria, para así someterlos a profilaxis post exposición con terapia antiretroviral.
- 3.
Inicio de la terapia antiretroviral si se considera apropiado: la terapia antiretroviral puede ser utilizada para suprimir la replicacion viral en orden a reducir la transmisión del VIH.
La óptima función de la terapia en fase aguda aún no es clara, a excepción de algunas poblaciones determinadas (síntomas severos, compromiso del SNC, etc.).
Hay diferentes reportes de beneficios clínicos de TAR tratados en infección primaria (3). Estas diferencias se pueden explicar por inicio antes o durante la seroconversión con reducción sostenida de la carga viral después que la TAR fue discontinuada, además hay una mejor función de células B y se disminuye el pool de clas T infectadas por VIH en estado de latencia. Está claro que se necesitan ensayos clínicos para determinar la relación costo beneficio del tratamiento. De momento sólo está destinado a subpoblaciones especiales.
En Chile la Guía Clínica 2013 sugiere que el tratamiento precoz de la infección aguda reduce el número de células infectadas, permitiendo a algunos pacientes mantener el control virológico en forma prolongada aunque se suspenda la terapia antiviral. Estos hallazgos no son absolutamente reproducibles y hay estudios que muestran rebote viral en la mayoría de los pacientes tratados precozmente en infección aguda, posterior a suspensión de terapia.
El potencial beneficio del inicio precoz TAR en erradicar la infección, como se planteó en un inicio, no parece posible ya que la integración del virus a las células blanco es muy precoz en el curso de la infección aguda. Otra de las ventajas teóricas de un tratamiento precoz es la posibilidad de retardar la progresión de la enfermedad, al establecer un nivel de carga viral más bajo que sin tratamiento y por tanto, una menor declinación del recuento de CD4. La limitación de esta estrategia está dada por la profunda e irreversible depleción de los linfocitos T CD4+ del tubo digestivo y de otros tejidos linfáticos que ocurre precozmente en el curso de la infección aguda por VIH. Este daño del tejido linfático intestinal (GALT) permite la translocación de productos bacterianos desde el intestino a la circulación sistémica y la activación del sistema inmune, que conduce a la depleción de linfocitos CD4 circulantes. El inicio de la TAR antes de la destrucción del GALT podría tener consecuencias beneficiosas, pero la ventana temporal para obtener este beneficio es estrecha y requeriría un diagnóstico y tratamiento muy precoz.
A pesar de alguna evidencia clínica que favorece tratar a todos los pacientes con SRA, los beneficios a largo plazo no han sido probados y no hay consenso en iniciar TAR a todo paciente en infección aguda, excepto en casos muy sintomáticos y prolongados, con compromiso SNC, CD4<350 en cualquier momento dentro de SRA, cuando hay infecciones oportunistas en SRA y en el embarazo. Si se decide tratar, se recomienda hacerlo en el marco de ensayos clínicos que agreguen más información sobre el eventual beneficio de esta intervención (20).
SíntesisSe define como infección aguda la presencia de altos niveles de RNA viral en plasma en presencia de un Test de Elisa negativo y/o Western Blot negativos o indeterminados. Dentro de estos primeros días de la adquisición del VIH ocurre una enfermedad transitoria, a veces, sintomática asociada a altos niveles de replicación del virus y a una rápida caída de los linfocitos T CD4. La rápida expansión del VIH primero en el GALT y luego sistémicamente, junto con este fuerte aumento de RNA viral en el plasma, es clínicamente importante ya que es coincidente la destrucción irreversible de los reservorios de células T helper. Por otro lado, estos altos niveles de carga viral hacen al sujeto más infectante que en etapas posteriores lo que se traduce en un problema importante de Salud Pública, ya que habitualmente la infección aguda es de difícil diagnóstico y por lo tanto, con menores posibilidades de información y profilaxis. En el futuro, las proyecciones y tendencias van al desarrollo de técnicas de laboratorio para diagnóstico precoz y continuar con estudios clínicos para decidir el momento de inicio de tratamiento en esta etapa.
El autor declara no tener conflictos de interés, en relación a este artículo.