La infección congénita por citomegalovirus (cCMV) es la causa más frecuente de infección neonatal en el mundo. La infección congénita por este virus puede causar numerosos trastornos entre ellos, alteraciones sensorioneurales auditivas de diverso grado, hasta llegar a la sordera profunda, en una proporción signifcativa de los niños infectados, en que, desafortunadamente, la mayoría es asintomática. En los últimos años se han registrado grandes progresos en el diagnóstico y tratamiento de la infección congénita por este agente. El objetivo de este artículo es mostrar estos avances y comentar nuestra experiencia en Clínica Las Condes.
Congenital Cytomegalovirus infection (cCMV) is the leading cause of neonatal infections worldwide. Congenital infection by this virus causes different abnormalities, among them hearing loss is the most common problem, and it affects a large proportion of asymptomatic children. It can range from a mild deficit to a bilateral profound hearing loss in a significant proportion of patients. In recent years there has been a considerable advancement in understanding this disease, which has lead to improvements in diagnosis and treatment. The aim of this article is to present these advancements and to comment our experience in Clínica Las Condes.
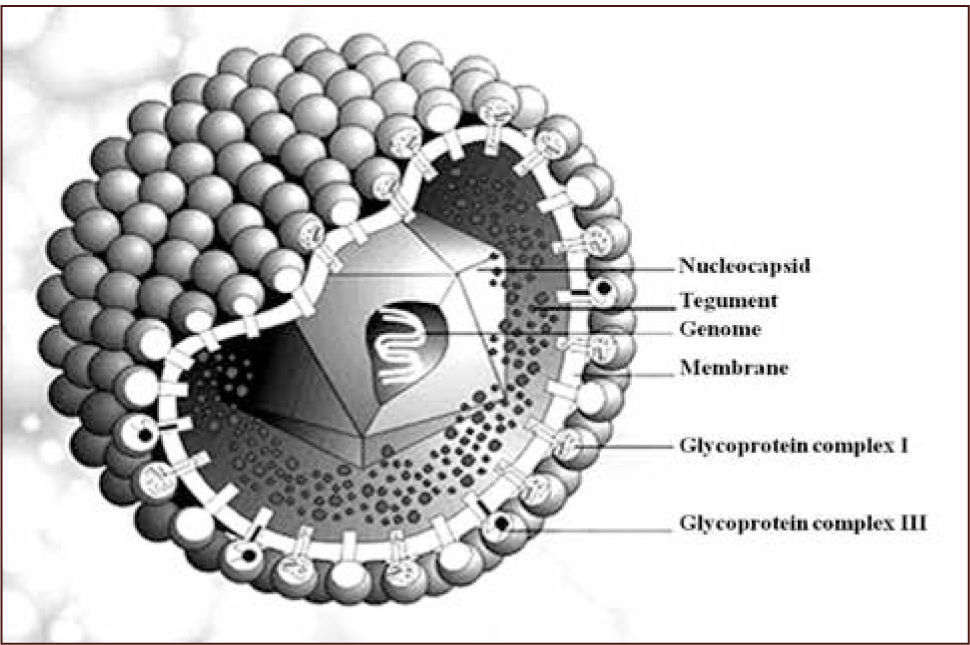
CMV es un virus que pertenece a la familia Herpesvirideae conocido como Herpesvirus Humano 5 (HHV-5), siendo un virus ADN, es uno de los virus más complejos que causan enfermedad en el hombre, con un genoma de 235kb y con más de 165 proteínas antigénicas constitutivas. Como miembro de esta familia, es un virus que permanece latente de por vida en el paciente infectado, pudiendo presentar reactivaciones según diferentes condiciones clínicas del hospedero, como puede ser la inmunosupresión, la desnutrición, el uso de corticoides o el embarazo (1) (figura 1).
Epidemiológicamente, se sabe que se encuentra de manera universal en todas las localizaciones geográficas y en todos los grupos socioeconómicos; infecta entre un 50% y un 85% de los adultos en Estados Unidos y cerca de un 93% en países en vías de desarrollo. La infección está más extendida en estos países y en áreas con pobres condiciones socioeconómicas. La infección puede ocurrir antes, durante o casi inmediatamente después del nacimiento, en una proporción que es cercana al 75%.
En Estados Unidos se reportan alrededor de 20.000 a 30.000 infectados cada año y es la primera causa de hipoacusia neurosensorial congénita de causa no genética (2). Se estima que alrededor de 40.000 mujeres embarazadas adquieren una primoinfección por CMV cada año, demostrada por seroconversión, y de ellas, aproximadamente unos 8.000 de sus recién nacidos (RN) desarrollará un daño neurológico severo y permanente (4), el que puede incluir, además, diversos trastornos neuronales, retardo mental o daño sensorioneural auditivo. La prevalencia de la infección neonatal por CMV se estima, en el mundo, en alrededor de 7 a 14 por 1.000 nacidos vivos (3).
CMV puede causar daño neurológico más frecuentemente que otras etiologías, como son la meningitis bacteriana, la toxoplasmosis, rubeola congénita o infección neonatal por Herpes simplex (4).
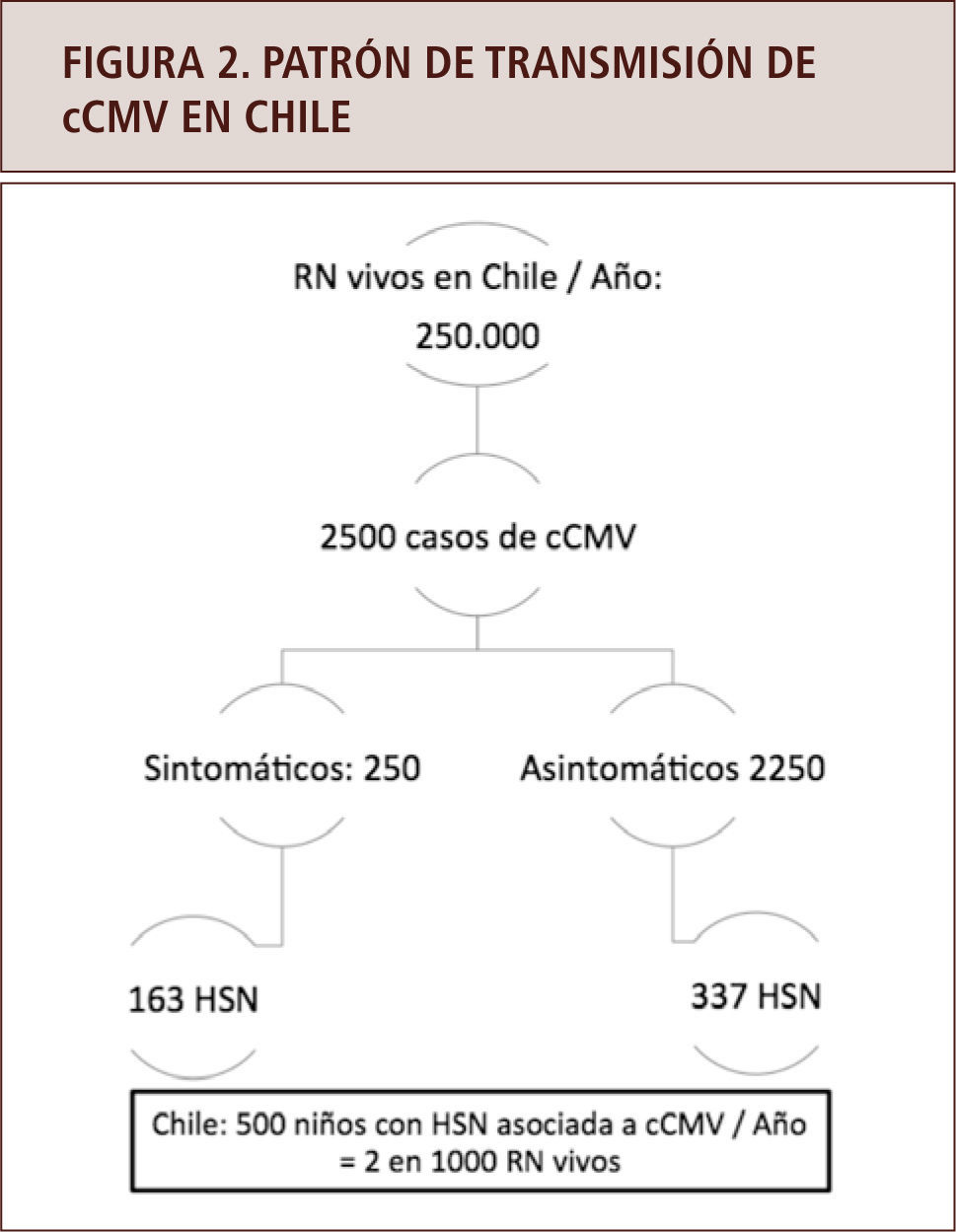
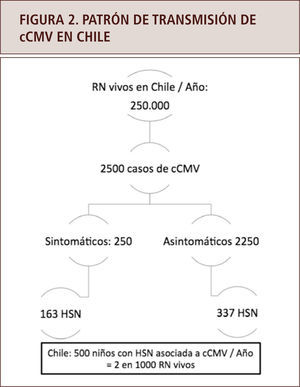
Aproximadamente un 90% de los RN infectados por CMV son asintomáticos al nacer y de ellos, un 15% desarrollará una secuela, que incluye un deterioro sensorioneural auditivo de diferente intensidad; extrapolado a la realidad chilena, cada año nacerían alrededor de 500 niños infectados con CMV (29) (figura 2). Por ello, en la actualidad, es recomendable un diagnostico virológico y serológico confirmatorio de infección en las primeras tres semanas de vida, ya que después de esa etapa es muy difícil distinguir entre infección congénita o adquirida (5).
La transmisión vertical del CMV puede ocurrir a través de tres vías: intrauterina, intraparto o postnatal inmediato. La trasmisión intrauterina es la más importante ya que es la que alcanza los mayores niveles de secuela y puede ocurrir por una primoinfección materna, una reinfección con un serotipo diferente o una reactivación latente. La postnatal puede ocurrir a través de la lactancia materna hasta en un 38% de los casos (RN seronegativos al nacer que se alimentaron con leche materna de madres seropositivas) (5, 6).
Siendo la infección congénita por CMV una enfermedad importante, ya que es la principal causa de trastornos del desarrollo neurológico y/o sordera adquirida en la infancia, a pesar de ello no hay un programa de screening universalmente aceptado para la detección precoz de esta infección y su manejo, por ello hay limitada evidencia para recomendar una guía de detección y manejo de la infección congénita por CMV, pero sí hay recomendaciones en la literatura de los últimos dos años que analizaremos.
En este artículo examinaremos las recomendaciones actuales sobre el diagnóstico y tratamiento de la infección congénita por CMV (cCMV), especialmente referidas al daño auditivo, tanto en su prevención como en el diagnóstico y el tratamiento recomendado. Describiremos nuestras sugerencias en el estudio y manejo de estos pacientes.
Diagnóstico ClínicoAInfección congénita sintomáticaLa mayoría de los RN con infección congénita (85–90%) es asintomática al nacer (4, 7). Aquellos que presentan síntomas clínicos (10–15%) nacen con anormalidades clínicas características de infección connatal, que pueden ir desde manifestaciones moderadas inespecíficas a múltiples compromisos en diferentes órganos, con especial predilección por el tejido reticuloendotelial y el sistema nervioso central (tabla 1).
Hallazgos Clínicos Y de Laboratorio en Niños Con Infección Congénita Sintomática Por CMV*
| HALLAZGOS | ANORMALIDADES (%) |
|---|---|
| CLÍNICOS | |
| Petequias | 76 |
| Ictericia | 67 |
| Hepatoesplenomegalia | 60 |
| Microcefalia | 53 |
| Retardo crecimiento intrauterino | 50 |
| Corioretinitis/atrofa óptica | 20 |
| Púrpura | 13 |
| Convulsiones | 7 |
| LABORATORIO | |
| Aspartato aminotransferasa elevada (>80U/L) | 83 |
| Hiperbilirrubinemia conjugada (bilirrubina directa >4mg/dL) | 81 |
| Trombocitopenia (<100 000mm3) | 77 |
| Proteinorraquia elevada (>120mg/dL) | 46 |
Aproximadamente la mitad de los RN sintomáticos son pequeños para la edad gestacional (PEG) y un tercio son prematuros. Estudios recientes sugieren que cerca del 5 al 10% de los RN sintomáticos fallecen en el período de RN (3, 8, 9) y estos estudios reportan un porcentaje entre 50–70% de secuelas, en RN sintomáticos (9).
Estudios de seguimiento a largo plazo de estos pacientes, muestran que cerca de la mitad de ellos desarrollará alteraciones auditivas sensorioneurales de diferente magnitud, hasta llegar a la sordera total. Otros desarrollarán dificultad de aprendizaje, algunos microcefalia y en menor proporción alteraciones visuales (7–9).
En la mayoría de estos niños sintomáticos, los hallazgos de laboratorio reflejan el compromiso hepatobiliar y/o del sistema reticuloendotelial y/o del sistema nervioso central (tabla 1).
BInfección congénita asintomáticaLos RN con infección congénita asintomática tienen mejor pronóstico a largo plazo que los sintomáticos. Sin embargo, aproximadamente un 10% de estos, desarrollará trastornos auditivos sensorineurales, lo que representa una proporción mucho mayor que lo que se observa en la población general; porcentaje que va entre 0,1–0,4% (9, 10).
Estudios prospectivos y de seguimiento, de niños infectados asintomáticos, muestran que aproximadamente la mitad de los que desarrollaron una alteración auditiva sensorioneural, esta fue bilateral con variación de intensidad, desde moderada a severa, incluso hasta sordera profunda. Se sabe que este compromiso auditivo es muchas veces progresivo; por ello, hay una necesidad permanente de evaluación pediátrica, neurológica y manejo otorrinolaringológico (11,12).
Además de las complicaciones sensorioneurales auditivas, otras complicaciones neurológicas pueden ocurrir, pero con mucho menos frecuencia que lo que se observa en niños sintomáticos. Aproximadamente un 5% de estos pacientes asintomáticos desarrollarán microcefalea y trastornos motores y solo un 2% presentará corioretinitis. Se desconoce si estos niños, con infección asintomática, tienen un riesgo agregado para desarrollar trastornos del aprendizaje o del desarrollo, independiente del dado por la hipoacusia. (9, 13).
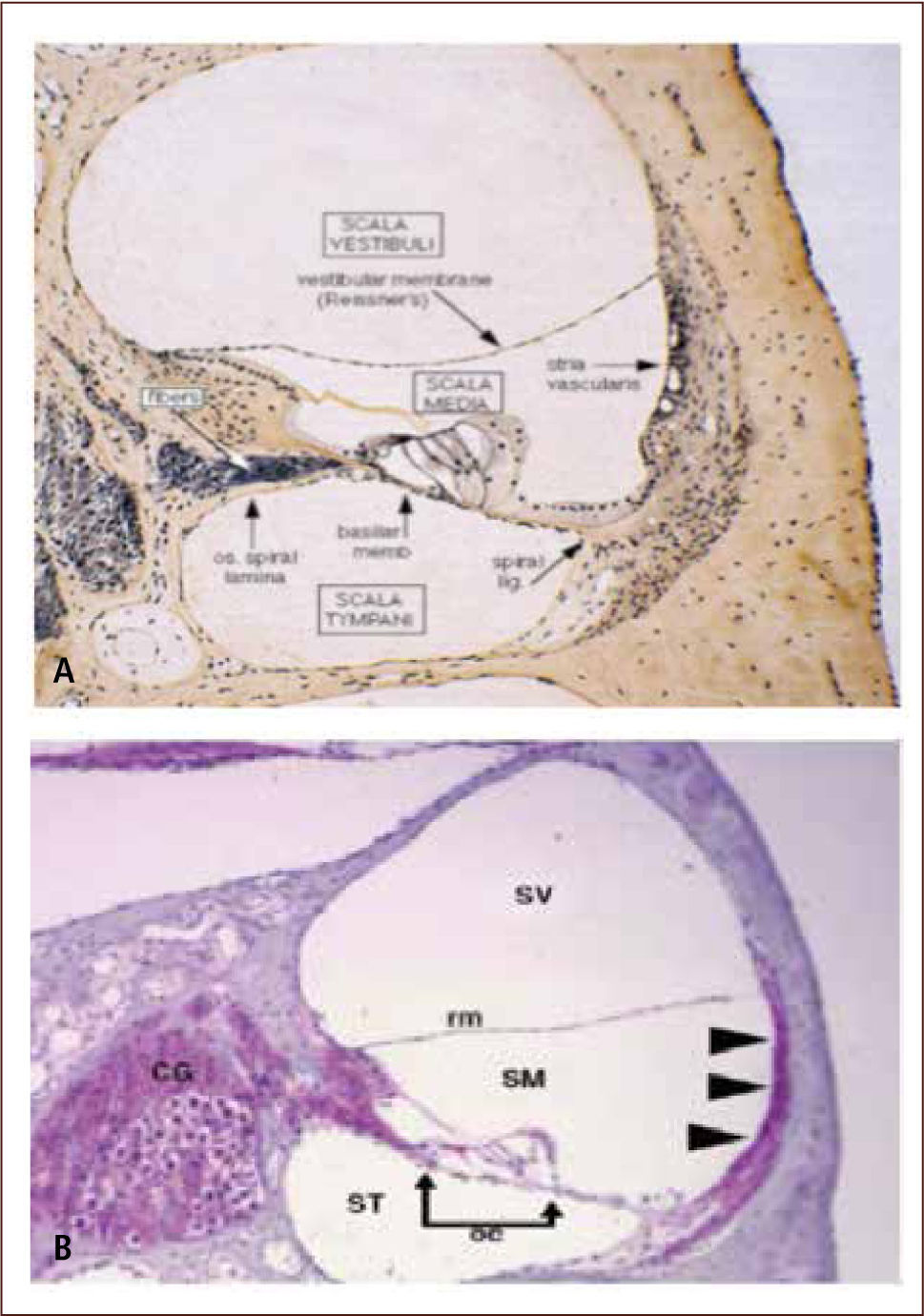
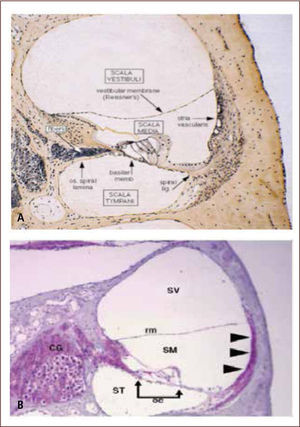
La patogénesis y los mecanismos por los cuales se desarrollará el daño auditivo y/o neurológico en estos pacientes, especialmente en los asintomáticos no son del todo conocidos. CMV, tiene claramente, un tropismo especial por la cóclea (figura 3) sin embargo no se han podido establecer factores predictivos adversos, por ello la necesidad de seguimiento y monitorización en todo niño con diagnóstico de cCMV (29).
Daño Coclear En cCMV Comparación Con Oído Normal
De hecho, algunos factores han sido desacreditados como predictivos, por ejemplo el tipo de embarazo. Se creía hasta hace poco, que la infección sintomática del RN se daba con más frecuencia en nacidos de madres que cursaban una infección primaria durante el embarazo; sin embargo, recientes publicaciones en Suiza, Inglaterra, Alabama y Brasil (7, 13) han demostrado que la infección sintomática puede ocurrir con igual frecuencia en niños nacidos de madres con primoinfección por CMV, como de madres seropositivas antes del embarazo. Adicionalmente la severidad de la enfermedad en el RN y las tasas de daño auditivo sensorioneural asociado a cCMV no diferen entre grupos de pacientes que han nacido de madres con infección primaria o infección antigua (14, 15).
En los últimos años sin embargo, se han descrito algunos parámetros que sí podrían ser predictivos:
La edad gestacional en que se adquiere la infección intrauterina se ha asociado con mayor intensidad de secuelas (4, 16). La seroconversión que ocurre precozmente en la madre, antes del inicio del segundo trimestre del embarazo, se asocia con más frecuencia a RN con secuelas del SNC que aquellos que nacen de madres que presentan seroconversión a fines del segundo o tercer trimestre del embarazo. Como dato clínico y epidemiológico, se ha demostrado que los niños nacidos sintomáticos por una infección cCMV tienen tasas de excreción viral, en orina, mucho mayores que la de los pacientes asintomáticos (15,16).
Extrapolando la utilidad que tiene la monitorización de la carga viral en sangre en los pacientes infectados inmunosuprimidos, se ha sugerido que cargas virales elevadas en RN podrían identificar a los niños con mayor riesgo de secuelas. Se ha confirmado que los niños sintomáticos tienen cargas virales más elevadas en saliva, sangre y orina sin embargo, recientes estudios han demostrado que no hay diferencias significativas en las cargas virales, en el primer mes de vida, entre los pacientes con o sin daño auditivo (4, 17, 18). Por lo tanto, y al parecer, con los datos hasta ahora conocidos, en los casos individuales de niños con cCMV una cifra elevada de carga viral no identificaría, necesariamente, al paciente que tiene mayor riesgo para desarrollar daño auditivo (4,18).
A pesar de que aún hay mucho que aprender y descubrir sobre la cCMV, existe un creciente interés por efectuar un screening neonatal a todo RN para detectar infección cCMV, en conjunto con el screening auditivo y decidir, con los resultados, el paciente que será candidato a terapia antiviral (sintomáticos) o los que necesitarán un control y seguimiento estricto (asintomáticos).
Recientes estudios han demostrado que una técnica de biología molecular, la reacción de polimerasa en cadena en tiempo real (RPC-TR) como método diagnóstico hecha en una muestra de salivaantes de las tres semanas de vida, es más efectiva, simple, económica y confiable, para confirmar infección cCMV, que la efectuada en muestras de orina o gota de sangre. Otros métodos diagnósticos como la serología, aislamiento en cultivo celular, antigenemia o técnicas inmunológicas como el Shell-Vial, son más engorrosos, tienen demora en sus resultados y con diferencias en la interpretación de sus resultados, pero comparativamente muestran una sensibilidad y especificidad semejante para confirmar el diagnóstico (4, 19, 27).
Aparte de los estudios microbiológicos que se efectuarán al niño, otros exámenes son indispensables para el análisis de esta infección y sus secuelas, entre ellos están las investigaciones de neuroimágenes, los exámenes oftalmológicos, los neurológicos y en especial y específicamente, los auditivos.
Todos los RN deberían ser sometidos a exámenes de screening neonatal auditivo, ya que la hipoacusia congénita es una enfermedad muy común (3 a 4 en 1000 RN), genera una gran alteración en el desarrollo del niño y es tratable con éxito en la inmensa mayoría de los casos (26).
A pesar de ello, la tasa de hipoacusia en edad escolar es aproximadamente de 6 – 7 por 1.000 niños. Es decir, durante los primeros años de vida la tasa de hipoacusia se duplica. Esto es particularmente preocupante al considerar que estos son los años en que los niños deben desarrollar su lenguaje. cCMV sería el principal responsable de hipoacusia progresiva en los primeros años de vida. Por un lado puede haber una progresión en el daño causado por el virus, pero por otro, se sabe que hay otros factores que pueden explicar este fenómeno (30).
Hay dos estudios que se utilizan para realizar estas pruebas de screening: las emisiones otoacústicas (EOA) y los potenciales evocados auditivos automatizados (PEAT-A). Las EOA son más rápidas de realizar y su uso esta más difundido en el mundo sin embargo, detectan la función de las células ciliadas externas, no la de las células internas, quienes son las verdaderas transductoras del sonido, por lo tanto en las situaciones en que hay daño de las células ciliadas internas con preservación de las externas, las EOA darán un resultado falsamente negativo, con resultado “pasan”. Este fenómeno es ampliamente conocido en hipoacusia asociada a prematurez, hipoxia y algunos ototóxicos, en quienes solo se debe realizar screening con PEAT-A.
Como ya se analizó, el mecanismo de daño en cCMV es una laberintitis, teóricamente hay un daño en varios niveles de la cóclea y por lo tanto, las EOA debieran ser un método de screening adecuado. Lamentablemente en el cCMV, es un hecho, que aproximadamente la mitad de los casos “pasan” el screening auditivo (screening auditivo falsamente negativo) y las alteraciones son detectadas tardíamente. Aún no está claro si esto se debe a que en el momento del parto no había daño alguno, o no era detectable para las EOA. Como la mayoría de los pacientes con cCMV son asintomáticos al momento de nacer, no hay cómo preseleccionar a quienes conviene realizar PEAT-A. Por esta razón, muchos autores recomiendan realizar el estudio de screening a todos los RN con PEAT-A, aun considerando el aumento en tiempo y eventualmente en el aumento de los costos (26, 28).
Tanto las EOA como los PEAT-A dan resultados simples, de “PASA” o “NO PASA”, sin embargo esto lo otorgan por cada oído, por separado y por diferentes frecuencias para cada uno, típicamente pueden resultar tres. De este modo quien realiza el examen, o el médico que analiza estos resultados pueden cometer el error de considerar como normal un examen que informa una sola frecuencia “NO PASA”. Esto sucede, lamentablemente con cierta frecuencia y por ello, se puede retrasar el diagnóstico en algunos pacientes.
De todas maneras, independientemente del método utilizado en la etapa neonatal, algunos pacientes desarrollan hipoacusia en los primeros años de vida. Es por esto que las academias, tanto la americana de pediatría como la de otorrinolaringología, recomiendan realizar un segundo screening auditivo universal entre los 3 y 4 años de vida. Esto puede hacerse nuevamente con EOA, con PEAT-A o con audiometría (26).
Dentro de los estudios de imágenes, la ecografía y resonancia magnética son los más útiles; el primero como screening inicial y el segundo para delimitar y definir lesiones intracraneanas con mayor precisión.
En relación a los exámenes microbiológicos, se espera que nuevos métodos de biología molecular, a futuro, puedan proveer la capacidad de identificar con mayor exactitud, en RN infectados, aquellos que van a tener mayor riesgo de secuela auditiva u otras alteraciones en la edad temprana de la vida.
Tratamiento y monitoreo de la infección cCMVEn resumen, se confirmará el diagnóstico de sintomático vs asintomático con un detallado examen clínico y con confirmación microbiológica a través de un examen de biología molecular (reacción de la polimerasa en cadena en tiempo real (RPC-TR) hecho en saliva y/o en orina o en sangre. Se efectúan exámenes de sangre (hematológicos, hepatológicos, función renal etc.), auditivos, oftalmológicos y de imagen (ecografía y resonancia) y con estos resultados se define el paciente entre estas dos posibilidades; en aquellos pacientes, especialmente sintomáticos, que se justifica estudio virológico de LCR, se debe confirmar la presencia de CMV en el SNC, para manejo terapéutico de meningoencefalitis por este agente. Aún hay mucha controversia en relación al manejo terapéutico del paciente asintomático, pero por otro lado ya existe más consenso en el manejo del niño sintomático (21,22).
Hay que tener presente que los trastornos sensorioneurales auditivos pueden estar al nacer o aparecer más tarde a lo largo de los primeros años de vida. Aproximadamente entre un 33 a un 50% de los trastornos sensorioneurales auditivos, que se diagnostican en la infancia precoz, se deben a una infección cCMV, durante el período de RN (20, 21).
La aparición tardía del compromiso auditivo ocurre durante los primeros años de vida, con una diferencia de hasta 11 meses (alrededor de los cuarenta y cuatro meses de edad), en niños asintomáticos vs los sintomáticos, en los que resulta ser mucho más precoz; lo que confirma que niños con infección cCMV, sintomáticos moderados o asintomáticos, deben ser evaluados auditivamente por otorrinolaringólogo cada 3 a 6 meses al menos por un espacio de 6 años.
Los pacientes sintomáticos con enfermedad focal o del SNC se tratan con antivirales, ganciclovir o valganciclovir por seis semanas a seis meses con monitoreo terapéutico (niveles sanguíneos de antivirales y carga viral semanalmente), seguimiento pediátrico a los 6 y 12 meses y otológico cada 3–6 meses hasta los 3 años; luego anualmente hasta los 6 años, mas evaluación neurológica del desarrollo psicomotor al año y seguimiento oftalmológico hasta los 5 años (tabla 2).
Resumen De Las Recomendaciones Para El Manejo De CCMV Sintomática (22)
| GRADO DE RECOMENDACIÓN | |
|---|---|
| A quién tratar | |
| 1. Enfermedad del SNC, auditivo, corioretinitis | B+ |
| 2. Enfermedad severa focal: Hepatitis, anemia neutropenia, trombocitopenia, colitis, neumonitis | D |
| Cuándo Tratar | |
| Inicio del tratamiento al menos los primeros 28 días de vida | B+ |
| Con qué tratar | |
| -Ganciclovir 6mg/Kg IV C/12 por 6 semanas | B+ |
| -Valganciclovir 16mg/Kg oral hasta buen resultado clínico | B+ |
| Cuánto tiempo de tratamiento | |
| -Duración total 6 semanas | B+ |
| Monitorización durante el tratamiento | |
| -Semanal: Hemograma-Pruebas hepáticas-Función renal | B+ |
Algunos autores, actualmente, recomiendan tratamiento con valganciclovir oral desde el inicio y por seis meses (Congreso ESPID, Dublin, mayo 2014. Kimberlin DW).
En los pacientes asintomáticos, con exámenes clínicos y de laboratorio normales no se recomienda tratamiento, sólo seguimiento estricto pediátrico hasta el año, audiológico cada 3–6 meses por 3 años y posteriormente anual hasta los 6 años (22).
Niveles De Evidencia y Recomendación
| ESTUDIO | NIVEL DE EVIDENCIA | GRADO De RECOMENDACIÓN |
|---|---|---|
| Bueno recientes estudios | la | A+ |
| Uno o más importantes estudios | Ib | A− |
| Uno o más estudios prospectivos | II | B+ |
| Uno o más estudios retrospectivos | III | B− |
| Combinación formal de opiniones de expertos | IVa | C |
| Opinión informal de experto | IVb | D |
En la actualidad hay dos mecanismos demostrados preventivos en el embarazo, especialmente en embarazadas seronegativas expuestas a niños pequeños en su trabajo o en el hogar. Uno de ellos son las medidas de higiene (lavado de manos, de fómites, cuidadosa eliminación de excretas, etc.) recomendaciones avaladas por el Centro de Control de Enfermedades Infecciosas de Estados Unidos (C.D.C.) (23).
Otra medida es la utilización de Inmunoglobulina hiperinmune anti CMV en embarazadas seronegativas de alto riesgo, que adquieren la infección durante el embarazo. En esta situación se ha mostrado una efcacia de 50% si la inmunoglobulina es administrada en los primeros días de la adquisición de la infección (23, 24).
En relación al desarrollo de una vacuna eficaz, se están efectuando exploraciones en numerosas líneas de investigación, como son vacunas con virus atenuado, con subunidades proteicas constitutivas, complejos pentaméricos (DNA) y vacunas plasmidiales con uso de vector viral; todas ellas en diferentes fases de investigación (25).
ConclusiónEn ausencia de un método preventivo eficaz, como podrían ser las vacunas y nuevos antivirales más efectivos y menos tóxicos, lo único que disponemos en la actualidad es la posibilidad de confirmar un diagnóstico precoz y ofrecer un tratamiento en los pacientes sintomáticos, muchos de los cuales han mostrado efectividad combinando terapia endovenosa con ganciclovir seguido de tratamiento prolongado con valganciclovir oral (28).
Faltan más estudios para entender mejor los riesgos y el manejo de los pacientes asintomáticos y qué tratamientos preventivos y/o terapéuticos efectivos podríamos ofrecer para reducir el daño auditivo a futuro en ellos.
Creemos sin embargo, que la evidencia actual sustenta la costo-efectividad de instalar programas de screening neonatal universal para la detección de cCMV con RPC-TR en saliva. De esta manera en los pacientes sintomáticos se iniciará tratamiento antiviral y los asintomáticos, ingresarán a programas de seguimiento estricto y dirigido pediátrico, neurológico y otorrinológico, iniciando el tratamiento antiviral cuando hayan indicios de compromiso auditivo sensoneural.
En países como Chile, una primera etapa, antes de concretar una cobertura universal, sugerimos que las instituciones de salud podrían instaurar programas de screening en RN con sospecha clínica de cCMV, para poder avalar e iniciar un tratamiento precoz que significará un mejor pronóstico auditivo.
La opinión de los autores, es que tomando estas medidas y según los estudios clínicos y epidemiológicos analizados, se podría teóricamente, llegar a prevenir cerca de 500 casos de hipoacusia infantil al año en Chile.
Los autores declaran no tener conflictos de interés, en relación a este artículo.