ORIGINALES
Análisis de la expresión del pepsinógeno C enmetástasis ganglionares de carcinoma de mama
Analysisof pepsinogen C expression in lymph node metastases of breastcancer
M. L.Lamelas*,M. I. Enguita*,J.Vázquez*,J. C.Rodríguez*,E. Plaza*,A. M.Merino**,F. Vizoso*
*Servicios de Ginecología, Cirugía General,Anatomía Patológica y Anestesia y Reanimación.Hospital de Jove. Gijón.
** Servicio de Anatomía Patológica. Hospital deCabueñes. Gijón.
Correspondencia:
F. Vizoso.
Servicio de Cirugía General.
Hospital de Jove.
Avda. Eduardo Castro, s/n.
33290 Gijón (Asturias).
SUMMARY
Here weanalyzed in primmary tumors and in metastasic axillary nodes of 30breast cancer patients, by immunohistochemical assay, the tumoralexpression of pepsinogen C, a protein normally expressed by gastricmucosa. Of the primmary tumors, 16 (53,3%) showed a positiveimmunostaining for pepsinogen C and 17 (56,6%) patients showed apositive immunostaining in their tumoral lymph nodes. In addition,theres was a significant positive relationship between the tumoralexpression of pepsinogen C in the primmary tumors and themetastatic lymph nodes (p < 0.002). However, only the tumoralexpression of this protein in primmary tumors achieved statisticalsignification (p < 0.05) as prognostic factor for favorableevolution to predict overall survival frompatients.
Keywords
PepsinogenC, Lymph node metastasic, Breast cancer.
RESUMEN
En esteestudio analizamos en los tumores primarios y en ganglios axilaresmetastásicos de 30 mujeres con cáncer de mama,mediante análisis inmunohistoquímico, laexpresión tumoral del pepsinógeno C, unaproteína normalmente expresada por la mucosagástrica. De los tumores mamarios primarios, 16 (53,3%)mostraron una tinción inmunohistoquímica positivapara el pepsinógeno C, mientras que 17 (56,6%) lo hicieronen sus ganglios linfáticos tumorales. Ademásexistió una relación significativamente positivaentre la expresión tumoral de pepsinógeno C en lostumores primarios y los ganglios metastásicos (p <0,002). Sin embargo, sólo la expresión tumoral de esaproteína en los tumores primarios alcanzósignificación estadística (p < 0,05) como factorpronóstico de evolución favorable para predecir lasupervivencia de las pacientes.
Palabrasclave
Pepsinógeno C, Metástasis ganglionareslinfáticas, Cáncer de mama.
INTRODUCCIÓN
En laactualidad se conoce poco acerca de los cambios específicosde la biología molecular del cáncer en general queocurren en el proceso metastásico. En relación con elcáncer de mama, los escasos estudios comparativos sobre loscarcinomas primarios y sus metástasis en nóduloslinfáticos han demostrado que ambos compartimentos tumoralesmuestran un fenotipo similar en cuanto a su histopatología,actividad proliferativa, 1-5 receptores de estrógenos y de progesterona 6-8 y expresión deoncógenes. 3, 9 Sinembargo, también se ha descrito la adquisición dealgunas anormalidades en ganglios linfáticosmetastásicos de carcinoma de mama, como son un incremento delos niveles del receptor del factor de crecimientoepidérmico 10 o de laproteína de choque térmico HSP27. 11 Además, el número total deaberraciones genéticas detectadas exclusivamente en esecompartimento tumoral es más elevado que el observadoúnicamente en los tumores primarios. 12Así pues, esa propensión a unnúmero elevado de cambios genéticos en laslocalizaciones metastásicas sugiere la hipótesis deque la progresión de los carcinomas mamarios a losnódulos linfáticos está asociada con laadquisición de nuevos cambios genéticos que confierenun fenotipo más agresivo.
Por otraparte, no existe en la actualidad información acerca delcomportamiento de las proteínas de secreción mamaria,como es el pepsinógeno C, en el compartimentometastásico del cáncer de mama. El pepsinógenoC es una enzima proteolítica normalmente expresada por lamucosa gástrica e involucrado en la digestión de lasproteínas en el estómago, 13 pero también se ha demostrado que el epitelio de los quistesde mama y un porcentaje significativo de carcinomas de mama humanosmuestran la capacidad de producir esta enzima. 14Además también se ha demostrado que laexpresión tumoral del pepsinógeno C estáasociada a un pronóstico favorable en el cáncer demama 15 y que es una de las pocasproteínas que son inducidas por andrógenos encélulas de cáncer de mama en cultivo. 16,17
El objetivode este estudio ha sido investigar la expresión depepsinógeno C en metástasis ganglionares decáncer de mama, la posible relación con suexpresión en los tumores primarios y su significaciónpronóstica.
MATERIAL YMÉTODOS
Pacientes
En estetrabajo se incluyeron 30 mujeres con el diagnósticohistológico de carcinoma ductal infiltrante y con gangliosaxilares positivos que fueron todas ellas tratadasquirúrgicamente en el Hospital de Jove de Gijón entre1983 y 1991. Ninguna de ellas había sido previamente tratadani presentaba signos de metástasis a distancia ni otraneoplasia maligna en el momento de su diagnóstico inicial ytodas ellas fueron sometidas a mastectomía radicalmodificada. Las características de las pacientes y de sustumores están expuestas en la tabla1. La edad media de las pacientes fue de 61,5 años(intervalo: 28 y 90 años). El grado histológico delos tumores fue determinado de acuerdo a los criterios de Bloom yRichardson 18, mientras que el estado deafectación de los ganglios linfáticos axilares fueevaluado histológicamente. El valor medio de gangliosaxilares linfáticos aislados fue de 11,5 (intervalo: cuatroy 22) y el de ganglios metastásicos fue de siete (intervalo:uno y 21). Del total de las 30 pacientes, 20 recibieronradioterapia postoperatoria. Además, 15 recibieron terapiasistémica adyuvante con ciclofosfamida, metrotexato y5-fluorouracilo y 18 fueron tratadas postoperatoriamente contamoxifeno. Todas las pacientes fueron sometidas a estudiosclínicos, radiológicos y biológicos cada tresmeses durante el primer año y luego anualmente. Elperíodo medio de seguimiento clínico fue de 50,7meses. De las 30 mujeres con cáncer de mama incluidas eneste estudio, 19 desarrollaron recurrencia tumoral y fallecierontodas ellas como consecuencia de ello. Finalmente, cuatrofallecieron de causas no relacionadas con el cáncer demama.
TABLA 1 CARACTERÍSTICAS DE LAS PACIENTES, DE LOSTUMORES Y ANÁLISIS UNIVARIANTE DE LA SUPERVIVENCIATOTAL | ||||
| Factor | N.º | Supervivenciatotal(%± ES) | p | |
| 2años | 5años | |||
| Estado menopáusico: | ||||
| -- Premenopáusico | 9 | 88 ± 10 | 53 ± 20 | 0,2481 |
| -- Postmenopáusico | 21 | 76 ± 9 | 45 ± 11 | |
| Tamaño tumoral: | ||||
| -- T1 | 8 | 80 ± 17 | 40 ± 29 | 0,1249 |
| -- T2 | 8 | 75 ± 15 | 60 ± 18 | |
| -- T3 | 8 | 75 ± 15 | 62 ± 17 | |
| -- T4 | 6 | 75 ± 15 | 25 ± 15 | |
| Grado histológico: | ||||
| -- I | 13 | 91 ± 7 | 32 ± 15 | 0,7935 |
| -- II | 13 | 69 ± 12 | 60 ± 13 | |
| -- III | 4 | 50 ± 25 | 50 ± 25 | |
| Número ganglios metastásicos: | ||||
| -- 1-3 | 11 | 81 ± 11 | 45 ± 15 | 0,3636 |
| -- 4-9 | 11 | 90 ± 8 | 57 ± 16 | |
| -- >= 10 | 8 | 62 ± 11 | 41 ± 20 | |
| Pep C en tumores primarios: | ||||
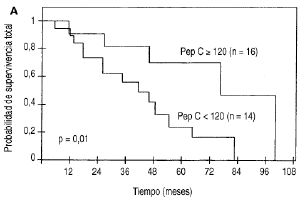
| -- < 120 | 14 | 73 ± 10 | 24 ± 11 | 0,0111 |
| -- >= 120 | 16 | 90 ± 8 | 70 ± 14 | |
| Pep C en ganglios metastásicos: | ||||
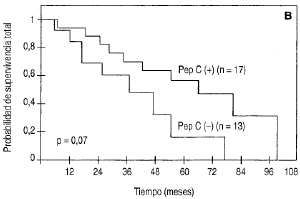
| -- Negativo | 13 | 69 ± 12 | 16 ± 14 | 0,0710 |
| -- Positivo | 17 | 88 ± 7 | 63 ± 11 | |
| ES: error estándar. | ||||
Purificación de las proteínas y producción deanticuerpos
Para obteneranticuerpos contra el pepsinógeno C se purificó laproteína a partir de mucosa gástrica humana obtenidade autopsias de pacientes sin enfermedades gástricassiguiendo el método de Folt-mann y Jensen 19.La naturaleza y calidad del antígeno purificado seconfirmó mediante determinación de su secuenciaaminoterminal por degradación automática de Edman. Elantisuero contra la proteína purificada fue obtenido enconejos blancos de Nueva Zelandasiguiendo el método descrito por Vaitukaitis. 20 A los conejos inmunizados les fueextraída la sangre 6 semanas después de lainyección de proteína y el suero obtenido fuedializado durante 24 horas a 4° C contra 20 mM de tampónde fosfato, pH 7,2. Entonces, el material dializado fuecromatografiado en columna de DEAE-celulosa equilibrada y eluido enel mismo tampón de fosfato y finalmente las fracciones quecontuvieron IgG fueron recogidas y congeladas a 20° Chasta su utilización.
Preparación de las muestras y tincióninmunohistoquímica
Todos lostejidos fueron fijados durante 16 horas en formaldehído al10%, tamponado con tampón fosfato 0,1M, pH 7,4.Posteriormente, las muestras tisulares fueron deshidratadasmediante pases sucesivos en etanol a concentraciones crecienteshasta el 99,5% y finalmente se aclararon en xilol e incluyeron enparafina. Todos estos pasos se realizaron en un procesadorautomático Citadel 2000 (Shandon, Astmoor,Inglaterra).
Latinción inmunohistoquímica se realizó sobrecortes de 6 µm de los bloques de parafina siguiendo elméto-do biotina-streptavidina mediante el sistemaSupersensitive (Biogenex, San Ramon CA, EE. UU.). Para ello lasmuestras tisulares fueron previamente desparafinadas en estufa a60° C durante 30 minutos y tras dos pases de 15 minutos enxilol se hidrataron por pases sucesivos en metanol aconcentración decreciente y agua desionizada. La presenciade la enzima fue revelada con Fast Red en Tris-Buffer conNaftol-Fosfato, controlando el grado de tinción en lapreparación de tumor utilizada como control positivo. Lafosfatasa alcalina endógena fue bloqueada con levamisole (adilución 1:50). El proceso de tinción fue detenidomediante lavado con agua destilada. Las preparaciones secontrastaron con hematoxilina de Mayer durante 30 segundos yhaciéndose virar ésta con agua corriente. Finalmentelas preparaciones fueron montadas en medio acuoso Aquatex (Merck,Darmastadt, Alemania).
Análisis de las tinciones
Una vezrealizado el proceso de inmunotinción las preparacioneshistológicas de los tumores primarios correspondientes a lasdeterminaciones del pepsinógeno C fueron analizadas de unamanera semicuantitativa de acuerdo al procedimiento descrito porMcCarty et al, 21 basado en la intensidad (I) y elporcentaje de células teñidas (PC) para cadaintensidad. Las diferentes intensidades obtenidas fueronclasificadas desde 0 (no tinción) hasta 3 (tinciónmuy intensa), mientras que para el porcentaje de célulasteñidas fueron utilizados agrupamientos del10%. Para cada preparación histológica se obtuvoun valor designado como HSCORE, 21 que fue calculado tras aplicar la siguientefórmula: HSCORE = S [(I + 1) * PC]. En la evaluación de las preparacioneshistológicas correspondientes a la determinación dela proteína en los ganglios linfáticosmetastásicos se consideraron como positivos si másdel 10% de las células tumorales mostraban unatinción inmunohistoquímica positiva. Cadainmunotinción fue evaluada por dos observadoresindependientes sin ningún conocimiento de resultadoclínico de las pacientes incluidas en el estudio. Lareproductividad del método de clasificaciónalcanzó el 90%. Si se producían diferencias entre losobservadores se alcanzaba una clasificación definitivamediante consenso tras revisar en conjunto las preparacionesproblemáticas.
Análisis estadísticos
Elanálisis de las diferencias entre los valores de HSCORE parael pepsinógeno C fue realizado mediante la prueba deMann-Whitney y el análisis de varianza de Kruskal-Wallis.Las curvas de supervivencia total fueron calculadas en base almétodo de Kaplan-Meier 22 yposteriormente comparadas mediante la prueba de log-rank.23 Para ese análisis desupervivencia se consideró un dintel de los valores HSCOREpara el pepsinógeno C de 120, previamente establecido porVizoso et al. 15 Los valores seexpresan como la media ± error estándar (ES). Elnivel de significación establecido fue del 95% (p <0,05).
RESULTADOS
Expresión de pepsinógeno C en los tumores mamariosprimarios
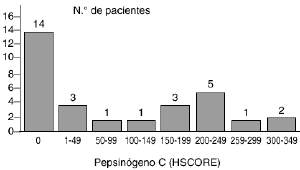
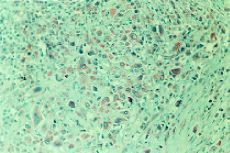
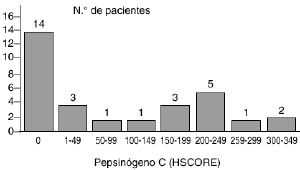
Laexpresión del pepsinógeno C en los 30 carcinomasmamarios primarios fue analizada mediante tincióninmunohistoquímica con un anticuerpo elaborado contra laproteína purificada de mucosa gástrica. En los casosen que dicha tinción resultó positiva ésta selocalizó en el citoplasma de las células tumorales.La figura 1 A muestra un casorepresentativo de tumores positivos para el pepsinógeno C.Los valores de HSCORE para la proteína variaron de 0 a 350 ysu distribución está reflejada en la figura 2. Como en ella se indica, un totalde 16 carcinomas mamarios (53,3%) mostraron una tincióninmunohistoquímica positiva para el pepsinógeno C,aunque existieron diferencias entre ellos en relación con laintensidad de tinción y porcentaje de célulasteñidas. Así, mientras que cuatro tumoresexhibían una tinción débil (HSCORE < 100),cuatro mostraban una tinción moderada (100 < HSCORE <200) y los restantes ocho mostraban una tinción fuertementepositiva para el pepsinógeno C (HSCORE > 200). El valormedio de HSCORE en el conjunto de los tumores fue de 91,5 ±19,9.
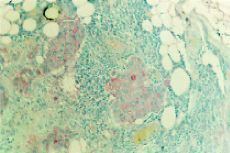
ABFig. 1. A: Carcinoma mamario primario con tinciónpositiva para el pepsinógeno C (400*). B:Metástasis ganglionares de carcinoma de mama continción positiva para el pepsinógeno C(200*).
Fig. 2. Distribución de los valores deHSCORE obtenidos en el estudio de tincióninmunohistoquímica para el pepsinógeno C en 30carcinomas primarios de mama.
Expresión de pepsinógeno C en los gangliosmetastásicos
Laexpresión de pepsinógeno C en los ganglios axilarestumorales de las 30 pacientes del estudio fue determinada de formasimilar a la expuesta en el apartado anterior. Un total de 17mujeres (56,6%) mostraron una tincióninmunohistoquímica positiva para el pepsinógeno C ensus ganglios tumorales. Dicha tincióninmunohistoquímica fue de localizaciónintracitoplasmática en todas las células tumorales delos ganglios y de intensidad moderada. La figura 1 B muestra uncaso representativo de ganglios tumorales positivos para elpepsinógeno C. Además, también cabeseñalar que todos los ganglios axilares tumorales de cadapaciente mostraron un mismo comportamiento en cuanto a latinción inmunohistoquímica para el pepsinógenoC.
Relación entre la expresión tumoral depepsinógeno C en los tumores primarios de mama y en losganglios metastásicos
Los tumoresmamarios primarios de las 17 pacientes con ganglios axilarestumorales positivos para el pepsinógeno C mostraron un valormedio de tinción inmunohistoquímica para elpepsinógeno C (HSCORE = 145 ± 27,1; mediana: 180;intervalo: 0-350) significativamente (p = 0,002) más elevadoque el de los tumores primarios de las 13 pacientes con gangliostumorales negativos para la enzima (HSCORE = 21,5 ± 14,6;mediana: 0; intervalo: 0-80). Sin embargo, cabe señalar quea pesar de esa asociación positiva de la expresión depepsinógeno C en el tumor primario y en los gangliosmetastásicos resultó llamativo observar que en cuatrocasos (13,3%) existió una tinción positiva para laenzima en los ganglios tumorales, mientras en el tumor primario nose detectó ninguna tinción. Por otra parte, no sedetectó ninguna asociación significativa entre losvalores de tinción inmunohistoquímica para elpepsinógeno C en los tumores primarios o en los gangliosmetastásicos y el número de éstos conafectación tumoral.
Expresión tumoral de pepsinógeno C ypronóstico
Durante elperíodo de seguimiento clínico existieron 14fallecimientos (100%) a consecuencia de la recurrencia tumoral enel grupo de las 14 pacientes con tumores primariospepsinógeno C negativo, mientras que tan sólo cincofallecimientos (31,2%) por el mismo motivo en el grupo de 16pacientes con tumores primarios pepsinógeno C positivos.Como se puede observar en la figura 3A y en la tabla 1 existieron diferencias significativasentre las curvas de supervivencia determinadas para esos dos gruposde pacientes (p = 0,01).
Fig. 3. Supervivencia total en función delos valores de pepsinógeno C en los tumores primarios demama (A) y en los ganglios metastásicos (B).
Conrelación al pronóstico de las pacientes enfunción de la expresión de pepsinógeno C enlos ganglios metastásicos, las diferencias entre las curvasde supervivencia total determinadas para esos dos grupos depacientes no fueron estadísticamente significativas como sepuede observar en la figura 3 B y en la tabla 1.
DISCUSIÓN
Este estudiorepresenta el primero en evaluar la expresión depepsinógeno C en metástasis ganglionares de carcinomade mama, ya que los estudios existentes hasta la fecha sobre laexpresión tumoral de esta proteína habían sidorealizados en los tumores primarios. Nuestro estudio demuestra laexpresión de esta proteína en los ganglioslinfáticos axilares metastásicos de un porcentajesignificativo de pacientes con ganglios positivos. Además,dicha expresión tumoral es coincidente en la mayoríade los casos con la de los tumores primarios. Sin embargo, deacuerdo a nuestros resultados, parece tener más valorpronóstico la expresión de pepsinógeno C eneste último compartimento tumoral.
La inmensamayoría de las investigaciones sobre parámetros de labiología tumoral de los carcinomas de mama se han centradoen la expresión de esos factores en los tumores y, engeneral, se asume que el comportamiento de esos parámetroses similar en las metástasis ganglionares linfáticasregionales o a distancia. Sin embargo, esa hipótesis no hasido probada en la mayoría de los casos, incluyendo laproteína de nuestro estudio, que se expresa por unporcentaje significativo de carcinomas mamarios primarios y tieneimportancia pronóstica. 15 Eneste sentido nuestros resultados sobre la expresión depepsinógeno C en los tumores primarios confirmanobservaciones previas de nuestro grupo acerca de laproducción de esa proteína por un porcentajesignificativo de carcinomas de mama. 15 Además también de acuerdo a esos estudiosprevios observamos la existencia de una ampliavariabilidad individual de los valores de tincióninmunohistoquímica (HSCORE) en los tumores primariospositivos para el pepsinógeno C.
Elanálisis inmunohistoquímico también nos hapermitido una evaluación morfológica de laexpresión tumoral del pepsinógeno C en los ganglioslinfáticos metastásicos. Así pudimos comprobarcómo a diferencia del tumor primario, donde en lamayoría de los casos existió una heterogeneidadintratumoral en cuanto a la expresión de la proteína,la tinción inmunohistoquímica fue uniforme yhomogénea en todos los casos de gangliosmetastásicos. Ello sugiere que los clones de célulasdel tumor primario que colonizan los ganglios linfáticosregionales muestran un mismo fenotipo en cuanto a laproducción de esta proteína.
En referenciaa la relación entre la expresión de laproteína por el tumor primario y las metástasisganglionares, nuestros resultados demuestran que el hallazgomás común es el de la producciónsimultánea de la proteína en esos dos compartimentostumorales, que ocurrió en el 86,6% de los casos.Además, el valor medio de la expresión depepsinógeno C en los tumores primarios fuesignificativamente más elevada en los casos de gangliosmetastásicos pepsinógeno C-positivos enrelación con los tumores primarios de pacientes con gangliosnegativos para la proteína. Así pues, nuestrosresultados están en la línea de otros estudios quedemuestran una relación positiva entre el tumor primario ylas metástasis de diversos parámetros de labiología tumoral del cáncer de mama, como son elcontenido de DNA e índices de proliferacióncelular, 24,25 oncógenes, 3, 9receptores de estrógenos 26y de progesterona. 25
Sin embargo,también pudimos comprobar en nuestro estudio que en un 13,3%de casos existió una absoluta discordancia de laexpresión de pepsinógeno C entre el tumor primario ysus metástasis ganglionares. Además pudimos observardos situaciones diferentes de esa discordancia. Por una parte, lapérdida absoluta de la expresión de esaproteína en las metástasis ganglionares cuando eltumor primario mostraba la producción de la misma. Y porotra, la ganancia de la peculiaridad biológica de expresaresa proteína en las metástasis ganglionares cuando eltumor primario no mostraba capacidad de producirla. Asípues, ello resulta indicativo de la complejidad del proceso de laprogresión maligna del cáncer de mama, através del cual las células cancerosas pueden perdero bien adquirir nuevas capacidades funcionales.
Nuestrosresultados también están de acuerdo con estudiosprevios de nuestro grupo que demuestran que la expresión depepsinógeno C por los tumores primarios está asociadacon un pronóstico favorable de la enfermedad. 15 Elmecanismo por el cual la expresión de pepsinógeno Cpor los tumores primarios de mama están asociados a unamenor agresividad tumoral parece estar en relación con unamayor diferenciación morfológica de los tumorespositivos para la proteína, 15 pero también pueden estar en relación con lahipótesis de que la expresión tumoral de estaproteína puede resultar indicativa de tumores que muestranuna vía específica de respuesta hormonal. En estesentido existen datos que sugieren una hormonodependencia de lostumores de mama positivos para el pepsinógeno C, ya que seha demostrado que los andrógenos, así comotambién los glucocorticoides, estimulan la expresiónde pepsinógeno C en células cancerosas de mama encultivo. 16 Además, una explicaciónadicional de porqué el pepsinógeno C, al contrario deotras enzimas proteolíticas en patología tumoral, noestá asociado a lesiones de evolución desfavorableprocede de la observación de que esta enzima es secretadacomo un precursor de alto peso molecular que requiere un pH muybajo para desempeñar su activaciónproteolítica. 14 Puesto que esas condiciones ácidas son muy difícilesde alcanzar en el medio extracelular del cáncer mamario,parece muy poco probable que el pepsinógeno C presenteactividad proteolítica funcional en el cáncer de mamay, por tanto, facilite la expansióntumoral.
Sin embargo,nuestros resultados también demuestran que laexpresión de pepsinógeno C por los ganglios axilaresmetastásicos no alcanza significaciónestadística como factor pronóstico. Ese hallazgosugiere también la importancia de las peculiaridadesbiológicas del tumor primario más que las de lasmetástasis ganglionares regionales en la evolución dela enfermedad. Pero serán necesarios estudios futuros paraconfirmar los resultados de este trabajo, así como paravalorar el posible significado biológico y clínico dela expresión del pepsinógeno C en el ámbito dela progresión tumoral en metástasis a distancia yrecurrencias locales del cáncer de mama.
REFERENCIAS
1. FeichterGE, Kaufmann M, Müller A, Haag D, Eckhardt R, Goerttler K. DNAindex and cell cycle analysis of primary breast cancer andsynchronous axillary lymph node metastases. Breast Cancer Res Treat1989;13: 17-22.
2.DaidoneMG, Silvestrini R, Valentinis B, Persici P, Mezzanotte G,Squicciarini P, et al. Proliferative activity of primary breastcancer and of synchronous lymph node metastases evaluated by3H-thymidine labelling index. Cell Tissue Kinet1990;23:401-8.
3.Tommasi S,Giannella C, Paradiso A, Barletta A, Mangia A, Simone G, et al.HER-2/neu gene in primary and local metastatic axillary lymph nodesin human breast tumors. Int J Biol Markers1992;7:107-13.
4.Chang DB,Yang PC, Chang KJ, Luh KT, Kuo SH. Comparison of DNA stemline andcell kinetics between primary breast cancer and its lymph nodemetastasis. Anal Quant Cytol Histol 1993;15:32-8.
5.Goodson W,Ljung BM, Moore D, Mayall B, Waldman FM, Chew K, et al. Tumorlabeling indices of primary breast cancers and their regional lymphnode metastases. Cancer 1993;71:3914-9.
6.AndersenJ, Poulsen HS. Relationship between estrogen receptor status in theprimary tumor and its regional and distant metastases. Animmunohistochemical study in human breast cancer. Acta Oncol1988;27:761-5.
7.Agthoven Tvan, Timmermans M, Dorssers LCJ, Henzen-Logmans SC. Expression ofestrogen, progesterone and epidermal growth factor receptors inprimary and metastatic breast cancer. Int J Cancer1995;63:790-3.
8.Umekita Y,Sagara Y, Yoshida H. Estrogen receptor mutations and changes inestrogen receptor and progesterone receptor protein expression inmetastatic or recurrent breast cancer. Jpn J Cancer Res1998;89:27-32.
9.MoffettBF, Baban D, Bao L, Tarin D. Fate of clonal lineages duringneoplasia and metastasis studied with an incorporated geneticmarker. Cancer Res 1992;52: 1737-43.
10.Mori T,Morimoto T, Komaki K, Monden Y. Comparison of estrogen receptor andepidermal growth factor receptor content of primary and involvednodes in human breast cancer. Cancer 1991;68:532-7.
11.Storm FK,Mahvi DM, Gilchrist KW. Heat shock protein 27 overexpression inbreast cancer lymph node metastasis. Ann Surg Oncol1996;3:570-3.
12.NishizakiT, De Vries S, Chew K, Goodson III WH, Ljung BM, Thor A, et al.Genetic alterations in primary breast cancers and their metastases:direct comparison using modified comparative genomic hybridization.Genes, Chromosomes & Cancer 1997;19:267-72.
13.SamloffIM. Peptic ulcer: the many proteinases of aggression.Gastroenterology 1989;96:586-95.
14.Sánchez LM, Freije JMP, Merino AM, Vizoso F, Foltmann B,López-Otín C. Isolation and characterization of apepsin C zymogen produced by human breast tissues. J Biol Chem1992;267:24725-31.
15. Vizoso F,Sánchez LM, Díez-Itza I, Merino AM,López-Otín C. Pepsinogen C is a new prognostic markerin primary breast cancer. J Clin Oncol 1995;13:54-61.
16.Balbín M, López-Otín C. Hormonal regulation ofthe human pepsinogen C gene in breast cancer cells. J Biol Chem1996;271:1575-81.
17.HaagensenDE, Stewart P, Dilley WG, Wells SA. Secretion of breast grosscystic disease fluid proteins by T47D breast cancer cells inculture-modulation by steroid hormones. Breast Cancer Res Treat1992;23:77-86.
18.BloomHJG, Richardson WW. Histological grading and prognosis in breastcancer. Br J Cancer 1957;11:359-77.
19.FoltmannB, Jensen AL. Human prograstricsin. Analysis of intermediatesduring activation into gastricsin and determination of theaminoacid sequence of the propart. Eur J Biochem1982;128:63-70.
20.Vaitukaitis JL. Production of antisera with small doses ofimmunogen: multiple intradermal injections. Methods Enzymol1981;73:46-52.
21.McCartyKS Jr, Szabo E, Flowers JL, Cox EB, Leight GS, Miller L. Use of amonoclonal anti-estrogen receptor antibody in theimmunohistochemical evaluation of human tumors. Cancer Res1986;46:4244-8.
22.KaplanEL, Meier P. Nonparametric estimation from incomplete observations.J Am Stat Assoc 1958;53:457-81.
23.Mantel N,Myers M. Problems of convergence of maximun likehood iterativeprocedures in multiparameter situations. J Am Stat Assoc1971;66:484-91.
24.Clark GM,Dressler LG, Owens MA, Pounds G, Oldaker T, McGuire WL. Predictionof relapse or survival in patients with node-negative breast cancerby DNA flow cytometry. N Engl J Med 1989;320:627-33.
25.Sigurdsson H, Baldetorp B, Borg A. Indicators of prognosis innode negative breast cancer. N Engl J Med1990;322:1045-53.
26. HartveitF, Maartmann-Moe H, Stoa KF, Tangen M, Thorsen T. Early recurrencein estrogen receptor negative breast carcinomas. A preliminaryreport. Acta Chir Scand 1980;146:93-5.