CASOCLÍNICO
Angiosarcoma de mama. Revisión a propósito de un casoclínico
Angiosarcoma of the breast. Review of a clinicalcase
M.aCayuela*,J. Pahisa*,B.Ferrer**
**Departamento de Obstetricia y Ginecología.
** Departamento de Anatomía Patológica. HospitalClínic. Barcelona
Correspondencia:
M.a I. Cayuela Maldonado.
Departamento de Obstetricia y Ginecología.
Hospital Clínic. Barcelona.
Villarroel, 170.
08036 Barcelona.
SUMMARY
Primaryangiosarcoma of the breast is a tumor that is rare in ocurrence.The frequent association with post-irradiation edema seems to playan important role. Mastectomy is the treactment of choice. Theaxillary lymphadenectomy is not indicated (because nodal metastasisis rare). A case of angiosarcoma of the breast in a 62 year oldwoman is presented and a review of theliterature.
Keywords
Angiosarcoma, Irradiation, Mastectomy.
RESUMEN
Elangiosarcoma primario de mama es un tumor poco frecuente. Laasociación con postirradiación del edema parece tenerun importante papel. La mastectomía es el tratamiento deelección. La linfadenectomía axilar no estáindicada (ya que la metástasis ganglionar es pocofrecuente). Se presenta un caso de angiosarcoma de mama en unamujer de 62 años junto con la revisiónbibliográfica.
Palabrasclave
Angiosarcoma, Irradiación,Mastectomía.
INTRODUCCIÓN
Elangiosarcoma mamario es un tumor de origen vascular poco frecuente.Cabe diferenciarlo del angiosarcoma cutáneo delocalización principalmente extramamaria, denominado Sd. DeStewart-Treves 4, 7, 8 (que suele asociarse a unlinfedema crónico de la extremidadsuperior).
Su frecuenciaestá en aumento debido al auge del tratamiento conservadoren la mama, siendo actualmente un tumor raro, pero preocupante, porsu alto grado de malignidad, su agresividad y su diagnósticotardío.
Gran variedadde nombres son utilizados para definir dicho tumor: angiosarcoma,hemangioendotelioma, hemangioblastoma o hemangiosarcoma.
CASOCLÍNICO
Paciente de62 años que no refiere antecedentes personales deinterés, salvo dos cesáreas anteriores. Noantecedentes en familiares próximos de neoplasias malignas.No alergias conocidas. No hábitos tóxicos. Refiereaparición en pocos días de tumoración situadaen el cuadrante superior externo de mama izquierda, no dolorosa. Norefiere traumatismo. En la exploración física seobjetiva nódulo de 2 cm de diámetro, móvil,bien delimitado, situado en el cuadrante superior de mamaizquierda. La axila es negativa. La exploración de la mamaderecha resulta ser anodina. En la mamografía se observanódulo situado en el cuadrante superior de mama izquierda,de límites imprecisos, de 2 * 2 cm aproximadamente, con microcalcificaciones en suinterior, sin provocar retracción ni edema cutáneo.Mediante el tru-cut se llega al diagnóstico deangioma con áreas de necrosis (difícil de precisar simaligno). Ante la sospecha clínica se realiza biopsiaperoperatoria confirmándose la presencia de un nódulode angiosarcoma bien diferenciado, de bajo gradohistológico, de 1,4 cm de diámetro. Se practicaposteriormente una mastectomía simple. La evoluciónpostoperatoria fue sin incidencias. En la anatomíapatológica de la pieza de mastectomía no seevidenció tejido tumoral residual. Los controles posterioreshan sido correctos hasta el momento actual. El estudioinmunohistoquímico se realizó sobre tejido fijado conformol e incluido en parafina. Se utilizaron anticuerpos contraendotelios vasculares (anti-CD31, Dako, Copenhagen, Dinamarca),quratinas y vimentina, tras efectuar desenmascaramientoantigénico mediante tratamiento en olla a presióndurante 5 minutos. La amplificación de la reacción serealizó con En Vision (Dako) y el revelado con peroxidasa yH2O2.
REVISIÓN DE LA LITERATURA
Respecto a suincidencia, el angiosarcoma (AS) es un tumor raro. Los sarcomasrepresentan del 0,1-1% de los tumores mamarios, y dentro deéstos, el AS supone el 2,7-10%. 4-6
El principalfactor que se relaciona con el aumento de incidencia de dicho tumores el incremento progresivo de la terapia conservadora, ymás concretamente es la utilización de radioterapiasobre el lecho mamario tras tumorectomía, por lo que lamayoría de las series revisadas están formadas porangiosarcoma secundarios a radioterapia (siendo escasa lainformación sobre los tumores primarios).
Existendiferencias significativas en la edad media de aparición.Los tumores primarios se dan en pacientes más jóvenes(20-40 años), son más agresivos y tienen unasupervivencia media de 19-30 meses. En los secundarios la media deedad es más tardía, siendo de 60 años (30-70años). 1 Parece existir una relacióndirecta entre la edad y el aumento de sensibilidad al tratamientoconservador. Brady et al encuentran una relación inversaentre la edad en que ha sido irradiado el paciente y la latencia deaparición del AS.
Tras laaplicación de radioterapia (RT) existe una incidencia deaparición de AS del 0,16%. 1 Eltiempo de latencia entre la aplicación del tratamientoconservador y la aparición de la neoplasia se sitúaalrededor de los 65-74 meses (intervalo: 29-178 meses).1
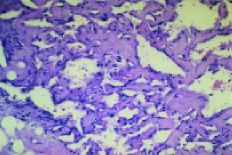
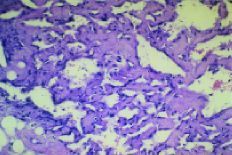
Fig. 1. Angiosarcoma. Hematoxilina-eosina*200. Por gentileza delos doctores Ordi y Ferrer.
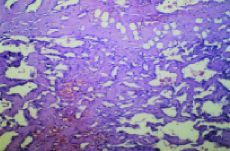
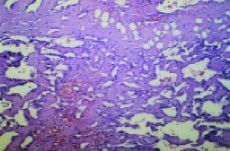
Fig. 2. Angiosarcoma. Hematoxilina-eosina*40. Por gentileza delos doctores Ordi y Ferrer. Hospital Clínic.Barcelona.
La RTtambién condiciona un aumento en frecuencia deaparición del resto de tumores de extirpe sarcomatosa(fibrosarcoma, histiocitoma, osteosarcoma, etc.), siendo elangiosarcoma el más raro. 2, 9-12
Existe unacorrelación entre la dosis de irradiación y el tiempode latencia. Experimentalmente se ha comprobado una relacióninversamente proporcional con dosis de aproximadamente 3.000 cGy ydirectamente proporcional con dosis de 4.000 cGy (debido a unbalance entre las células malignas que mueren por lairradiación y la transformación neoplásica delas no malignas). 3 En estas series de pacientes se haencontrado un tiempo de latencia superior en la aparición deAS extramamario que mamario (174 frente a 65 meses). El riesgo detransformación neoplásica se incrementa linealmente apartir de dosis de 100 cGy. 3
Dentro de laetiología se postulan dos hipótesis: a) AS aparece apartir de la malignización de un hemangioma, y b) el efectomutagénico de la RT ocasiona la transformaciónneoplásica del lecho del tumor primario. 3, 13, 14,17
Laanatomía patológica del AS está determinadapor la coexistencia de dos grupos celulares. El primero estáformado por las células endoteliares neoplásicas,caracterizadas por marcadores como el factor VIII, CD 31+ y lavimentina. El otro está constituido por la agrupaciónde células pequeñas, fusiformes que tienen comomarcadores la actina, vimentina y son negativas para el factor VIIIy CD31. Son negativas para marcadores epiteliares como lascitoqueratinas, CAM5,2, MNF 116. Las células endoteliaresmalignas forman lechos vasculares que rodean las célulasfusiformes íntimamente adheridas (clusters).2,15
Lapositividad para el factor VIII y CD31 nos permite establecer eldiagnóstico diferencial con otros tumores, como loscarcinomas poco diferenciados o los melanomas amelanóticos.Los AS bien diferenciados son de más difícildiferenciación con el hemangioma o con simplesatípicas lesiones vasculares que suceden tras RT. Ladiferencia principal con éstos es un grado superior deactividad mitótica y una atipia citológica.13,15
De entre susformas de presentación la más frecuente suele sercomo área inflamatoria con múltiples nódulos(negros, azulados, en una zona equimótica, eritematosa oedematosa).
El AStambién puede aparecer en el lecho del linfedemacrónico que se produce tras la mastectomía máslinfadenectomía (Stewart y Treves).
Las pacientescon AS primario suelen ser relativamente más jóvenesque las con adenocarcinoma. Esto implica la posibilidad deaparición en la mujer durante la gestación. Rosen etal encuentran una incidencia de los AS del 6%. G. Barrenetxeapublica un caso de coexistencia con la gestación. No existeevidencia de su hormonodependencia, pero se han encontradoreceptores de estrógenos y glucocorticoides en ellos.5,21
Laagresividad de estos tumores viene caracterizada por el efectoinmunosupresor debido al tumor primario o al tratamiento recibido,la obstrucción linfática, el compromiso vascularcondicionado por la fibrosis postradioterapia (que dificulta lallegada de la quimioterapia), la predominancia del grado pocodiferenciado y el diagnóstico tardío. 15
Eldiagnóstico del AS es difícil, factor que condicionasu pronóstico. Dicha dificultad viene condicionada por laaparición de lesiones postradioterapia que enmascaran elproceso como edema, telangiectasias, fibrosis, endarteritis, etc.(aunque el 90% de los pacientes presentaban fibrosis, éstano está asociada a un incremento del riesgo de padecerAS). 1Por otro lado, es un tumor poco sospechado debido asu baja incidencia.
Respecto alas técnicas diagnósticas existe un 33% de falsosnegativos con la mamografía. La ecografía parece serútil sólo para el estudio de la masa tumoral.16 El diagnóstico más fiable es la biopsiaincisional, siendo el puch o la citologíainsuficientes.
El principalfactor pronóstico es el grado de resecabilidad. Tras unaresección completa, la supervivencia global a los 2años se halla en el 83%; sin embargo, si la resecciónes parcial no se encuentran supervivientes a los 2 años (LucJ. A. Strobbe et al).
Eltamaño tumoral juega un papel importante,considerándose la resección completa de un tumor demenos de 5 cm de diámetro como un factor pronósticoindependiente (Brady et al). La presencia de masa palpable es unsigno de enfermedad avanzada, siendo la supervivencia global mediade 37 meses. 1
Respecto algrado de diferenciación, existen controversias entre losdiferentes autores. Luc Strobbe et al no han encontrado diferenciassignificativas; sin embargo, otros encuentran una supervivenciamedia a los 5 años de los bien diferenciados del 95%, encontraposición al 14% de los poco diferenciados (poco omedianamente diferenciados suelen tener una supervivencia inferiora 3 años). 18 En series de Rosen et al lasupervivencia libre de enfermedad se sitúa en 15años, 12 años y 15 meses para los grado dediferenciación I/II/III, respectivamente. El númeroelevado de mitosis (Nack et al) y la presencia dedegeneración, la invasión linfática ymetástasis a distancia son factores determinantes de malpronóstico.
Eltratamiento principal de estos tumores es la cirugíaradical. 8 La resección completa de lalesión, con suficiente margen libre, se acompaña demayores índices de supervivencia global que la parcial (83%frente al 0% a los 2 años). 1 Dentro de las técnicas quirúrgicas lamás frecuente empleada es la mastectomía simple,aunque la exéresis amplia con márgenes libres tienesimilares índices de supervivencia. Tras estudiar diversasseries no se encuentra beneficio en realizar lalinfadenectomía, ya que suelen encontrarse gangliospositivos cuando ya existen metástasis adistancia.
Cuando lacirugía falla la supervivencia se encuentra seriamenteafectada, ya que los restantes tratamientos --radioterapia yquimioterapia (QT)-- no se han demostrado efectivos. La QT se puedeutilizar como tratamiento paliativo a corto plazo.
Diversosautores han publicado la utilización de RT asociada ahipertermia para el control local de las recurrencias que no sonsuceptibles de someterse a otra cirugía. 19, 20 Recientes estudios sugieren que la QT adyuvante puedealargar la supervivencia de aquellos pacientes con tumoraciones degrado III. Rosen et al encuentran una disminución de lasrecurrencias en pacientes con QT adyuvante.
CONCLUSIONES
El AS es untumor con una baja incidencia. De las series publicadas predominanlos aparecidos postradioterapia que los primarios; estos tienen unaedad media de aparición diferente (60 frente a 30años, respectivamente). Las lesiones previas (que enmascaranel proceso) y su baja frecuencia son factores que dificultan sudiagnóstico. Como principales factores pronósticosencontramos el tamaño tumoral, la duración de lossíntomas, número de mitosis, presencia deafectación linfática y a distancia, gradohistológico y modalidad de tratamiento. El tratamientomás efectivo es la resección completa conmárgenes libres. La QT y RT están limitados adeterminados casos. Estudios recientes demuestran un aumento de lasupervivencia en aquellos tumores que se asocia QTadyuvante.
REFERENCIAS
1.StrobbeLJA, l. Peterse HI, Van Tinteren H, Wijnmaalen A, Rutgers EJT.Angiosarcoma of the breast after conservation therapy for invasivecancer, the incidence and outcome. An unforeseen sequela. BreastCancer Research and Treatment 1998;47:101-9.
2.Parham DM,Fisher C. Angiosarcoma of the breast developing post radiottherapy.Histopathology 1997,31: 189-95.
3.Cafiero,et al. Radiaton associated angiosarcoma. Cancer 1996;77.
4.Bolin DJ,Lukas GM. Low-grade dermal angiosarcoma of the breast followingradiotherapy. The American Surgeon 1996;62:668-71.
5.Barrenetxea G, Schneider J, Tánago JG, Pérez C,Centeno MM, Rodríguez-Escudero FJ. Angiosarcoma of thebreast and pregnancy: a new therapeutic approach. European J O andG and RB 1995;60:87-9.
6.NorifumiNaka et al. Prognostic factors in angiosarcoma: a multivariateanalysis of 55 cases. Journal of Surgical Oncology1996;61:170-6.
7.StewartFW, Treves N. Lymphangiosarcoma in postmastectomy lymphedema: areport of six cases in elephantiasis chirugica. Cancer1948;1:64-81.
8.RainwaterLM, Martin KJ, Geffey TJ. Angiosarcoma of the breast. Arch Surg1986;121:669-72.
9.FergusonDJ, Sutton HG, Dawson PJ. Late effects of adjuvant radiotherapy forbreast cancer. Cancer 1984; 54:2319-23.
10.Kuten A,Sapir D, Cohen Y. Postirradiation soft tissue sarcoma occurring inbreast cancer patients: report of seven cases and result ofcombination chemotherapy. J Surg Oncol 1985:28:168-71.
11.Zucali R,Merson M, Placucci M, Di Palma S, Veronesi U. Soft tissue sarcomaof the breast after conservative surgery and irradiation for earlymammary cancer. Radiotherapy and Oncology 1994;30:271-3.
12.PierceSM, Recht A, Lingos TL. Long-term radiaton complication followingconservative urgery and radiation therapy. Int J Rad Oncol BiolPhys 1987;23:479-83.
13.DaviesJD, Rees GJ, Mera SI. Angiosarcoma in irradiated postmastectomychest wall. Histopathology 1983;7:947-56.
14.CostelloSA, Seywwright M. Psotirradiaton malignant transformation in benignhaemangioma. Eur J Surg Oncol 1990;16:517-9.
15.LaskinWB, Silverman TA, Enzinger FM. Postradiaton soft tissue sarcomas.Cancer 1988;62:2330-40.
16.TassinGB, Fornage BD, Sneige N. Primary multifocal angiosarcoma of thebreast. J Ultrasound Med 1990; 9:481-83.
17.Badwe RA,Hanby AM, Fentirman IS. Angiosarcoma of th skin overlying anirradiated breast. Breast Cancer Res Treatment1991;19:69-72.
18.Rosen PP,Kimmel M, Ersberg D. Mammary angiosarcoma. The prognosticsignificance of tumor differentiaton. Cancer1988;62:2145-51.
19.BuattiJM, Harari OM. Radiaton-induced angiosarcoma of the breast. Am JClin Oncol 1994;17:444-7.
20.SlotmanBJ, Van Hattum AH, Meyer S, Njo KH. Angiosarcoma of th breastfollowing conserving treatment of breast cancer. Eur J Cancer1994;30;416-7.
21.BretaniMM, Pacheco MM, Oshima CT, Nagai MA. Steroid receptor in breastangiosarcoma. Cancer 1983;51;2105-11.
22.TresserraS, Grases J. Hemangioma perilobulillar de la mama: apropósito de dos casos y revisión de la literatura.Rev Senología y Patol Mam 1995;8:47-9.
23.De VillaVH, Idoate MA. Angiosarcoma cutáneo sobre mama tratadapreviamente por cáncer con cirugía conservadora yradioterapia. Rev Senología y Patol Mamaria19958:197-201.
24.Álvarez A, Valbuena L. Angiosarcoma de mama. RevSenología y Patol Mamaria 1989;2:12-5.