Revisar nuestra experiencia en la biopsia selectiva del ganglio centinela (BGC) en pacientes con cáncer de mama operable tratadas con quimioterapia neoadyuvante (QTN).
Material y métodosEstudio prospectivo, enero de 2008/diciembre de 2014, 235 BGC en pacientes con cáncer de mama infiltrante T1-3/N0-1, tratadas con epirrubicina/ciclofosfamida, docetaxel y trastuzumab en Her2/neu positivas. El estatus axilar se estableció por exploración física, ecografía axilar y punción de ganglios sospechosos. El día antes de la cirugía se inyectaron periareolarmente 74-111 MBq de 99mTc-nanocoloide de albúmina. Al finalizar el tratamiento se realizó BGC y linfadenectomía axilar. El GC se analizó por cortes de congelación, hematoxilina-eosina, inmunohistoquímica o one-step nucleic acid amplification. Se determinaron tasa de identificación (Id.GC) y falsos negativos (FN).
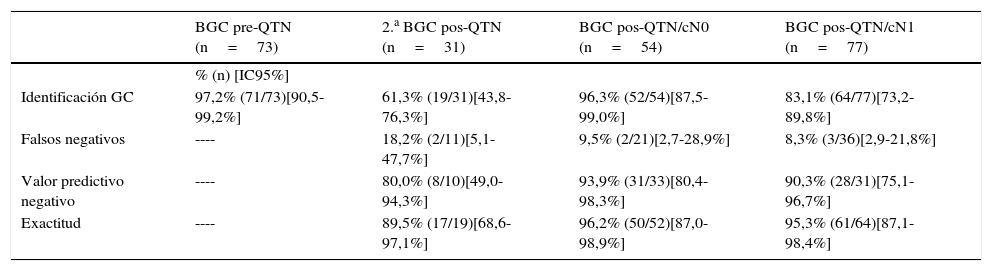
ResultadosGrupo I BGC pre-QTN pacientes cN0 de inicio: n=73, Id.GC 97,2% (IC95% 90,5-99,2). Grupo II 2.a BGC pos-QTN pacientes pN1(gc) de inicio: n=31, Id.GC 61,3% (IC95% 43,8-76,3), FN 18,2% (IC95% 5,1-47,7). Grupo III BGC pos-QTN pacientes cN0 de inicio: n=54, Id.GC 96,3% (IC95% 87,5-99,0), FN 9,5% (IC95% 2,7-28,9). Grupo IV BGC pos-QTN pacientes cN1 de inicio, ycN0 posneoadyuvancia: n=77, Id.GC 83,1% (IC95% 73,2-89,8), FN 8,3% (IC95% 2,9-21,8).
ConclusionesLa identificación de la BGC pre-QTN es excelente. En pacientes pN1(gc) al diagnóstico, una 2.a BGC pos-QTN no es válida para su aplicación clínica. La BGC pos-QTN puede realizarse con fiabilidad en pacientes cN0 y cN1 de inicio, con axila clínicamente negativa al finalizar la neoadyuvancia (ycN0), y linfadenectomía axilar si el resultado del GC es positivo o no se identifica en la cirugía, en el ámbito de un equipo multidisciplinar con experiencia.
To analyze our experience of sentinel lymph node biopsy (SLNB) in patients with operable breast cancer treated with neoadjuvant chemotherapy (NAC).
Material and methodsA prospective study was conducted between January 2008 and December 2014 in 235 SLNB in patients with infiltrating breast carcinoma T1-3/N0-1 treated with epirubicin/cyclophosphamide, docetaxel and trastuzumab in Her2/neu-positive patients. Axillary evaluation included physical examination and ultrasound, with guided core needle biopsy of any suspicious lymph nodes. The day before surgery, 74-111 MBq of 99mTc-albumin nanocolloid was injected periareolar. Following NAC, patients underwent SLNB and axillary lymph node dissection. SLN were examined with hematoxylin-eosin staining and immunohistochemical analysis or one-step nucleic acid amplification. The identification rate (IR) and false-negative rate (FNR) were determined.
ResultsGroup I SLNB pre-NAC in patients cN0 at diagnosis: n=73, IR 97.2% (95%CI: 90.5-99.2). Group II 2nd SLNB pos-NAC in patients pN1(sn) at diagnosis: n=31, IR 61.3% (95%CI: 43.8-76.3), FNR 18.2% (95%CI: 5.1-47.7). Group III SLNB pos-NAC in patients cN0 at diagnosis: n=54, IR 96.3% (95%CI: 87.5-99.0), FNR 9.5% (95%CI: 2.7-28.9). Group IV SLNB pos-NAC in patients cN1 at diagnosis and ycN0 post-treatment: n=77, IR 83.1% (95%CI: 73.2-89.8), FNR 8.3% (95%CI: 2.9-21.8).
ConclusionsThe detection rate for SLNB prior to NAC is excellent. A second SLNB after NAC in women with a positive SLN at diagnosis is not useful. SLNB after NAC is feasible in cN0 and cN1 patients at diagnosis, clinically axillary node-negative after therapy (ycN0), with subsequent axillary lymph node dissection if the SLNB is positive or not identified during surgery, when performed by an experienced multidisciplinary team.
La quimioterapia neoadyuvante (QTN) es el tratamiento estándar en el cáncer de mama inoperable, localmente avanzado o inflamatorio, y existen evidencias que apoyan su uso en estadios más precoces. Entre sus ventajas están el inicio precoz del tratamiento sistémico, la conversión en operable de un cáncer de mama no quirúrgico, el aumento de cirugías conservadoras, la valoración in vivo de la quimiosensibilidad, y ser un modelo para la investigación clínica o traslacional1,2.
La biopsia selectiva del ganglio centinela (BGC) es el procedimiento de elección para la estadificación axilar del cáncer de mama, seleccionando a pacientes en las que la linfadenectomía axilar (LA) no aporta ningún beneficio adicional. En la literatura se discute la posibilidad de realizar la BGC tanto antes como después de la QTN y las posibles ventajas e inconvenientes3,4. Hasta hace poco se recomendaba la práctica de la BGC antes de iniciar la neoadyuvancia, pero existe una tendencia a su realización al finalizar el tratamiento. Así, la revisión 2013 del consenso sobre la BGC en el cáncer de mama de la Sociedad Española de Senología y Patología Mamaria considera que: en pacientes con axila clínica/ecográficamente negativa de inicio (cN0), puede realizarse tanto previa como posterior al tratamiento sistémico primario (TSP); y en pacientes cN1/N2 de inicio con negativización clínica y ecográfica de la axila tras la neoadyuvancia (ycN0), puede realizarse después del TSP y evitar la LA cuando el GC sea negativo5. Del mismo modo, según la actualización 2014 de las recomendaciones de la American Society of Clinical Oncology, la BGC puede ofrecerse antes o después de la QTN en mujeres con cáncer de mama operable, pero este procedimiento parece ser menos preciso después de la QTN6.
El objetivo del estudio es revisar y actualizar el análisis de la experiencia adquirida por nuestro hospital en la BGC en pacientes con cáncer de mama en el contexto de la QTN, para seleccionar el momento más adecuado para su realización.
Material y métodosPacientesEstudio clínico prospectivo observacional que incluyó a mujeres con carcinoma de mama infiltrante operable, confirmado histológicamente mediante biopsia con aguja gruesa (BAG), candidatas o tratadas con QTN, cirugía de la mama y BGC con LA inmediata. Se excluyeron a las mujeres con carcinoma inflamatorio, cirugía y/o radioterapia mamaria previa, hormonoterapia neoadyuvante, tumores multicéntricos, enfermedad metastásica, segunda neoplasia, progresión de la enfermedad durante el tratamiento, gestantes o en periodo de lactancia, menores de 18 años, alergia a la albúmina humana o retirada del consentimiento en cualquier momento del estudio. Las pacientes se clasificaron en cuatro grupos: I. BGC pre-QTN (BGC preneoadyuvancia en pacientes con axila clínica/ecográficamente negativa de inicio); II. 2.a BGC pos-QTN (2.a BGC posneoadyuvancia y LA en pacientes con axila clínica/ecográficamente negativa de inicio y GC positivo preneoadyuvancia); III. BGC pos-QTN/cN0 (BGC posneoadyuvancia y LA en pacientes con axila clínica/ecográficamente negativa de inicio); y IV. BGC pos-QTN/cN1 (BGC posneoadyuvancia y LA en pacientes cN1 de inicio y negativización clínica de la axila).
El estudio de mama y axila al diagnóstico constaba de exploración física, mamografía, ecografía, resonancia magnética y BAG ecoguiada de los ganglios axilares sospechosos. Al finalizar la quimioterapia, las pacientes se evaluaron con exploración física, resonancia magnética y/o ecografía. Para la estadificación de las pacientes se ha seguido la clasificación TNM7. El esquema secuencial de quimioterapia consistió en: epirrubicina (90mg/m2)/ciclofosfamida (600mg/m2) 4 ciclos, cada 21 días, y docetaxel (100mg/m2) 4 ciclos, con trastuzumab (8mg/kg dosis de carga, 6mg/kg cada 21 días) en pacientes con sobreexpresión de HER2. El grado de respuesta clínica a la QTN se evaluó según criterios RECIST8. En todas las pacientes se obtuvo el consentimiento informado por escrito.
Detección gammagráfica e intraoperatoria del ganglio centinelaEl día antes de la cirugía se inyectaron periareolarmente 74-111 MBq de 99mTc-nanocoloide de albúmina y después se practicó una linfogammagrafía hasta visualizar el GC. Se identificó como GC, al ganglio/s visualizado/s, especialmente si están conectados a un canal linfático y una vez confirmados se marcó su localización sobre la piel. En la cirugía, se consideraron GC a los identificados en el territorio determinado por la linfogammagrafía que presentaban actividad con la sonda detectora gamma en el lecho quirúrgico5.
Estudio anatomopatológicoEn la BAG del tumor se determinaron tipo histológico, receptores de estrógenos (RE), receptores de progesterona (RP), expresión del receptor 2 del factor de crecimiento epidérmico humano (HER2), índice de proliferación Ki-67, y citoqueratina 19 (CK19). Las pacientes se clasificaron como: luminal-A (RE+/HER2-/Ki-67 <20%/RP+), luminal-B/HER2-negativo (RE+/HER2-/Ki-67 >20% o RP <20%), luminal-B/HER2-positivo (RE+/HER2+/cualquier Ki-67 o RP), HER2-positivo (HER2+/RE-/RP-) y triple negativo (ductal, RE-/RP-/HER2-)9.
El GC se estudió por análisis histológico intraoperatorio mediante cortes por congelación y análisis diferido con tinción de hematoxilina-eosina e inmunohistoquímica con anticuerpos anticitoqueratina AE1/AE3 (IHQ), u OSNA (amplificación de ácido nucleico de un solo paso), según la disponibilidad de la técnica durante el periodo de estudio. Considerando GC positivo al que presentó macrometástasis (>5.000 copias/μL ARNm-CK19, o tamaño >2mm de diámetro) o micrometástasis (250-5.000 copias/μL ARNm-CK19, o tamaño entre 0,2-2mm de diámetro); y GC negativo al que presenta células tumorales aisladas (100-250 copias/μL ARNm-CK19, o tamaño ≤0,2mm) o ausencia de células tumorales metastásicas (<100 copias/μL ARNm-CK19)5. Los ganglios de la LA se analizaron con hematoxilina-eosina, e IHQ según criterio del patólogo responsable. En la pieza de la mama se evaluó la respuesta patológica del tumor primario a la QTN como respuesta patológica completa (RCp, ausencia de tumor infiltrante o presencia de carcinoma in situ residual), o ausencia de respuesta (NRp, persistencia de carcinoma infiltrante residual).
Análisis estadísticoEn el análisis descriptivo, se expresaron las variables cuantitativas como media, desviación típica, mínimo y máximo; y para las variables cualitativas se calculó su frecuencia y porcentaje relativo en la población. Se determinaron el porcentaje de identificación del GC y la tasa de falsos negativos (FN). Se diseñaron tablas de contingencia 2×2 para calcular la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y exactitud diagnóstica, con estimación del intervalo de confianza al 95% (IC95%).
El análisis de las diferencias en las variables categóricas se realizó con la prueba de Chi-cuadrado de Pearson (χ2) o el estadístico exacto de Fisher con una perspectiva bilateral, y para las diferencias en los valores medios de las variables continuas la prueba t de Student, considerando estadísticamente significativo un valor de p <0,05. Los programas informáticos usados fueron SPSS versión 15.0 y la calculadora CASPe para diagnóstico.
Parte de la población de este estudio y la metodología ya han sido incluidas en publicaciones anteriores10–12. El estudio ha sido aprobado por el Comité de Ética y ensayos clínicos del hospital.
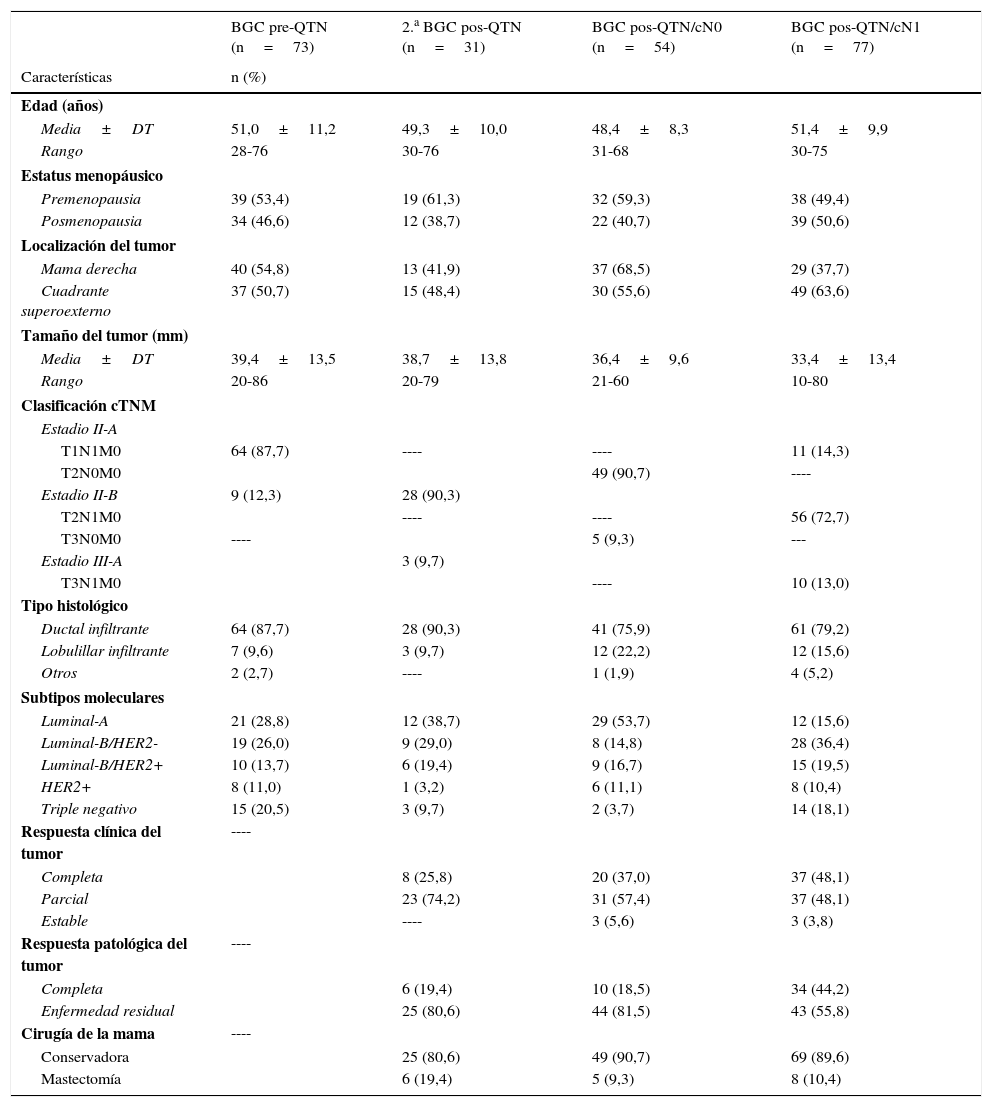
ResultadosEntre enero de 2008 y diciembre de 2014, se han realizado 235 procedimientos BGC en cáncer de mama en el contexto de la QTN. Las características clínicas y patológicas de las pacientes se resumen en la tabla 1. La tabla 2 presenta los parámetros de validez diagnóstica de la BGC, y la tabla 3 el número de GC identificados y metastásicos, y ganglios axilares de la LA. En 92 pacientes se realizó un análisis histológico del GC y en 114 la técnica molecular OSNA.
Características clínicas y patológicas de las pacientes
| BGC pre-QTN (n=73) | 2.a BGC pos-QTN (n=31) | BGC pos-QTN/cN0 (n=54) | BGC pos-QTN/cN1 (n=77) | |
|---|---|---|---|---|
| Características | n (%) | |||
| Edad (años) | ||||
| Media±DT | 51,0±11,2 | 49,3±10,0 | 48,4±8,3 | 51,4±9,9 |
| Rango | 28-76 | 30-76 | 31-68 | 30-75 |
| Estatus menopáusico | ||||
| Premenopausia | 39 (53,4) | 19 (61,3) | 32 (59,3) | 38 (49,4) |
| Posmenopausia | 34 (46,6) | 12 (38,7) | 22 (40,7) | 39 (50,6) |
| Localización del tumor | ||||
| Mama derecha | 40 (54,8) | 13 (41,9) | 37 (68,5) | 29 (37,7) |
| Cuadrante superoexterno | 37 (50,7) | 15 (48,4) | 30 (55,6) | 49 (63,6) |
| Tamaño del tumor (mm) | ||||
| Media±DT | 39,4±13,5 | 38,7±13,8 | 36,4±9,6 | 33,4±13,4 |
| Rango | 20-86 | 20-79 | 21-60 | 10-80 |
| Clasificación cTNM | ||||
| Estadio II-A | ||||
| T1N1M0 | 64 (87,7) | ---- | ---- | 11 (14,3) |
| T2N0M0 | 49 (90,7) | ---- | ||
| Estadio II-B | 9 (12,3) | 28 (90,3) | ||
| T2N1M0 | ---- | ---- | 56 (72,7) | |
| T3N0M0 | ---- | 5 (9,3) | --- | |
| Estadio III-A | 3 (9,7) | |||
| T3N1M0 | ---- | 10 (13,0) | ||
| Tipo histológico | ||||
| Ductal infiltrante | 64 (87,7) | 28 (90,3) | 41 (75,9) | 61 (79,2) |
| Lobulillar infiltrante | 7 (9,6) | 3 (9,7) | 12 (22,2) | 12 (15,6) |
| Otros | 2 (2,7) | ---- | 1 (1,9) | 4 (5,2) |
| Subtipos moleculares | ||||
| Luminal-A | 21 (28,8) | 12 (38,7) | 29 (53,7) | 12 (15,6) |
| Luminal-B/HER2- | 19 (26,0) | 9 (29,0) | 8 (14,8) | 28 (36,4) |
| Luminal-B/HER2+ | 10 (13,7) | 6 (19,4) | 9 (16,7) | 15 (19,5) |
| HER2+ | 8 (11,0) | 1 (3,2) | 6 (11,1) | 8 (10,4) |
| Triple negativo | 15 (20,5) | 3 (9,7) | 2 (3,7) | 14 (18,1) |
| Respuesta clínica del tumor | ---- | |||
| Completa | 8 (25,8) | 20 (37,0) | 37 (48,1) | |
| Parcial | 23 (74,2) | 31 (57,4) | 37 (48,1) | |
| Estable | ---- | 3 (5,6) | 3 (3,8) | |
| Respuesta patológica del tumor | ---- | |||
| Completa | 6 (19,4) | 10 (18,5) | 34 (44,2) | |
| Enfermedad residual | 25 (80,6) | 44 (81,5) | 43 (55,8) | |
| Cirugía de la mama | ---- | |||
| Conservadora | 25 (80,6) | 49 (90,7) | 69 (89,6) | |
| Mastectomía | 6 (19,4) | 5 (9,3) | 8 (10,4) | |
BGC: biopsia del ganglio centinela; DT: desviación típica; QTN: quimioterapia neoadyuvante.
Parámetros de validez diagnóstica de la detección del ganglio centinela
| BGC pre-QTN (n=73) | 2.a BGC pos-QTN (n=31) | BGC pos-QTN/cN0 (n=54) | BGC pos-QTN/cN1 (n=77) | |
|---|---|---|---|---|
| % (n) [IC95%] | ||||
| Identificación GC | 97,2% (71/73)[90,5-99,2%] | 61,3% (19/31)[43,8-76,3%] | 96,3% (52/54)[87,5-99,0%] | 83,1% (64/77)[73,2-89,8%] |
| Falsos negativos | ---- | 18,2% (2/11)[5,1-47,7%] | 9,5% (2/21)[2,7-28,9%] | 8,3% (3/36)[2,9-21,8%] |
| Valor predictivo negativo | ---- | 80,0% (8/10)[49,0-94,3%] | 93,9% (31/33)[80,4-98,3%] | 90,3% (28/31)[75,1-96,7%] |
| Exactitud | ---- | 89,5% (17/19)[68,6-97,1%] | 96,2% (50/52)[87,0-98,9%] | 95,3% (61/64)[87,1-98,4%] |
BGC: biopsia del ganglio centinela; IC95%: intervalo de confianza al 95%; QTN: quimioterapia neoadyuvante.
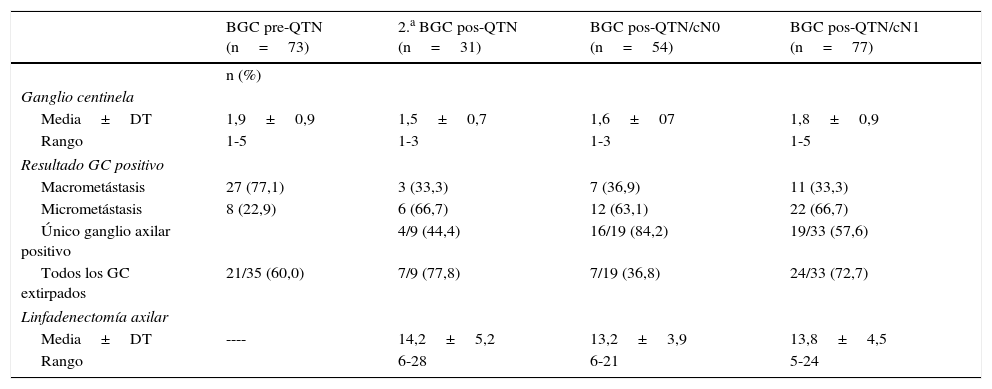
Comparación de los ganglios axilares extirpados
| BGC pre-QTN (n=73) | 2.a BGC pos-QTN (n=31) | BGC pos-QTN/cN0 (n=54) | BGC pos-QTN/cN1 (n=77) | |
|---|---|---|---|---|
| n (%) | ||||
| Ganglio centinela | ||||
| Media±DT | 1,9±0,9 | 1,5±0,7 | 1,6±07 | 1,8±0,9 |
| Rango | 1-5 | 1-3 | 1-3 | 1-5 |
| Resultado GC positivo | ||||
| Macrometástasis | 27 (77,1) | 3 (33,3) | 7 (36,9) | 11 (33,3) |
| Micrometástasis | 8 (22,9) | 6 (66,7) | 12 (63,1) | 22 (66,7) |
| Único ganglio axilar positivo | 4/9 (44,4) | 16/19 (84,2) | 19/33 (57,6) | |
| Todos los GC extirpados | 21/35 (60,0) | 7/9 (77,8) | 7/19 (36,8) | 24/33 (72,7) |
| Linfadenectomía axilar | ||||
| Media±DT | ---- | 14,2±5,2 | 13,2±3,9 | 13,8±4,5 |
| Rango | 6-28 | 6-21 | 5-24 | |
BGC: biopsia del ganglio centinela; DT: desviación típica; QTN: quimioterapia neoadyuvante.
En el grupo BGC pre-QTN (noviembre de 2010/diciembre de 2014), se estudian 73 cánceres de mama. En el grupo 2.a BGC pos-QTN (septiembre de 2011/diciembre de 2014), se incluyeron 29 pacientes con GC positivo (21 macrometástasis, 8 micrometástasis) y 2 sin migración del grupo BGC pre-QTN. En 18 pacientes hubo drenaje axilar homolateral, uno a axila ipsilateral y mamaria interna, y 2 a mamaria interna. No se intentó la extirpación de los ganglios de mamaria interna. En 11/12 mujeres sin migración axilar la LA fue negativa. En los 2 FN solo se identificó un GC axilar y en la LA un ganglio con macrometástasis.
En el grupo BGC pos-QTN/cN0 (enero de 2008/enero de 2011), se evaluaron 54 pacientes. En las 2 pacientes sin identificación del GC la LA fue negativa. En los 2 FN se identificaron 1 y 3 GC, con afectación de 2/13 y 3/14 ganglios en la LA, respectivamente. En el grupo BGC pos-QTN/cN1 (enero de 2008/diciembre de 2014), se han incluido 77 pacientes, con confirmación anatomopatológica del estatus axilar en el 89,6% (64 BAG, 5 PAAF). Ninguna de las pacientes presentó adenopatías axilares palpables después del tratamiento. En 8 de 13 (61,5%) pacientes sin migración del radiofármaco la LA fue positiva. En los 3 FN se identificaron 1, 3 y 4 GC, con afectación de 3/16, 2/15 y 2/19 ganglios en la LA, respectivamente.
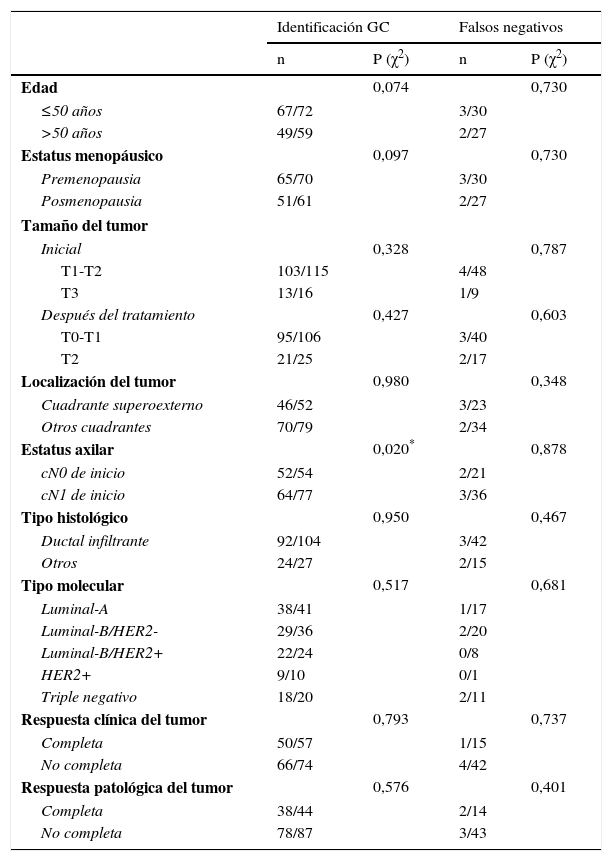
En la BGC pos-QTN, el porcentaje de identificación del GC fue significativamente menor en las pacientes cN1 de inicio que en las cN0 (p=0,020). En el resto de variables no existieron diferencias estadísticamente significativas en la identificación del GC ni en la tasa de FN (tabla 4). Las pacientes con macrometástasis en el GC tuvieron afectación en otros ganglios axilares en el 28,6% (2/7) de las cN0 y en el 45,5% (5/11) de las cN1, p=0,474; en los casos con micrometástasis en el GC, el 8,3% (1/12) de las cN0 y el 40,9% (9/22) de las cN1, presentaron una LA positiva, p=0,046. En las pacientes cN1 al diagnóstico la RCp axilar tras QTN fue del 44,1% (34/77), con diferencias entre los diferentes subtipos moleculares, p<0,0001. El 32,5% (25/77) de los casos presentaban RCp tanto en la mama como en la axila (tabla 5).
Relación entre factores clínico-patológicos y parámetros de validez diagnóstica en pacientes BGC pos-QTN
| Identificación GC | Falsos negativos | |||
|---|---|---|---|---|
| n | P (χ2) | n | P (χ2) | |
| Edad | 0,074 | 0,730 | ||
| ≤50 años | 67/72 | 3/30 | ||
| >50 años | 49/59 | 2/27 | ||
| Estatus menopáusico | 0,097 | 0,730 | ||
| Premenopausia | 65/70 | 3/30 | ||
| Posmenopausia | 51/61 | 2/27 | ||
| Tamaño del tumor | ||||
| Inicial | 0,328 | 0,787 | ||
| T1-T2 | 103/115 | 4/48 | ||
| T3 | 13/16 | 1/9 | ||
| Después del tratamiento | 0,427 | 0,603 | ||
| T0-T1 | 95/106 | 3/40 | ||
| T2 | 21/25 | 2/17 | ||
| Localización del tumor | 0,980 | 0,348 | ||
| Cuadrante superoexterno | 46/52 | 3/23 | ||
| Otros cuadrantes | 70/79 | 2/34 | ||
| Estatus axilar | 0,020* | 0,878 | ||
| cN0 de inicio | 52/54 | 2/21 | ||
| cN1 de inicio | 64/77 | 3/36 | ||
| Tipo histológico | 0,950 | 0,467 | ||
| Ductal infiltrante | 92/104 | 3/42 | ||
| Otros | 24/27 | 2/15 | ||
| Tipo molecular | 0,517 | 0,681 | ||
| Luminal-A | 38/41 | 1/17 | ||
| Luminal-B/HER2- | 29/36 | 2/20 | ||
| Luminal-B/HER2+ | 22/24 | 0/8 | ||
| HER2+ | 9/10 | 0/1 | ||
| Triple negativo | 18/20 | 2/11 | ||
| Respuesta clínica del tumor | 0,793 | 0,737 | ||
| Completa | 50/57 | 1/15 | ||
| No completa | 66/74 | 4/42 | ||
| Respuesta patológica del tumor | 0,576 | 0,401 | ||
| Completa | 38/44 | 2/14 | ||
| No completa | 78/87 | 3/43 | ||
BGC: biopsia del ganglio centinela; QTN: quimioterapia neoadyuvante; χ2: Chi-cuadrado.
Relación entre respuesta patológica y subtipo molecular en pacientes BGC pos-QTN/cN1
| Luminal-A (n=12) | Luminal-B/HER2 - (n=28) | Luminal-B/HER2 + (n=15) | HER2 + (n=8) | Triple negativo (n=14) | |
|---|---|---|---|---|---|
| RCp | n (%) | ||||
| Mama y axila | 3 (25,0) | 6 (21,4) | 7 (46,7) | 2 (25,0) | 7 (50,0) |
| Solo mama | 2 (16,7) | 2 (7,1) | 1 (6,7) | 1 (12,5) | 3 (21,4) |
| Solo axila | 0 (0) | 1 (3,6) | 1 (6,7) | 5 (62,5) | 2 (14,3) |
BGC: biopsia del ganglio centinela; QTN: quimioterapia neoadyuvante; RCp: respuesta patológica completa.
En la BGC pre-QTN identificamos el GC axilar en el 97,2% (IC95%: 90,5-99,2%) de los casos, el 47,9% con resultado del GC positivo, lo que implicó la realización de LA tras finalizar el tratamiento. En la literatura, el porcentaje de identificación del GC preneoadyuvancia es superior al 97%13 con un resultado positivo entre el 27-85%14. Su principal inconveniente es que al finalizar la QTN no se puede diferenciar si se ha producido una respuesta ganglionar axilar o si la enfermedad estaba limitada a los GC extirpados. Además, se somete a la paciente a dos cirugías y puede retrasar el comienzo de la QTN3,4.
La 2.a BGC pos-QTN solo localizó el GC en el 61,3% (IC95%: 43,8-76,3%) de los casos, con una tasa de FN del 18,2% (IC95%: 5,1-47,7%), probablemente debido a la distorsión del drenaje linfático por la quimioterapia y la cirugía axilar previa. Con resultados similares, el estudio SENTINA15 considera inaceptables una identificación del GC del 60,8% (IC95%: 55,6-65,9%) con un 51,6% (IC95%: 38,7-64,2%) de FN, y concluye que una 2.a BGC al finalizar la QTN en las pacientes pN1(gc) al diagnóstico no es una opción útil en esta situación clínica.
Existe una tendencia a aceptar la realización de la BGC posneoadyuvancia en pacientes con axila negativa al diagnóstico, pero en las enfermas con axila positiva su aplicación resulta aún controvertida. En la BGC pos-QTN/cN0 el porcentaje de identificación del GC fue del 96,3% (IC95%: 87,5-99,0%), con una tasa de FN del 9,5% (IC95%: 2,7-28,9%), resultados similares a los descritos en otros estudios posneoadyuvancia16–18, y en cáncer de mama en estadios precoces19. En la BGC pos-QTN/cN1 el GC se identificó en el 83,1% (IC95%: 73,2-89,8%) de los casos, con un tasa de FN del 8,3% (IC95%: 2,9-21,8%). La exactitud diagnóstica fue similar en ambos grupos: 96,2% (IC95%: 87,0-98,9%) y 95,3% (IC95%: 87,1-98,4%), respectivamente. Estos resultados coinciden con otros autores en que el estatus axilar positivo al diagnóstico disminuye la capacidad de identificación del GC, pero no modifica su precisión diagnóstica17,20.
En la actualidad, ninguna técnica de imagen es lo suficientemente precisa para la identificación de la RCp axilar en las pacientes con cáncer de mama tratadas con QTN21. Es aconsejable realizar ecografía axilar con punción de los ganglios sospechosos tanto en la estadificación inicial como antes de la cirugía, y un estudio negativo ayuda a seleccionar a las pacientes candidatas a la realización de BGC22–24.
Se han publicado cuatro estudios multicéntricos que analizan la utilidad de la BGC posneoadyuvancia en pacientes con cáncer de mama y axila positiva al diagnóstico: SENTINA15, ACOSOG-Z107125, SN-FNAC26 y GANEA-227; con porcentajes de identificación del GC entre 80,1-92,9%, y una tasa de FN entre 12,6-14,6%. En un análisis de subgrupos se evidencia que los FN disminuyen cuando se extraen 2 o más GC, alcanzando valores entre el 6,1-12%15,25–27; la utilización de una técnica mixta (radiofármaco y colorante) mejora la precisión diagnóstica de la BGC, con un aumento en la identificación del GC25 y disminución de los FN15,25,26; y el análisis del GC con técnicas de IHQ y la consideración de las células tumorales aisladas como enfermedad residual posneoadyuvancia disminuyen la tasa de FN a valores alrededor del 8,5%25,26. Se ha propuesto una estrategia interesante que consiste en marcar el ganglio axilar positivo puncionado al diagnóstico con marcadores metálicos28,29, semillas radiactivas de Yodo-12530 o tatuaje con partículas de carbón31, para garantizar que se encuentre entre los GC extirpados en la cirugía.
Aunque los subtipos moleculares no tengan influencia en la identificación del GC ni en su eficacia diagnóstica, sí existen diferencias en la RCp axilar tras la QTN: 64,3% en triple negativo, 65,2% en HER2+ y luminal-B/HER2+, y 25,0% en luminal A o luminal-B/HER2-. Por lo tanto, los subtipos moleculares permiten seleccionar a las pacientes con más probabilidades de tener un estatus ganglionar negativo posneoadyuvancia, tumores HER2+ y triple negativo, candidatas a una cirugía axilar más conservadora32–34.
Ante cualquier resultado positivo del GC en las pacientes con cáncer de mama y axila positiva al diagnóstico tratadas con QTN se considera obligatoria la realización de LA, por el peor significado pronóstico de la enfermedad microscópica residual después del tratamiento35. En nuestra serie, más del 40% de las enfermas BGC pos-QTN/cN1 con GC positivo tuvieron además otros ganglios afectados en la LA. Por el contrario, en la BGC pos-QTN/cN0, el 28,6% de las pacientes con macrometástasis y solo el 8,3% con micrometástasis en el GC tenían una LA positiva, por lo que podría cuestionarse la necesidad de realizar LA en este último subgrupo de pacientes y la radioterapia axilar ser una alternativa. Con estos resultados, se podría haber evitado la LA en el 57,4% de las pacientes BGC pos-QTN/cN0 y el 36,4% de las cN1 que tenían un GC verdadero negativo. Además, en el 84,2% de las cN0 y el 57,6% de las cN1 la afectación axilar se limitaba a los GC extirpados.
Entre las limitaciones del estudio están que: en solo el 89,6% de las pacientes BGC pos-QTN/cN1 se obtuvo confirmación patológica del estatus axilar al diagnóstico; en la técnica de localización del GC solo hemos usado radiotrazador; y se han utilizado dos procedimientos en el estudio anatomopatológico del GC. Estas diferencias en el procedimiento reflejan la disponibilidad de las técnicas diagnósticas, los cambios en los criterios e indicaciones de la BGC, y la experiencia adquirida por el equipo multidisciplinar a lo largo de los años revisados.
En conclusión, el porcentaje de identificación de la BGC pre-QTN es excelente, pero en casi la mitad de las pacientes un GC positivo implicó la realización de LA al finalizar el tratamiento. En pacientes cN0 con GC positivo al diagnóstico, los resultados de una 2.a BGC pos-QTN no son válidos para su aplicación en la práctica clínica. La BGC pos-QTN puede realizarse con fiabilidad en pacientes cN0 y cN1 de inicio, con axila clínicamente negativa al finalizar la neoadyuvancia (ycN0), seguida de LA si el resultado del GC es positivo o no se identifica en la cirugía, en el ámbito de un equipo multidisciplinar con experiencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.