Comparar la supervivencia del cáncer de mama en mujeres que han sido cribadas en el programa de Detección Precoz del Cáncer de Mama (DPCM) y en las que no han participado en él.
Pacientes y métodosEs un estudio descriptivo y longitudinal en el que se han estudiado todos los cánceres de mama registrados en el servicio de Anatomía Patológica del Hospital de Tortosa Verge de la Cinta (Tarragona) de mujeres de 50-65años, que se habían detectado la enfermedad ellas mismas o que la había detectado el programa DPCM, desde junio de 1999 hasta junio de 2003. Se registraron 101pacientes con cáncer de mama, de las que en 84 se pudieron recoger todos los datos relativos al tumor, la cirugía y el tratamiento. En el 2014, tras un seguimiento de 11,6±1,8 años, se anotó el estado actual.
ResultadosNo hay diferencia estadísticamente significativa en la supervivencia de los 2 grupos. Pacientes con carcinoma in situ y sin ganglios metastásicos se encuentran entre las fallecidas, mientras que ninguna paciente con carcinoma bien diferenciado falleció.
ConclusionesEn nuestro estudio, el cribado del cáncer de mama no mejora la supervivencia y determinados factores en los que se apoyan los programas de cribado, como la detección de carcinomas no infiltrantes y/o de ganglios no metastásicos, no aseguran la curación.
To compare survival in breast cancer between women diagnosed in an early breast cancer detection programme and those not attending this programme.
Patients and methodsWe conducted a descriptive and longitudinal study that analysed all types of breast cancer registered in the Pathology Service of the Hospital de Tortosa Verge de la Cinta (Tarragona, Spain). Tumour samples were obtained from 50-65-year-old women who had detected alterations on self-examination and from those attending the early breast cancer detection programme from June 1999 to June 2003. All the information relating to the tumour, surgery or treatment was registered. In 2014, after a follow-up of 11.6±1.8 years, the current status of each patient was recorded.
ResultsThere was no significant statistical difference in survival between the two groups of patients. Non-survivors included patients with in situ carcinoma and without lymph node metastases. Survival was 100% in patients with well differentiated carcinoma.
ConclusionsBreast cancer screening did not improve survival in our study. The elements on which screening programs are based, such as non-invasive carcinoma detection and/or non- metastatic lymph nodes, do not ensure recovery.
El cáncer de mama es el tumor maligno de mayor incidencia y mortalidad entre las mujeres. En la década de los sesenta se empezó a estudiar la posibilidad de cribar la población femenina, mediante mamografías, para detectarlo precozmente y de esta manera disminuir la mortalidad, aumentar la curación y la supervivencia de la enfermedad, utilizando los recursos terapéuticos disponibles antes de su propagación o metástasis. Tras unos primeros estudios que concluyeron su efectividad, en la actualidad y desde hace ya 15 años la comunidad científica y la sociedad entera asiste a un vivo debate sobre el balance entre riesgos y beneficios de los programas poblacionales de detección precoz1–3 del cáncer de mama (DPCM). Estudios recientes informan que cuanto mejor informadas están las mujeres sobre los riesgos del DPCM, menos participan en él4.
En España, en paralelo a otros países con programas poblacionales, la investigación en cribado ha evolucionado desde los primeros estudios descriptivos de participación hasta los estudios longitudinales sobre efectos adversos, como falsos positivos y cáncer de intervalo5. Por otro lado, una proporción importante de casos sobrediagnosticados y sobretratados, que nunca habrían llegado a manifestarse clínicamente, representan una importante cuestión a la que atender en este y otros programas de detección precoz oncológica. El diagnóstico anatomopatológico establece las bases para el manejo clínico de la paciente, sin embargo, el nivel de desacuerdo entre expertos, las dificultades de las diferentes técnicas de estudio de los tejidos y la propia dinámica biológica de las lesiones incipientes, hacen que el nivel de seguridad de la biopsia sea escasamente comprendido tanto por la población general como por los propios profesionales.
La reciente revisión Cochrane, incluyendo más de 600.000 mujeres, muestra que no existe evidencia que apoye un efecto beneficioso del programa DPCM3. Ello contrasta con la percepción de la población general, muy alejada de los datos reales que muestran que por cada 1.000 mujeres, unas 4 muertes son por cáncer de mama cuando se hace cribado y 5 cuando no se hace6. Por cada muerte prevenida a lo largo de 10años con una mamografía anual, se asume que entre 490-670 mujeres tendrán un falso positivo, con repetición del estudio, biopsias innecesarias y entre 3-14 sobrediagnósticos de cáncer de mama que nunca se hubieran manifestado clínicamente a lo largo de la vida de la mujer7.
Numerosos estudios denuncian que los efectos de los programas de detección precoz han sido sobreestimados y sus daños potenciales escasamente considerados2,8. Con la intención de objetivar si realmente el programa de cribado es eficiente en cuanto a la mejora de la supervivencia y/o disminución de la mortalidad en la era moderna del tratamiento de cáncer de mama, hemos estudiado los datos del Baix Ebre, Montsià y Terra Alta, comarcas de Tarragona (Catalunya), con una población de aproximadamente 9.000 mujeres con una edad de 50 a 65años, donde se implantó el programa DPCM en 1999.
Material y métodosSe trata de un estudio descriptivo y longitudinal en el cual se recogieron todos los cánceres de mama detectados en mujeres de 50 a 65años, en la consulta de Cirugía del Hospital Verge de la Cinta de Tortosa (Tarragona) y en el programa DPCM, durante 4 años (del 15 de junio de 1999 al 15 de junio de 2003). Se identificaron los casos registrados en la consulta de Cirugía como «asistenciales» y los casos del programa como «DPCM». Los asistenciales son pacientes que no seguían el DPCM y que acudieron a la consulta de Cirugía porque se detectaron ellas mismas una alteración en la mama, frecuentemente como «un bulto» o «dolor». En el momento de la inclusión en la base de datos, se registraron todos los datos relativos al tumor (tipo histológico, grado nuclear, afectación ganglionar), a su cirugía y al tratamiento. Se ha realizado un seguimiento hasta el año 2014 (media: 11,6±1,8años), en que se ha anotado el estado actual de las pacientes consultando la historia clínica. Para este estudio se obtuvo la aprobación de la comisión de investigación institucional.
El análisis descriptivo de las variables del estudio se ha realizado mediante frecuencias y porcentajes para las variables cualitativas y la media±desviación estándar para las variables cuantitativas. La comparación entre las diferentes variables se ha analizado mediante la prueba de Chi-cuadrado de Pearson (χ2) y la prueba t de Student. La estimación de la función de supervivencia se ha realizado con el método de Kaplan-Meier y la comparación, con el test log rank. Se ha considerado un valor de p≤0,05 como diferencia estadísticamente significativa. Para la creación de la base de datos y el análisis estadístico se ha utilizado el paquete estadístico SPSS v.19.0.
ResultadosDurante estos 4 años se registraron un total de 101pacientes con cáncer de mama de 50 a 65años de edad, de las cuales se pudieron obtener todos los datos necesarios para el estudio de 84pacientes (83,2%). Las pacientes restantes (16,8%), tras ser informadas del diagnóstico, decidieron operarse en otros centros, mayoritariamente en Barcelona, y por ello no pudimos acceder a los datos para el estudio.
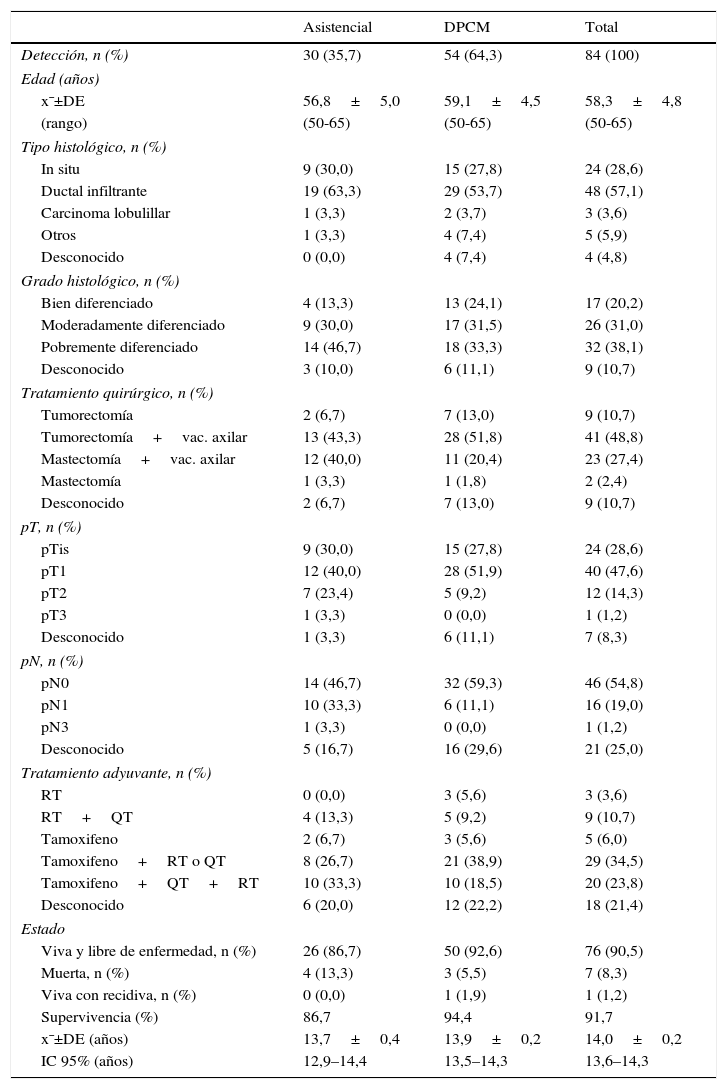
En la tabla 1 se muestra la distribución de las diferentes variables recogidas de las características del tumor según el tipo de detección. Treinta tumores (35,7%) fueron detectados por las mismas pacientes y/o sus médicos y 54 (64,3%), por el DPCM. En cuanto a los tipos histológicos del tumor, en ambos tipos de detección el 30% son carcinomas in situ; el más frecuente es el carcinoma ductal infiltrante, 5 tumores presentan un tipo histológico poco frecuente y en 4 casos es desconocido. No hay diferencias estadísticamente significativas entre los 2 grupos de detección. El grado histológico se distribuye también bastante homogéneamente en ambas situaciones, siendo más frecuentes los pobremente diferenciados y los menos frecuentes los bien diferenciados. El porcentaje de los bien diferenciados es superior en el DPCM (24,1% vs 13,3%), mientras que es inferior en los pobremente diferenciados (33,3% vs 46,7%), diferencias no estadísticamente significativas.
Distribución de las características tumorales según el tipo de detección de la neoplasia
| Asistencial | DPCM | Total | |
|---|---|---|---|
| Detección, n (%) | 30 (35,7) | 54 (64,3) | 84 (100) |
| Edad (años) | |||
| x¯±DE | 56,8±5,0 | 59,1±4,5 | 58,3±4,8 |
| (rango) | (50-65) | (50-65) | (50-65) |
| Tipo histológico, n (%) | |||
| In situ | 9 (30,0) | 15 (27,8) | 24 (28,6) |
| Ductal infiltrante | 19 (63,3) | 29 (53,7) | 48 (57,1) |
| Carcinoma lobulillar | 1 (3,3) | 2 (3,7) | 3 (3,6) |
| Otros | 1 (3,3) | 4 (7,4) | 5 (5,9) |
| Desconocido | 0 (0,0) | 4 (7,4) | 4 (4,8) |
| Grado histológico, n (%) | |||
| Bien diferenciado | 4 (13,3) | 13 (24,1) | 17 (20,2) |
| Moderadamente diferenciado | 9 (30,0) | 17 (31,5) | 26 (31,0) |
| Pobremente diferenciado | 14 (46,7) | 18 (33,3) | 32 (38,1) |
| Desconocido | 3 (10,0) | 6 (11,1) | 9 (10,7) |
| Tratamiento quirúrgico, n (%) | |||
| Tumorectomía | 2 (6,7) | 7 (13,0) | 9 (10,7) |
| Tumorectomía+vac. axilar | 13 (43,3) | 28 (51,8) | 41 (48,8) |
| Mastectomía+vac. axilar | 12 (40,0) | 11 (20,4) | 23 (27,4) |
| Mastectomía | 1 (3,3) | 1 (1,8) | 2 (2,4) |
| Desconocido | 2 (6,7) | 7 (13,0) | 9 (10,7) |
| pT, n (%) | |||
| pTis | 9 (30,0) | 15 (27,8) | 24 (28,6) |
| pT1 | 12 (40,0) | 28 (51,9) | 40 (47,6) |
| pT2 | 7 (23,4) | 5 (9,2) | 12 (14,3) |
| pT3 | 1 (3,3) | 0 (0,0) | 1 (1,2) |
| Desconocido | 1 (3,3) | 6 (11,1) | 7 (8,3) |
| pN, n (%) | |||
| pN0 | 14 (46,7) | 32 (59,3) | 46 (54,8) |
| pN1 | 10 (33,3) | 6 (11,1) | 16 (19,0) |
| pN3 | 1 (3,3) | 0 (0,0) | 1 (1,2) |
| Desconocido | 5 (16,7) | 16 (29,6) | 21 (25,0) |
| Tratamiento adyuvante, n (%) | |||
| RT | 0 (0,0) | 3 (5,6) | 3 (3,6) |
| RT+QT | 4 (13,3) | 5 (9,2) | 9 (10,7) |
| Tamoxifeno | 2 (6,7) | 3 (5,6) | 5 (6,0) |
| Tamoxifeno+RT o QT | 8 (26,7) | 21 (38,9) | 29 (34,5) |
| Tamoxifeno+QT+RT | 10 (33,3) | 10 (18,5) | 20 (23,8) |
| Desconocido | 6 (20,0) | 12 (22,2) | 18 (21,4) |
| Estado | |||
| Viva y libre de enfermedad, n (%) | 26 (86,7) | 50 (92,6) | 76 (90,5) |
| Muerta, n (%) | 4 (13,3) | 3 (5,5) | 7 (8,3) |
| Viva con recidiva, n (%) | 0 (0,0) | 1 (1,9) | 1 (1,2) |
| Supervivencia (%) | 86,7 | 94,4 | 91,7 |
| x¯±DE (años) | 13,7±0,4 | 13,9±0,2 | 14,0±0,2 |
| IC 95% (años) | 12,9–14,4 | 13,5–14,3 | 13,6–14,3 |
DPCM: diagnóstico precoz del cáncer de mama; IC: intervalo de confianza; QT: quimioterapia; RT: radioterapia; vac: vaciamiento.
El tratamiento quirúrgico y el adyuvante dependen de los factores patológicos, de las características tumorales y del protocolo aplicado en el momento del diagnóstico. Destaca que el porcentaje de mastectomías es superior en el grupo de mujeres asistenciales (46,5% vs 25,5%). El 44% de las pacientes asistenciales presentaban metástasis ganglionares, mientras que solo las presentaban el 15,8% de las del DPCM. El estado final de las pacientes al término del estudio fue que el 90,5% de todas ellas estaban vivas y libres de enfermedad, 7 (8,3%) habían fallecido y solo una (1,2%) paciente se encontraba viva pero con recidiva. Las 7 pacientes fallecidas lo fueron a causa del cáncer de mama, certificado por el servicio de Oncología del hospital. Una de las pacientes del estudio murió por una causa no atribuible al cáncer de mama, confirmado en la autopsia, pero siguió en el estudio con la condición de «viva y libre de enfermedad» hasta la fecha de su defunción.
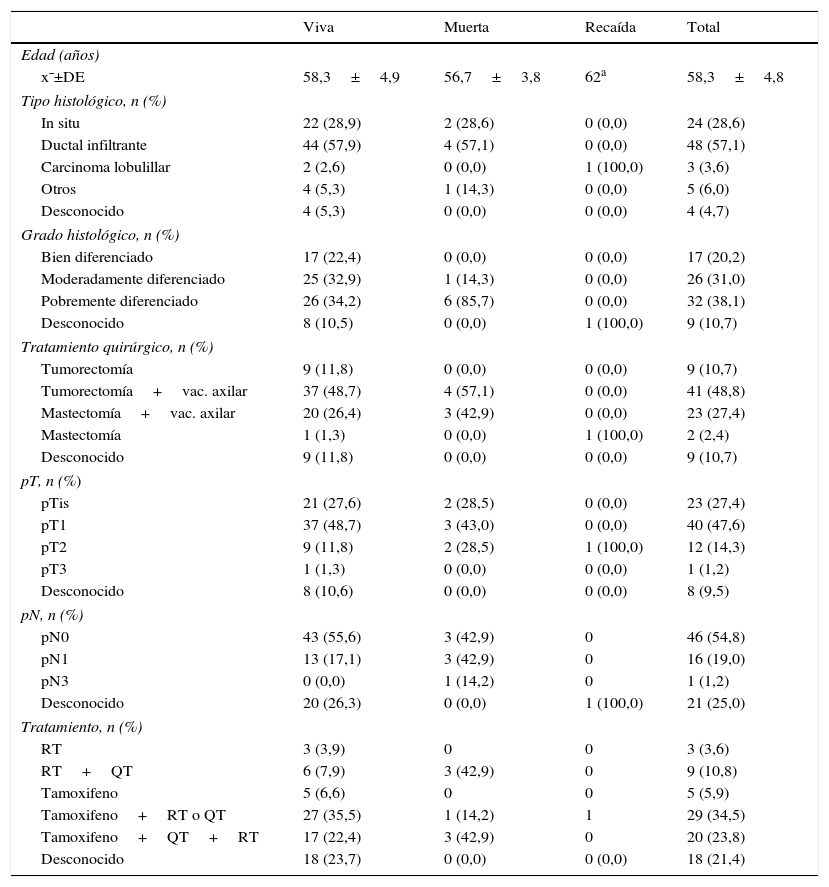
La distribución de las variables según el estado final de las pacientes, independientemente de la procedencia de la paciente, queda recogida en la tabla 2. De las pacientes fallecidas, 2 (28,6%) presentaban un carcinoma in situ, 4 (57,1%) un carcinoma ductal infiltrante y una un carcinoma neuroendocrino. La única recidiva se observó en un carcinoma lobulillar. Seis (85,7%) de las fallecidas presentaban un tumor pobremente diferenciado y ninguna paciente de las que tenían un tumor bien diferenciado murió. Tres (42,9%) de las pacientes fallecidas no presentaban metástasis ganglionares, otras 3 pacientes presentaban micrometástasis o metástasis en 1 a 3 ganglios axilares y la única paciente con más de 10 ganglios metastásicos (pN3) estaba fallecida.
Distribución de las características tumorales, tratamiento y supervivencia al término del estudio
| Viva | Muerta | Recaída | Total | |
|---|---|---|---|---|
| Edad (años) | ||||
| x¯±DE | 58,3±4,9 | 56,7±3,8 | 62a | 58,3±4,8 |
| Tipo histológico, n (%) | ||||
| In situ | 22 (28,9) | 2 (28,6) | 0 (0,0) | 24 (28,6) |
| Ductal infiltrante | 44 (57,9) | 4 (57,1) | 0 (0,0) | 48 (57,1) |
| Carcinoma lobulillar | 2 (2,6) | 0 (0,0) | 1 (100,0) | 3 (3,6) |
| Otros | 4 (5,3) | 1 (14,3) | 0 (0,0) | 5 (6,0) |
| Desconocido | 4 (5,3) | 0 (0,0) | 0 (0,0) | 4 (4,7) |
| Grado histológico, n (%) | ||||
| Bien diferenciado | 17 (22,4) | 0 (0,0) | 0 (0,0) | 17 (20,2) |
| Moderadamente diferenciado | 25 (32,9) | 1 (14,3) | 0 (0,0) | 26 (31,0) |
| Pobremente diferenciado | 26 (34,2) | 6 (85,7) | 0 (0,0) | 32 (38,1) |
| Desconocido | 8 (10,5) | 0 (0,0) | 1 (100,0) | 9 (10,7) |
| Tratamiento quirúrgico, n (%) | ||||
| Tumorectomía | 9 (11,8) | 0 (0,0) | 0 (0,0) | 9 (10,7) |
| Tumorectomía+vac. axilar | 37 (48,7) | 4 (57,1) | 0 (0,0) | 41 (48,8) |
| Mastectomía+vac. axilar | 20 (26,4) | 3 (42,9) | 0 (0,0) | 23 (27,4) |
| Mastectomía | 1 (1,3) | 0 (0,0) | 1 (100,0) | 2 (2,4) |
| Desconocido | 9 (11,8) | 0 (0,0) | 0 (0,0) | 9 (10,7) |
| pT, n (%) | ||||
| pTis | 21 (27,6) | 2 (28,5) | 0 (0,0) | 23 (27,4) |
| pT1 | 37 (48,7) | 3 (43,0) | 0 (0,0) | 40 (47,6) |
| pT2 | 9 (11,8) | 2 (28,5) | 1 (100,0) | 12 (14,3) |
| pT3 | 1 (1,3) | 0 (0,0) | 0 (0,0) | 1 (1,2) |
| Desconocido | 8 (10,6) | 0 (0,0) | 0 (0,0) | 8 (9,5) |
| pN, n (%) | ||||
| pN0 | 43 (55,6) | 3 (42,9) | 0 | 46 (54,8) |
| pN1 | 13 (17,1) | 3 (42,9) | 0 | 16 (19,0) |
| pN3 | 0 (0,0) | 1 (14,2) | 0 | 1 (1,2) |
| Desconocido | 20 (26,3) | 0 (0,0) | 1 (100,0) | 21 (25,0) |
| Tratamiento, n (%) | ||||
| RT | 3 (3,9) | 0 | 0 | 3 (3,6) |
| RT+QT | 6 (7,9) | 3 (42,9) | 0 | 9 (10,8) |
| Tamoxifeno | 5 (6,6) | 0 | 0 | 5 (5,9) |
| Tamoxifeno+RT o QT | 27 (35,5) | 1 (14,2) | 1 | 29 (34,5) |
| Tamoxifeno+QT+RT | 17 (22,4) | 3 (42,9) | 0 | 20 (23,8) |
| Desconocido | 18 (23,7) | 0 (0,0) | 0 (0,0) | 18 (21,4) |
DPCM: diagnóstico precoz del cáncer de mama; QT: quimioterapia; RT: radioterapia; vac: vaciamiento.
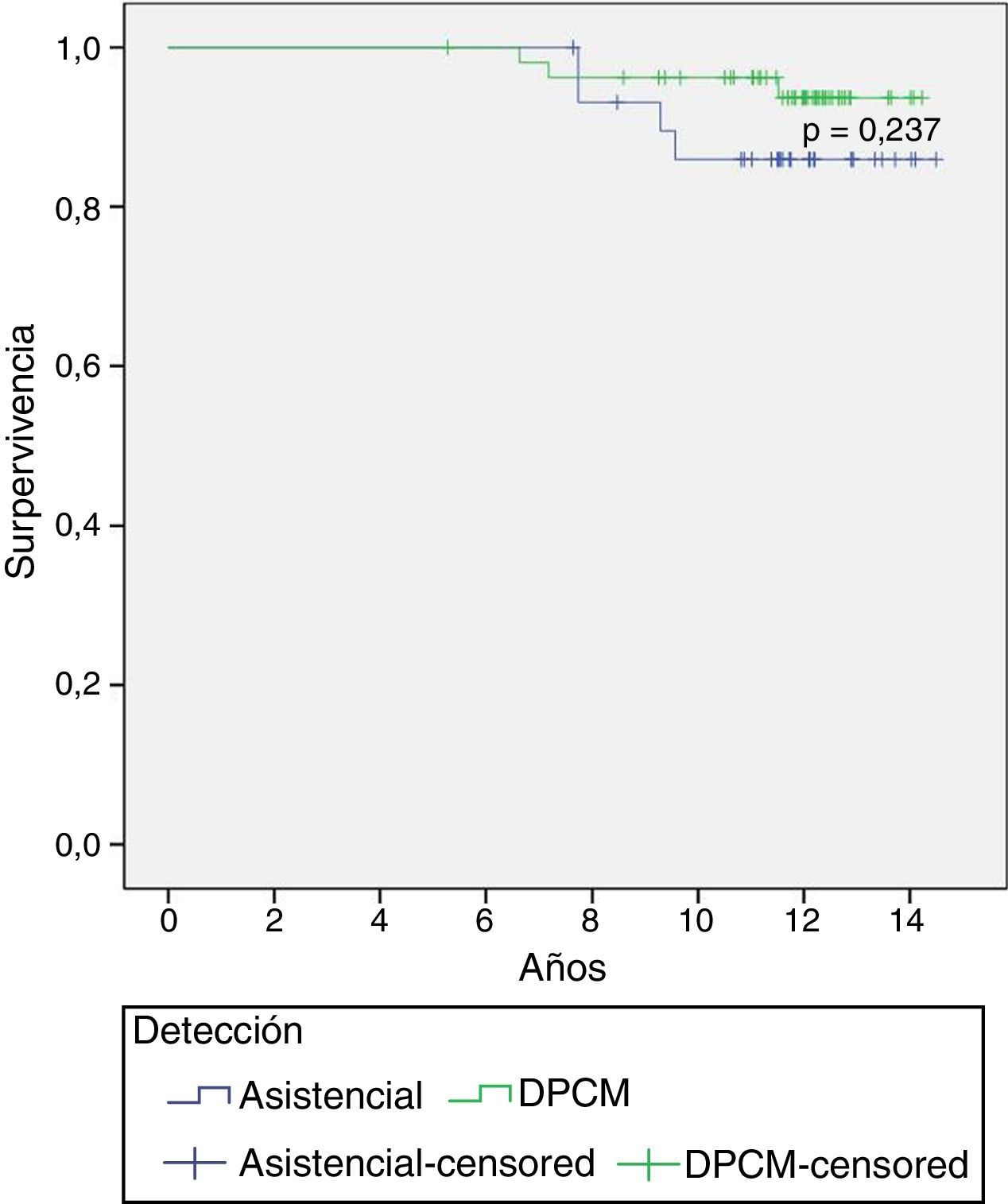
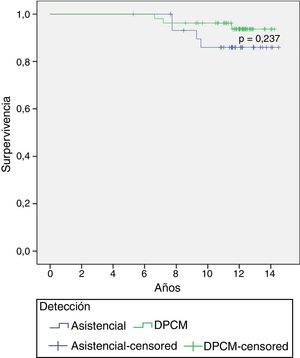
En el análisis de la supervivencia se obtiene una supervivencia global del 91,0%, con un 85,9% para las pacientes asistenciales y un 93,7% para las del DPCM (tabla 1). La diferencia no es estadísticamente significativa (fig. 1, p=0,237). Hay una diferencia de 7,8puntos y al analizar el intervalo de confianza (tabla 1), para la media de la supervivencia, prácticamente es igual (12,9-14,4 vs 13,5-14,3 años).
DiscusiónEl programa DPCM se basa en la mejora de la supervivencia en las mujeres afectadas, hecho que no se ha podido demostrar en ningún estudio a lo largo de los 50años que se viene desarrollando en todo el mundo. Los datos disponibles en este momento apuntan a que el riesgo es mayor que el beneficio para la mamografía de rutina, y algunas instituciones médicas desaconsejan y han abolido ya su uso9, mientras que otras están revisando a la baja sobre qué población y con qué cadencia realizar el cribado. Se basan en los datos disponibles en este momento, cuya valoración sistemática en el periodo 1960-2014 muestra la evidencia de que de cada 10.000 mujeres estudiadas anualmente en la década de sus 50años, se han logrado prevenir 5 muertes por cáncer de mama. A cambio, más de 6.000 mujeres han tenido test falsos positivos, que han supuesto estudios adicionales de imagen y la realización de biopsias innecesarias8. Ello supone una proporción de falsos positivos superior al 60%, un indicador de baja calidad del test, que obliga a la realización de numerosas pruebas innecesarias y genera un elevado coste emocional y económico, valorado en más de 4 billones de dólares al año en Estados Unidos.
Uno de los puntos en los que se apoya el DPCM es que se detectan las lesiones antes de que sean avanzadas, es decir, que la mayoría serán carcinomas in situ y que ello sería bueno para la supervivencia, ya que no hay invasión o infiltración del tumor fuera de los ductos mamarios y, por tanto, tras la extirpación quirúrgica se podría considerar a la paciente como libre de enfermedad. Sin embargo, un estudio reciente subraya el nivel de imprecisión de los patólogos, especialmente en el diagnóstico de estas entidades, en que apenas coinciden sus diagnósticos en un 75%10. El acuerdo es mayor para el carcinoma infiltrante y menor en los casos de carcinoma ductal in situ y atipia.
Parece necesario que los patólogos hagan su evaluación de una forma más ligada al resto de información clínica, radiológica, quirúrgica y oncológica. Es importante incorporar claramente la comprensión de que es más importante evaluar el potencial metastásico de la lesión, probablemente prestando mayor atención a la información del estroma11, que establecer la etiqueta de lesión cancerosa.
Un sobrediagnóstico del 20-30% ocurre en mujeres que creen que sus vidas han sido salvadas, con un elevado coste en ansiedad y estrés, cuando en realidad sufren cirugía, quimioterapia o radioterapia, o una combinación de todas ellas, cuyo impacto pronóstico es muy bajo o no existe en absoluto.
En nuestro estudio se observa la misma cantidad de carcinomas in situ en los 2 grupos estudiados (30%), es decir, que también dichas lesiones preinvasivas pueden ser detectadas por las pacientes. Pero, además, no es cierto que el hecho de tener un carcinoma preinvasivo quiera decir que es curable o que la supervivencia de estos casos sea del 100%. Dos (casi un 30%) de las pacientes con un carcinoma in situ de nuestra serie fallecieron, por lo que no es garantía de curación el hecho de detectar el cáncer de mama en un estadio tan precoz como puede ser el carcinoma in situ. Aunque la historia natural del carcinoma ductal in situ no tratado sigue siendo desconocida, se estima que solo un 14% desarrollarán con el tiempo un carcinoma infiltrante, mientras que el 86% restante son casos sobrediagnosticados que nunca llegarán a manifestarse clínicamente12, aunque ya se han propuesto estudios para comprobarlo13.
Lo mismo se puede comentar sobre el estadio ganglionar. El DPCM defiende que se registran con él una mayor proporción de pacientes con ausencia de afectación ganglionar, y en nuestra serie es cierto (84,2 vs 56,0%), pero ello tampoco es indicativo de un aumento de la supervivencia, ya que el 42,9% de las pacientes sin ganglios metastásicos fallecieron en nuestro estudio.
Sí que parece relevante el grado histológico: el 85,7% de las pacientes que fallecieron tenían un grado histológico de tumores pobremente diferenciados, mientras que ninguna paciente con un carcinoma bien diferenciado falleció. El grado histológico es un factor predictivo clásico de la supervivencia en el cáncer de mama; se relaciona con el grado de agresividad biológica del tumor y probablemente está determinado desde el momento en que se inicia el desarrollo del tumor, tanto si se ha descubierto mediante un programa de DPCM como si lo ha hecho la propia paciente.
La supervivencia global es muy buena (91%). La supervivencia entre los 2 grupos estudiados es mayor en el grupo del DPCM, aunque la diferencia no es estadísticamente significativa. Nuestros resultados apoyan los estudios que no muestran evidencia de que los programas de DPCM sean eficientes. Si tenemos en cuenta la historia natural del cáncer de mama, hemos de considerar que estamos ante una enfermedad muy heterogénea, donde los aspectos biológicos y de agresividad clínica del tumor son definidos desde un primer instante, independientemente del tiempo que tarde en ser detectado. Así, el grupo de mayor crecimiento es aquel que tiene menos probabilidad de ser detectado en las pruebas de cribado (cáncer de intervalo), mientras que aquellos que tienen una fase preclínica más larga muestran menos agresividad; desde el punto de vista biológico, son los que serán detectados por el DPCM y muchos de ellos, los de crecimiento más lento, nunca hubieran sido diagnosticados ni se hubieran manifestado clínicamente en ausencia del DPCM.
Entre las limitaciones del estudio debemos considerar el número limitado de casos que componen nuestra serie. Asimismo, es necesario tener en cuenta la polémica actual con respecto a las evidencias a favor y en contra de la eficacia de los programas de detección precoz14
En conclusión, tal vez los esfuerzos realizados en la prevención del cáncer de mama deban adoptar un enfoque más individualizado, implicando más a las mujeres en sus propias decisiones y cuidado y dirigiéndose de una forma más específica hacia las personas que tengan un riesgo alto, ya sea por la densidad del tejido mamario, la historia familiar, las pruebas genéticas u obesidad, pero sobre todo informando a las mujeres de las posibles consecuencias del cribado y de su grado de eficacia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.