El carcinoma metaplásico de mama es un grupo heterogéneo de carcinomas invasivos que pueden manifestar un espectro morfológico amplio, lo cual genera dificultades en su diagnóstico. Se presenta el caso de una adulta joven de 27 años de edad, nulípara, sin antecedentes patológicos, quien consultó por una masa de gran tamaño en la mama derecha de 12 meses de evolución. Macroscópicamente se observó un tumor lobulado, amarillento, con áreas de necrosis. Microscópicamente presentaba 2 patrones histológicos: el primero compuesto por células epitelioides con núcleos atípicos, pleomórficos y con figuras de mitosis. El segundo por lipoblastos pleomórficos inmersos en un fondo sarcomatoso. Se expone el segundo caso reportado en la literatura de un carcinoma metaplásico con diferenciación liposarcomatosa pleomórfica, haciendo hincapié en el abordaje macroscópico, histológico, inmunohistoquímico y en sus diagnósticos diferenciales.
Metaplastic breast carcinoma is a heterogeneous group of invasive carcinomas that can manifest a wide morphological spectrum, which generates difficulties in its diagnóstico. We present the case of a 27-year-old young adult, with no pathological history, who consulted for a large mass in the right breast of 12 months of evolution. Macroscopically, a yellowish lobulated tumor with areas of necrosis was observed. Microscopically, it presented two histological patterns: the first composed of epithelioid cells with atypical nuclei, pleomorphic and with figures of mitosis. The second by pleomorphic lipoblasts immersed in a sarcomatous background. The second case reported in the literature of a metaplastic carcinoma with pleomorphic liposarcomatous differentiation is presented, emphasizing the macroscopic, histological, immunohistochemical approach and its differential diagnoses.
El carcinoma metaplásico de mama corresponde a un grupo heterogéneo de carcinomas invasivos que se caracterizan por la diferenciación del epitelio neoplásico hacia células escamosas y/o elementos mesenquimales. Según la Organización Mundial de la Salud, se clasifica en: carcinoma adenoescamoso de bajo grado, carcinoma metaplásico similar a fibromatosis, carcinoma de células fusiformes, carcinoma de células escamosas, carcinoma metaplásico con diferenciación mesenquimal heteróloga y carcinoma mixto1.
Las variantes del carcinoma metaplásico frecuentemente son agresivas, resistentes a la quimioterapia y tienen una alta propensión a hacer metástasis, excepto el carcinoma metaplásico similar a la fibromatosis y el carcinoma adenoescamoso de bajo grado2.
El carcinoma metaplásico representa el 0,2–1% de todos los carcinomas invasivos de mama1,3. Es más frecuente entre los 48 y 59 años de edad, se manifiesta como una masa de rápido crecimiento y comúnmente no tiene compromiso ganglionar en el momento del diagnóstico4,5. Las tasas de supervivencia a 3, 5 y 10 años son del 77, 62 y 53% respectivamente1. Lo anterior contrasta con la tasa de supervivencia del 85,1% que posee el carcinoma ductal invasivo de tipo no especial6. La evidencia es limitada en cuanto al tratamiento y la respuesta a la terapia sistémica neoadyuvante es del 10–17%7.
Más del 90% de los carcinomas metaplásicos son negativos para los receptores de estrógeno, los receptores de progesterona y HER28. El carcinoma metaplásico no tiene un perfil molecular homogéneo y puede ser de tipo seudo basal o bajo en claudina según la clasificación intrínseca1,9; también puede ser seudo basal o seudo mesenquimal según la clasificación propuesta por Lehmann et al.1,10.
Esta entidad patológica exhibe una alta variabilidad morfológica, por lo cual se convierte en un desafío diagnóstico para el médico patólogo. Requiere de un muestreo macroscópico adecuado, una valoración histológica cuidadosa, la utilización racional de la inmunohistoquímica y la correlación clínico patológica correcta; todo lo anterior en aras de brindar un diagnóstico veraz. El objetivo del siguiente manuscrito es presentar el segundo caso reportado en la literatura de un carcinoma metaplásico con diferenciación liposarcomatosa pleomórfica.
Reporte de casoUna paciente femenina de 27 años de edad, nulípara, sin antecedentes patológicos. Consulta por una masa en la mama derecha de 12 meses de duración. En el examen físico se reconoce la asimetría y en la inspección se observa un eritema asociado a una circulación venosa anormal, nódulos de permeación y complejo aréola-pezón expandido. Clínicamente no había adenopatías. La biopsia incisional planteó un carcinoma metaplásico versus un sarcoma del estroma mamario. La paciente se programa para mastectomía radical modificada sin vaciamiento axilar.
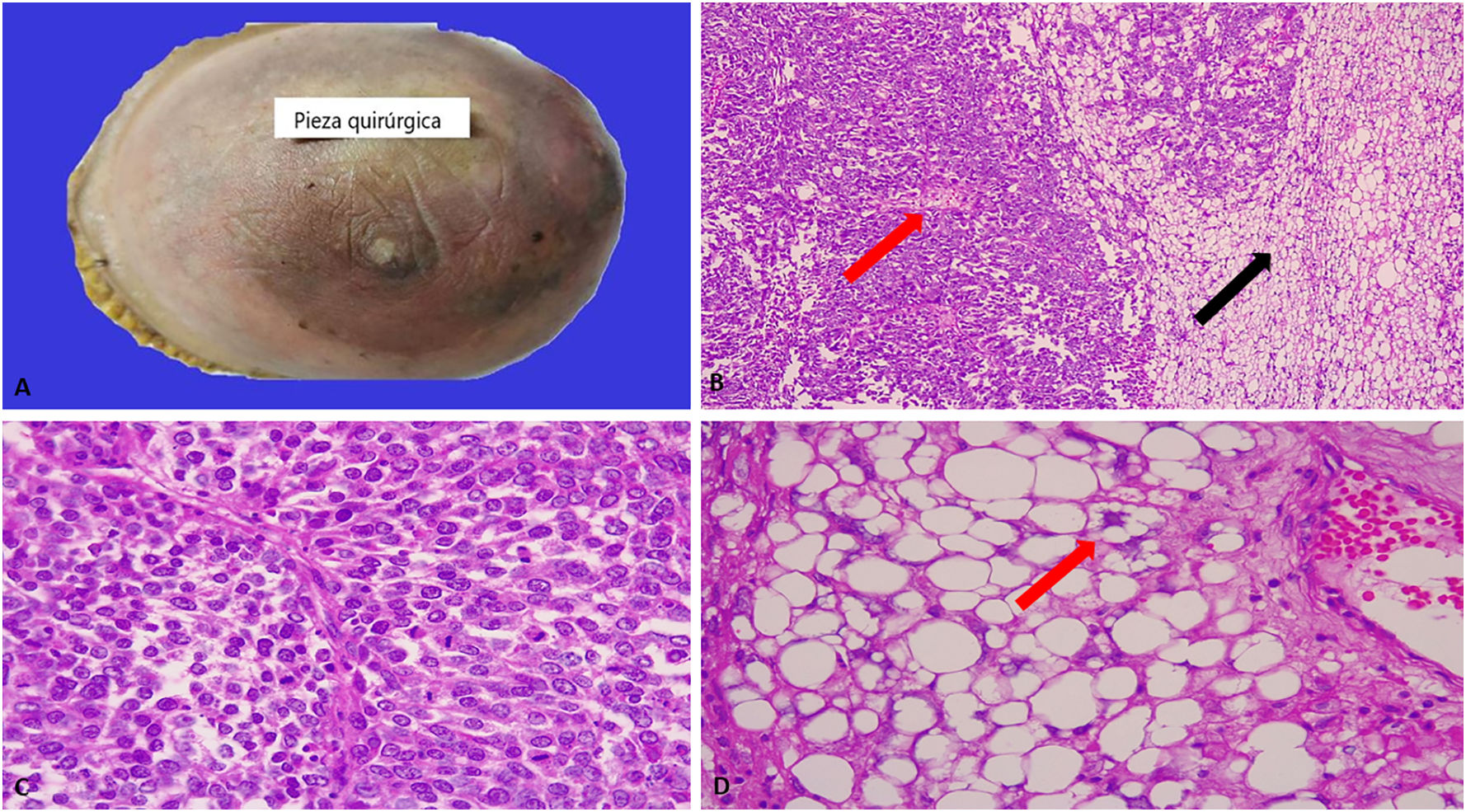
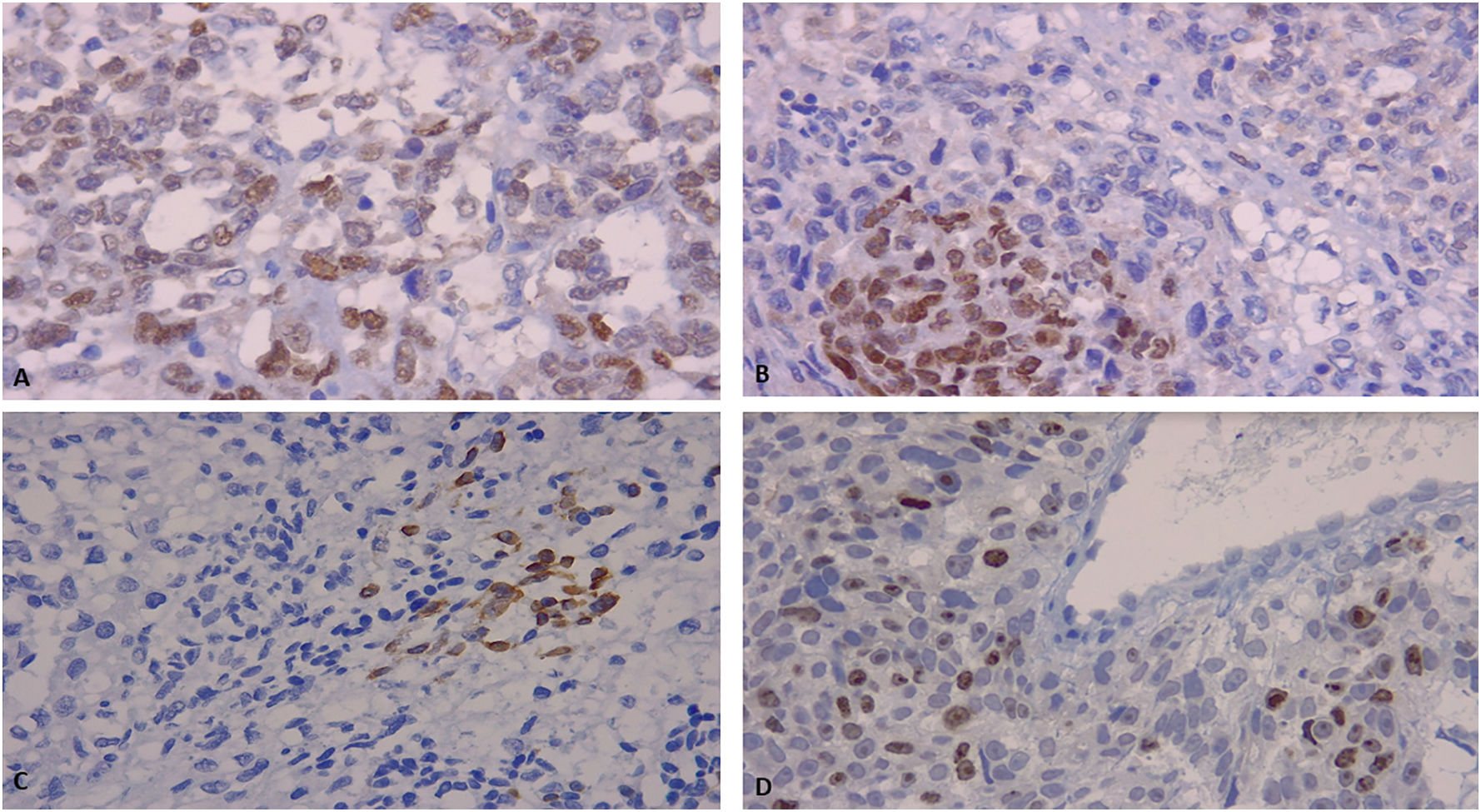
En la valoración macroscópica la mama midió 22 x 17 x 8 cm y pesó 1.260 g. El tumor tuvo un tamaño de 13,5 x 11 x 9 cm, ocupaba los 4 cuadrantes, era lobulado y su superficie era amarillenta con focos de necrosis. El examen microscópico evidenció una transición brusca entre los 2 componentes celulares; el primero presentaba células epitelioides, con núcleos atípicos, pleomórficos y frecuentes figuras de mitosis. El segundo reveló lipoblastos con núcleos hipercromáticos, festoneados y abundantes vacuolas intracitoplasmáticas; los lipoblastos se hallaban inmersos en un fondo sarcomatoso. A pesar del extenso muestreo macroscópico, no se identificó un patrón bifásico que sugiriera un tumor filodes maligno. Se realizaron tinciones de inmunohistoquímica en varios bloques de parafina con AE1/AE3, p63, p40, actina de músculo liso, CK7, CK8/18, CK19, CK5/6, CDK4, MDM2, CK34betaE12, CD34, CD31, receptores de estrógeno, receptores de progesterona, Ki67, HER2, EFGR y desmina. Los resultados revelaron positividad multifocal en las células tumorales con p63, p40 y CK34betaE12, el índice de proliferación celular con Ki67 fue del 40% y el resto de los marcadores de inmunohistoquímica fueron negativos (figs. 1 y 2).
A) Pieza quirúrgica de mastectomía. La piel presenta eritema y nódulos de permeación tumoral. B) Transición del tumor entre el componente epitelioide (flecha roja) y el componente liposarcomatoso (flecha negra). H/E, 10 x. C) El componente epitelioide estaba compuesto por células poligonales con núcleos atípicos y abundantes figuras de mitosis. H/E, 40x. D) La flecha roja muestra un lipoblasto caracterizado por núcleos atípicos, hipercromáticos, irregulares y citoplasmas vacuolados. H/E, 40x.
Debido a las características morfológicas, a la expresión de p63, p40, CK34betaE12 y a la ausencia de un patrón bifásico a pesar del muestreo extenso, se realizó el diagnóstico de carcinoma metaplásico con diferenciación liposarcomatosa pleomórfica. La paciente fue tratada con quimioterapia adyuvante y posteriormente con radioterapia adyuvante. Luego de 6 meses de acompañamiento la paciente continúa con buen estado de salud y en estrecho control clínico por mastología y oncología.
DiscusiónEl carcinoma metaplásico puede generar confusión al médico patólogo, por las características histológicas e inmunohistoquímicas que presenta. Las neoplasias que pueden mostrar diferenciación liposarcomatosa en la mama son: el tumor filodes maligno, el liposarcoma primario y el carcinoma metaplásico11. Son más frecuentes los tumores filodes malignos con diferenciación liposarcomatosa. La presencia de un patrón bifásico y la expresión negativa de las citoqueratinas estaría a favor de un tumor filodes maligno, sin embargo, estos hallazgos no fueron concordantes en esta paciente. El liposarcoma primario de mama es un tumor excepcionalmente raro, con menos de 50 casos reportados en la literatura y representa el 0,3% de todos los sarcomas primarios de la mama12. El liposarcoma pleomórfico y el liposarcoma pleomórfico variante epitelioide generalmente son negativos para CDK4, MDM2 y se ha descrito positividad para S100 en menos del 50% de los casos8. La expresión de p63, p40 y CK34betaE12 permitió descartar el liposarcoma primario de mama. Otras neoplasias benignas con patrón lipomatoso como los adenolipomas, angiolipomas, fibroadenomas, lipoma pleomórfico e implantes de silicona podrían considerarse en el diagnóstico diferencial8.
El panel de inmunohistoquímica a utilizar tiene que realizarse con cautela debido a que su expresión puede ser focal, lo que refleja la importancia de un muestreo macroscópico adecuado y la ejecución de la inmunohistoquímica en varios bloques de parafina cuando sea pertinente. Se describen múltiples marcadores que pueden solicitarse. Los más frecuentes son AE1/AE3, CK34betaE12, CK5/6, CK14, CK8/18, CK7, CK19, p63, p40, actina de músculo liso, S100 y CD1013. La interpretación debe ser meticulosa porque no son positivos en el 100% de los casos1. Otro marcador que ha sido evaluado es el receptor del factor de crecimiento epidérmico (EGFR), el carcinoma metaplásico sobreexpresa constantemente EGFR, pero por lo general carece de la sobreexpresión y amplificación del HER2. Estudios han encontrado que el EGFR puede ser positivo hasta en el 76% de las pacientes con esta entidad14.
El tratamiento del carcinoma metaplásico sigue las mismas recomendaciones del carcinoma ductal de tipo no especial, sin embargo, el carcinoma metaplásico responde mal a la quimioterapia sistémica y tiene peores resultados clínicos. En cuanto a la radioterapia, hay estudios y cohortes pequeñas que demuestran que la supervivencia de las pacientes mejora posterior al uso de radioterapia. Debido a las limitaciones terapéuticas, nuevos tratamientos se están estudiando, como por ejemplo la inhibición del mTOR, PI3K, NOS y la inmunoterapia, los cuales podrían considerarse como opciones una vez se tengan resultados de los múltiples ensayos clínicos que se están realizando15.
Con la búsqueda bibliográfica que se realizó, este sería el segundo caso reportado de carcinoma metaplásico con diferenciación liposarcomatosa pleomórfica. El primer caso fue reportado por Elghosbashy et al.11 en una paciente de 47 años de edad en el año 2018.
Es inusual la diferenciación liposarcomatosa pleomórfica del carcinoma metaplásico de mama. Este patrón morfológico puede llevar a la confusión con otras neoplasias malignas, por lo cual es importante que el equipo de médicos que abordan a las pacientes con lesiones mamarias conozca esta entidad.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Responsabilidades éticasEste manuscrito no incumple ninguna ley, no interviene seres humanos o animales y no se expone ningún dato en donde se pueda identificar al paciente. Los autores tienen el permiso del paciente para la publicación del artículo.
Consentimiento del pacienteLos autores declaran que han obtenido el consentimiento del paciente para la publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.