la biopsia selectiva de ganglio centinela (GC) es la técnica estándar para la estadificación axilar en el cáncer de mama. No hay consenso en el empleo del método OSNA (One-Step Nucleic Acid Amplification) para el análisis del GC en las pacientes que recibieron el tratamiento neoadyuvante (TNA). En este trabajo analizamos los resultados obtenidos con OSNA en estas pacientes para justificar su implantación en nuestro centro.
Material y métodosse seleccionaron 42 casos del grupo de 163 pacientes con CM tratadas con TNA en nuestro centro, a las que se realizó OSNA del GC, obteniéndose una media de 2,1 ganglios por paciente. Se analizó además la expresión de citoqueratina 19 (CK19), grado tumoral, fenotipo molecular y el grado de respuesta al TNA de estas pacientes. Se estudiaron los GC mediante técnica OSNA y los no centinelas por el método tradicional.
Resultadosel grado tumoral fue 2-3 en el 97,6% de los casos, el fenotipo luminal A (17%), luminal B (38%), triple-negativo (26,1%) y HER2 (19%). La respuesta al TNA fue completa en el 59,5% de las pacientes y la expresión de CK19 no se vio modificada. Los ganglios estudiados fueron positivos en 9 pacientes (21,4%) en las que posteriormente se realizó una linfadenectomía y un único caso presentó ganglio no centinela afecto (2,3%).
Conclusionesel método OSNA para el estudio del GC tras el TNA es muy superior al método tradicional, ya que permite la detección intraoperatoria de grupo celular aislado y micrometástasis no detectables con los métodos tradicionales, evitando segundas intervenciones y falsos negativos al analizarse completo el GC, y demuestra que no se altera la expresión de CK19 con el TNA.
Selective sentinel node (SN) biopsy is the standard technique for axillary staging in breast cancer (BC). There is no consensus on the use of OSNA (One-Step Acid Nucleic Amplification) method for SN in patients undergoing neoadjuvant treatment (NAT). We have studied the results obtained in our centre to justify the advantages of its implementation.
Material and methods42 cases were selected from the group of 163 patients with BC treated with NAT, who underwent OSNA of the SN, obtaining a mean of 2.1 nodes per patient. We also analyzed cytokeratin 19 (CK19) expression, tumour grade, molecular phenotype and the degree of response to NAT in these patients. The SN were studied using the OSNA technique and non-sentinel nodes using the traditional method.
ResultsTumour grade was 2-3 in 97.6% of cases, phenotype luminal A (17%), luminal B (38%), triple-negative (26.1%) and HER2 (19%). The response to NAT was complete in 59.5% of patients and CK19 expression was unchanged. The nodes studied were positive in 9 patients (21.4%) in whom lymphadenectomy was performed and only one case had a non-sentinel node involvement (2.3%).
ConclusionsThe OSNA method for the study of SN after NAT is far superior to the traditional method as it: It allows intraoperative detection of isolated cell group and micrometastases not detectable with traditional methods, avoiding second interventions. It avoids false negatives when the whole SN is analyzed. It shows that CK19 expression is not altered by NAT.
El ganglio centinela (GC) es el primer ganglio linfático de drenaje de un tumor. La técnica de OSNA en cáncer de mama (CM) consiste en la monitorización del flujo de un marcador coloreado o radiactivo a través de los vasos linfáticos hasta la axila para realizar únicamente la extirpación de los ganglios marcados. Hasta la introducción de esta técnica, la linfadenectomía regional era obligatoria en todas las pacientes diagnosticadas de carcinoma infiltrante de mama. Sin embargo, gracias a este procedimiento se realiza la linfadenectomía únicamente en aquellas pacientes cuyos GC resultan positivos.
La incorporación a la práctica clínica del estudio de trazadores en GC se inició en el Hospital Universitario de Navarra en el año 20001 suponiendo un avance considerable por la importante reducción del número de linfadenectomías realizadas2, evitando así los graves efectos secundarios que conlleva, como el linfedema1–3.
En 2009, se incorporó a la práctica clínica el método OSNA (One-Step Nucleic Acid Amplification)4–6, tras un estudio de validación7. Este método molecular permite realizar el estudio completo del ganglio, con lo que se evitan los falsos negativos que se producían en el estudio convencional con corte de congelación o impronta citológica. Ofrece un valor numérico, es decir se estandariza el resultado, y este se asimila a los 3 tamaños aplicados a las metástasis ganglionares (grupo celular aislado [GCA], micrometástasis y macrometástasis)7.
Paralelamente al desarrollo del GC en el CM se han ido modificando los esquemas de tratamiento oncológico, y se ha ido implantando progresivamente el tratamiento neoadyuvante (TNA). En la actualidad se considera que aquellas pacientes con estudio de biopsia o citología ganglionar negativa son candidatas para el estudio del GC coincidiendo con la cirugía de extirpación del tumor tras el TNA, realizándose la linfadenectomía en aquellos casos en que la biopsia del GC resulte positiva8,9.
Hasta el momento, las guías internacionales (TNM 8 edición)10,11, establecen para las pacientes que reciben TNA, la indicación de linfadenectomía ante cualquier tipo de metástasis, incluso las más pequeñas (GCA), por lo que resulta de gran transcendencia detectar con carácter intraoperatorio todas estas metástasis, para evitar una nueva intervención y completar la linfadenectomía.
Presentamos aquí la revisión de nuestra casuística de utilización del método OSNA para el estudio del GC posneoadyuvancia. Esta revisión incluye los casos intervenidos en el Hospital Universitario de Navarra desde junio del 2018 hasta mayo del 2021. El objetivo del estudio es analizar las ventajas de la utilización del método OSNA para el estudio del GC en CM tras el TNA.
Material y métodosPara el estudio se han considerado todas las pacientes diagnosticadas con CM y tratadas mediante TNA desde junio de 2018. En aquellas pacientes en las que no se ha evidenciado afectación de los ganglios axilares, se ha realizado el estudio intraoperatorio de GC con el método OSNA. Los GC se resecaron tras la inyección intraoperatoria de coloide de azufre Tc-99. Se eliminó el tejido extraganglionar y se homogenizó el GC para la posterior amplificación del ARNm de CK19 en el instrumento automatizado RD100i (Sysmex, Kobe, Japón). Las curvas en tiempo real basadas en la turbidez, muestran el número de copias del ARNm de CK19 en escalas logarítmicas y semicuantitativas. Se establecieron valores de corte para discriminar como negativo (menos de 160 copias de ARNm de CK19/μl), el GCA (160-250 copias de CK19/μl), micrometástasis (250-5.000 copias de CK19/μl) y macrometástasis (más de 5.000 copias de CK19/μl), como se describió previamente12.
Hemos estudiado en primer lugar la afectación de los GC y posteriormente hemos analizado aquellos casos con GC y no centinela positivos que recibieron una linfadenectomía. Por otro lado, hemos analizado la expresión de la CK19 tras el TNA para comprobar que no se ha producido una pérdida de esta proteína necesaria para la detección del método OSNA. La proteína CK19 se expresa en el 98,0% de los CM y solo está presente en el ganglio si existe una invasión por las células del CM.
Se han estudiado además algunas características del tumor primario como el grado de Nottingham13, así como el fenotipo subrogado (subgrupos moleculares) con el análisis de receptores estrógeno, receptores de progesterona, HER2 y Ki-67 siguiendo las indicaciones del consenso de St Gallen 201312 y TNM octava edición11. Estos anticuerpos han sido testados en los sistemas automáticos de tinción Ultra Benchmark.
Hemos analizado el grado de respuesta patológica al tratamiento oncológico en el tumor primario, siguiendo los criterios de Miller-Payne14. En este sistema se clasifica la respuesta en 5 grupos, de 1 al 5, siendo el 5 la respuesta completa sin restos de tumor infiltrante. Finalmente hemos cuantificado el parámetro Residual cancer burden (RCB) cuando disponíamos de todos los datos necesarios para su cálculo15,16.
En cuanto a los datos clínicos debemos destacar que en el momento actual las 9 pacientes que se realizaron linfadenectomía no han presentado recidiva tumoral y están vivas sin enfermedad.
ResultadosDesde junio de 2018, un total de 163 mujeres diagnosticadas de carcinoma infiltrante de mama fueron intervenidas quirúrgicamente tras completar el TNA. En 121 de estas pacientes, la cirugía en la mama se completó con una linfadenectomía axilar al confirmarse en todos los casos la presencia de metástasis axilar mediante estudio histológico o citológico.
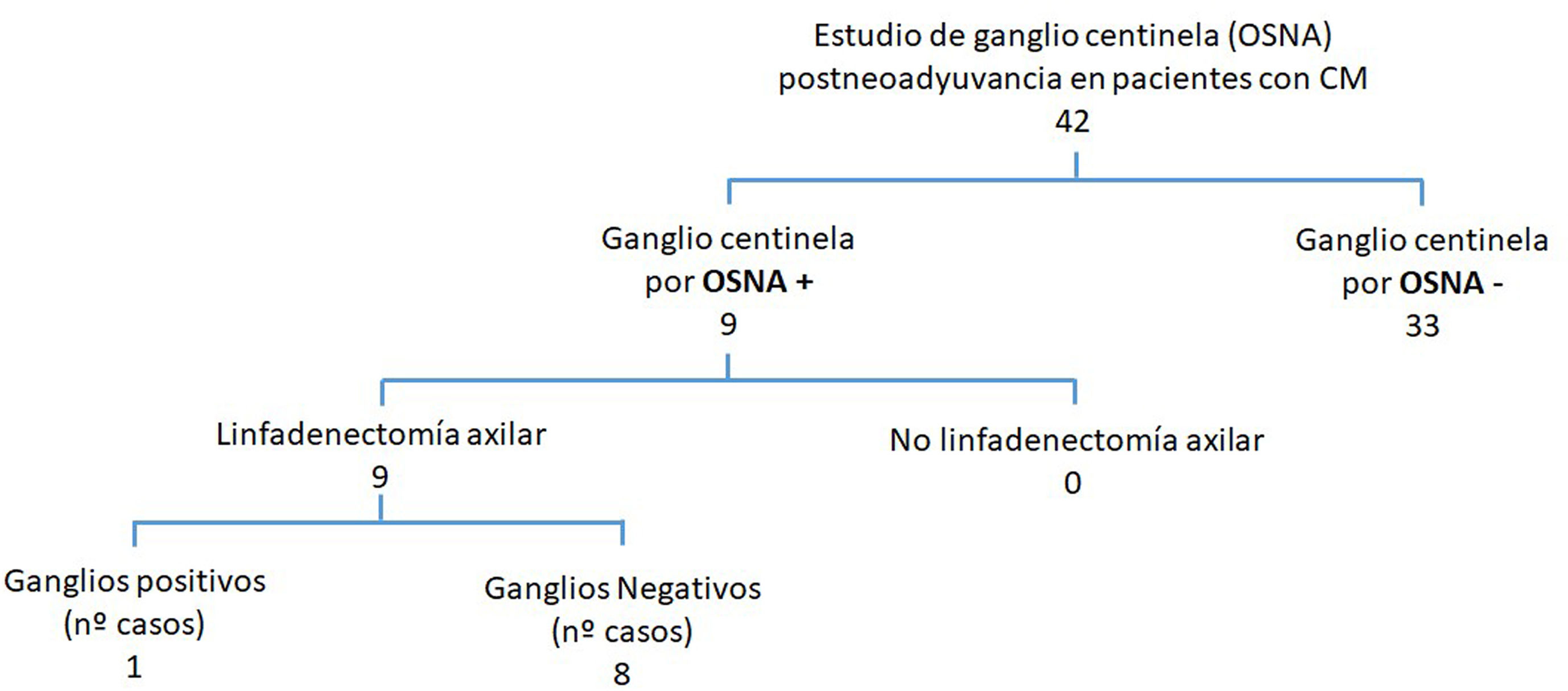
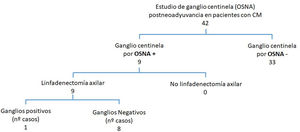
En aquellas pacientes que no presentaban afectación axilar después de haber recibido TNA (42 pacientes) se programó el estudio del GC mediante una biopsia selectiva del GC. En todos los casos se empleó el método OSNA al comprobarse que el CM antes del TNA expresaba CK19. Se estudiaron 90 GC con una media de 2,1 ganglios (1-5 ganglios) por paciente.
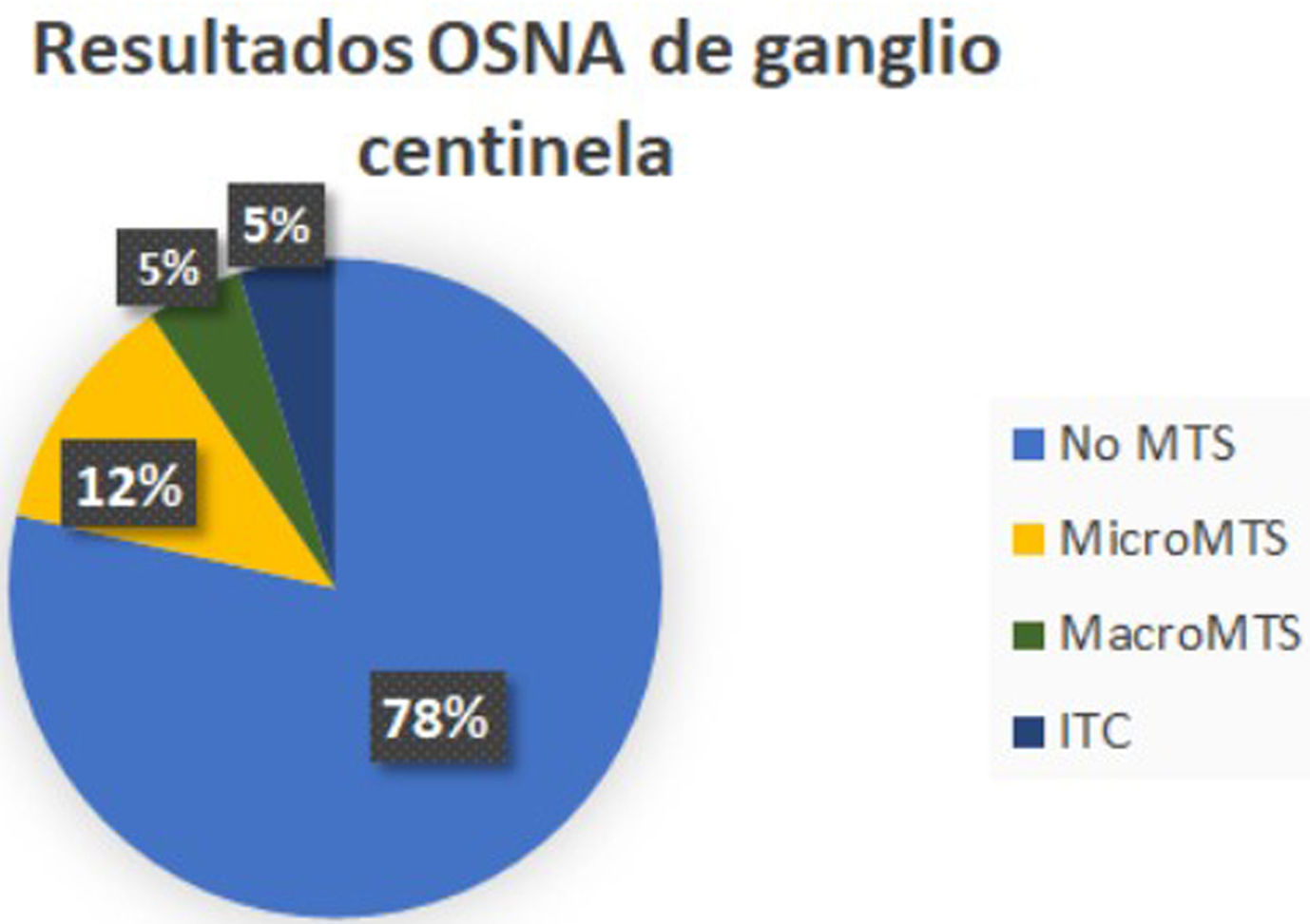
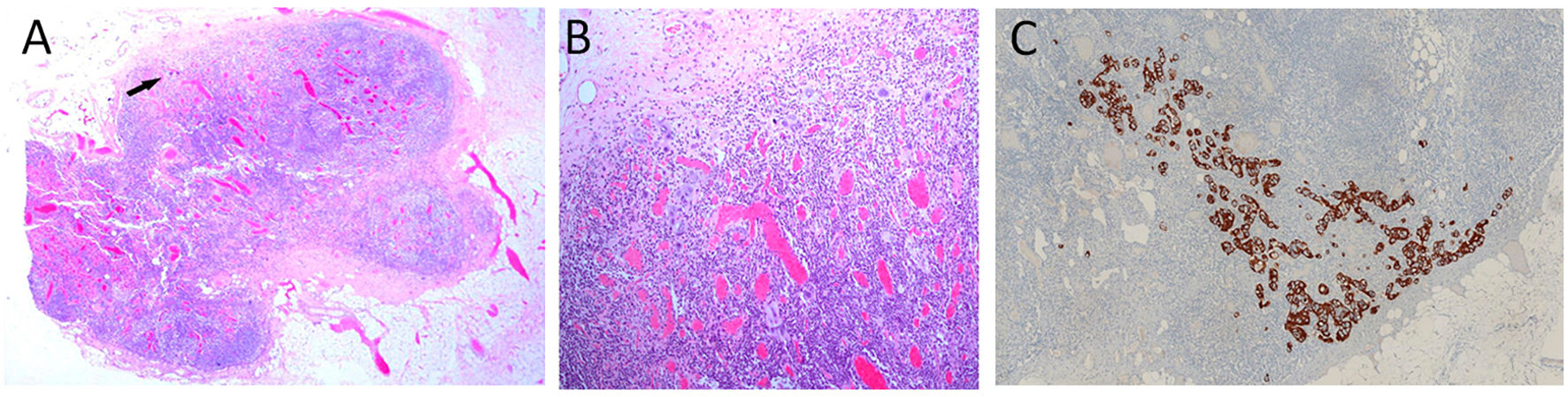
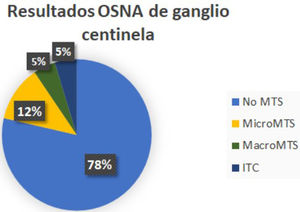
En 33 pacientes los GC fueron negativos mientras que hallamos GCA en 2 casos, micrometástasis en 5 casos y macrometástasis en 2 casos (fig. 1). A estas 9 pacientes con GC positivo, se realizó linfadenectomía posterior y de ellas, el estudio histológico definitivo del resto de los ganglios fue negativo en 8. Encontramos una micrometástasis en la paciente que presentó un GCA (figs. 2y 3; tabla 1).
Características generales
| N° de pacientes | Porcentaje | |
|---|---|---|
| Edad | ||
| Adulto ≥ 50 | 25 | 59,5 |
| Adulto < 50 | 17 | 40,5 |
| Lateralidad | ||
| Izquierda | 23 | 54,8 |
| Derecha | 19 | 45,2 |
| Grado tumoral | ||
| G1 | 1 | 2,4 |
| G2 | 20 | 47,6 |
| G3 | 21 | 50 |
| Subtipo molecular | ||
| HER2 | 8 | 19 |
| LA | 1 | 2,4 |
| LB | 7 | 16,7 |
| LB-HER2 | 15 | 35,7 |
| TN | 11 | 26,2 |
| TNM post-NAT | ||
| ypT0-pCR | 21 | 50 |
| ypT0N1 | 2 | 4,8 |
| ypT1aN0 | 2 | 4,8 |
| ypT1bN0 | 4 | 9,5 |
| ypT1bN1 | 3 | 7,1 |
| ypT1cN0 | 6 | 14,3 |
| ypT2N1 | 1 | 2,4 |
| ypTis-pCR | 3 | 7,1 |
| Miller & Payne | ||
| 1 | 1 | 2,4 |
| 2 | 0 | 0 |
| 3 | 12 | 28,6 |
| 4 | 4 | 9,5 |
| 5 | 25 | 59,5 |
| Regresión | ||
| pCR | 24 | 57,1 |
| No pCR | 18 | 42,9 |
| Pacientes con linfadenectomía | 9 | |
| Ganglios positivos en LA | 1 | 11,11 |
| Ganglios negativos en LA | 8 | 88,88 |
LA: luminal A; LA: linfadenectomía; LB: luminal B; TN: triple negativo; post-NAT: post-Neoadyvancia; pCR: pathologic complete response.
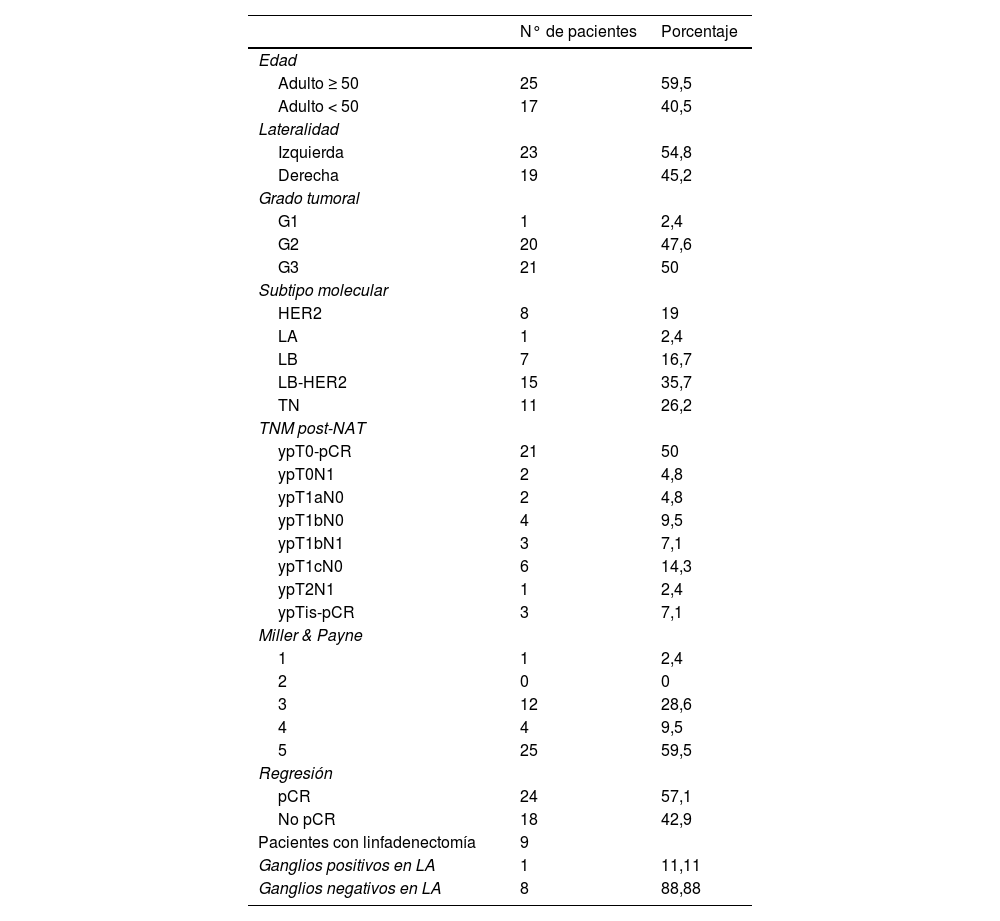
En relación al grado histológico de Nottingham8 encontramos un caso de grado uno, 20 casos de grado 2 y en 21 pacientes el carcinoma infiltrante de mama era de grado 3 (tabla 1).
La distribución de la serie en función del fenotipo subrogado según los criterios de St Gallen9, mostró un caso de fenotipo luminal A, 7 casos de fenotipo luminal B, 15 casos de fenotipo luminal B-HER2, 8 casos de fenotipo HER2 puro y por último 11 mostraban un fenotipo triple negativo.
En relación al grado de regresión según el esquema de Miller y Payne10, se evidenció una respuesta de grado 5 o respuesta histopatológica completa en 25 pacientes (59,5%); 4 pacientes presentaron un grado 4 (9,5%), 12 alcanzaron un grado 3 (30,9%) y en un caso la respuesta fue de grado uno (2,3%).
Los 17 casos que mostraron persistencia de carcinoma infiltrante, se evaluó la expresión de CK19 y se comprobó que en todos ellos resultaba positiva (100%).
DiscusiónEl objetivo actual de la técnica del GC es evitar la morbilidad secundaria al tratamiento quirúrgico sobre la axila (linfadenectomía), y proporcionar un tratamiento oncológico adecuado, tras el diagnóstico de CM. Por ello, el objetivo es obtener la máxima información del GC, de forma intraoperatoria, para definir la indicación correcta de tratamiento quirúrgico de la axila (linfadenectomía). De ahí, la transcendencia de elegir la técnica más sensible para el estudio del GC.
La técnica utilizada para el diagnóstico histológico de los GC, y la búsqueda de las metástasis ha ido variando a lo largo de los años. Los principales problemas para los patólogos a la hora de estudiar los GC son diversos. Inicialmente se realizaba el estudio de los ganglios de forma diferida15 con gran fiabilidad, pero obligaba a realizar una segunda intervención para la linfadenectomía en aquellos casos con GC positivos. A continuación, se comenzó el estudio intraoperatorio para ofrecer un diagnóstico que permitiera la realización de la linfadenectomía en la misma intervención. El mayor inconveniente era que se disponía de un tiempo corto que obligaba a un estudio parcial mediante cortes de congelación o improntas citológicas. Los falsos negativos debían realizarse una segunda intervención para la realización de la linfadenectomía2.
Paralelamente al desarrollo del GC en el CM, se han ido modificando los esquemas de tratamiento oncológico, y se ha ido implantando progresivamente el TNA17–21. Cuando se comenzó la implantación de este esquema de tratamiento, todas las pacientes que recibían el TNA eran tratadas posteriormente con cirugía de resección del tumor y linfadenectomía. Posteriormente se estableció que aquellas pacientes sin afectación ganglionar (con estudio de biopsia o citología ganglionar negativa) fueran candidatas para el estudio del GC tras el TNA y coincidiendo con la cirugía de extirpación del tumor, realizándose la linfadenectomía en aquellos casos en que la biopsia del GC resultara positiva19,22.
En este contexto, no existe un consenso nacional sobre cuál es el método para el estudio y diagnóstico de la afectación del GC. Planteamos las posibles alternativas que recogen las técnicas abandonadas a través de los años desde la incorporación del GC.
La primera es la utilización del sistema tradicional mediante cortes de congelación o impronta citológica, que resulta muy complicada porque el tejido de los ganglios muestra modificaciones asociadas a la respuesta al tratamiento oncológico recibido. Estos hechos dificultan la detección de las metástasis más pequeñas como grupo celular aislado y micrometástasis. En estudios recientes en que se ha procesado el ganglio mediante el método tradicional como Wong, de 201916; ofrecen unos resultados de un 28% de falsos negativos. Este resultado, condujo a la realización de una segunda intervención para la linfadenectomía, hasta en un 11,8% de los casos.
Otra opción es la utilización del método OSNA para el estudio del GC post neoadyuvante. En las guías internacionales no se contempla esta posibilidad por la falta de implantación del método en EE. UU. Sin embargo, se han publicado varios estudios españoles que han confirmado la eficiencia del método OSNA, para el estudio del GC posneoadyuvante. Queremos destacar los trabajos de Espinosa-Bravo et al., que observó que utilizando el método OSNA podía reducir en un 18% la realización de una segunda cirugía para completar la linfadenectomía21,23–26. El trabajo de Parada et al. ratificó en 2016 la eficiencia y eficacia del método en el contexto neoadyuvante24–27.
En el HUN, valoramos que el método OSNA nos brindaba la posibilidad de emitir un informe definitivo, con carácter intraoperatorio. También consideramos muy trascendente encontrar la técnica con mayor sensibilidad para detectar metástasis de pequeño tamaño como ha demostrado el método OSNA23,28, porque en el contexto neoadyuvante, todo tipo de metástasis (hasta las más pequeñas) suponen una indicación de linfadenectomía. En nuestro estudio hemos detectado 7 metástasis pequeñas (2 grupos celulares aislados y 5 micrometástasis). Estos casos resultan muy difícilmente detectables con el método tradicional, siendo alta la probabilidad de un falso negativo. Con ello, podemos considerar que hemos reducido las segundas intervenciones en un 14,6% de las pacientes, evitando la morbilidad asociada a esta segunda intervención quirúrgica.
Un argumento en contra de la utilización del método OSNA en el marco de la TNA es por la posible modificación del fenotipo de los CM, por la evolución del tumor y por el TNA18,23,26,27. El método OSNA se basa en la detección de la CK19, por lo que era necesario comprobar que su expresión no se modificaba con el TNA. La Dra. Vieites et al. realizaron un estudio evaluando la expresión de CK19 antes y después del TNA demostrando que esta expresión no se modifica sustancialmente durante el TNA. En este trabajo hemos realizado el estudio de la CK19 en GC antes del inicio del tratamiento, y se ha repetido el estudio tras el tratamiento. Esta sido posible en todos aquellos casos (17 casos) en los que detectamos un tumor en la cirugía post-tratamiento. El resultado ha sido positivo en todos los casos, corroborando los hallazgos de la Dra. Vieites et al., único trabajo publicado sobre este hecho hasta la fecha27.
Otro argumento en contra de la utilización del método OSNA tras el TNA se refiere a la forma de medir el tamaño de las metástasis en los ganglios linfáticos, ya que inicialmente se consideraba la suma del tumor y el área de regresión10, pero actualmente se considera solo el foco de crecimiento tumoral de mayor tamaño sin contabilizar el tejido fibroso que es exactamente lo que valora el sistema OSNA proporcionando un valor preciso21,25,26.
Por último, la utilización del sistema OSNA nos proporciona un rango estandarizado cuantitativo del número de copias del CK19 para calcular el tamaño de las metástasis según las 3 categorías de GCA, micrometástasis o macrometástasis. Sin embargo, no permite obtener una medida del componente tumoral en unidades de longitud. Este factor de medida es uno de los factores que se utilizan para el calculador de pronóstico RCB (Residual Cancer Burden), diseñado por el MD Anderson10 y disponible de forma gratuita en la red.
Cabe destacar que en nuestra serie hemos podido proporcionar este valor de RCB, en todos los casos en que los ganglios fueron negativos (en 33 pacientes) y también aquellos que mostraron algún ganglio positivo en la linfadenectomía (un paciente), porque estos ganglios se procesan según el método convencional (parafinado y hematoxilina –eosina) y se puede medir en centímetros. Por tanto, solo en 2 (4,7%) pacientes no pudimos ofrecer este valor con importancia pronóstica.
Para concluir debemos destacar que, a pesar de los inconvenientes referidos, las ventajas que supone realizar la técnica OSNA son claras por su valor definitivo intraoperatorio con alta sensibilidad y especificidad, evitando un número no desdeñable de segundas intervenciones, lo que claramente justifica su uso para el estudio del GC en las pacientes tratadas con TNA. También hemos confirmado que la expresión de CK19 en CM no se modifica con el tratamiento.
FinanciaciónNo se ha recibido ningún fondo de financiación específico para la realización de esta revisión.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Consideraciones éticasEste estudio fue revisado por el comité ético de investigación clínica del Hospital Universitario de Navarra emitiendo un informe favorable para su publicación.