Evaluar la respuesta patológica a la quimioterapia neoadyuvante tanto en la mama como en la axila según los fenotipos moleculares de cáncer de mama.
Pacientes y métodoEstudio retrospectivo entre enero de 2011 y diciembre de 2014 que incluye a las pacientes con cáncer de mama infiltrante intervenidas tras tratamiento con quimioterapia neoadyuvante. Hemos considerado 5 fenotipos moleculares según los criterios de St. Gallen 2013. La respuesta patológica en mama y en axila se ha evaluado según los criterios de Sataloff.
ResultadosSe recogen los datos de un total de 181 pacientes tratadas con quimioterapia neoadyuvante, de las que a 96 se les realizó linfadenectomía axilar. El 34,3% tenían un fenotipo molecular Her-2, 28,7% basal, 25,4% luminal B y 11,6% luminal A. En los luminal A, el 28,5% han tenido una respuesta patológica completa en la mama frente al 21,4% en la axila; en los luminal B, 34,7 frente al 13,7%; en los luminal B Her-2, 65 frente a 41,1%; en los Her-2, 95,4 frente a 70,5%; en los basales, 59,6 frente a 36,8%. Globalmente, la respuesta patológica completa en la mama ha sido del 55,2% frente al 35,4% en axila.
ConclusionesLos fenotipos moleculares Her-2 y basal presentan mayores tasas de respuesta patológica completa tras quimioterapia neoadyuvante. No existe correlación entre la respuesta patológica observada en la mama y en la axila. La respuesta axilar es, en términos generales, menor que en la mama.
To evaluate pathological response to neoadjuvant chemotherapy in the breast and axilla according to the different molecular phenotypes of breast cancer.
Patients and methodA retrospective study was performed between January 2011 and December 2014, including those patients with infiltrating carcinoma who underwent surgery after neoadjuvant chemotherapy. Five molecular phenotypes were considered according to St. Gallen's 2013 criteria. Pathological axillary and breast response were evaluated following the Sataloff system.
ResultsWe analysed data from 181 patients treated with neoadjuvant chemotherapy. Of these, an axillary lymphadenectomy was performed in 96 patients. In total, 34.3% of the patients belonged to the Her-2 group, 28.7% to the basal group, 25.4% to the luminal B group and 11.6% to the luminal A group. In luminal A tumours, pathological complete response was observed in the breast in 28.5% of the patients and in the axilla in 21.4%; in luminal B group, 34.7 versus 13.7%; in luminal B-Her-2, 65 versus 41.1%; in Her-2 positive tumours, pathological complete response was observed in the breast in 95.4% of the patients versus 70.5% in the axilla; in the basal group, pathological complete response was achieved in the breast in 59.6% versus only 36.8% in the axilla. Overall, pathological complete response was observed in the breast in 55.2% compared with 35.4% in the axilla.
ConclusionsHer-2 and basal phenotypes of breast cancer show better rates of complete pathological complete response after neoadjuvant chemotherapy. No correlation was found between pathological response in the breast and the axilla. Axillary response was worse than that found in the breast.
La quimioterapia neoadyuvante (QTNA) es el tratamiento sistémico con quimioterápicos administrados antes del procedimiento quirúrgico definitivo del cáncer de mama. Sus objetivos son posibilitar la cirugía en casos inoperables de inicio, así como disminuir el tamaño tumoral para plantear cirugía conservadora en los casos en que la mastectomía sería la primera opción. Del mismo modo, permite evaluar la eficacia del tratamiento sistémico valorando in vivo la respuesta tumoral. Algunas publicaciones, además, le otorgan un papel en el tratamiento precoz de las micrometástasis, aunque sin que esto consiga impactar en la supervivencia1.
Por ello, la QTNA tiene tradicionalmente un papel fundamental en el cáncer de mama localmente avanzado (estadios iiiA-iiiC, T3-T4)2, en el que la cirugía no es posible inicialmente, y en el cáncer de mama en estadios precoces con indicación de tratamiento sistémico adyuvante (i-ii), en los que existe mala relación tumor/mama y que estarían abocados a mastectomía o en los que la localización del tumor condicionaría un mal resultado estético. Pero, cada vez de forma más clara, donde la administración de la QTNA adquiere una especial relevancia es en los fenotipos de cáncer de mama triple negativos y Her-2, independientemente del tamaño tumoral. En estos casos, la evaluación objetiva de la respuesta tumoral in vivo nos puede proporcionar información pronóstica fundamental para las pacientes3.
La forma definitiva para evaluar la respuesta al tratamiento quimioterápico neoadyuvante es el estudio anatomopatológico de la pieza quirúrgica. Aunque hay criterios dispares, en líneas generales hablamos de respuesta patológica completa (RPC) cuando se evidencia una desaparición completa del componente infiltrante tanto en la mama como en la axila. La persistencia en la mama del componente intraductal se considera, del mismo modo, RPC.
La finalidad del presente estudio es objetivar la respuesta patológica tras el tratamiento sistémico neoadyuvante según los diferentes fenotipos moleculares de cáncer de mama, evaluando dicha respuesta tanto en la mama como en la axila.
MétodoEstudio retrospectivo que incluye 181 pacientes con cáncer de mama intervenidas tras la administración de QTNA, en el periodo de tiempo comprendido entre enero de 2011 y diciembre de 2014. En 96 de ellas se realizó linfadenectomía axilar por presentar adenopatías metastásicas objetivadas mediante PAAF/BAG previamente al inicio del tratamiento sistémico. Los protocolos de quimioterapia del periodo de estudio son homogéneos, basándose en antraciclinas y taxanos, más Herceptin® en los tumores Her-2 positivos, según el siguiente esquema: antraciclinas×4 (21 d) → paclitaxel×8 (semanal) y antraciclinas×4 → paclitaxel (semanal)+Herceptin®×8 si Her-2 positivo (21 d-un año). Los criterios empleados para la administración de QTNA han sido los siguientes: pacientes con tumores localmente avanzados y/o con tumores Her-2 neu positivos, o triple negativo, así como algunos tumores luminal B Her-2 negativo con Ki elevado, o luminal A/B con axila positiva, en función de las características de las pacientes.
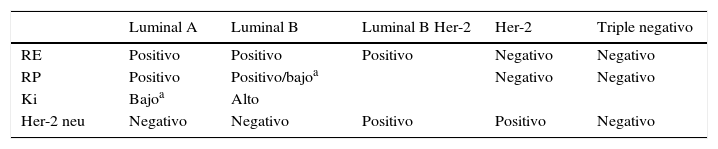
Cada paciente ha sido asignada a uno de los 5 fenotipos moleculares de cáncer de mama descritos atendiendo a los criterios acordados en la reunión St. Gallen 20134 (tabla 1). La respuesta patológica tanto en la mama como en la axila ha sido evaluada según los criterios de Sataloff5 (tabla 2).
Clasificación del cáncer de mama en fenotipos moleculares
| Luminal A | Luminal B | Luminal B Her-2 | Her-2 | Triple negativo | |
|---|---|---|---|---|---|
| RE | Positivo | Positivo | Positivo | Negativo | Negativo |
| RP | Positivo | Positivo/bajoa | Negativo | Negativo | |
| Ki | Bajoa | Alto | |||
| Her-2 neu | Negativo | Negativo | Positivo | Positivo | Negativo |
RE: receptores de estrógenos; RP: receptores de progesterona.
Adaptada a partir de los criterios de St. Gallen 2013 (Goldhirsch et al.4).
Evaluación de la respuesta patológica en mama y axila según Sataloff
| Mama |
| T-A: Efecto terapéutico total o prácticamente total |
| T-B: Efecto terapéutico>50% pero no completo |
| T-C: Efecto terapéutico<50% |
| T-D: Sin efecto terapéutico |
| Axila |
| N-A: Cambios secundarios a quimioterapia, sin metástasis |
| N-B: Sin cambios secundarios, sin metástasis |
| N-C: Cambios secundarios a quimioterapia pero metástasis |
| N-D: Metástasis, sin cambios secundarios a quimioterapia |
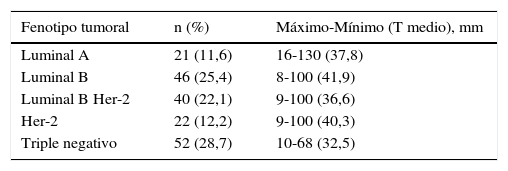
Del total de 181 pacientes, 66 (34,3%) se incluyeron dentro del fenotipo Her-2 (tanto puro como luminal B), constituyendo el grupo más numeroso, seguido del triple negativo con 52 pacientes (28,7%); 46 (25,4%) tenían un cáncer de mama luminal B, mientras que 21 pacientes (11,6%) se clasificaron como luminal A, siendo este el menos frecuente. En la tabla 3 se representan estos datos, así como los tamaños de los tumores según cada fenotipo molecular.
Fenotipos moleculares. Distribución de las pacientes tratadas con quimioterapia neoadyuvante y tamaño tumoral de cada grupo
| Fenotipo tumoral | n (%) | Máximo-Mínimo (T medio), mm |
|---|---|---|
| Luminal A | 21 (11,6) | 16-130 (37,8) |
| Luminal B | 46 (25,4) | 8-100 (41,9) |
| Luminal B Her-2 | 40 (22,1) | 9-100 (36,6) |
| Her-2 | 22 (12,2) | 9-100 (40,3) |
| Triple negativo | 52 (28,7) | 10-68 (32,5) |
T: tamaño del tumor.
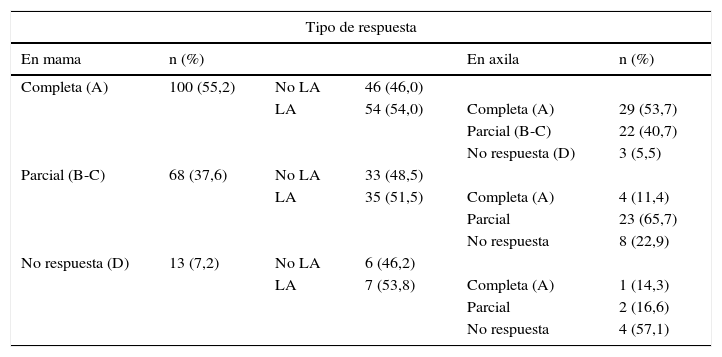
En cifras globales, independientemente del fenotipo de cáncer de mama, hemos encontrado una respuesta patológica completa en la mama del 55,2% frente al 44,8% con respuestas parciales o sin respuesta (100 frente a 81). En la axila, se ha objetivado una respuesta patológica completa en el 35,4% de los casos, frente al 64,6% de respuesta parcial o sin respuesta (34 frente a 62) (tabla 4).
Distribución de las pacientes con respuesta patológica completa frente a respuesta parcial o sin respuesta en mama y axila
| Tipo de respuesta | |||||
|---|---|---|---|---|---|
| En mama | n (%) | En axila | n (%) | ||
| Completa (A) | 100 (55,2) | No LA | 46 (46,0) | ||
| LA | 54 (54,0) | Completa (A) | 29 (53,7) | ||
| Parcial (B-C) | 22 (40,7) | ||||
| No respuesta (D) | 3 (5,5) | ||||
| Parcial (B-C) | 68 (37,6) | No LA | 33 (48,5) | ||
| LA | 35 (51,5) | Completa (A) | 4 (11,4) | ||
| Parcial | 23 (65,7) | ||||
| No respuesta | 8 (22,9) | ||||
| No respuesta (D) | 13 (7,2) | No LA | 6 (46,2) | ||
| LA | 7 (53,8) | Completa (A) | 1 (14,3) | ||
| Parcial | 2 (16,6) | ||||
| No respuesta | 4 (57,1) | ||||
LA: linfadenectomía axilar.
En las pacientes con cáncer de mama luminal A, se objetivó una respuesta patológica completa en la mama (T-A Sataloff) en 6 de ellas, lo que supone un 28,5% de los casos. Por el contrario, no se observó efecto terapéutico (T-D Sataloff) en 5 pacientes, es decir, en un 23,8% de las mismas. En 7 pacientes (33,3%) la respuesta objetivada fue superior al 50% (T-B Sataloff), mientras que en 3 de ellas (14,3%) fue inferior al 50% (T-C Sataloff). En la axila, de un total de 15 pacientes, 7 (46,7%) seguían teniendo afectación metastásica sin cambios secundarios al tratamiento quimioterápico (N-D), en 5 (33,3%) persistían las metástasis pero se objetivaron cambios secundarios al tratamiento (N-C), y tan solo en 3 de ellas (20,0%) se observó desaparición de la afectación metastásica, con cambios secundarios evidentes a la quimioterapia (N-A). No hubo ningún caso de respuesta N-B.
En las pacientes con cáncer de mama luminal B, la respuesta patológica fue completa en la mama (T-A) en 16 de ellas (34,8%), mientras que en la axila, de un total de 29, solo se evidenció en 4 (13,7%) de las mismas (N-A). Por el contrario, no hubo respuesta alguna ni en mama ni en axila (T-D, N-D) en 2 (6,9%) y 6 (20,1%) pacientes, respectivamente. En 16 casos (34,7%) se observó una respuesta en la mama clasificable como T-B según Sataloff, mientras que en 12 (26,1%) fue T-C. En la axila, 16 pacientes (55,2%) tuvieron una respuesta N-C, siendo el grupo más numeroso. Solo 3 casos (10,3%) presentaron una respuesta N-B.
En los tumores clasificados como luminal B Her-2, la respuesta patológica fue completa o casi completa en la mama (T-A) en 26 pacientes (65,0%), frente a 8 (42,1%) de un total de 19 en la axila (N-A). No ha habido respuesta ni en la mama ni en la axila en un 5 y un 15,7%, respectivamente. Se obtuvo una respuesta T-B en 11 pacientes (23,9%). Solo un paciente (2,5%) presentó una respuesta T-C. En la axila, la respuesta fue N-B en 5 casos (26,3%) y N-C en 3 (15,7%).
Las pacientes con tumores Her-2 tuvieron una respuesta patológica completa T-A en un 95,5% de los casos, frente al 4,5% que obtuvo una respuesta T-B (21 pacientes frente a 1). No se han observado casos de respuesta T-C ni T-D. En la axila, de un total de 16 casos, 11 (68,8%) alcanzaron una respuesta patológica completa N-A, 3 (18,8%) N-B y solo 2 (12,5%) N-C. En ningún caso se objetivó falta de respuesta al tratamiento sistémico en la axila (N-D).
En los triple negativos, la respuesta fue completa o casi completa en la mama en 31 pacientes (59,6%), frente a 6 (35,2%) en la axila (17 linfadenectomías). En 4 pacientes no se obtuvo respuesta en la mama (T-D), lo que supone el 7,7% del total, mientras que en la axila la ausencia de respuesta (N-D) se objetivó en 3 casos, alcanzando el 17,6%. En 10 pacientes (19,2%) se obtuvo una respuesta T-B en la mama, mientras que en 7 de ellas (13,5%) la respuesta fue T-C. En la axila, 3 pacientes (17,6%) presentaron una respuesta clasificable como N-B, frente a 5 (29,4%) como N-C.
Las diferencias en tasa de respuesta se muestran estadísticamente significativas para los distintos fenotipos moleculares (p<0,001).
En la tabla 4 se presentan los datos globales en relación con la respuesta patológica objetivada tanto en mama como en axila.
Evidentemente no se pueden comparar las respuestas en mama y en axila para el total de la población, ya que no a todas las pacientes se les realizó una linfadenectomía axilar, pero sí entre aquellas a las que se realizó ambas (cirugía en la mama y linfadenectomía axilar), en las que la tasa de RPC es del 55,7% en mama y del 35,1% en axila (p<0,001). Esta diferencia es también significativa si comparamos por separado los distintos tipos de respuesta en axila en función de si ha habido o no RPC en mama (p<0,001).
Según nuestros resultados, en todos los fenotipos moleculares de cáncer de mama se han objetivado mayores tasas de respuesta patológica completa en la mama en comparación con las obtenidas en la axila.
DiscusiónAunque la QTNA no conlleva mayor supervivencia global ni intervalo libre de enfermedad en comparación con el tratamiento sistémico adyuvante5, múltiples publicaciones demuestran que las pacientes con RPC tras la administración de QTNA presentan mayor supervivencia global e intervalo libre de enfermedad que aquellas con tumor infiltrante residual tras la misma6,7. Esto es especialmente cierto en los tumores triple negativos8,9. Por ello, podemos afirmar que la RPC tras QTNA es el factor predictivo más importante en cuanto a supervivencia global e intervalo libre de enfermedad, estando también relacionado este último con los diferentes fenotipos moleculares del cáncer de mama10.
Según nuestros resultados, la respuesta patológica objetivada en la mama ha sido mayoritariamente de tipo completa. Pero existe una gran variabilidad en la RPC en la mama entre los diferentes fenotipos moleculares, que ha sido ampliamente estudiada, siendo los datos objetivados muy homogéneos. Así, podemos establecer, en líneas generales, que la literatura recoge que la RPC en la mama en el subtipo Her-2 es del 60%; en el triple negativo, del 40% y en el luminal A y B, inferior al 10%11,12. Otras publicaciones, como la de Cortázar et al.13, que analiza 12 estudios aleatorizados con una muestra total de 12.000 pacientes, describen tasas de RPC en mama del 31-50% en los luminales B Her-2 y Her-2 puros, respectivamente, tasas del 34% en los triples negativos y solo del 8-16% en los luminales A y B. La RPC observada en la mama en las pacientes objeto de estudio en nuestro centro es significativamente superior a las publicadas en la literatura, en especial en los subtipos Her-2 y triple negativo frente a los luminales A y B. Estas diferencias podrían deberse a diversas razones: el grupo más numeroso en nuestra población de estudio ha sido el fenotipo Her-2; se han incluido pacientes con estadios iniciales de cáncer de mama con fenotipos moleculares de mayor riesgo (triple negativo y Her-2) por la implicación pronóstica que tiene la consecución de una RPC en ellas, y las pacientes incluidas en el estudio con subtipo luminal B presentaban ciertas características inmunohistoquímicas directamente relacionadas con mayores tasas de RPC, como un Ki-67 elevado o un grado histológico G3. Así mismo, el porcentaje de respuesta puede verse influido por el criterio de clasificación empleado: la clasificación de Sataloff es menos exigente que otras a la hora de definir la RPC.
Los resultados obtenidos en nuestro estudio en relación con la RPC global en la axila tras la administración de QTNA (35,4%) están dentro del amplio espectro (20-60%) recogido por la literatura14,15. La RPC axilar fue mayor en los fenotipos moleculares Her-2 tanto puros (68,8%) como luminal B Her-2 (42,1%) y en los triple negativos o basales (35,2%), frente a los luminales B y A en los que la respuesta objetivada fue mucho menor (13,7 y 20,0%, respectivamente). No obstante, aunque los tumores Her-2 y triple negativos responden en mayor medida, coincidiendo con lo publicado en la literatura, los porcentajes absolutos de respuesta de nuestro estudio difieren ligeramente de ellos. Así, Jiménez-Ballvé et al.2 obtienen una RPC en axila mayor en los fenotipos triple negativos frente a los Her-2 (69 frente a 62%), aunque estos resultados no son estadísticamente significativos.
Si comparamos los datos obtenidos en nuestro estudio en la mama y en la axila, es evidente que la RPC en la primera es significativamente mayor. Esto nos plantea la siguiente cuestión: ¿Por qué la respuesta patológica es, en general, superior en la mama frente a la axila?, ¿de qué factores depende la respuesta a la QTNA en la axila?, ¿existe algún marcador de predicción de la respuesta patológica en la axila? Es evidente que se requieren más estudios en esta línea.
En conclusión, la administración de tratamiento sistémico previo al quirúrgico definitivo posibilita tratar de forma conservadora el cáncer de mama en aquellos casos que por su estadio en el momento del diagnóstico o por la mala relación tamaño tumoral/mama estarían abocados a una mastectomía, siempre y cuando exista indicación de tratamiento sistémico adyuvante. Así mismo, tiene hoy día un papel fundamental en los subtipos moleculares de alto riesgo Her-2 y triple negativos, ya que la respuesta patológica obtenida tras la misma es el factor pronóstico más importante. Las pacientes con RPC tras QTNA tienen mayor supervivencia global e intervalo libre de enfermedad que aquellas con tumor infiltrante residual.
Las tasas de respuesta patológica completa en la mama son superiores a las objetivadas en la axila en todos los subtipos moleculares de cáncer de mama. Hoy día desconocemos qué factores condicionan la diferente respuesta patológica en mama y axila.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.