Las microvesículas (exosomas y micropartículas) son cuerpos celulares derivados que conforman un sistema de transmisión de señales entre células, tanto local como a distancia, capaces de portar tanto marcadores de superficie celular como material genético, interviniendo en el comportamiento celular. Participan en los procesos de tumorogénesis, desde la angiogénesis hasta la amplificación de clones tumorales, entre otros. Han sido identificadas en algunas series clínicas como factores de mal pronóstico o incluso marcadores de complicaciones asociadas al cáncer como los eventos trombóticos.
Con un prometedor papel como vehículo de transporte para dirigir de forma selectiva microRNA o moléculas capaces de modificar el comportamiento tumoral, con un enfoque terapéutico, a través de la transmisión de factores proapoptóticos o supresores tumorales. Así como con el desarrollo de sistemas de ultrafiltración selectiva de microvesículas.
En cáncer de mama son aún escasos los resultados obtenidos pero sí prometedores, en cuanto que abren una nueva línea de conocimiento en la biogénesis tumoral, por su valor tanto en diagnóstico precoz como en su asociación con el pronóstico tumoral e incluso como marcadores predictivos.
Microvesicles (exosomes and microparticles) are subcellular bodies. They constitute a cell-to-cell signalling system, both locally and at a distance, and are able to carry both cell surface biomarkers and genetic material, influencing cell behaviour. These vesicles participate in tumorigenesis, including angiogenesis and amplification of tumour clones, among other processes. They have been identified in some clinical series as markers of poor prognosis and even as markers of cancer-associated complications such as thrombotic events.
These subcellular bodies have a promising role as a “transport vehicle” or “signal vector” to selectively direct microRNA or molecules able to modify tumour behaviour, and may even have a therapeutic role, through transmission of proapoptotic factors or tumour suppressors, respectively. In addition, selective microvesicle ultrafiltration systems are under development, which are able to eliminate those microvesicles that play a precursor role in tumour development.
The results obtained in breast cancer are scarce but promising, insofar as they open up new areas of knowledge in tumour biogenesis, due to their value both in early diagnosis and in tumour prognosis and even as predictive biomarkers.
This article reviews the literature on the role of microvesicles in breast cancer, with special emphasis on related clinical studies.
La vesiculación celular fue descrita por primera vez en 1967 por Wolf, que describió la liberación de «residuos» celulares tras la activación plaquetaria1.
Las microvesículas (MV) son cuerpos celulares liberados de una variedad de células normales (fundamentalmente células endoteliales, plaquetas, leucocitos y monocitos) así como de células tumorales, que portan material génico, proteico etc., por lo que constituyen un sistema de comunicación célula-célula tanto local como sistémico2. Dependiendo de su tamaño y mecanismo de liberación, las MV pueden clasificarse en exosomas, cuerpos apoptóticos y micropartículas (MP) o ectosomas.
Las MV son detectables en condiciones fisiológicas, pero sus niveles aumentan en plasma cuando estímulos inflamatorios, tales como las citocinas (factor de necrosis tumoral, interleucina-1) o agentes citotóxicos actúan sobre la superficie celular, generando un aumento en su liberación3,4. Por ello, en procesos tumorales, enfermedades cardiovasculares, diabetes y procesos inflamatorios, está descrito un aumento en su concentración plasmática. Pueden ser liberadas tras un proceso o bien de activación o bien de apoptosis celular.
Las MP son vesículas de membrana celular de un tamaño entre 0,1 y 1μm de diámetro. Son liberadas directamente desde la membrana plasmática celular por un proceso de exocitosis. Su liberación viene precedida de la activación celular o de la apoptosis temprana celular. Las MP contienen acúmulos lipídicos, ARN, fosfatidilserina e histonas, mientras que apenas contienen ADN5. Tienen una alta capacidad de unión a anexina V.
Los exosomas son vesículas de menor tamaño (40-100nm) y derivan de un proceso de endocitosis de membrana celular que, a su vez, se fusiona con cuerpos intracelulares y son liberados al medio por exocitosis, tras un proceso de activación celular. Contienen microARN, ARNm, fragmentos de ADN y proteínas6. Tienen una baja o nula capacidad de ligarse a anexina V7.
Los exosomas desempeñan un papel en la respuesta inmune, la progresión tumoral y otros procesos degenerativos8,9.
En muestras de fluidos de pacientes con cáncer, incluyendo cáncer de mama10, ovario11, glioblastoma12 y próstata13, se han encontrado exosomas con proteínas y miARN del tumor primario y cuya concentración, en muchas ocasiones, se correlacionaba con el estadio tumoral.
Los cuerpos apoptóticos son fragmentos celulares y miden de 1 a 4μm. Son liberados de forma tardía en el proceso de apoptosis y contienen ADN e histonas. Tienen alta capacidad de unión a anexina V14.
La determinación o cuantificación de MV puede hacerse por diversas técnicas, pero es la citometría de flujo la más utilizada por su capacidad de cuantificación y de discriminación entre MV, basada en métodos de fluorescencia15.
Las MV en el contexto tumoral podrían actuar como transportadores de moléculas o material genético prooncogénico, y contribuir así a la expansión tumoral.
Microvesículas y cáncerLas MV participan como mediadores biológicos en el cáncer. Tanto las MP como los exosomas son emitidos por la célula y el estroma tumoral. Cada vez son más los estudios que relacionan los niveles elevados MP con el cáncer, así como con las complicaciones asociadas a este.
Mecanismos de progresión tumoral mediados por microvesículasEn el caso de la enfermedad neoplásica, las MV podrían actuar como vehículo de transmisión de oncogenes mutados, es decir, actuar como oncosomas, confiriendo a células no mutadas la capacidad de transformarse en células mutadas para un determinado oncogén y, por lo tanto, con mayor agresividad tumoral o resistencia al tratamiento. En gliomas se ha comprobado que los clones tumorales más agresivos, que expresan un EGFRvIII truncado, estimulan la liberación de MV que, a su vez, portan dicha proteína, transfiriendo así dicha molécula a clones tumorales menos agresivos. Cuando se aplicaba un paninhibidor de Erb-cinasa, ese efecto disminuía.
Se han descrito MV portadoras de factor tisular (TF), FasL, VEGF y otros mediadores, que propagan así su función en otras células, y de marcadores específicos de la célula tumoral de origen, incluyendo moléculas de adhesión de la célula epitelial (EpCam), HER-2, CCR-6, metaloproteínas extracelulares, VEGF, etc.16–20.
La concentración de MP tumorales parece estar relacionada con la progresión tumoral clínica en algunas neoplasias, como el cáncer de próstata y ovario18,21.
Microvesículas y evasión inmuneExisten datos que apoyan la capacidad de las MV tumorales de interferir en la maduración de los monocitos hacia células dendríticas maduras, limitando así una adecuada y efectiva respuesta inmune. Así, las células dendríticas mal diferenciadas bloquean la actividad de los linfocitos T a través del factor de crecimiento transformante β (TGF- β)22,23.
La interacción de la proteína de membrana Fas, miembro de la familia del factor de necrosis tumoral, con su receptor Fas ligando (FasL), induce la apoptosis celular. Por ello, la liberación de MV portadoras de FasL, en su unión con Fas expresado por la célula inmune T, propiciaría su apoptosisy contribuiría a la evasión inmune24. En el plasma de pacientes con carcinoma de cabeza y cuello25, carcinoma colorrectal26 y melanoma27 se han detectado MV tumorales (CD63+ y CEA+) unidas a FasL y, a su vez, fijadas a linfocitos T CD8+en apoptosis.
Microvesículas, metastatización y angiogénesis tumoralDiversos estudios han mostrado que las MV tumorales, endoteliales y plaquetarias intervienen en la angiogénesis tumoral mediante su capacidad para transportar VEGF, factor de crecimiento de fibroblastos (FGF), citocinas proinflamatorias y proteasas, que contribuían al desarrollo proangiogénico intratumoral28–31. Un mecanismo conocido de interacción de las MV unidas a moléculas proangiogénicas es su unión, a través de la fosfatidilserina, al receptor celular de esta (PSR). Uno de estos PSR es BAI1 (inhibidor tipo I de la angiogénesis cerebral), que destaca por su acción inhibitoria en la angiogénesis32.
Las MV podrían modular, así mismo, la expresión de genes relacionados con la angiogénesis, como los genes para citocinas CXCL5, factor inhibidor de la migración de macrófagos, y genes para receptores de VEGF, como el VEGFR-233.
En modelos murinos, se ha descrito una cuádruple vía de activación de células endoteliales: las MP circulantes activarían el factor de transcripción NFκβ a través de la vía PARP; las MPE (micropartículas endoteliales) transportadoras de miARN-126, activarían, a través de este, el CXCL12/CXCL4, estimulando así las células endoteliales; las MPP (micropartículas plaquetarias) activarían las células endoteliales a través de lípidos de membrana; y, por último, las MP linfocitarias, bien liberadas tras la activación o bien tras la apoptosis, podrían transportar VEGF y óxido nítrico activador de la célula endotelial34.
Las MPE podrían influir en la regeneración endotelial por 2vías: interactuando directamente con la célula endotelial y promoviendo la regeneración vascular, o bien a través de la activación de los progenitores endoteliales35.
Las MPE también pueden portar metaloproteinasas activas, desempeñando por ello un papel en el remodelamiento tisular, angiogénesis y expansión tumoral28.
Los datos clínicos sobre la correlación de las MPE con la evolución o el pronóstico de determinadas enfermedades son todavía limitados. En enfermedades no neoplásicas en cuya fisiopatología se produce un deterioro endotelial, como en la esclerosis múltiple y la disfunción eréctil, se ha correlacionado su evolución o grado de afectación clínica con los niveles de MPE plasmáticas, lo que permite plantear el uso de los niveles de MPE como marcador de respuesta a las terapias para estas enfermedades36–38.
Resistencia a los tratamientos antitumoralesLos exosomas de cáncer de mama y colorrectal muestran anfirregulina en su superficie, que junto con HER1/EGFR en las células tumorales puede aumentar su invasividad39. En el mismo estudio, se observó que la anfirregulina unida a exosomas era 5veces más eficiente en el aumento de la invasividad tumoral en comparación con la misma concentración de anfirregulina recombinante soluble.
Un efecto protumoral importante de los exosomas derivados de las células tumorales es su mediación en la resistencia a los agentes de inmunoterapia. El anticuerpo humanizado monoclonal Herceptin® (trastuzumab; Genentech Inc., San Francisco, CA, EE. UU.), que se une al dominio extracelular de HER2, es el estándar de tratamiento para los cánceres de mama con amplificación de HER2. La proteína HER2 está representada en las superficies de los exosomas de cáncer de mama y se ha demostrado que se unen y son capaces de secuestrar el anticuerpo monoclonal Herceptin®, facilitando de ese modo la proliferación celular tumoral continua40. La secreción de exosomas ricos en HER2 en cáncer de mama con sobreexpresión de HER2 podría ser un factor que contribuyera al desarrollo de resistencia a los tratamientos anti-HER2 en el cáncer de mama41.
Estudios clínicos de microvesículas circulantes como biomarcadores en cáncer de mamaEn general, en varios estudios existe una correlación directa entre la carga tumoral o estadio tumoral en cáncer de mama42,43, los eventos trombóticos en cáncer,la mortalidad por cáncer44 y la concentración de MV plasmáticas. Por el contrario, existe una reducción en los niveles de MV cuando disminuye la carga tumoral, un fenómeno observado en el caso de los glioblastomas multiformes y cáncer de páncreas tras ser resecados45,46.
En el caso del cáncer de mama, no se dispone de estudios de asociación directa entre niveles de MV y asociación pronóstica. La relación entre los niveles de MV y la carga tumoral y su reducción tras el tratamiento tampoco ha sido demostrada hasta ahora, solo se ha hallado diferencia entre pacientes y controles10,47.
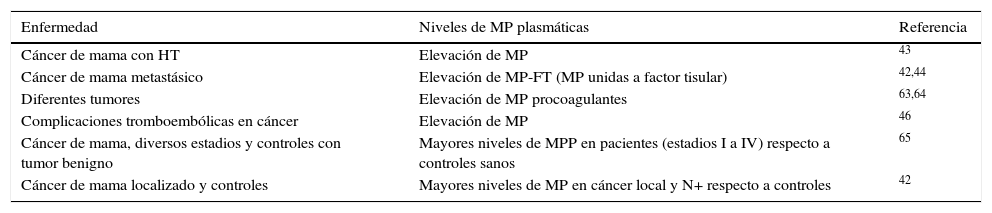
En la tabla 1 se recogen los diversos estudios realizados en cáncer de mama y el comportamiento descrito de las MV48.
Relación de enfermedad tumoral por cáncer de mama y comportamiento de las microvesículas
| Enfermedad | Niveles de MP plasmáticas | Referencia |
|---|---|---|
| Cáncer de mama con HT | Elevación de MP | 43 |
| Cáncer de mama metastásico | Elevación de MP-FT (MP unidas a factor tisular) | 42,44 |
| Diferentes tumores | Elevación de MP procoagulantes | 63,64 |
| Complicaciones tromboembólicas en cáncer | Elevación de MP | 46 |
| Cáncer de mama, diversos estadios y controles con tumor benigno | Mayores niveles de MPP en pacientes (estadios I a IV) respecto a controles sanos | 65 |
| Cáncer de mama localizado y controles | Mayores niveles de MP en cáncer local y N+ respecto a controles | 42 |
MP: micropartículas; MP-FT: micropartículas de factor tisular; MPP: micropartículas plaquetarias.
Los exosomas portadores de miARN tienen mayor capacidad de incorporación a la célula tumoral o a su ambiente circundante que el miARN libre. En un estudio llevado a cabo en pacientes con cáncer de mama en neoadyuvancia, tratadas con epirrubicina y paclitaxel, se determinó la expresión plasmática de miR-503 (un inhibidor de las ciclinas D2 y D3, que participan en la proliferación tumoral), y se hallaron mayores niveles tras el tratamiento, con relación a la liberación de exosomas endoteliales portadoras de miARN-503 por efecto del tratamiento quimioterápico49. Estos hallazgos establecen una relación entre los efectos de la quimioterapia en el endotelio vascular y su influencia en el desarrollo tumoral. También es relevante el estudio de Eichelser con 168 pacientes con cáncer de mama, en el que, en el plasma de las pacientes con tumores triple negativo, los niveles de exosomas con miR-373 eran superiores respecto al resto de subtipos moleculares, lo que apoya su implicación en la expresión de fenotipos más agresivos50.
En el reciente estudio de Hoshino et al., en modelo murino y en líneas celulares tumorales humanas de cáncer de mama, se muestra la afinidad por el lugar de metastatización en función de la integrina que expresen los exosomas tumorales51.
En el estudio de Menck52, los niveles de MV portadoras de EMMPRIN (metaloproteinasa de matriz inducida asociada a mal pronóstico tumoral53) hiperglicosilada eran mayores en el plasma de pacientes con cáncer de mama metastásico respecto a plasma de controles sanos, e in vitro estas MV inducían una mayor invasividad en las líneas celulares de cáncer de mama. Por el contrario, con la deglicosilación de EMMPRIN, la invasividad de las células disminuía.
La posible implicación clínica de estos datos está siendo ya valorada en ensayos clínicos como el NCT01344109, en el que participan pacientes con cáncer de mama en neoadyuvancia y donde se hacen determinaciones de exosomas basales, mensuales durante el tratamiento quimioterápico y tras la resección quirúrgica del tumor residual. Su objetivo principal es correlacionar los niveles de exosomas con la respuesta tumoral (https://clinicaltrials.gov).
Microvesículas y trombosis en pacientes con cáncer de mamaEl factor tisular (FT) también es portado por las MV, que representan la fracción mayoritaria del FT plasmático. Está sobreexpresado en el tumor y en las células sanas circundantes en las neoplasias de mama humana54, mientras que sus niveles son menores en controles sanos.
Existe una correlación entre la concentración de MP-FT y los eventos trombóticos en pacientes con cáncer que ha sido particularmente estudiada en pacientes con cáncer de mama, colon y páncreas44 y en pacientes tratados con quimioterapia55.
En estudios realizados en pacientes con cáncer de mama o páncreas avanzado, los niveles de MP-FT plasmáticos elevados se asocian a una menor supervivencia y a mayor número de eventos trombóticos44. En cuanto a los cambios relacionados con el tratamiento, también en cáncer de mama Marijke et al., con plasma de 40 pacientes tratadas con hormonoterapia, tanto en adyuvancia como en enfermedad metastásica, detectaron una elevación en los niveles de MP-FT, respecto a controles sanos. A su vez, al valorar la actividad procoagulante de estas pacientes a través del test de generación de trombina, esta actividad era mayor en las pacientes respecto a los controles, sin diferencias entre pacientes con enfermedad avanzada o en adyuvancia43.
Existen 2ensayos clínicos en marcha en los que se evalúan las MP y su asociación con eventos trombóticos en pacientes con cáncer: el estudio MICA (NCT02095925) en pacientes con estadio III-IV de cáncer tratados con quimioterapia y con alto riesgo de trombosis según la escala de Khorana, a los que se les determinan niveles de MP-FT y se relaciona con el evento trombótico; y el estudio NCT01299038: pacientes con cáncer de mama metastásico con hormonoterapia y tratadas con rosuvastatin, en las que se analiza el descenso en los niveles plasmáticos de MP-FT (https://clinicaltrials.gov).
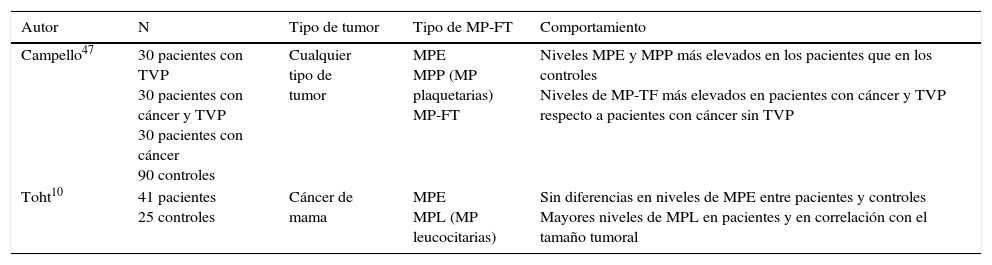
Estudios clínicos de micropartículas endoteliales en cáncer de mamaEn el caso de la enfermedad neoplásica, y en particular del cáncer de mama, los datos son muy limitados. No existen estudios de correlación entre la respuesta al tratamiento y los niveles de MPE en la enfermedad tumoral, aunque sí existe relación entre enfermedad tumoral y mayores niveles de MPE (tabla 2) donde, en general, los niveles de MPE están más elevados en pacientes respecto a controles sanos y sus niveles están más elevados a medida que aumenta la carga tumoral.
Estudios clínicos de micropartículas endoteliales en cáncer de mama
| Autor | N | Tipo de tumor | Tipo de MP-FT | Comportamiento |
|---|---|---|---|---|
| Campello47 | 30 pacientes con TVP 30 pacientes con cáncer y TVP 30 pacientes con cáncer 90 controles | Cualquier tipo de tumor | MPE MPP (MP plaquetarias) MP-FT | Niveles MPE y MPP más elevados en los pacientes que en los controles Niveles de MP-TF más elevados en pacientes con cáncer y TVP respecto a pacientes con cáncer sin TVP |
| Toht10 | 41 pacientes 25 controles | Cáncer de mama | MPE MPL (MP leucocitarias) | Sin diferencias en niveles de MPE entre pacientes y controles Mayores niveles de MPL en pacientes y en correlación con el tamaño tumoral |
MP-FT: micropartículas de factor tisular; MPE: micropartículas endoteliales; MPP: micropartículas plaquetarias; TVP: tromboembolia venosa.
Datos preliminares de nuestro grupo apuntan a que los niveles de MPE podrían ser útiles como marcadores de respuesta al tratamiento, en tanto que la disminución de sus niveles tras el efecto del tratamiento antitumoral se relaciona con la respuesta tumoral objetiva.
Potencial terapéutico de las microvesículasUna estrategia de tratamiento del cáncer prometedora implica la hemofiltración extracorpórea de factores inmunosupresores que incluyen exosomas de la circulación. En el estudio pionero de Lentz, se utilizó ultraaféresis continua de sangre entera para eliminar las proteínas de bajo peso molecular (<120, 000Da) de la sangre de 16 pacientes con cáncer, de los cuales 6 presentaron una reducción de al menos un 50% en el tamaño de los tumores56. La base biológica para estos tratamientos es similar a la terapia de inmunoadsorción de proteínas plasmáticas, realizada con el dispositivo Prosorba Column, y aprobado por la FDA para pacientes con artritis reumatoide o PTI como complemento al tratamiento inmunosupresor. De hecho, en un estudio que examina la eficacia de la columna Prosorba en el cáncer, hubo una reducción medible en la carga del tumor en 22 de 104 pacientes57. Sin embargo, en un ensayo de fase II en cáncer de mama metastásico tratados mediante Prosorba, este no confirió beneficios clínicos58.
Otra compañía, Aethlon Medical, ha ideado un enfoque terapéutico basado en hemofiltración, denominado Aethlon ADAPTTM (plataforma tecnológica de diálisis con afinidad adaptada). La sangre del paciente pasa a través del dispositivo y los componentes del plasma con tamaño<200nm (exosomas y viriones) interactúan y se adsorben selectivamente en los poros de la membrana, mientras que las células de la sangre y los componentes del suero no unido pasan59. Hipotéticamente, de manera similar podría utilizarse para el reconocimiento de proteínas tumorales específicas en la superficie de los exosomas con el fin de capturar exosomas tumorales sin afectar exosomas producidos por las células no malignas. Por ejemplo, en el cáncer de mama con sobreexpresión de HER2, mediante dicha hemofiltración, podrían eliminarse exosomas portadores de HER2, así como HER2 soluble escindido por proteólisis de la superficie celular tumoral, el cual participa en la resistencia a la terapia anti-HER2 (trastuzumab)60.
De la otra forma, se trata de aislar exosomas o MP y unirlas a complejos inmunes o antiangiogénicos capaces de tener una actividad antitumoral en la reinyección al tumor, terapia conocida como «ExoDrug»61,62.
ConclusionesEl conocimiento de las MV en el cáncer de mama es un campo en desarrollo, que nos puede aportar datos no solo de la biología tumoral, sino que quizá pueda tener también valor como potenciales marcadores pronósticos y predictivos de respuesta a los tratamientos antitumorales.
Dado su papel de «vectores biológicos intercelulares», exosomas o MP podrían ser usados como vehículo de transporte para dirigir de forma selectiva microARN o moléculas capaces de modificar el comportamiento tumoral, con un enfoque terapéutico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.