Determinar la implicación de la biopsia selectiva de ganglio centinela (BSGC) a nivel de la cadena mamaria interna (CMI) en la radioterapia (RT) adyuvante cuando no se realiza BSGC a nivel axilar en pacientes con cáncer de mama.
Pacientes y métodosSe realizó un estudio analítico retrospectivo seleccionando pacientes con cáncer de mama en estadios precoces diagnosticado entre enero de 2008 y diciembre de 2016. Se incluyeron únicamente aquellas pacientes con indicación de BSGC y migración exclusiva del radiotrazador a CMI. Se recogieron las características clínicas de las pacientes y anatomopatológicas del tumor, el tratamiento quirúrgico, el tratamiento adyuvante, la recurrencia locorregional y la supervivencia global.
ResultadosSe diagnosticaron un total de 2.622 carcinomas infiltrantes de mama. Se documentó drenaje exclusivo a CMI en 23 pacientes (2,2%). En el 65,2% (15/23) se localizó el ganglio centinela en CMI y se extrajeron una media de 1,61 ganglios. Se administró RT adyuvante sobre CMI en el 75% de las pacientes que recibieron RT sobre cadenas ganglionares. Se administró quimioterapia en el 52,2% (12/23) y hormonoterapia en el 87% (20/23) de las pacientes. Se encontró asociación estadísticamente significativa entre la localización del ganglio centinela y la RT sobre la CMI (p<0,003) y también entre el resultado del ganglio centinela y la RT a este nivel (p<0,006). Una de las pacientes presentó una recidiva mamaria y otra tuvo metástasis óseas. La mediana de seguimiento fue de 60 meses. No se notificó ningún fallecimiento.
ConclusionesTanto el éxito en la localización del ganglio como el resultado de la biopsia en CMI modifican de manera significativa la RT a este nivel.
To determine the role of internal mammary sentinel lymph node (IM-SLN) biopsy in adjuvant radiotherapy in female patients with early-stage breast cancer when axillary lymph node biopsy is not performed.
Patients and methodsRetrospective cohort study of female patients with early-stage breast cancer diagnosed between January 2008 and December 2016. Only patients with an indication for SLN biopsy and migration of the radiotracer into the internal mammary nodes were included. Data were recorded and analysed on the patients’ clinical features, tumour histology, surgical treatment, adjuvant treatment, locoregional recurrence and overall survival.
ResultsA total of 2,622 invasive breast carcinomas were diagnosed. Twenty-three (2.2%) patients had exclusive drainage to the internal mammary nodes. IM-SLN was detected in 65.2% (15/23) of patients, with a mean of 1.61 nodes harvested per patient. Seventy-five per cent of patients receiving adjuvant radiation therapy received it on the internal mammary chain. Chemotherapy and endocrine therapy were administered to 52.2% (12/23) and 87% (20/23) of patients, respectively. A statistically significant association was found between IM-SLN identification and radiotherapy to the internal mammary chain (P<.003), as well as between IM-SLN involvement and radiotherapy to the internal mammary chain (P<.006). One patient developed breast cancer recurrence and another patient developed bone metastases. The median follow-up was 60 months. No deaths were reported.
ConclusionsBoth IM-SLN identification and involvement modify the rate of radiotherapy to the internal mammary chain in patients with early-stage breast cancer.
La invasión de los ganglios linfáticos es el factor pronóstico más importante en el cáncer de mama1. Conocer el grado de invasión de los mismos determinará, no solo el pronóstico, sino también las terapias adyuvantes que recibirán las pacientes.
Para conocer el estado ganglionar, desde los años 90 se ha establecido la biopsia selectiva de ganglio centinela (BSGC) como técnica de primera elección, reservando la linfadenectomía axilar a determinados casos con invasión ganglionar demostrada en el estudio histológico2,3. La localización más frecuente de los ganglios centinela en el cáncer de mama es la axila, seguida de la cadena mamaria interna (CMI)4, pero la realización de la BSGC en la CMI resulta una técnica controvertida. En los casos con drenaje del trazador tanto a axila como a CMI, la mayoría de los centros se decantan por realizar únicamente el estudio a nivel axilar, con el consecuente riesgo de infraestadificación que ello conlleva5. El problema se presenta cuando el único territorio de migración es la CMI.
El objetivo principal de este estudio es determinar la implicación de la BSGC en la CMI en la radioterapia (RT) adyuvante en pacientes con cáncer de mama en estadios precoces sin sospecha de afectación a nivel axilar. Secundariamente, se recogen las complicaciones derivadas de la técnica, la recurrencia locorregional y la supervivencia global en estas pacientes.
Pacientes y métodosEstudio retrospectivo de cohortes llevado a cabo en un hospital universitario de nivel terciario de Madrid, España. Se incluyeron pacientes mayores de 18 años con cáncer de mama en estadio precoz diagnosticadas entre enero de 2008 y diciembre de 2016 y candidatas a la realización de BSGC con migración del radiotrazador a la CMI, de manera exclusiva, en la linfogammagrafía preoperatoria, realizada el día previo a la intervención y utilizando nanocoloides de albúmina marcados con tecnecio (99mTc) administrados a nivel intratumoral o peritumoral. Se excluyeron todas aquellas pacientes con migración del radiotrazador a territorio axilar, pacientes con cáncer de mama bilateral, pacientes gestantes y pacientes sin indicación de BSGC.
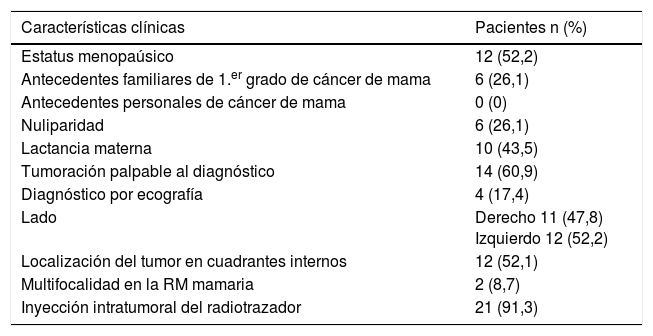
Se recogieron los datos clínicos de las pacientes incluidas en el estudio: edad, antecedentes familiares y personales de cáncer de mama, paridad, lactancia materna, estatus menopáusico, síntoma primario, lado y localización del tumor, caracterización en las pruebas de imagen y la técnica de inyección del radiotrazador. También se recogieron las características anatomopatológicas del tumor: tipo y grado histológicos, subtipo molecular según la clasificación de St. Gallen6, tamaño tumoral (T) y estadio (FIGO). Por último, se recogieron los datos correspondientes al tratamiento quirúrgico, al tratamiento adyuvante administrado en función del resultado de la BSGC y los datos relacionados con la recurrencia locorregional y la supervivencia global. Todos los datos descritos se recogen en las tablas 1 y 2.
Características clínicas de las pacientes incluidas en el estudio
| Características clínicas | Pacientes n (%) |
|---|---|
| Estatus menopaúsico | 12 (52,2) |
| Antecedentes familiares de 1.er grado de cáncer de mama | 6 (26,1) |
| Antecedentes personales de cáncer de mama | 0 (0) |
| Nuliparidad | 6 (26,1) |
| Lactancia materna | 10 (43,5) |
| Tumoración palpable al diagnóstico | 14 (60,9) |
| Diagnóstico por ecografía | 4 (17,4) |
| Lado | Derecho 11 (47,8) Izquierdo 12 (52,2) |
| Localización del tumor en cuadrantes internos | 12 (52,1) |
| Multifocalidad en la RM mamaria | 2 (8,7) |
| Inyección intratumoral del radiotrazador | 21 (91,3) |
Datos anatomopatológicos del tumor
| Características anatomopatológicas | n (%) |
|---|---|
| Tipo histológico | |
| Ductal infiltrante | 18 (78,3) |
| Lobulillar infiltrante | 3 (13) |
| Mucinoso | 1 (4,3) |
| Metaplásico | 1 (4,3) |
| Grado histológico | |
| G1 | 3 (13) |
| G2 | 17 (73,9) |
| G3 | 3 (13) |
| Subtipo molecular | |
| Luminal A | 14 (60,9) |
| Luminal B | 4 (17,4) |
| Luminal B HER2+ | 3 (13) |
| Basal like | 2 (8,7) |
| Tamaño tumoral (T) | |
| T1b | 4 (13) |
| T1c | 15 (60,9) |
| T2 | 3 (21,7) |
| T4a | 1 (4,3) |
| Estadio (FIGO) | |
| IA | 19 (82,6) |
| IIA | 2 (8,7) |
| IIB | 1 (4,3) |
| IV | 1 (4,3) |
Para la detección intraoperatoria del ganglio centinela (GC) se empleó la gammasonda con cabezal de 10mm del sistema Europrobe®.
Los datos fueron recogidos y analizados mediante el paquete estadístico SPSS®. Para el análisis de las variables categóricas se utilizaron test no paramétricos. Se estableció como significativa una p<0,05.
ResultadosDurante el período de tiempo estudiado se diagnosticaron un total de 2.622 carcinomas infiltrantes de mama y en 1.051 pacientes (40,1%) se realizó BSGC. En la linfogammagrafía preoperatoria se documentó drenaje exclusivo a CMI en 23 pacientes (2,2%).
La edad media de las pacientes al diagnóstico fue de 55,4 años (36-83); el 52,2% (12/23) eran posmenopáusicas. El 52,1% (12/23) de los tumores se localizaron en cuadrantes internos y el 78,3% (18/23) correspondían a carcinomas ductales infiltrantes. El subtipo luminal A fue el más frecuente (60,9%, 14/23). El radiotrazador se inyectó a nivel intratumoral en el 91,3% de las pacientes (21/23).
En el 86,9% (20/23) de casos se realizó cirugía conservadora sobre la mama y BSGC exclusivamente en el 69,5% (16/23), sin muestreo ganglionar ni linfadenectomía axilar. En el 65,2% (15/23) se localizó el GC en CMI y se remitió para estudio anatomopatológico; en una de las pacientes se localizó, pero no se pudo obtener por situarse a nivel retrocostal. Se obtuvo una media de 1,61 ganglios (1-6). El resultado tras el estudio histológico resultó negativo en el 80% (12/15). Los resultados de la BSGC en CMI se resumen en la tabla 3.
En las pacientes en las que no se realizó BSGC en CMI, bien porque no se localizó en quirófano, o bien porque se decidió no llevarla a cabo, se optó por linfadenectomía axilar (establecida en nuestra base de datos como obtención de 6 ganglios o más) en el 71,4% (5/7) y por muestreo axilar (al obtener menos de 6 ganglios) en el 28,6% (2/7). La media de ganglios obtenidos fue de 7,86 (4-11), con una media de 0,0 afectos. En las pacientes en las que se realizó la BSGC en CMI no se registró ninguna complicación. Dos pacientes (28,6%) en las que se llevó a cabo cirugía sobre la axila se complicaron con un seroma posquirúrgico, pero ninguna de ellas requirió reintervención.
Se administró RT adyuvante sobre la mama en el 86,9% (20/23), es decir, en todas las pacientes en las que se llevó a cabo una cirugía conservadora. Se administró además RT sobre cadenas ganglionares en el 17,3% (4/23). Entre las pacientes que recibieron RT sobre cadenas ganglionares además de la mama, recibieron RT sobre la CMI el 75% (3/4), una de ellas por resultado positivo para metástasis ganglionar en CMI, otras 2 pacientes por metástasis ganglionar a nivel axilar sin estudio de CMI y la paciente restante por las características del tumor primario (T4a). Se administró quimioterapia (QT) adyuvante en el 52,2% (12/23) y hormonoterapia en el 87% (20/23).
Se encontró asociación estadísticamente significativa entre la localización del GC y la RT sobre la CMI (p=0,003) y también entre el resultado del GC y la RT a este nivel (p=0,006).
Una de las pacientes presentó una recidiva mamaria (4,3%) y otra tuvo metástasis óseas. La mediana de seguimiento fue de 60 meses. No se notificó ningún fallecimiento durante el período de estudio.
DiscusiónLa CMI es el segundo territorio más frecuente de afectación linfática, por detrás de la axila4, e incluso puede ser el único territorio ganglionar implicado, lo que obliga a establecer el estado de invasión ganglionar por medio del estudio de esta región. Como se ha mencionado antes, es un tema controvertido. A nivel nacional, el consenso sobre la biopsia selectiva de ganglio centinela de la Sociedad Española de Senología y Patología Mamaria recomienda la realización de la BSGC a este nivel siempre y cuando sea factible7.
La localización del tumor a nivel profundo y medial en la mama se asocia a migración del radiotrazador a la CMI8-10 y así lo vemos en los resultados, donde la localización del GC exclusivamente en la CMI se asocia a tumores situados en los cuadrantes mediales de la mama. También comprobamos que la inyección intratumoral del radiotrazador suele obtener migraciones a CMI con mayor frecuencia que las inyecciones superficiales11.
Nuestra tasa de detección del GC en CMI fue similar a la de la literatura12,13. Esta técnica es factible y accesible en manos expertas, sin alargar excesivamente el tiempo quirúrgico4,14,15.
En los casos en los que no se realizó BSGC en CMI, se llevó a cabo muestreo ganglionar o linfadenectomía a nivel axilar para poder establecer el estado de invasión ganglionar, y siempre tras comprobar que no existía captación con la gammasonda a este nivel. Un estudio similar al nuestro destaca la importancia de descartar metástasis a este nivel, pero concluye que la linfadenectomía resulta también una decisión controvertida16. En una reciente revisión de la Cochrane acerca del tratamiento sobre la axila, en pacientes con cáncer de mama en estadios precoces, se establece que la linfadenectomía axilar ya no es una técnica quirúrgica aceptable en una axila clínica y radiológicamente negativa. En aquellos casos en los que no sea posible realizar la BSGC, se acepta el muestreo ganglionar axilar ya que la efectividad en cuanto a supervivencia global es similar a la linfadenectomía, con unas tasas menores de linfedema, aunque no determina su papel en las recurrencias locorregionales ni en la metástasis a distancia17. En estos casos en los que no se realizó la BSGC en CMI, a pesar de que se proponga seguimiento en algunos estudios y se discuta la utilidad de la linfadenectomía axilar18, en nuestro caso se optó por realizar estudio a nivel axilar porque así se recogía hasta 2017 en los protocolos del centro.
El porcentaje de metástasis en CMI en nuestro estudio también es similar al de la literatura. Tan et al. sostienen que el porcentaje de pacientes con metástasis en CMI es pequeño (en torno al 9%) y que este dato no implica de manera significativa una modificación en el tratamiento adyuvante planeado12. Dada la probabilidad de complicaciones graves, como neumotórax, y su escasa implicación en la decisión de la administración de tratamiento adyuvante, no recomiendan la BSGC en CMI. De la misma manera concluyen Postma et al.19, a pesar de reconocer que las metástasis a nivel de la CMI empeoran el pronóstico. Domènech et al.20 publicaron en 2009 un estudio similar al nuestro, en el que el 100% (5/5) de las pacientes modificaban el estadio de su tumor tras la BSGC de CMI, pero únicamente en el 40% (2/5) se modificaba el criterio de administrar QT adyuvante. Puesto que la QT adyuvante ha demostrado beneficio en pacientes con cáncer de mama e indicación de recibir dicho tratamiento, la realización de la BSGC en CMI estaría aconsejada en pacientes sin criterios de QT por las características del tumor, que pueden terminar recibiéndola si se hallan metástasis ganglionares9,21.
Puesto que el control locorregional del tumor reduce la mortalidad, el tratamiento de los territorios ganglionares afectos mejorará la supervivencia10. Los ensayos clínicos aleatorizados MA.2022, el EORTC2292-10925 y, más recientemente, el DBCG-IMN22,23 sugieren que la RT aplicada sobre los ganglios del nivel III axilar, del nivel supraclavicular y de la CMI aumenta la supervivencia libre de enfermedad, la supervivencia libre de metástasis y la supervivencia global21, pero si no se dispone de datos sobre invasión ganglionar a nivel de la CMI, no se puede saber qué pacientes se estarán sobretratando. Con la introducción de nuevas unidades de tratamiento y nuevas modalidades de RT, como son la RT de intensidad modulada y los sistemas de control respiratorio durante la irradiación, como son el gating o la irradiación en inspiración profunda (breath hold irradiation)24, los efectos derivados de la radiación en la región paraesternal han disminuido, pero no se deben infraestimar; por ello, parece importante confirmar histológicamente la afectación de los ganglios a este nivel1,25.
En conclusión, la CMI puede ser el único territorio ganglionar implicado en la BSGC y, a la vista de los resultados, podría obviarse el estudio ganglionar a nivel axilar cuando no hay sospecha clínica ni radiológica de afectación. Si bien es cierto que la casuística de los estudios publicados es pequeña, tanto el éxito en la localización del GC como el resultado de la biopsia en CMI modifican de manera significativa la indicación de RT a este nivel, por lo que su búsqueda y realización no debería ser obviada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.