Determinar la prevalencia mutacional en BRCA1 y 2 de mujeres afectas por cáncer de mama/ovario en el área de Ciudad Real y describir las características clinicopatológicas de dichas neoplasias.
Pacientes y métodosEstudio descriptivo. Se evaluaron 111 pacientes de familias de alto riesgo y se analizaron los antecedentes oncológicos, familiares y las mutaciones halladas en BRCA1 y 2.
ResultadosLa prevalencia de mutaciones patogénicas en BRCA fue del 21,6% (16 en BRCA2 y 8 en BRCA1). En las portadoras de mutaciones en BRCA1 predominó el cáncer de mama: 10 casos (90,9%), tipo ductal infiltrante: 8 (72,7%), estadioII: 6 (54,5%), luminalA: 4 (36,4%), triple negativo: 4 (36,4%) y grado histológico2: 3 (27,3%) y3: 3 (27,3%). Las portadoras de mutaciones en BRCA2 desarrollaron cáncer de mama en 16 casos (80%), tipo ductal infiltrante: 11 (55%), estadioII: 11 (55%), luminalA: 10 (50%) y grado histológico2: 5 (25%).
ConclusionesEn nuestro análisis, la prevalencia de mutaciones en BRCA2 fue superior a la registrada en BRCA1, en correspondencia con algunos estudios previos nacionales. Las características clinicopatológicas de los cánceres de mama/ovario en las portadoras de estas mutaciones fueron similares al perfil descrito en la literatura.
To determine the mutational prevalence in BRCA1 and 2 among women with breast/ovarian cancer in Ciudad Real and to describe the clinical-pathological characteristics of these neoplasms.
Patients and methodsDescriptive study. A total of 111 patients from high-risk families were evaluated and the oncological history, family history, and BRCA1 and 2 mutations found were analysed.
ResultsThe prevalence of pathogenic mutations in BRCA was 21.6% (16 in BRCA2 and 8 in BRCA1). In BRCA1 mutations, breast cancer was predominant: 10 cases (90.9%), infiltrating ductal type: 8 (72.7%), stageII: 6 (54.5%), luminalA: 4 (36.4%), triple negative: 4 (36.4%) and histological grade2: 3 (27.3%) and3: 3 (27.3%).
Among BRCA2 mutation carriers, 16 (80%) developed breast cancer: infiltrating ductal type: 11 (55%), stageII: 11 (55%), luminalA: 50% (10) and histological grade2: 5 (25%).
ConclusionsIn our analysis, the prevalence of mutations was higher in BRCA2 than in BRCA1, in agreement with some previous national studies. The clinical-pathological characteristics of breast/ovarian cancer in the carriers of these mutations were similar to the profile described in the literature.
El cáncer de mama (CM) constituye la neoplasia más frecuente descrita en las mujeres a nivel mundial (25%), erigiéndose como la primera causa de muerte por cáncer en este sexo1. En España, en 2012 se diagnosticaron 25.215 nuevos casos de CM, con una mortalidad del 15,5% (6.075 casos)2.
Por otro lado, el cáncer de ovario (CO) es la séptima neoplasia más prevalente en las mujeres (3,6%), con la misma posición en cuanto a mortalidad, a nivel mundial1. En nuestro país constituye el sexto tumor más frecuente en mujeres (3,7%), con 3.236 nuevos casos diagnosticados en 2012 y la sexta causa de muerte por cáncer (4,7%)2.
Aunque la mayor parte de estas neoplasias son esporádicas, del 5 al 10% de los casos de CM y del 10 al 15% de los CO presentan una historia familiar y se engloban dentro del síndrome de cáncer de mama y ovario hereditario3,4. Aproximadamente el 20% de estos casos se asocian a mutaciones germinales en los genes BRCA1 (Breast Cancer susceptibility gene 1, MIM # 113705) y BRCA2 (Breast Cancer susceptibility gene 2, MIM # 600185), aunque estas cifras pueden variar según la población estudiada5. Estos genes actúan como supresores de tumores, y en familias de alto riesgo con un patrón de herencia autosómica dominante fueron identificados en el brazo largo del cromosoma17 (17q21), el gen BRCA1 y el BRCA2, en el cromosoma13 (13q12)3.
Las portadoras de mutaciones en estos genes presentan un riesgo incrementado de CM y CO. Kuchenbaecker et al.6, en un estudio reciente, describieron el riesgo medio acumulado a 80años para portadoras de mutaciones en BRCA1 en un 72% para CM y en un 44% para CO. En BRCA2 el riesgo fue del 69% para CM y del 17% para CO.
Los genes BRCA1 y 2 muestran un patrón mutacional heterogéneo que varía según los diferentes grupos étnicos y áreas geográficas analizadas7. En la base de datos Breast Cancer Information Core (BIC) se han registrado más de 1.800 mutaciones en BRCA1 y más de 2000 en BRCA28.
En general, los CM asociados a mutaciones en BRCA1 son mayoritariamente ductales infiltrantes, de tipo basal (triple negativo), con un alto grado histológico, infiltración linfocitaria y márgenes continuos expansivos. Los CO suelen ser de tipo seroso, de alto grado y bilaterales9. Los CM relacionados con BRCA2 parecen no diferir de los esporádicos3,10,11.
El objetivo principal de nuestro estudio fue determinar la prevalencia de mutaciones en los genes BRCA1 y 2 de mujeres portadoras, afectas por CM/CO, en el área sanitaria de Ciudad Real y Puertollano, pertenecientes a familias de alto riesgo. Como objetivo secundario, planteamos describir las características clinicopatológicas de las neoplasias de mama u ovario en las pacientes portadoras de mutaciones en BRCA1 y 2 analizadas en nuestra área.
Pacientes y métodosRealizamos un estudio transversal, descriptivo, de noviembre de 2010 a diciembre de 2016, donde evaluamos 370 pacientes, pertenecientes a 347 familias de alto riesgo, estudiados en la consulta de consejo genético del Hospital General Universitario de Ciudad Real, provenientes del área sanitaria de Ciudad Real y Puertollano (337.618 habitantes).
La muestra analizada fue de 111 pacientes (111 familias) que cumplían los criterios de inclusión: mujeres con antecedentes personales de CM/CO evaluadas en la consulta, pertenecientes a familias de alto riesgo, en las que se analizaron las mutaciones en los genes BRCA1 y 2.
La realización del estudio fue aprobada por el Comité Ético de Investigación Clínica del Hospital General Universitario de Ciudad Real. Todos los pacientes firmaron el consentimiento informado antes de ser incluidos en el análisis.
El análisis molecular se realizó a partir de muestras obtenidas de sangre periférica de las pacientes en el laboratorio 14 del Centro de Investigación del Cáncer (Universidad de Salamanca-Centro Superior de Investigaciones Científicas) en Salamanca (España).
La muestra fue de 20ml de sangre periférica recogida en un tubo con EDTA. La extracción de ADN se realizó de forma manual siguiendo los procedimientos estándar fenol-cloroformo y la del ARN total utilizando el reactivo TRIzol® reagent (LTC, California, EE.UU.).
Utilizamos tres aproximaciones diferentes para realizar el estudio de las mutaciones germinales en los genes BRCA1 y BRCA2:
- a)
Amplificación mediante PCR de ambos genes y secuenciación directa por el método de Sanger mediante el analizador genético ABI PRISM 3130® utilizando para ello el BigDye Terminators® sequencing kit (ambos, Applied BioSystems, Nueva York, EE.UU.), en las 37 primeras pacientes.
- b)
Sistema de resecuenciación BRCA MASTR® (Multiplicom, Niel, Bélgica) y marcado de cada muestra con oligonucleótidos específicos (Multiplicom, Niel, Bélgica) seguido de pirosecuenciación con 454 Junior (Roche, Basilea, Suiza), en las siguientes 52 mujeres.
- c)
Opción b confirmando las mutaciones patogénicas mediante PCR específica de la zona en la que se localizó la alteración, con posterior secuenciación por el método de Sanger, en las últimas 22 pacientes de la muestra.
La confirmación de la mutación c.442_4357del en BRCA1 se realizó mediante Multiplex Ligation-dependent Probe Amplification (MLPA) con el kit P002-C2 (MRC-Holanda, Ámsterdam, Países Bajos).
Las secuencias de referencia utilizadas para los análisis BRCA1 y BRCA2 fueron GenBank U14680.1 para BRCA1 y GenBank NM_000059.1 para BRCA2 (Base de datos de secuencias genéticas del National Institutes of Health, EEUU. https://www.ncbi.nlm.nih.gov/genbank/). La nomenclatura de mutaciones se describe de acuerdo con la Human Genome Variation Society (HGVS)12.
La recogida de datos se realizó mediante la revisión de las historias clínicas específicas de los sujetos incluidos en el estudio, pertenecientes a la consulta de consejo genético.
Las variables analizadas fueron:
- •
Generalidades: número de familia y edad de evaluación en la consulta de consejo genético.
- •
Antecedentes familiares de CM/CO: número de antecedentes familiares de CM y CO.
- •
Estudio genético: resultado de estudio genético, gen mutado, mutación específica según la nomenclatura de HGVS y BIC.
- •
Antecedentes oncológicos: tipo cáncer, localización, edad diagnóstico, estadio postoperatorio en CM según American Joint Committee on Cancer 201013, estadio postoperatorio en CO según International Federation of Gynecology and Obstetrics14, anatomía patológica, subtipo de CM e inmunofenotipo15, grado histológico.
El análisis estadístico se realizó mediante el programa SPSS® versión 18.0. Se utilizó el test chi-cuadrado o el test exacto de Fisher cuando fue necesario. Un valor de p<0,05 fue considerado como estadísticamente significativo.
ResultadosAnalizamos 111 pacientes con una edad media al diagnóstico de su neoplasia de 40,6±9,2años (intervalo: 23-63años). De ellas, 45 (40,5%) eran premenopáusicas y 25 (22,5%) y 34 (30,6%) posmenopáusicas antes y después de los 45años, respectivamente.
La prevalencia de mujeres con mutaciones en BRCA que observamos fue del 27,9% (31), siendo patogénicas 24 (21,6%) y 7 (6,3%) variantes de significado desconocido.
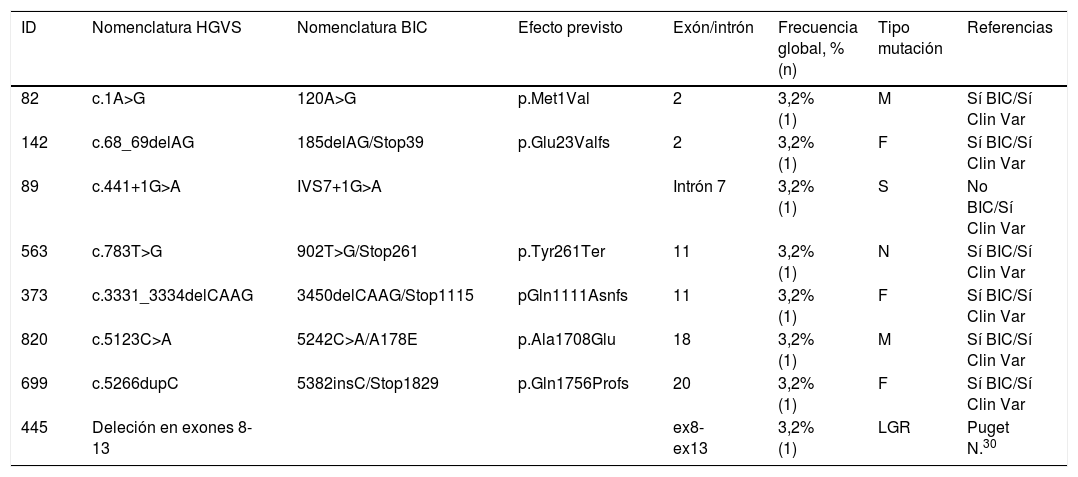
Centrándonos en las mutaciones objetivadas en BRCA1 (tabla 1), cuya prevalencia fue del 9,9% (11), de ellas 8 (72,7%) fueron patogénicas. Los exones afectos con mayor frecuencia fueron el 2 y el 11, en 2 y 3 casos, respectivamente, predominando las mutaciones tipo frameshift (3 casos).
Mutaciones patogénicas identificadas en BRCA1
| ID | Nomenclatura HGVS | Nomenclatura BIC | Efecto previsto | Exón/intrón | Frecuencia global, % (n) | Tipo mutación | Referencias |
|---|---|---|---|---|---|---|---|
| 82 | c.1A>G | 120A>G | p.Met1Val | 2 | 3,2% (1) | M | Sí BIC/Sí Clin Var |
| 142 | c.68_69delAG | 185delAG/Stop39 | p.Glu23Valfs | 2 | 3,2% (1) | F | Sí BIC/Sí Clin Var |
| 89 | c.441+1G>A | IVS7+1G>A | Intrón 7 | 3,2% (1) | S | No BIC/Sí Clin Var | |
| 563 | c.783T>G | 902T>G/Stop261 | p.Tyr261Ter | 11 | 3,2% (1) | N | Sí BIC/Sí Clin Var |
| 373 | c.3331_3334delCAAG | 3450delCAAG/Stop1115 | pGln1111Asnfs | 11 | 3,2% (1) | F | Sí BIC/Sí Clin Var |
| 820 | c.5123C>A | 5242C>A/A178E | p.Ala1708Glu | 18 | 3,2% (1) | M | Sí BIC/Sí Clin Var |
| 699 | c.5266dupC | 5382insC/Stop1829 | p.Gln1756Profs | 20 | 3,2% (1) | F | Sí BIC/Sí Clin Var |
| 445 | Deleción en exones 8-13 | ex8-ex13 | 3,2% (1) | LGR | Puget N.30 |
BIC: breast cancer information core; F: frameshift; HGVS: human genome variation society; ID: identificación; LGR: long genomic rearrangement; N: nonsense; S: splice.
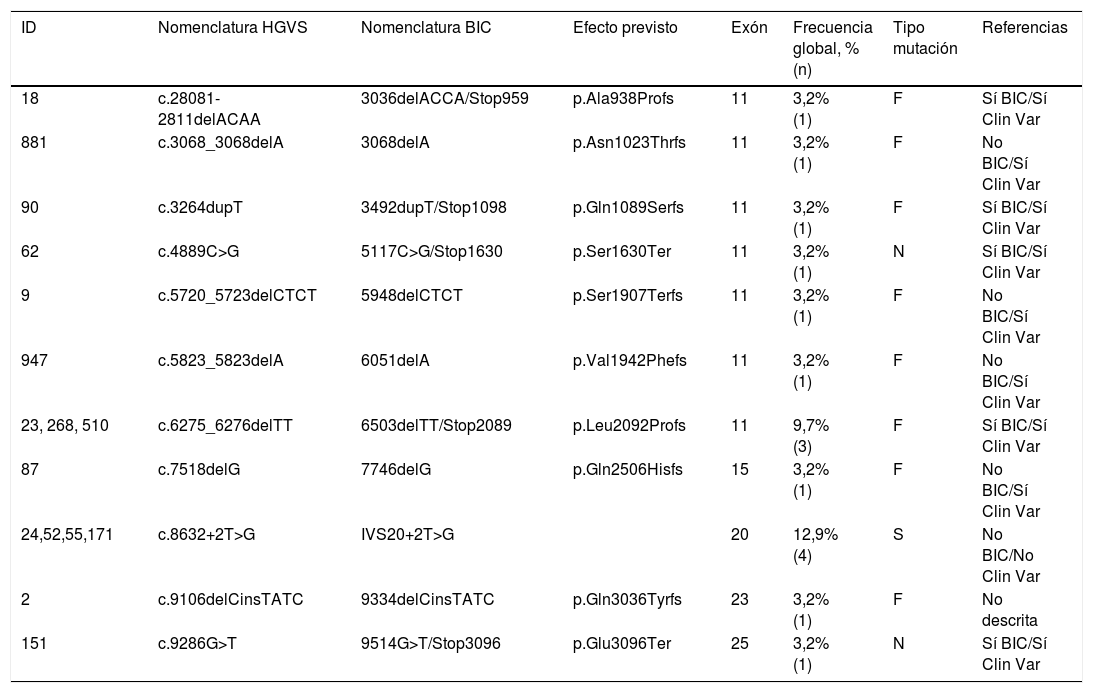
La prevalencia de mutaciones en BRCA2 (tabla 2) fue del 18% (20), en 16 (80%) casos patogénicas. El exón 11 fue el implicado con mayor frecuencia (9 casos), así como el tipo de mutación frameshift (9 casos), la más usualmente registrada. Analizamos 11 mutaciones en 16 mujeres, siendo descrita por primera vez la mutación c.8632+2T>G en el exón 20 y la mutación c.9106delCinsTATC en el exón 23.
Mutaciones patogénicas identificadas en BRCA2
| ID | Nomenclatura HGVS | Nomenclatura BIC | Efecto previsto | Exón | Frecuencia global, % (n) | Tipo mutación | Referencias |
|---|---|---|---|---|---|---|---|
| 18 | c.28081-2811delACAA | 3036delACCA/Stop959 | p.Ala938Profs | 11 | 3,2% (1) | F | Sí BIC/Sí Clin Var |
| 881 | c.3068_3068delA | 3068delA | p.Asn1023Thrfs | 11 | 3,2% (1) | F | No BIC/Sí Clin Var |
| 90 | c.3264dupT | 3492dupT/Stop1098 | p.Gln1089Serfs | 11 | 3,2% (1) | F | Sí BIC/Sí Clin Var |
| 62 | c.4889C>G | 5117C>G/Stop1630 | p.Ser1630Ter | 11 | 3,2% (1) | N | Sí BIC/Sí Clin Var |
| 9 | c.5720_5723delCTCT | 5948delCTCT | p.Ser1907Terfs | 11 | 3,2% (1) | F | No BIC/Sí Clin Var |
| 947 | c.5823_5823delA | 6051delA | p.Val1942Phefs | 11 | 3,2% (1) | F | No BIC/Sí Clin Var |
| 23, 268, 510 | c.6275_6276delTT | 6503delTT/Stop2089 | p.Leu2092Profs | 11 | 9,7% (3) | F | Sí BIC/Sí Clin Var |
| 87 | c.7518delG | 7746delG | p.Gln2506Hisfs | 15 | 3,2% (1) | F | No BIC/Sí Clin Var |
| 24,52,55,171 | c.8632+2T>G | IVS20+2T>G | 20 | 12,9% (4) | S | No BIC/No Clin Var | |
| 2 | c.9106delCinsTATC | 9334delCinsTATC | p.Gln3036Tyrfs | 23 | 3,2% (1) | F | No descrita |
| 151 | c.9286G>T | 9514G>T/Stop3096 | p.Glu3096Ter | 25 | 3,2% (1) | N | Sí BIC/Sí Clin Var |
BIC: breast cancer information core; F: frameshift; HGVS: human genome variation society; ID: identificación; N: nonsense; S: splice.
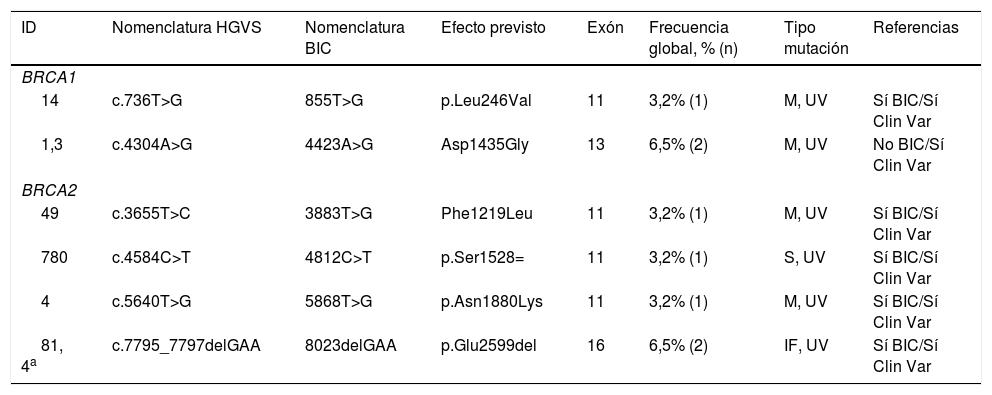
La prevalencia de mujeres con variantes de significado desconocido (tabla 3) fue del 6,3% (7), observando en BRCA1 (dos mutaciones en 3 pacientes, 42,9%) y en BRCA2 (cuatro mutaciones en 4 mujeres, 57,1%). La mayoría se objetivó en el exón 11 (4 casos) y predominó el tipo missense (4 casos).
Variantes de significado desconocido en BRCA1 y 2
| ID | Nomenclatura HGVS | Nomenclatura BIC | Efecto previsto | Exón | Frecuencia global, % (n) | Tipo mutación | Referencias |
|---|---|---|---|---|---|---|---|
| BRCA1 | |||||||
| 14 | c.736T>G | 855T>G | p.Leu246Val | 11 | 3,2% (1) | M, UV | Sí BIC/Sí Clin Var |
| 1,3 | c.4304A>G | 4423A>G | Asp1435Gly | 13 | 6,5% (2) | M, UV | No BIC/Sí Clin Var |
| BRCA2 | |||||||
| 49 | c.3655T>C | 3883T>G | Phe1219Leu | 11 | 3,2% (1) | M, UV | Sí BIC/Sí Clin Var |
| 780 | c.4584C>T | 4812C>T | p.Ser1528= | 11 | 3,2% (1) | S, UV | Sí BIC/Sí Clin Var |
| 4 | c.5640T>G | 5868T>G | p.Asn1880Lys | 11 | 3,2% (1) | M, UV | Sí BIC/Sí Clin Var |
| 81, 4a | c.7795_7797delGAA | 8023delGAA | p.Glu2599del | 16 | 6,5% (2) | IF, UV | Sí BIC/Sí Clin Var |
BIC: breast cancer information core; HGVS: human genome variation society; ID: identificación; IF: in frame; M: missense; S: splice; UV: unclassified variant.
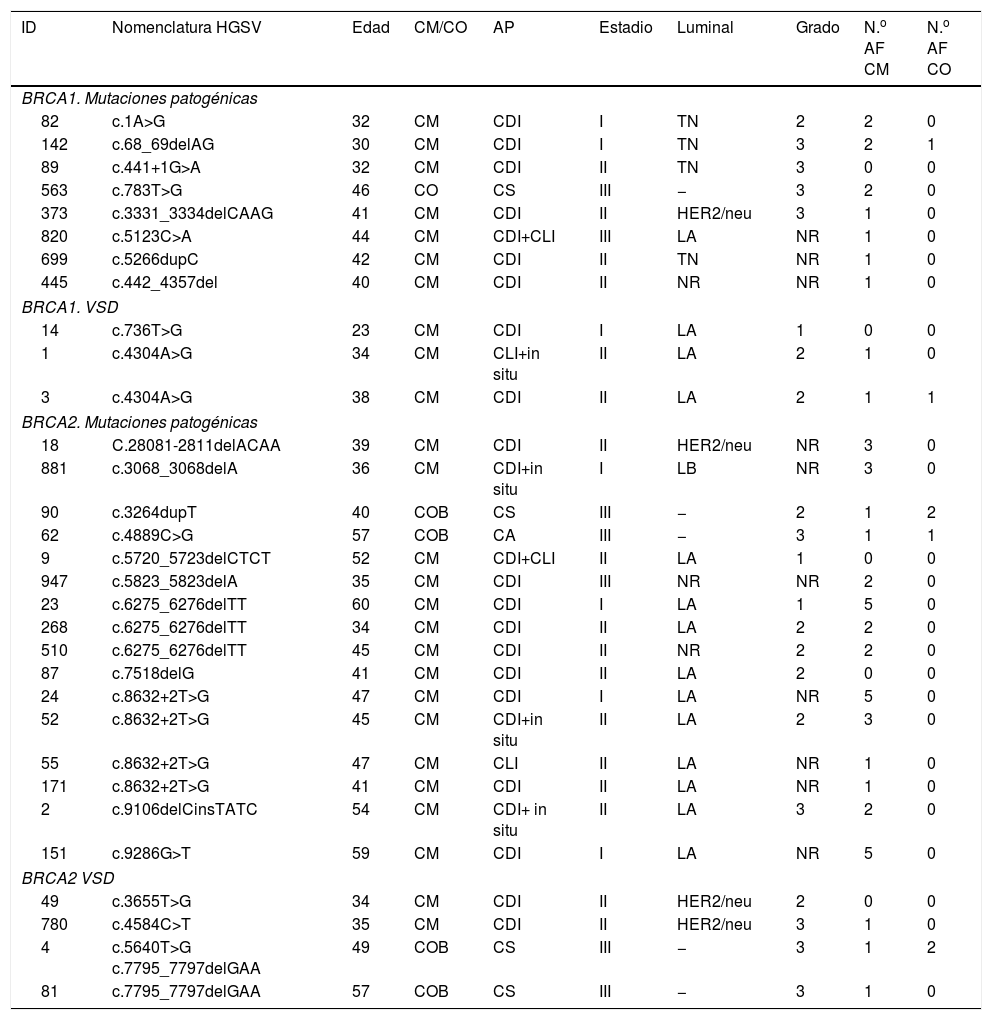
Las pacientes portadoras de mutaciones en BRCA1 (tabla 4) presentaron una edad media al diagnóstico de su neoplasia de 36,6±7años (intervalo: 23-46años). El CM predominó: 10 (90,9%), y únicamente observamos una mujer con CO. En su historia familiar presentaron uno o dos familiares (de primer, segundo o tercer grado), afectos por CM, en 6 (54,5%) y 3 (27,3%) casos, respectivamente. Solo 2 mujeres (18,2%) contaban con antecedentes de CO.
Características clinicopatológicas de los CM/CO en portadoras de mutaciones en BRCA1 y 2
| ID | Nomenclatura HGSV | Edad | CM/CO | AP | Estadio | Luminal | Grado | N.o AF CM | N.o AF CO |
|---|---|---|---|---|---|---|---|---|---|
| BRCA1. Mutaciones patogénicas | |||||||||
| 82 | c.1A>G | 32 | CM | CDI | I | TN | 2 | 2 | 0 |
| 142 | c.68_69delAG | 30 | CM | CDI | I | TN | 3 | 2 | 1 |
| 89 | c.441+1G>A | 32 | CM | CDI | II | TN | 3 | 0 | 0 |
| 563 | c.783T>G | 46 | CO | CS | III | − | 3 | 2 | 0 |
| 373 | c.3331_3334delCAAG | 41 | CM | CDI | II | HER2/neu | 3 | 1 | 0 |
| 820 | c.5123C>A | 44 | CM | CDI+CLI | III | LA | NR | 1 | 0 |
| 699 | c.5266dupC | 42 | CM | CDI | II | TN | NR | 1 | 0 |
| 445 | c.442_4357del | 40 | CM | CDI | II | NR | NR | 1 | 0 |
| BRCA1. VSD | |||||||||
| 14 | c.736T>G | 23 | CM | CDI | I | LA | 1 | 0 | 0 |
| 1 | c.4304A>G | 34 | CM | CLI+in situ | II | LA | 2 | 1 | 0 |
| 3 | c.4304A>G | 38 | CM | CDI | II | LA | 2 | 1 | 1 |
| BRCA2. Mutaciones patogénicas | |||||||||
| 18 | C.28081-2811delACAA | 39 | CM | CDI | II | HER2/neu | NR | 3 | 0 |
| 881 | c.3068_3068delA | 36 | CM | CDI+in situ | I | LB | NR | 3 | 0 |
| 90 | c.3264dupT | 40 | COB | CS | III | − | 2 | 1 | 2 |
| 62 | c.4889C>G | 57 | COB | CA | III | − | 3 | 1 | 1 |
| 9 | c.5720_5723delCTCT | 52 | CM | CDI+CLI | II | LA | 1 | 0 | 0 |
| 947 | c.5823_5823delA | 35 | CM | CDI | III | NR | NR | 2 | 0 |
| 23 | c.6275_6276delTT | 60 | CM | CDI | I | LA | 1 | 5 | 0 |
| 268 | c.6275_6276delTT | 34 | CM | CDI | II | LA | 2 | 2 | 0 |
| 510 | c.6275_6276delTT | 45 | CM | CDI | II | NR | 2 | 2 | 0 |
| 87 | c.7518delG | 41 | CM | CDI | II | LA | 2 | 0 | 0 |
| 24 | c.8632+2T>G | 47 | CM | CDI | I | LA | NR | 5 | 0 |
| 52 | c.8632+2T>G | 45 | CM | CDI+in situ | II | LA | 2 | 3 | 0 |
| 55 | c.8632+2T>G | 47 | CM | CLI | II | LA | NR | 1 | 0 |
| 171 | c.8632+2T>G | 41 | CM | CDI | II | LA | NR | 1 | 0 |
| 2 | c.9106delCinsTATC | 54 | CM | CDI+ in situ | II | LA | 3 | 2 | 0 |
| 151 | c.9286G>T | 59 | CM | CDI | I | LA | NR | 5 | 0 |
| BRCA2 VSD | |||||||||
| 49 | c.3655T>G | 34 | CM | CDI | II | HER2/neu | 2 | 0 | 0 |
| 780 | c.4584C>T | 35 | CM | CDI | II | HER2/neu | 3 | 1 | 0 |
| 4 | c.5640T>G c.7795_7797delGAA | 49 | COB | CS | III | − | 3 | 1 | 2 |
| 81 | c.7795_7797delGAA | 57 | COB | CS | III | − | 3 | 1 | 0 |
AF: antecedentes familiares; AP: anatomía patológica; CA: carcinosarcoma; CDI: carcinoma ductal infiltrante; CLI: carcinoma lobulillar infiltrante; CM: cáncer de mama; CMB: cáncer de mama bilateral; CO: cáncer de ovario; COB: cáncer de ovario bilateral; CS: cistoadenocarcinoma seroso; HGVS: human genome variation society; ID: identificación; LA: luminalA; LB: luminalB; NR: no registrado; TN: triple negativo; VSD: variante de significado desconocido.
El CM predominante fue el tipo ductal infiltrante: 8 (72,7%), estadioII yI: 6 (54,5%) y 3 (27,3%) casos, respectivamente. El inmunofenotipo más frecuente fue el triple negativo y luminalA, cada uno observado en 4 casos (36,4%). El grado histológico más común fue el 2 y el 3 con 3 casos (27,3%) en ambos grados.
La edad media al diagnóstico de las mujeres portadoras de mutaciones en BRCA2 (tabla 4) fue de 45,3±8,8años (intervalo: 34-60años). En este grupo predominó el CM: 16 (80%), registrando 4 casos (20%) de CO. Las pacientes presentaron uno o dos antecedentes familiares de CM, en 7 (35%) y 4 (20%) casos, respectivamente, y solo presentaron antecedentes de CO las 4 pacientes que desarrollaron esta neoplasia.
El carcinoma ductal infiltrante fue el CM más común: 11 (55%), estadioII: 11 (55%), luminalA: 10 (50%) y grado histológico2: 5 (25%). Los CO fueron todos bilaterales al diagnóstico, estadioIII y tipo cistoadenocarcinoma seroso con grado histológico3 en 3 (75%) de los casos.
Se compararon las características clinicopatológicas de las neoplasias de mama y ovario en las mujeres portadoras de mutaciones en BRCA1 con respecto de BRCA2, sin hallar diferencias estadísticamente significativas.
DiscusiónLa prevalencia de mutaciones en BRCA1 y 2 en familias con síndrome de cáncer de mama y ovario hereditario se ha descrito en diferentes regiones de España, mostrando datos heterogéneos tanto a nivel global como en relación a las mutaciones recurrentes, según el área geográfica analizada16. Esta prevalencia —directamente relacionada con los criterios de selección del estudio, las características demográficas y étnicas de las poblaciones analizadas y las técnicas de detección empleadas17— puede variar en nuestro país del 20-40%18-20. Las mutaciones patogénicas, con un amplio rango registrado, del 5,6-37%21,22, se describen sobre todo en familias con tres o más casos de CM/CO, existiendo una menor prevalencia en familias con solo 2 casos de CM (10-15%) o en pacientes muy jóvenes sin antecedentes familiares (<5%). Asimismo, la existencia de un caso de CO se relaciona con una elevada probabilidad de mutaciones en BRCA, sobre todo BRCA13. Nuestro estudio, el primero desarrollado en el área sanitaria de Ciudad Real y Puertollano que analiza la prevalencia de mutaciones en BRCA en sujetos afectos por CM/CO pertenecientes a familias de alto riesgo, registró una prevalencia del 27,9% (31), ubicándose estas cifras entre los rangos citados previamente.
Las mutaciones en BRCA1 parecen ser las responsables del 45% de las familias con agregación de casos de CM y de la mayoría de los síndromes de cáncer de mama y ovario hereditarios. Por otro lado, hasta el 35% de las familias con agregación de CM pueden explicarse por mutaciones en BRCA2, así como el CM en el varón20. Por ello, aunque parece congruente que la prevalencia de mutaciones en BRCA1 hallada en estudios internacionales y algunos nacionales sea superior a la observada en BRCA219,20,23,24, en muchos análisis españoles, así como en nuestro estudio, se aprecia la situación inversa, predominando las mutaciones en BRCA218,21,25.
A nivel nacional, la prevalencia de mutaciones en BRCA1 muestra un intervalo de 0,7-30% y en BRCA2 de 4,2-24,8%18-20,26. Nuestros resultados, aunque enmarcados dentro de estos intervalos, se encuentran más próximos al límite superior en BRCA2 que en el caso del BRCA1.
La mayoría de las mutaciones que registramos fueron patogénicas, tipo frameshift, en correspondencia con la literatura19,20. En BRCA2, de las 11 mutaciones que estudiamos (en 16 pacientes), la mutación c.8632+2T>G (exón 20) y la mutación c.9106delCinsTATC (exón 23) se han descrito por primera vez en la literatura. En nuestro estudio hallamos varias mutaciones recurrentes a nivel nacional, en BRCA2: c.6275_6276delTT así como en BRCA1: c.5123C>A, c.5266dupC y c.68_69delAG. Estas dos últimas constituyen unas de las mutaciones fundadoras principales en la población judía Ashkenazi, descritas también en España por la histórica presencia de judíos en nuestro país.
Aunque la literatura se centra en las mutaciones deletéreas en BRCA, las variantes de significado desconocido también son investigadas, presentando una prevalencia en ambos genes en nuestro país del 6,8-32,8% (mayor en BRCA2 que en BRCA1)20,24,26. La prevalencia hallada en nuestro análisis fue inferior a la descrita en dichos estudios.
En las pacientes portadoras de mutaciones en BRCA1 de nuestro estudio que presentaron CM, con una edad media de 36,6±7años, predominó el tipo ductal infiltrante, estadioI yII, inmunofenotipo triple negativo, luminalA, y el grado histológico más común fue 2 y 3. Estos datos se correlacionan con la literatura, donde el CM acontece en mujeres jóvenes (edad media 40años); el más común es el tipo ductal infiltrante (87,5%) e in situ (12,5%), con inmunofenotipo agresivo y poco diferenciado, triple negativo (hasta en un 80%), con grado histológico 2 y 3, índice mitótico elevado, infiltración linfocítica y alto porcentaje de áreas necróticas. En estas pacientes se registra una proporción elevada de carcinoma medular (hasta en un 11%) con respecto de los casos esporádicos3,11,27,28. Los CO en pacientes con mutaciones en BRCA1 suelen ser posteriores a los CM, en su mayoría de tipo seroso (>90% versus 50% en casos esporádicos), alto grado histológico y bilaterales9. Nuestro análisis solo registró un caso de CO, que se ajustó a estas características.
Los CM descritos en las pacientes portadoras de mutaciones en BRCA2, a diferencia de las mutaciones en BRCA1, constituyen un grupo heterogéneo, sin fenotipo específico, que no muestra diferencias significativas con respecto de los CM esporádicos. Destacar una mayor presencia tubular, menores índices mitóticos y márgenes continuos expansivos3,9,11,27,28. En nuestro estudio el perfil fue más semejante a los CM esporádicos, predominando el tipo ductal infiltrante, luminalA y grado histológico2. En nuestro caso, registramos un mayor porcentaje de CO en este grupo de mujeres.
Comparando las características clinicopatológicas de las neoplasias en ambos tipos de portadoras (BRCA1 y 2), a pesar de una edad media inferior y mayor prevalencia de triples negativos en las primeras, no hallamos diferencias significativas. Ello puede explicarse por la muestra de reducidas dimensiones.
En cuanto al pronóstico del CM/CO en portadoras de mutaciones en BRCA, los resultados en la literatura son controvertidos. La mayoría de los estudios no muestran diferencias con respecto de controles (cánceres de mama y ovario esporádicos), pero hay análisis que describen tanto un mejor como un peor pronóstico29.
Destacar, por último, la importancia del seguimiento exhaustivo de este grupo de mujeres de alto riesgo y de sus familiares de primer grado. En nuestro caso, basándonos en las guías de la NCCN30 de 2017, iniciamos el seguimiento a los 25años, y cada 6meses en la unidad de mama de alta resolución, además de la necesaria exploración clínica, alternamos la realización de mamografía/ecografía y la RM mamaria en un mismo periodo anual, hasta los 70años.
Como conclusión, la prevalencia de sujetos con mutaciones en BRCA que observamos fue del 27,9% (31), siendo superior en BRCA2 con respecto de BRCA1, en correspondencia con algunos estudios previos nacionales. Las características clinicopatológicas de los CM/CO en las portadoras de estas mutaciones fueron similares al perfil descrito en la literatura.
AutoríaConcepción y diseño: Dra. Manzanares.
Recogida de datos: Dra. Manzanares, Dra. Muñoz.
Interpretación de resultados y borrador del artículo: Dra. Manzanares.
Procesamiento ADN (material y métodos), evaluación de mutaciones: Dra. Sánchez.
Análisis estadístico, tablas: Dra. Manzanares, Dra. Muñoz.
Revisión manuscrito: Dra. Sánchez, Dr. Martín.
Todos los autores aprueban la versión definitiva del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.