La consolidación de los programas poblacionales de detección precoz de cáncer de mama y el debate sobre el balance entre el beneficio y el riesgo han juntado la oportunidad y la necesidad de investigación para mejorar la efectividad de los mismos. En España, en paralelo a otros países con programas poblacionales, la investigación en cribado ha evolucionado desde los primeros estudios descriptivos de participación hasta los estudios longitudinales sobre efectos adversos como falsos positivos y cáncer de intervalo, y estudios para conocer mejor el riesgo individual de presentar un cáncer de mama, aprovechando la información que ofrecen las cohortes de mujeres cribadas. Además, se han desarrollado nuevas metodologías de investigación que permiten evaluar nuevas estrategias de cribado, aún teóricas, basadas en el riesgo individual. Por último, se están empezando a desarrollar herramientas de ayuda a la toma de decisiones para facilitar el proceso de informar de forma individualizada a las mujeres.
The consolidation of population-based screening programs for breast cancer and the debate on the risk-benefit balance have coincided with the opportunity and need for research to improve the effectiveness of these programs. In Spain, in parallel to other countries with population-based programs, research on screening has evolved from the early descriptive studies of participation to longitudinal studies of adverse effects, such as false-positives and interval cancers, and studies designed to better understand the individual risk of breast cancer. These studies have been able to take advantage of the information offered by the cohort of screened women. New research methodologies have been developed to allow the evaluation of new theoretical screening strategies based on individual risk. Finally, decision-making tools are being designed to facilitate the process of informing women individually, contributing to shared decision-making.
La finalización del despliegue de programas de detección precoz de cáncer de mama en España y en muchos países europeos ha permitido realizar una investigación exhaustiva de los beneficios y riesgos del cribado. La publicación en el año 2000 de un primer artículo cuestionando la reducción de mortalidad debida al cribado y atribuyendo al mismo una proporción importante de casos sobrediagnosticados y sobretratados desató un debate que todavía no ha concluido1. Desde entonces, y aprovechando la información acumulada de varias rondas de participación en los programas poblacionales, se empezaron a realizar estudios observacionales orientados a mejorar la efectividad del cribado y a evaluar el impacto de la introducción de nuevas tecnologías como la mamografía digital, introducida en la primera década del 2000, entre otros. Las organizaciones internacionales empezaron al mismo tiempo a hacer recomendaciones para incorporar y proporcionar información a las mujeres participantes no solo sobre los beneficios, sino también sobre los riesgos2.
Los resultados de esta investigación, junto con las nuevas tendencias de personalización de la medicina, han redirigido el debate hacia la necesidad de personalizar las estrategias de cribado de cáncer de mama e implicar a las mujeres en el proceso de decisión en base a la información recibida, y teniendo en cuenta sus valores y preferencias. Se expone a continuación el recorrido de la investigación en cribado de cáncer de mama en España hasta la situación actual.
MetodologíaEl presente artículo pretende ser una reflexión de cómo ha ido evolucionando la investigación sobre el diagnóstico precoz en cáncer de mama desde los primeros estudios de cohorte con información individual de mujeres cribadas de varios programas. El período analizado comprende 6 años, desde el año 2007, cuando se concedió el primer proyecto de investigación colaborativo entre varios programas de detección precoz de cáncer de mama de España, hasta la actualidad, y hacemos referencia solamente a proyectos relacionados estrictamente con el cribado y con información individual de las mujeres participantes en diversos programas de cribado de España. No se incluyen, por lo tanto, otras investigaciones relacionadas con factores de riesgo del cáncer de mama, tendencias de la incidencia y mortalidad, factores pronóstico, aspectos radiológicos o avances en el tratamientos desligados del cribado, ni ensayos con medicamentos.
De la evaluación de la efectividad a la personalización del cribadoLas características de la historia natural del cáncer de mama favorecen la posibilidad de la detección precoz mediante el cribado mamográfico (fig. 1). Sin embargo, existen efectos adversos asociados al proceso del cribado que fueron muy poco o nada estudiados en los primeros ensayos que habían demostrado la reducción de mortalidad. La experiencia acumulada de varias rondas de cribado permitió iniciar esta investigación sobre efectos adversos, que en España ha tenido varias fases3. Los primeros estudios realizados con información de varios programas y varias rondas tenían por objetivo responder cuestiones no resueltas, como el estudio de los determinantes del resultado falso positivo y el riesgo acumulado del mismo (proyecto RAFP), la relación entre un resultado falso positivo y la adherencia de la mujer al programa, así como la propia detección posterior de cáncer, la evaluación del impacto de la introducción de la mamografía digital (proyecto DIGIRAFP) y la evaluación de cáncer de intervalo y falsos negativos (proyecto INCA).
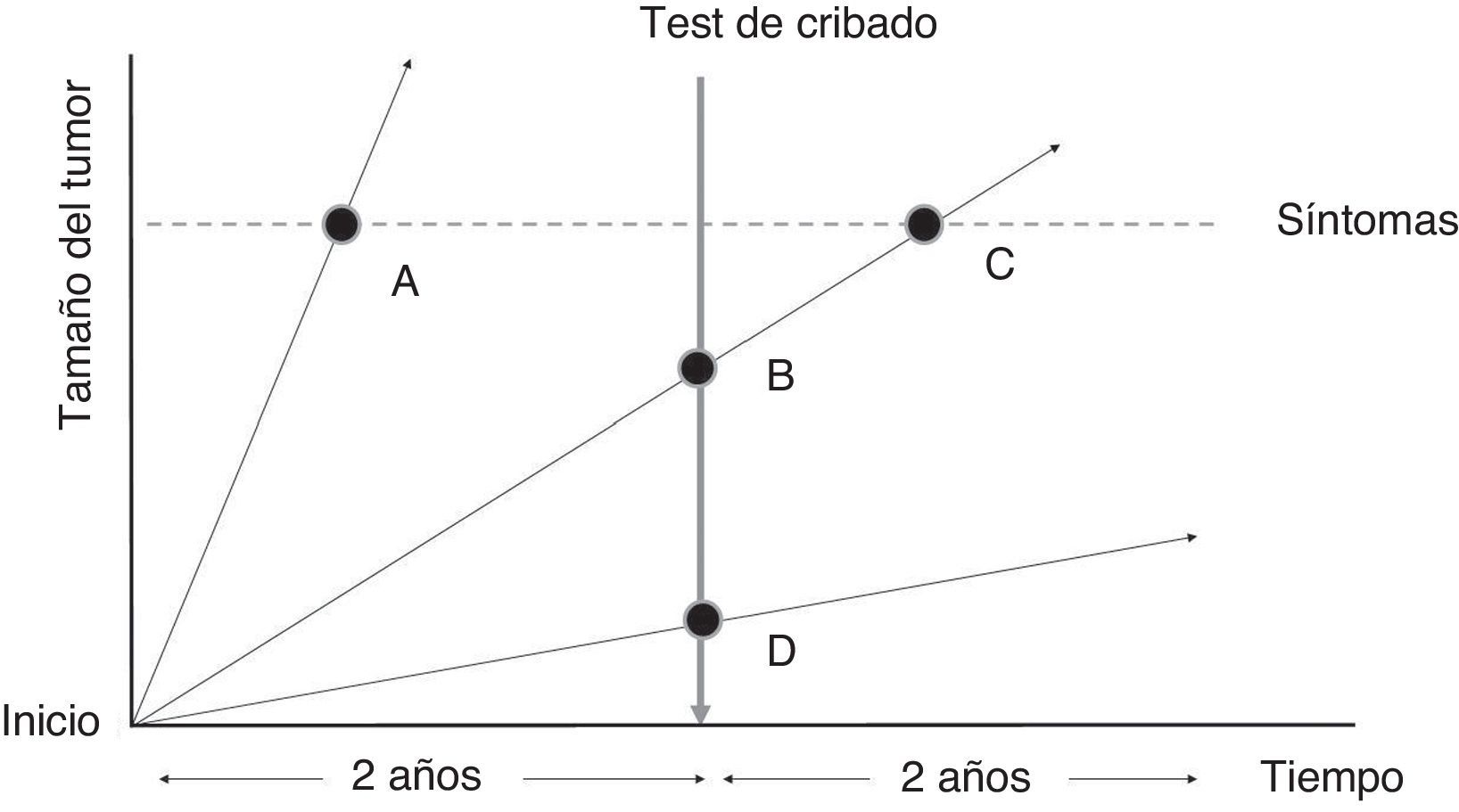
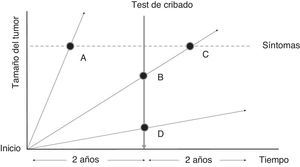
Efecto del cribado en la evolución del cáncer. Los tumores de crecimiento rápido (A) presentan una menor probabilidad de ser detectados en las pruebas de cribado (en España, cada 2 años) y mayor probabilidad de aparecer por sintomatología entre los intervalos del cribado (verdaderos cánceres de intervalo). Los tumores con una fase preclínica larga son más susceptibles de ser detectados en las pruebas de cribado en estados preclínicos de la enfermedad (B), aunque en algunos casos tumores asintomáticos visibles en las pruebas de cribado no son detectados y pueden aparecer por sintomatología antes de la siguiente invitación (falsos negativos) (C). Finalmente, existen tumores de crecimiento muy lento que en ausencia del cribado nunca hubieran sido diagnosticados (D).
Adaptada de Fletcher y Fletcher44.
A raíz de estos proyectos se construyó una cohorte de más de un millón y medio de mujeres participantes en programas de cribado de cáncer de mama de varias comunidades autónomas de España en el período 1990-2006. Los resultados de estos proyectos, en coherencia con estudios realizados en otros contextos4,5, pusieron de manifiesto que un tercio de las mujeres que participaran en 10 rondas de cribado tendrían al menos un resultado falso positivo, pero con una elevada variabilidad en el riesgo6 y desprendiéndose que este reducía la adherencia posterior al programa7. También se demostró que a mayor experiencia del radiólogo menor riesgo de falso positivo8, que las mujeres que iniciaban el cribado antes de los 50 años tenían más riesgo de presentar un falso positivo sin un aumento de la tasa de detección9, o que la realización de pruebas intermedias aumentaba el riesgo de tener resultados falsos positivos, pero también la tasa de detección10, así como la relación del resultado falso positivo con el diagnóstico posterior de cáncer11 y la influencia de las características de los programas en la tasa de detección12. La evaluación del impacto de la introducción de la mamografía digital puso de manifiesto, contrariamente a lo observado en algunos países13, cómo la mamografía digital, a igualdad de precisión diagnóstica, reducía la tasa de reconvocatorias y el resultado falso positivo14. Sin embargo, este resultado se ha confirmado recientemente en un estudio realizado en otro contexto, en Noruega15, con un período de tiempo con técnicas digitales más largo.
El paso siguiente fue el estudio del cáncer de intervalo, que es uno de los principales indicadores de calidad de los programas poblacionales. Además, la disminución de la tasa de reconvocatoria observada después de la introducción de la técnica digital obligaba a descartar un aumento del cáncer de intervalo. Muy pocos estudios en España habían estudiado el cáncer de intervalo con anterioridad, incluyendo información de un solo programa16,17. Desde el punto de vista biológico, los cánceres de intervalo constituyen un grupo heterogéneo de tumores, que presentan un peor pronóstico que los cánceres detectados durante el cribado18,19. El estudio INCA ha permitido evaluar los factores asociados a la aparición del cáncer de intervalo, clasificar los subtipos (verdadero cáncer de intervalo, falsos negativos, signos mínimos y tumores ocultos) y evaluar sus características biológicas y el rol de la densidad.
Uno de los hallazgos más interesantes fue la observación de que los verdaderos cánceres de intervalo, que representan la mitad de los cánceres de intervalo, muestran en mayor proporción el fenotipo triple negativo y, a su vez, se dan en mayor proporción en mujeres con mamas muy densas20. La elevada densidad mamográfica también presentó una fuerte asociación con tumores ocultos, apuntando a un posible efecto enmascarador, que sería menos relevante en el caso de los tumores falsos negativos.
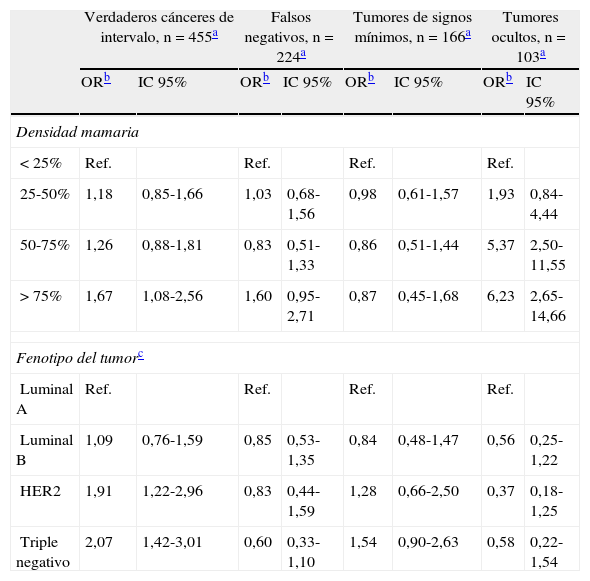
Un resumen de estos resultados se muestra en la tabla 1, adaptada de Domingo et al.20, donde se observa que la presencia de fenotipo triple negativo aumenta el riesgo de verdadero cáncer de intervalo (OR=2,07; IC 95%: 1,42-3,01), y que la elevada densidad mamaria se asocia muy fuertemente a los tumores ocultos (OR=6,23; IC 95%: 2,65-14,66) y en menor intensidad a los verdaderos cánceres de intervalo.
Asociación entre la densidad mamaria y los fenotipos tumorales con las categorías de cáncer de intervalo
| Verdaderos cánceres de intervalo, n=455a | Falsos negativos, n=224a | Tumores de signos mínimos, n=166a | Tumores ocultos, n=103a | |||||
| ORb | IC 95% | ORb | IC 95% | ORb | IC 95% | ORb | IC 95% | |
| Densidad mamaria | ||||||||
| <25% | Ref. | Ref. | Ref. | Ref. | ||||
| 25-50% | 1,18 | 0,85-1,66 | 1,03 | 0,68-1,56 | 0,98 | 0,61-1,57 | 1,93 | 0,84-4,44 |
| 50-75% | 1,26 | 0,88-1,81 | 0,83 | 0,51-1,33 | 0,86 | 0,51-1,44 | 5,37 | 2,50-11,55 |
| >75% | 1,67 | 1,08-2,56 | 1,60 | 0,95-2,71 | 0,87 | 0,45-1,68 | 6,23 | 2,65-14,66 |
| Fenotipo del tumorc | ||||||||
| Luminal A | Ref. | Ref. | Ref. | Ref. | ||||
| Luminal B | 1,09 | 0,76-1,59 | 0,85 | 0,53-1,35 | 0,84 | 0,48-1,47 | 0,56 | 0,25-1,22 |
| HER2 | 1,91 | 1,22-2,96 | 0,83 | 0,44-1,59 | 1,28 | 0,66-2,50 | 0,37 | 0,18-1,25 |
| Triple negativo | 2,07 | 1,42-3,01 | 0,60 | 0,33-1,10 | 1,54 | 0,90-2,63 | 0,58 | 0,22-1,54 |
Adaptada de Domingo et al.16.
Modelo de regresión logística multinomial, ajustado por edad en el cribado, programa de cribado y tamaño del tumor (<11mm, 11-20mm, 21-50mm,>50mm). La categoría de referencia para el modelo multinomial son los cánceres detectados en el cribado (n=1.297).
El fenotipo tumoral se basa en la expresión detectada por técnicas de inmunohistoquímica de receptores de estrógenos (RE), receptores de progesterona (RP) y el factor de crecimiento HER2. Luminal A: RE+/HER2− o RP+/HER2−; Luminal B: RE+/HER2+ o RP+/HER2+; HER2: RE−/RP−/HER2+; Triple negativo: RE−/RP−/HER2−.
Esta información debería resultar útil para intervenir en aquellos aspectos modificables y mejorar la efectividad del programa de cribado, reduciendo, por ejemplo, falsos positivos y falsos negativos, y/o para identificar subgrupos de mujeres que por sus características tengan mayor riesgo de presentar tanto cánceres de cribado como verdaderos cánceres de intervalo. Este mejor conocimiento de los determinantes de algunos efectos adversos y la variabilidad en el riesgo ha hecho plantear un cribado poblacional adaptado al riesgo individual de la mujer21. Sin embargo, el planteamiento de la utilización de estrategias adaptadas al riesgo debe ir precedido de una mejora en los modelos de medida del riesgo individual de cáncer de mama, lo que hace necesario continuar la investigación sobre factores de riesgo de este cáncer. Actualmente en Europa están en marcha varios proyectos que tienen por objetivo la detección precoz personalizada del cáncer de mama. Entre ellos están el proyecto Adapting Breast Cancer Screening Strategy Using Personalised Risk Estimation –ASSURE–, que propone añadir a la mamografía la resonancia magnética o la ecografía 3D según el riesgo de la mujer, el PROCAS, en el Reino Unido, que propone incluir información sobre antecedentes familiares, estilo de vida, densidad mamaria y características genéticas a partir de muestras de saliva, el estudio KARMA, del Instituto Karolinska en Suecia, o el Tailored Breast Screening Trial en Italia, que se centra especialmente en el rol de la densidad.
Conocer más y mejor los factores asociados al riesgo de cáncer de mama posterior a un cribado negativo para poder personalizar el cribadoLa asociación entre un resultado falso positivo y el riesgo aumentado de cáncer de mama posterior observado también en otros estudios22,23 supuso plantearse cuestiones relacionadas con cómo las lesiones benignas o imágenes radiológicas que generaron un falso positivo podían evolucionar a lesiones cancerosas. La cohorte de mujeres sanas (o de riesgo medio) participantes en programas poblacionales de cribado ofrecía la posibilidad casi única de estudiar esta relación. Dentro de las posibles causas de esta asociación destacan principalmente 3 hipótesis: 1) un posible resultado falso negativo en el cribado anterior, o en las pruebas adicionales; 2) la evolución de las propias lesiones benignas, y 3) ciertas características de las mamas que predispondrían a tener un mayor riesgo de cáncer.
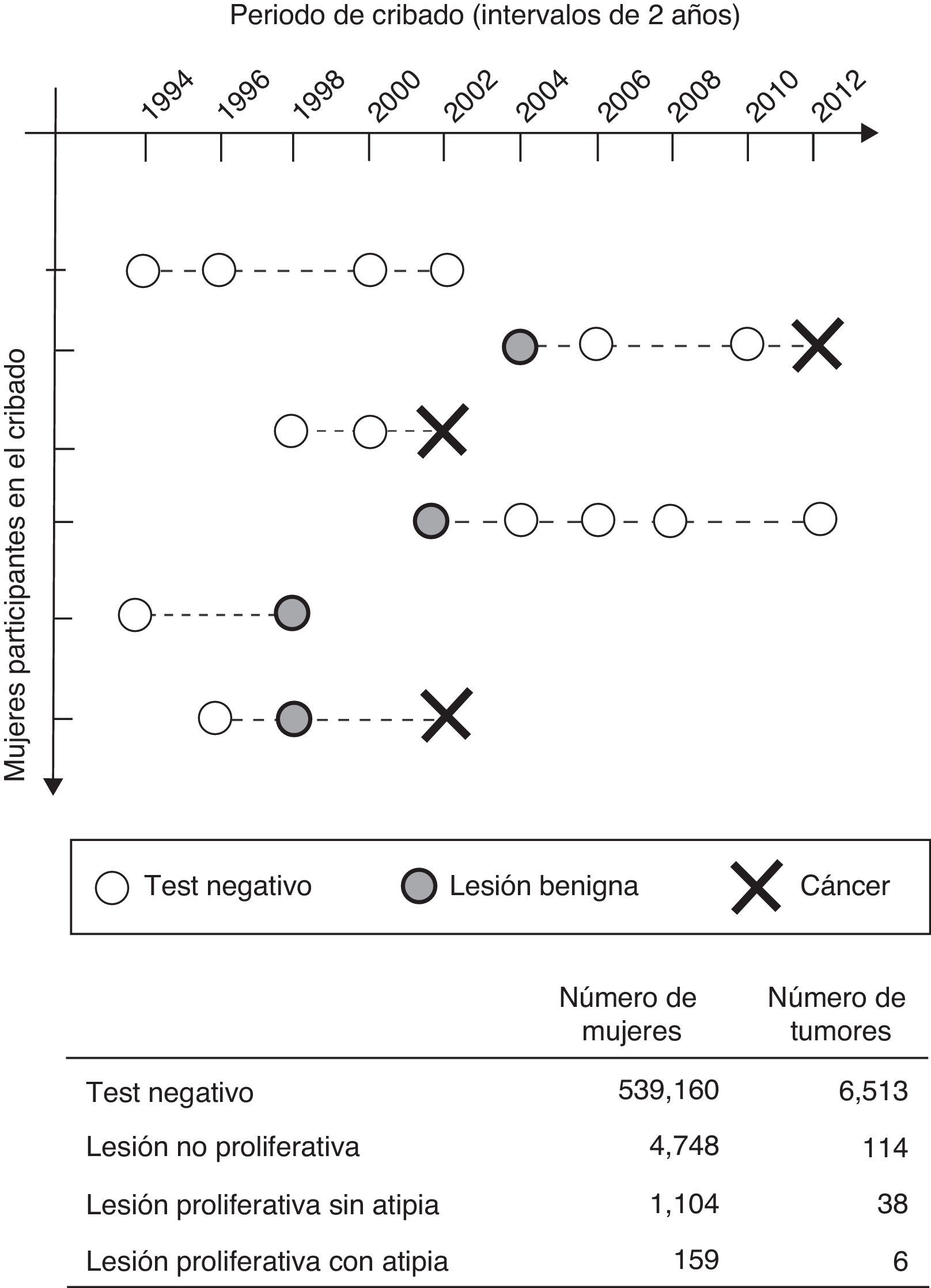
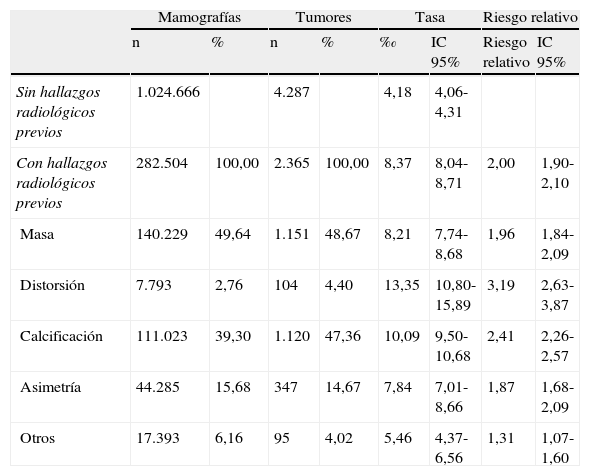
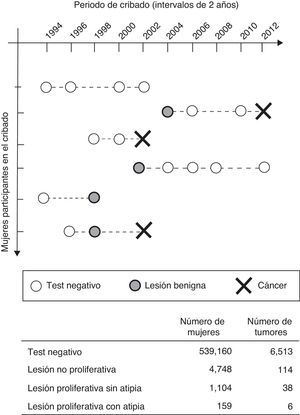
Estas preguntas están siendo contestadas con el proyecto BELLE, que aprovechando una subcohorte de más de 1.700.000 mamografías correspondientes a más de 500.000 mujeres cribadas con información del resultado final de cada episodio de cribado, permite realizar el seguimiento de las mujeres que han presentado un resultado falso positivo (fig. 2). La asociación entre lesiones no proliferativas, tumores benignos o lesiones proliferativas con y sin atipia y el riesgo aumentado de desarrollar posteriormente un cáncer de mama ya ha sido descrito previamente en el contexto clínico24,25. Kabat et al.26 determinaron que las hiperplasias atípicas eran las que presentaron un riesgo sustancialmente elevado de presentar posteriormente un tumor maligno en la misma mama. No obstante, en el marco del cribado no se ha realizado ningún trabajo que defina los riesgos específicos de las diferentes entidades histológicas, ni las diferencias de estos con el riesgo de los cribados con test negativos sin sospecha de lesión, hechos que podrían ser útiles para revisar las recomendaciones clínicas sobre el manejo de estas lesiones identificadas en el cribado. Hasta ahora, su abordaje es el mismo que para las mujeres que no presentan ninguna sospecha. Tampoco ha sido muy estudiada la relación entre patrones radiológicos de las mamografías de cribado en mujeres que posteriormente desarrollan cáncer, y los escasos resultados se basan en pocas observaciones y no son concluyentes. La mayoría de ellos estudian el papel de los patrones radiológicos para diferenciar entre la hiperplasia ductal atípica, el carcinoma ductal in situ y lesiones más avanzadas27. Los resultados preliminares del proyecto BELLE apuntan a que las distorsiones son las sospechas radiológicas que presentan un mayor riesgo de cáncer en participaciones sucesivas28, seguidas por las calcificaciones, la masa y la asimetría (tabla 2). Sin embargo, todavía no está claro cómo esta información se puede utilizar para mejorar la detección precoz del cáncer, y son necesarios más estudios para explorar diferencias considerando mediciones adicionales posteriores a la sospecha radiológica.
Representación esquemática del diseño de estudio del proyecto BELLE. Esquema de seguimiento de 6 mujeres hipotéticas en función de las diferentes situaciones que se pueden dar (resultado negativo, positiva con lesión benigna y cáncer). El seguimiento de las mujeres cribadas permite calcular el riesgo de cáncer en función del resultado previo de la mamografía (lesión benigna o test negativo).
Frecuencia y riesgo relativo de tumores con hallazgos radiológicos en rondas previasa
| Mamografías | Tumores | Tasa | Riesgo relativo | |||||
| n | % | n | % | ‰ | IC 95% | Riesgo relativo | IC 95% | |
| Sin hallazgos radiológicos previos | 1.024.666 | 4.287 | 4,18 | 4,06-4,31 | ||||
| Con hallazgos radiológicos previos | 282.504 | 100,00 | 2.365 | 100,00 | 8,37 | 8,04-8,71 | 2,00 | 1,90-2,10 |
| Masa | 140.229 | 49,64 | 1.151 | 48,67 | 8,21 | 7,74-8,68 | 1,96 | 1,84-2,09 |
| Distorsión | 7.793 | 2,76 | 104 | 4,40 | 13,35 | 10,80-15,89 | 3,19 | 2,63-3,87 |
| Calcificación | 111.023 | 39,30 | 1.120 | 47,36 | 10,09 | 9,50-10,68 | 2,41 | 2,26-2,57 |
| Asimetría | 44.285 | 15,68 | 347 | 14,67 | 7,84 | 7,01-8,66 | 1,87 | 1,68-2,09 |
| Otros | 17.393 | 6,16 | 95 | 4,02 | 5,46 | 4,37-6,56 | 1,31 | 1,07-1,60 |
Otros estudios están evaluando el papel de la densidad y los cambios de la misma en el riesgo de cáncer, ya que los modelos de estimación del riesgo individual propuestos hasta ahora, como el Gail, Chen o Barlow, no predicen adecuadamente el riesgo29–31. Entre otros motivos están que fueron desarrollados con referencia a la población norteamericana y como criterio de elegibilidad para la quimioprevención primaria con tamoxifeno.
Nuevas herramientas de investigación: modelización matemáticaPlantear un cambio de estrategia en el cribado poblacional supone un reto importante para la salud pública, para los responsables de planificar y gestionar los programas y para el colectivo de profesionales que atienden a las mujeres participantes y posibles afectadas. Considerar a la vez el beneficio de la detección precoz no solo en términos de reducción de la mortalidad, sino también en tratamientos menos agresivos y menos impactantes en la calidad de vida de la mujer, la probabilidad de presentar un efecto adverso, o los posibles cambios tecnológicos y de tratamientos que se suceden con gran rapidez implica una dificultad metodológica difícil de resolver con ensayos aleatorizados o estudios observacionales. Además, se añade la necesidad de proporcionar información individualizada a la mujer para tomar la decisión de si participar o no32.
Los ensayos aleatorizados controlados para evaluar estas estrategias tendrían importantes limitaciones, como tamaños de muestra necesarios muy grandes, con largos períodos de seguimiento, y, muy importante, contaminación de los grupos. Los modelos matemáticos –analíticos o de simulación– son una alternativa a los ensayos poblacionales para responder a la mayoría de las preguntas que se plantean. Estos modelos utilizan información de los ensayos clínicos, metaanálisis, estudios observacionales y registros demográficos o sanitarios. Aunque ambos tipos de modelos tienen limitaciones, permiten obtener resultados poblacionales y a largo plazo imposibles de conseguir con los diseños observacionales o experimentales. En EE. UU. ya se utiliza la modelización para informar y guiar las decisiones clínicas y de planificación sanitaria sobre el control del cáncer con la iniciativa Cancer Intervention and Surveillance Modeling Network (CISNET) del National Cancer Institute, basada, entre otros, en modelos probabilísticos como el desarrollado por Lee y Zelen33. Una adaptación de este modelo ha servido para evaluar el coste y los efectos en salud, incluyendo los resultados de los proyectos RAFP e INCA, de diversas estrategias de cribado, adaptadas al contexto español34. El estudio diferencia entre estrategias de cribado fijas, como la que tenemos, donde todas las mujeres de la población diana reciben el mismo número de exámenes independientemente del riesgo de cáncer de mama, y estrategias con periodicidad variable (no existentes y, por lo tanto, imposibles de evaluar con diseños epidemiológicos clásicos) de la prueba mamográfica según el riesgo individual de tener cáncer de mama, utilizando, entre otra, la información acumulada de los proyectos de investigación descritos hasta ahora. El resultado demuestra que las estrategias variables adaptadas al riesgo de padecer cáncer de mama producen menos efectos adversos y son más eficientes que las fijas.
Otro modelo, en este caso de simulación de eventos discretos, ha permitido evaluar, por ejemplo, el impacto presupuestario a largo plazo de la digitalización, observándose que esta supone un ahorro global para el programa, derivado tanto del ahorro en costes de pruebas adicionales como del tratamiento de los casos diagnosticados más precozmente35.
Finalmente, estos modelos también se utilizan para evaluar el sobrediagnóstico, el efecto adverso que supone el reto metodológico más difícil. El sobrediagnóstico se produce cuando, mediante cribado, se diagnostican tumores que nunca se hubieran diagnosticado en vida del individuo y que, sin embargo, una vez diagnosticados reciben tratamiento. La metodología para estimar el sobrediagnóstico es variada y presenta limitaciones, con estimaciones muy dispares que van de menos del 5% al 50% de los casos diagnosticados36–39. El debate sigue abierto, pero actualmente se acepta que el cribado supone un sobrediagnóstico de entre el 10-15%40.
Información y herramientas de ayuda en la toma de decisionesEn el replanteamiento del cribado poblacional, además de la adaptación al riesgo individual, está tomando fuerza la conveniencia y el deber de informar a la población de las posibles consecuencias del cribado. Algunos programas incluyen ya esa información de forma detallada en sus dípticos y webs oficiales, como el National Health Services del Reino Unido41. Sin embargo, no hay consenso sobre el alcance de la información que se debe dar ni datos del efecto de la misma sobre la participación, pero la corriente que se impone es informar a las mujeres para que tomen la mejor decisión teniendo en cuenta sus preferencias y valores. Las herramientas de ayuda en la toma de decisiones compartida en la detección precoz del cáncer son materiales informativos diseñados para ayudar a la toma de decisiones incorporando los valores y preferencias individuales. Son útiles en situaciones con más de una opción razonable, cuando no hay una opción que tenga una clara ventaja en términos de resultados de salud, y cuando cada opción presente riesgos y beneficios que los pacientes pueden valorar de manera distinta42. En la actualidad, existen ya algunos ensayos aleatorizados en marcha que aportarán información sobre la influencia del proceso de informar en mujeres que están considerando participar en programas de cribado43. En España, dentro de la Red de Investigación en Servicios Sanitarios de Salud en Enfermedades Crónicas, está en marcha un proyecto coordinado de investigación sobre servicios sanitarios en cáncer de mama (proyecto CAMISS), que incluye el diseño de esta herramienta.
En conclusión, la investigación es un proceso dinámico que intenta dar respuesta a los retos que plantea la sociedad. En el cribado de cáncer de mama, las preguntas por responder son cómo identificar de forma eficaz a las mujeres con mayor riesgo de tener cáncer de mama para poderles ofrecer mejores estrategias preventivas y cómo informar adecuadamente para tomar la decisión de forma individualizada. Y, por supuesto, cómo los servicios sanitarios se adaptarían a este cambio de paradigma.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste estudio cuenta con el apoyo de la cofinanciación del ISCIII FEDER,(PI12/00387, PI11/01296, PS09/01153).
Autoría- 1.
Todos los autores han participado en la concepción y diseño del estudio y en la interpretación de los datos.
- 2.
Maria Sala, Laia Domingo y Montse Rué han participado en la redacción del texto, y todos los autores han hecho revisiones críticas del mismo.
- 3.
Todos los autores han aprobado la versión que finalmente va a ser publicada.
Los autores declaran no tener ningún conflicto de intereses.