El linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL según sus siglas en inglés) es un tipo raro de linfoma no Hodgkin que se ha descrito en el contexto de la cirugía reconstructiva y estética de mama mediante implantes. Estos artículos presentan un consenso de la Sociedad Española de Senología y Patología Mamaria (SESPM) con la idea de unificar, en esta primera parte, los criterios de diagnóstico de esta enfermedad describiendo asimismo la epidemiología y la etiopatogenia.
Breast implant-associated anaplastic large-cell lymphoma (BIA-ALCL) is a rare type of non-Hodgkin lymphoma that has been described in the context of reconstructive and aesthetic breast implant surgery. These articles present a consensus of the Spanish Society of Senology and Breast Disease (SESPM). In this first part, the aim is to unify the diagnostic criteria of this disease and describe its epidemiology and etiopathogenesis.
El linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL según sus siglas en inglés) es un tipo de linfoma no Hodgkin raro que se caracteriza por expresar siempre el CD30 y haberse descrito en el contexto de la cirugía reconstructora de mama mediante implantes. En 1997 se describió el primer caso en una paciente de 41 años con una masa incluida en la cápsula de una prótesis colocada con motivos estéticos1. En 2011, la U.S. Food and Drug Administration (FDA) publicó una alarma de seguridad promoviendo un esfuerzo internacional para intentar comprender los motivos de aparición de esta nueva enfermedad2. En ese momento se conocía la existencia de 63 casos en el mundo y se estimaba que el número de cirugías con implante estaba entre los 5 y 10 millones (550.000 anuales solo en EE.UU.), con lo que la incidencia de la enfermedad se consideró extremadamente rara. Desde entonces se han ido notificando cada vez más casos y, de forma progresiva, se ha convertido en motivo de preocupación tanto para los especialistas involucrados y la industria implicada como para las pacientes.
El diagnóstico y tratamiento de esta rara enfermedad debe ser realizado desde un punto de vista multidisciplinario, motivo por el cual se ha decidido realizar este documento de consenso desde la Sociedad Española de Senología y Patología Mamaria, al ser la única sociedad científica multidisciplinaria dedicada de forma específica al estudio de la mama y sus enfermedades y que aglutina todas las especialidades que forman parte de su diagnóstico, tratamiento y seguimiento.
En este primer artículo del documento de consenso, se revisarán los aspectos relacionados con la epidemiología, la etiopatogenia, su clínica y diagnóstico.
EpidemiologíaDesde 1997 se han comunicado más de 500 casos de BIA-ALCL en 23 países. La mayor serie publicada corresponde a 173 casos recogidos de la literatura mundial en la que todas las pacientes habían recibido, en algún momento, un implante texturado a lo largo de su evolución3.
La incidencia internacional es variable y oscila entre uno de cada 1.000 y uno de cada 10.000 implantes4-6. Hasta el momento actual, Australia ha declarado 72 casos, 3 de ellos con resultado de muerte7, 41 casos en el Reino Unido8,9, 22 en Italia10, 43 en Holanda11, 19 en Francia12, 7 en Alemania13 y 149 confirmados en los Estados Unidos (para un total de 414 casos con 9 muertes asociadas)4,14.
No es posible determinar el riesgo de desarrollar un BIA-ALCL tras la colocación de un implante de forma exacta pero, por estimación, su incidencia es de 1/2.832 mujeres con implantes de poliuretano en Australia y Nueva Zelanda, de 1/30.000 con implantes texturados en los Estados Unidos y de 1/24.000 en el Reino Unido, basado en el número total de implantes vendidos8. Agrupada por edades, la tasa de incidencia es de 1/35.000 en pacientes de 50 años de edad, 1/12.000 a los 70 años y 1/7.000 con 75 años11.
En 2016 la OMS clasificó el BIA-ALCL como un nuevo tipo de linfoma15.
EtiopatogeniaEn el momento actual no está clara la etiología del BIA-ALCL, pero existe una evidente relación de la presencia de implantes mamarios texturados con la aparición de esta enfermedad.
La infección crónica en el lugar de colocación del implante, al igual que en la aparición de otros linfomas no Hodgkin, parece tener un papel importante16 y en algunos grupos se ha asociado de forma importante con la aparición del BIA-ALCL17.
Hu et al. publicaron un estudio de las cápsulas periprotésicas en el que se comparaban 26 casos de BIA-ALCL con 62 casos sin evidencia tumoral y se evidenció un mayor crecimiento de bacterias en los casos asociados a linfoma, con una mayor proporción de Ralstonia spp. presente en las muestras con ALCL frente a las muestras no tumorales, en las que se aisló con más frecuencia Staphylococcus spp.18.
También, y debido a su escasa incidencia y al hecho de no haberse comunicado ningún caso en determinadas poblaciones (ninguno en mujeres asiáticas), se ha propuesto la posible implicación de un componente genético en el desarrollo de esta enfermedad4.
Desde el punto de vista etiopatogénico, no obstante, lo más relevante en la actualidad es el hecho de que los implantes texturados están presentes en la mayoría de los BIA-ALCL, y el mecanismo de acción parece ser una respuesta inmune intensa a la silicona por parte de los linfocitos T, responsables de la inmunidad celular, que acabaría originando el linfoma19.
El modelo de progresión descrito por Clemens et al.20 estima que el BIA-ALCL comienza como células individuales alrededor del implante texturado que, por un mecanismo no conocido completamente, favorece el crecimiento celular y la necrosis que inicialmente se manifiestan como derrame. Las células tumorales surgen en la cara interna capsular y están en contacto con el implante, y la diferencia entre los casos se basa en la extensión de la infiltración a través de la misma, su profundidad y, en los casos avanzados, a la afectación de los dos lados de la cápsula e incluso de la mama o los tejidos blandos circundantes. Cualquier masa detectada indica que el tumor ha traspasado la cápsula pudiendo llegar a la pared torácica y ganglios regionales. En todos los casos de mortalidad descritos hasta el momento la enfermedad se ha diagnosticado cuando esa infiltración ya se había producido con afectación sistémica20,21.
ClínicaEn el 60-80% de las mujeres el BIA-ALCL empieza como un seroma agudo y persistente que suele ir acompañado de un aumento del diámetro de la mama, asimetría y dolor20. El seroma tardío (más de un año tras el implante) ocurre en entre un 0,05% y un 0,1% de las pacientes con implante texturado, y entre ellas el riesgo de desarrollar el BIA-ALCL es del 9-13%22,23. De hecho, su diagnóstico se suele realizar tras 7-10 años de la colocación del implante, con un rango entre 2,2 meses y 28 años3,4. Otras causas de aparición de derrames tardíos son la infección y los traumatismos, que siempre deben ser descartados.
El BIA-ALCL es bilateral en el 5% de los casos; las adenopatías aparecen en un 15% de los casos, y en un 10-20% la aparición del BIA-ALCL se asocia a la presencia de una masa palpable en la cápsula alrededor del implante17,20. En casos más raros comienza con la aparición de un rash cutáneo o como una contractura capsular, pero esta suele ser semiología acompañante, no habiéndose descrito nunca su aparición asociada solo a la contractura capsular24.
El 60% de los casos están relacionados con cirugía estética y el 40% con cirugía reconstructiva; sin embargo, gracias al seguimiento más controlado, los BIA-ALCL se diagnostican antes en las pacientes reconstruidas por cáncer25.
La enfermedad no ocurre solo en mujeres, sino que también se ha observado en 3 pacientes transexuales con implantes texturados11.
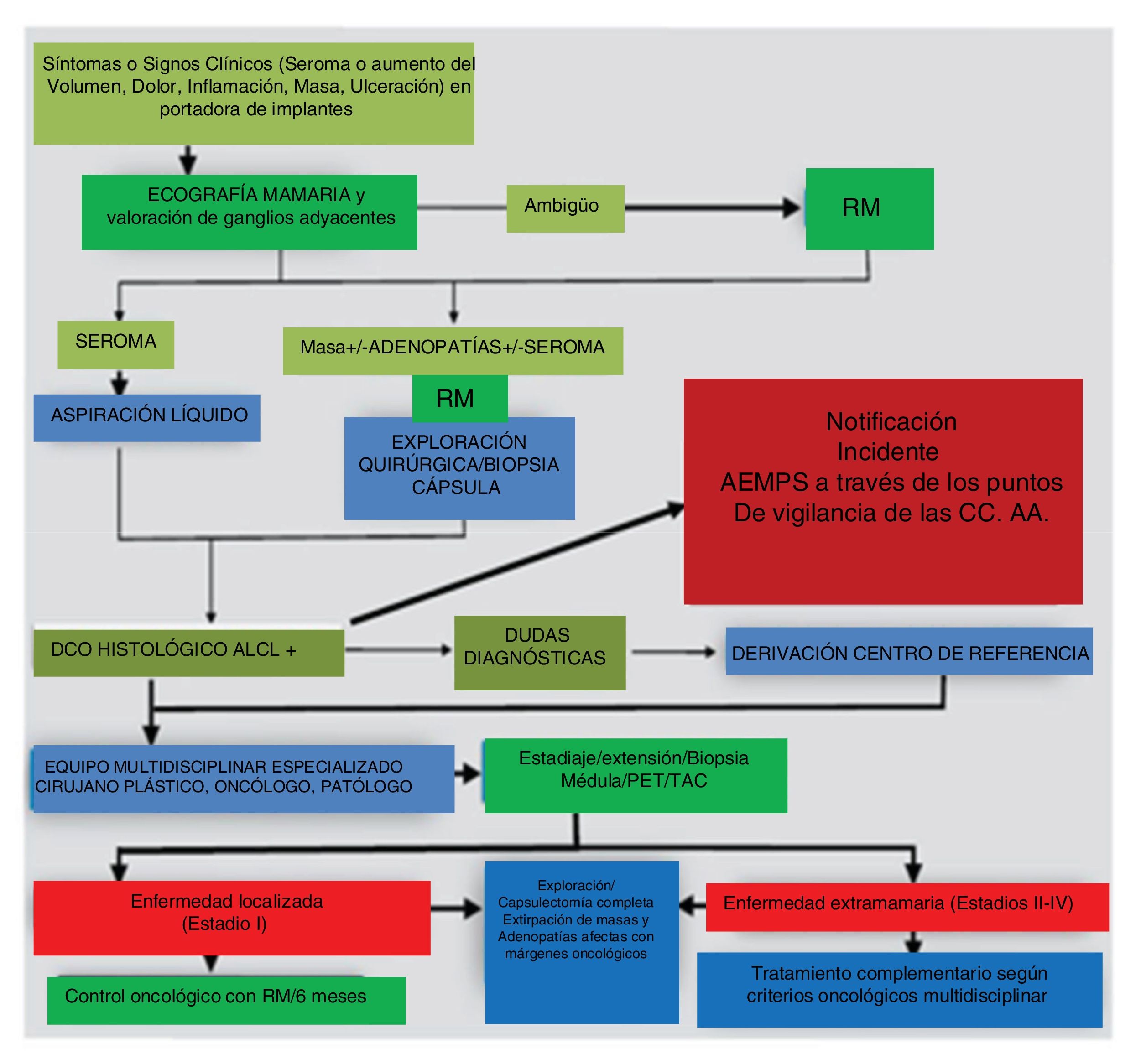
Por todo lo anterior, desde un punto de vista clínico, todas las pacientes con signos o síntomas de un posible BIA-ALCL deberán ser evaluadas y remitidas a un departamento de Radiología para realizar las diferentes exploraciones que permitan el diagnóstico diferencial26,27.
DiagnósticoPruebas de imagen: radiologíaAunque la mamografía (con o sin tomosíntesis asociada) no está incluida en el protocolo de diagnóstico ante la sospecha clínica del BIA-ALCL, puede ser la prueba inicial que alerte al radiólogo en casos asintomáticos, ya que puede detectar cambios en la apariencia del implante, generalmente por la presencia de una colección periprotésica o una masa asociada, aunque para distinguir entre ambos es necesaria la realización de una ecografía complementaria. La sensibilidad y la especificidad de la mamografía para detectar estas anomalías son del 73% y 50%, respectivamente28.
Por otra parte, las pacientes que presenten signos o síntomas relacionados con el BIA-ALCL, particularmente el desarrollo de seroma tardío, serán subsidiarias de exploraciones radiológicas dirigidas.
Como ya se ha mencionado al hablar de la clínica, esta forma de linfoma debe considerarse en el diagnóstico diferencial de cualquier derrame periprotésico subagudo/tardío, excluyendo otras causas como la rotura protésica (aunque como regla general, en estos casos no aumenta el volumen mamario), las infecciones o los traumatismos recientes en la pared torácica. En este contexto, se debe diferenciar del hallazgo incidental de mínima cantidad de líquido periprotésico (5-10ml) asociado a implantes en pacientes asintomáticos y que no requiere más investigación, a diferencia de los derrames periprotésicos asociados a BIA-ALCL cuyas cantidades oscilan entre 200 y 1.000ml29.
Así pues, el estudio inicial ante la sospecha clínica se realizará mediante ecografía para evaluar la presencia de derrame periprotésico, nódulos/masa mamaria o adenopatías (con más frecuencia axilares [93%]30, y más raras en la mamaria interna o supraclaviculares). La ecografía presenta una sensibilidad del 84% y una especificidad del 75% para la detección de derrame, una sensibilidad del 46% y una especificidad del 100% para la detección de masas31, y representa la prueba más eficiente para la detección de derrame periprotésico, así como de utilidad para guiar la toma de muestra para citología o biopsia ante la sospecha de BIA-ALCL30.
En aquellos casos en los que la ecografía no sea concluyente se debe indicar una resonancia magnética (RM)24. La RM, sin y con contraste intravenoso, tiene una sensibilidad del 82% y una especificidad del 33% para la detección de derrame, y una sensibilidad del 50% y una especificidad del 93% para la detección de masas31.
Para continuar el estudio del derrame periprotésico, será necesario realizar una punción con aguja fina (PAAF) que, guiada por ecografía, permitirá valorar en todo momento la posición del implante, así como su integridad. Se deberán extraer, como mínimo, 10ml, siendo lo ideal desde 50ml y recomendable extraer la mayor cantidad de líquido posible para facilitar el posterior estudio por parte de Anatomía Patológica, que incluirá citología y una citometría de flujo para la determinación de CD30.
Por el contrario, en aquellos casos en los que se presente como masa, será necesario realizar una biopsia con aguja gruesa (BAG) (preferiblemente con calibre 14G) guiada por ecografía. Si el inicio clínico es como adenopatía, deberá caracterizarse histológicamente también mediante BAG guiada por ecografía, si la localización lo permite, o mediante biopsia escisional si esta no fuese posible. En todo caso sería conveniente completar el estudio de extensión mediante la tomografía por emisión de positrones-tomografía computarizada (PET-CT), exploración que es útil tanto para valorar tras localizaciones posibles de afectación como, posteriormente, en el seguimiento de la respuesta al tratamiento.
Ante un estudio con resultado citológico o histológico indeterminado y un alto índice de sospecha clínica se podrá repetir la PAAF si persiste líquido periprotésico en cantidad suficiente o la biopsia, o bien remitir la consulta a un centro con experiencia en diagnóstico y tratamiento de linfomas.
Un esquema del manejo diagnóstico radiológico se puede observar en el contexto del algoritmo de actuación que muestra la figura 1.
Pruebas de imagen: medicina nuclearLas pautas actuales sobre cómo se debe manejar esta afección se basan en estudios observacionales. La mayor revisión30 hasta el momento incluyó estudios de imágenes de 44 pacientes con BIA-ALCL probado histológicamente, que datan de 1997 a 2013, y revisa la aportación de los estudios de imagen (ecografía, CT, RM, PET-CT y mamografía). A 19 de los 44 pacientes se les realizó una PET-CT la cual detectó derrame en 5/13 (38%) y masa en 7/11 (64%) pacientes. Cuatro pacientes mostraron una captación difusa alrededor de los implantes. Once pacientes mostraron captación focal en la cara posterior de la cápsula, así como captación en los ganglios de cadena mamaria interna y supraclaviculares. Una paciente con masa mostraba intensa captación de 18F-FDG en la masa del tejido blando adyacente al implante, así como una captación en el ganglio linfático axilar ipsilateral.
La sensibilidad/especificidad de la PET-CT para detectar un derrame es del 38% y 83%, mostrando un patrón de captación difuso de 18F-FDG alrededor de la prótesis. Para detectar una masa, la sensibilidad y especificidad comunicadas son del 64% y 88%, respectivamente, siendo la captación de 18F-FDG intensa, redondeada y homogénea, similar a otros tipos de linfomas no Hodgkin que afectan la mama. Como diagnóstico diferencial en este escenario, las características de la PET-CT en el linfoma de mama no asociado con implantes incluyen un aumento difuso de la acumulación de 18F-FDG, la captación unilateral de forma anular de 18F-FDG en el tejido mamario, o una actividad homogénea intensa y redonda en las masas mamarias.
Tras la realización de una ecografía como herramienta de detección para casos sospechosos, la estadificación de los casos confirmados se debe realizar con PET-CT. Así, para los casos de diagnóstico confirmado, una exploración PET-CT con 18F-FDG permite demostrar la presencia de masas capsulares asociadas, afectación de la pared torácica, afectación ganglionar regional y/o la existencia de metástasis a distancia.
La PET-CT puede, además, contribuir a la planificación quirúrgica, permitiendo establecer una adecuada estrategia de resección y del momento de la cirugía, concretando, por ejemplo, la indicación de quimioterapia neoadyuvante ante casos inicialmente irresecables por invasión de la pared torácica.
Diagnóstico patológico e inmunohistoquímicoEl diagnóstico definitivo del BIA-ALCL se realiza tanto en el líquido aspirado del seroma como en el tejido biopsiado si existe tumoración evidente. Se observan células linfoides con rasgos distintivos de este tipo de neoplasia (Hallmark cells), consistentes en células grandes, irregulares, de núcleo reniforme excéntrico, citoplasma basófilo y destacada región Golgi eosinófila. Puede haber presencia de ocasionales células Reed-Sternberg-like sobre un fondo que es de aspecto inflamatorio, pudiendo existir necrosis. Inmunohistoquímicamente, las células tumorales expresan de forma uniforme CD30 y son negativas para ALK.
El procedimiento a seguir en el servicio de Anatomía Patológica es el siguiente:
- –
Citología. En caso de que la muestra proceda del líquido aspirado del seroma, se debe fijar de forma convencional y realizar, en los casos en que sea posible, bloque celular y CD30 y ALK como tinciones imprescindibles. Si se dispone de citometría de flujo, se procederá de acuerdo con el procedimiento e, igual que con la citología convencional, es imprescindible realizar CD30 y ALK. Otros marcadores como CD2, CD3, CD4, CD6, CD7, CD8 y CD45, aunque útiles, no son imprescindibles.
- –
Biopsia. Se procesará el tejido de forma habitual (fijación en formol, inclusión en parafina y tinción con hematoxilina y eosina [H&E]) y, además, se realizarán tinciones inmunohistoquímicas con los siguientes marcadores: CD2, CD3, CD4, CD6, CD7, CD8, CD30, CD45 y ALK.
El inmunofenotipo es de CD30+ (100%, membrana y Golgi) y ALK negativo. CD3 y BCL-2 son frecuentemente positivos (lo mismo que en los linfomas T periféricos) y EMA es frecuentemente negativo.
Siempre que sea posible, se debe especificar el clon del anticuerpo utilizado, así como cualquier posible variación en el procesado habitual de la muestra.
No se conocen alteraciones moleculares específicas asociadas a este tipo de linfoma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
B. Acea (CU A Coruña), B. Albi (HU Fundación Jiménez Díaz. Madrid), M. Albi (HU Fundación Jiménez Díaz. Madrid), R. Andrés-Luna (H Santa Maria. Lisboa), C. Ara (C Dexeus. Barcelona), M. Arranz (HU La Princesa. Madrid), M. Caba (Fundación Tejerina. Madrid), J. Camps (HU Ribera. Alzira), C. Carcamo (HU Fundación Jiménez Díaz. Madrid), R. Ciérvide (HM CIO Clara Campal, San Chinarro. Madrid), L. Comin (HG Teruel Obispo Polanco), P. Cordeiro (Memorial Sloan Kettering Cancer Centre. Nueva York), G. de Castro (CHU de Vigo), M. Delgado (HGU Ciudad Real), M. Durán Poveda (HU Rey Juan Carlos. Móstoles), N. Estelles (HU Dr. Peset. Valencia), N. Estrada (Fundación Tejerina. Madrid), E. Fernández (HU Ramón y Cajal. Madrid), G. Fuster (HGU de Valencia), J. García-Foncillas (HU Fundación Jiménez Díaz. Madrid), I. García (HU Virgen de la Victoria. Málaga), C. García Mur (HU Miguel Servet. Zaragoza), L. Garcia Pardo (HU Fundación Jiménez Díaz. Madrid), M.A. Gil Olarte (HGU Ciudad Real), A. González (HGU de Valencia), I. Gutierrez (HU Insular de Gran Canaria), F. Hernanz (HU Valdecilla. Santander), Y. Izarzugaza (HU Fundación Jiménez Díaz. Madrid), J. Jimeno (HU Valdecilla. Santander), F. Lobo (HU Fundación Jiménez Díaz. Madrid), D. Martínez (HG de Castellón), M. Martínez (HU Morales Meseguer. Murcia) R. Martínez (HU Dr. Peset. Valencia), P. Matei (Wolverhampton. Reino Unido), J. Masià (H de la Santa Creu i Sant Pau. Barcelona), S. Menjón (HU Virgen de las Nieves. Granada), J. Murillo (H San Juan de Dios. Pamplona), P. Orihuela (HU Fundación Jiménez Díaz. Madrid), I. Osorio (HU Fundación Jiménez Díaz. Madrid), A. Peña y Lillo (HU Fundación Jiménez Díaz. Madrid), S. Pérez (HU Ramón y Cajal. Madrid), A. Pinardo (HGU Ciudad Real), M.A. Piris (HU Fundación Jiménez Díaz. Madrid), M.J. Pla (HU Bellvitge. L’Hospitalet de Llobregat), T. Ramón y Cajal (H de la Santa Creu i Sant Pau. Barcelona), M. Ramos (HU de Salamanca), T. Ramos (HU de Salamanca), S. Rivas (HU Ramón y Cajal. Madrid), I. Rodriguez (HU Insular de Gran Canaria), N. Rodriguez (CU Navarra), C. Romero (HG Virgen de la Salud. Toledo), F. Rojo (HU Fundación Jiménez Díaz. Madrid), J.M. Sanroman (HU Fundación Jiménez Díaz. Madrid), J. Sanz (IMIM Institut Hospital del Mar. Barcelona), V. Salvatierra (HU Fundación Jiménez Díaz. Madrid), S. Salido (HU Fundación Jiménez Díaz. Madrid), J.I. Sánchez (HU La Paz. Madrid) J.M. Serra (C Quirón. Barcelona), C. Serrano (HU Fundación Jiménez Díaz. Madrid), M. Socorro (HU Fundación Jiménez Díaz. Madrid), Alejandro Tejerina (Fundación Tejerina. Madrid), Antonio Tejerina (Fundación Tejerina. Madrid), F. Treserra (H Dexeus. Barcelona), G. Valadas (H de Portimao. Portugal), M. Vernet (HU del Mar. Barcelona), V. Vega (HU Insular de Gran Canaria), S. Vidal (H Clínic de Barcelona), L. Zarain (HU Rey Juan Carlos. Móstoles).