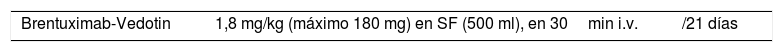El linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL según sus siglas en inglés) es un tipo raro de linfoma no Hodgkin que se ha descrito en el contexto de la cirugía reconstructiva y estética de mama mediante implantes. Este segundo artículo presenta la parte del consenso de la Sociedad Española de Senología y Patología Mamaria (SESPM) sobre el tratamiento quirúrgico, médico, radioterápico, pronóstico y seguimiento.
Breast implant-associated anaplastic large-cell lymphoma (BIA-ALCL) is a rare type of non-Hodgkin lymphoma that has been described in the context of breast implant reconstructive and cosmetic surgery. This second article presents the consensus of the Spanish Society of Senology and Breast Disease (SESPM) on the medical and surgical treatment of this disease, radiotherapy, prognosis and follow-up.
En el artículo previo1 se analizaron los aspectos relacionados con la epidemiología, la etiopatogenia, la clínica y el diagnóstico del linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL). En este se revisan los apartados referentes a su estadificación, tratamiento, pronóstico y seguimiento.
Estudio de extensión y estadificaciónUna vez confirmada la existencia de biopsia compatible con BIA-ALCL, el siguiente paso sería su distinción de la posible afectación sistémica por un proceso linfoproliferativo y, en caso de descartarse, realizar una adecuada estadificación.
Para el primer paso es fundamental una anamnesis por aparatos detallada y una exploración física dirigida, junto a una serie de pruebas complementarias que deben incluir:
- •
Hemograma.
- •
Bioquímica (incluido LDH, B2 microglobulina y ácido úrico).
- •
Serologías VIH, VHB, VHC. Carga viral en casos determinados.
Y la conveniencia de una técnica de imagen, preferiblemente una PET-TC (grado de recomendación 1B).
En los casos de citopenias inexplicables, o cuando se confirma el BIA-ALCL en estadios avanzados, estaría indicada la biopsia de médula ósea.
Del mismo modo, en pacientes que vayan a ser sometidas a tratamiento sistémico con antraciclinas debe realizarse un ecocardiograma basal pretratamiento y un test de gestación en mujeres en edad fértil.
En cuanto a la valoración de la extensión del BIA-ALCL, su estadificación debe permitir diferenciar la enfermedad localizada (la circunscrita a la cápsula periprotésica y el seroma) de la enfermedad extramamaria (con afectación ganglionar y/o diseminada). En este contexto se utiliza la clasificación basada en el sistema TNM de la AJCC2, y que distingue los diferentes grados y estadios:
- •
En relación al grado T, propio de la enfermedad local, se clasifica en:
- ∘
T1: El linfoma se limita a la superficie de la cápsula.
- ∘
T2: El linfoma infiltra ligeramente la cápsula.
- ∘
T3: El linfoma invade la cápsula pero no la atraviesa.
- ∘
T4: Las células linfomatosas atraviesan la cápsula.
- •
En relación al grado N, propio de la posible afectación ganglionar, en:
- ∘
N0: Sin afectación ganglionar.
- ∘
N1: Con única afectación ganglionar.
- ∘
N2: Con afectación ganglionar múltiple.
- •
En cuanto a su posible diseminación distancia (M):
- ∘
M0: Sin diseminación a otros órganos.
- ∘
M1: Con afectación de otros órganos a distancia.
Los diferentes grados de las variables TNM se agrupan en los siguientes estadios:
- •
IA: T1 N0 M0.
- •
IB: T2 N0 M0.
- •
IC: T3 N0 M0.
- •
IIA: T4 N0 M0.
- •
IIB: T1-3 N1 M0.
- •
III: T4 N1-2 M0.
- •
IV: T1-4 N1-2 M1.
Dependerá del estadio en el que se diagnostique. A continuación se muestran de forma esquemática las indicaciones terapéuticas dependiendo del estadio TNM para, posteriormente, desarrollar los aspectos concretos del tratamiento del BIA-ALCL.
Estadios I A-B-C- 1.
Capsulectomía total con resección de la prótesis completa.
- 2.
Valoración de resección total de la prótesis contralateral.
- 3.
Si capsulectomía parcial o resección incompleta de la prótesis, con enfermedad residual, tratamiento adyuvante (valorar radioterapia).
- 1.
Capsulectomía total con resección de la prótesis completa.
- 2.
Valoración de resección total de la prótesis contralateral.
- 3.
Si capsulectomía parcial o resección incompleta de la prótesis, con enfermedad residual, tratamiento adyuvante con radioterapia y/o tratamiento quimioterápico sistémico (si existe afectación ganglionar o contraindicación de radioterapia).
- 1.
Capsulectomía total con resección de la prótesis completa.
- 2.
Valoración de resección total de la prótesis contralateral.
- 3.
Tratamiento sistémico con inmuno/quimioterapia.
El tratamiento principal del BIA-ALCL es quirúrgico, dado que la progresión de la enfermedad se caracteriza por su afectación local o regional, al menos inicialmente.
Independientemente de la extensión de la enfermedad al diagnóstico, son imprescindibles la explantación del implante afecto y la realización de una capsulectomía total3,4. La extirpación quirúrgica completa tiene un papel fundamental en el manejo de esta patología, habiéndose demostrado un aumento de la supervivencia en estos casos cuando se compara con pacientes en los que se realizó una cirugía limitada, quimioterapia y/o radioterapia5,6. En este sentido, Clemens et al.5 publicaron en 2015 una revisión en la que el 50% de los pacientes recibieron quimioterapia, pero aproximadamente un tercio de ellos presentaron progresión de la enfermedad o no respondieron, por lo que el tratamiento sistémico, como tratamiento único, parece ser insuficiente.
El tratamiento quirúrgico debe incluir la retirada del implante y una capsulectomía total y exéresis de las zonas afectadas, logrando márgenes sanos sin afectación tumoral. En el caso de que se asocie además una masa, esta debe ser también extirpada con márgenes negativos. La cirugía debe realizarse con una técnica oncológica estricta, que incluye el uso de suturas de orientación de la muestra, la colocación de clips quirúrgicos dentro del lecho del tumor y el uso de instrumental distinto para la extracción de un implante contralateral. Las pacientes con evidencia de enfermedad más allá de la cápsula tienen mayor riesgo de recurrencia comparadas con las que desarrollan una enfermedad limitada a la cápsula6-8.
No se ha observado una relación entre el derrame del líquido periprotésico durante la capsulectomía (inevitable en muchos casos) y la tasa de recurrencias de la enfermedad.
Ya que en aproximadamente el 5% de los casos se encuentra linfoma en la otra mama, y con el fin de evitar una recurrencia o un segundo primario contralateral, en las portadoras de prótesis bilaterales se debe considerar la explantación contralateral y su capsulectomía. En caso de realizarla, se debe remitir siempre para estudio anatomopatológico4,7,8.
La reimplantación no es recomendable, dado el actual conocimiento sobre el origen de esta enfermedad, y en el caso de llevarse a cabo se desconoce si el empleo de una prótesis lisa puede ser beneficioso. Tampoco existe unanimidad en cuanto al momento de la reconstrucción, si esta se considera. Parece claro que la sustitución por otro implante texturizado no es la opción más indicada. En casos de enfermedad localizada puede optarse por la reconstrucción, inmediata o diferida, con tejido autólogo, injertos de tejido adiposo seriados o implantes lisos. En cualquier caso, pero más si se opta por la reconstrucción con implantes lisos, debe existir una completa seguridad en cuanto a la total extirpación de todo tejido afectado por la enfermedad8. El tratamiento quirúrgico debe tener en cuenta los resultados cosméticos finales, por lo que es recomendable el abordaje a través de cicatrices mamarias previas, a través de una incisión en el surco submamario o la explantación en combinación con una mastopexia.
En los casos de enfermedad limitada al implante, la cápsula o la mama, en los que se consigue una escisión completa sin que quede enfermedad residual, no es necesario ningún tratamiento adyuvante (quimioterapia o radioterapia). En cambio, en los casos en que la capsulectomía es solo parcial o no se consigue una escisión quirúrgica completa, así como en los estadios II-IV, es necesario asociar tratamiento adyuvante, que se debe discutir en el Comité de Tumores. El protocolo recomendado se resume en la guía NCCN 2019 (fig. 1)7,9.
Manejo del territorio linfáticoA pesar de que la diseminación linfática ocurre con más frecuencia en la región ganglionar axilar, el drenaje linfático de la cápsula periprotésica puede drenar a múltiples territorios linfáticos y no tiene sentido la realización de una biopsia selectiva de ganglio centinela. Lo que se recomienda hacer es una biopsia escisional de los ganglios sospechosos, aumentados de tamaño a la exploración o en las pruebas de imagen (el 60% de ellos estarán afectos). En este sentido, es importante conocer que se debe evitar realizar PAAF diagnóstica en los ganglios sospechosos en pruebas de imagen, ante la baja especificidad de la prueba y la elevada posibilidad de obtener un falso negativo4,7,10.
RadioterapiaIndicaciones de radioterapia según estadioDe acuerdo con la clasificación propuesta por Clemens, en los estadios precoces (I-A y I-B), en los que la forma de presentación es el derrame y tan solo se afecta la cápsula periprotésica, la realización de una capsulectomía total y retirada del implante presenta una tasa de control excelente, y en estos casos no parece que la adición de la radioterapia pueda aportar disminución en la tasa de recurrencias10-12. No obstante, en estadios precoces en los que la situación clínica no permita realizar una resección completa de la cápsula, existen grupos de trabajo que añaden radioterapia adyuvante con buenos resultados de control12.
En estadios precoces que se presentan con masa visible o palpable (I-C, II-A) la tasa de recaídas se eleva considerablemente y la enfermedad se comporta de forma más agresiva8,11-14. Parece incluso que los estudios anatomopatológicos encuentran que esta diferencia en pronóstico se acompaña de un diferente patrón inmunohistoquímico ya que, a pesar de encontrar en ambas ALK− y CD30+, en los linfomas asociados a prótesis que forman masa se han encontrado marcadores similares a los de la enfermedad de Hodgkin6,15. Dado que la tasa de recaídas aumenta en algunos trabajos hasta en un 40-45% respecto a las pacientes con presentación tipo derrame, la adición de la radioterapia en esta situación parece aportar un control necesario de forma local10,16. Esto es más evidente todavía en casos de afectación de pared por la masa tumoral. La radioterapia ofrece buenos resultados de control en estos escenarios17.
En estadios más avanzados con afectación ganglionar (II-B y III) los datos disponibles en la literatura son muy heterogéneos y poco específicos en cuanto a las indicaciones precisas de la radioterapia. Se suele individualizar la decisión clínica y tomarla en comités multidisciplinares caso a caso6,7,12-15. Parece lógico pensar que si la radioterapia aporta control local ante masa palpable o radiológicamente visible, también aporte control ante la afectación ganglionar en estos casos en los que, además, la supervivencia libre de enfermedad puede estar más comprometida. Por tanto, la radioterapia adyuvante tras cirugía de extirpación de la cápsula o linfadenectomía, o como opción en casos con extensión locorregional no resecable, parece ser una buena opción.
Cuando se acompaña de extensión a distancia IV la radioterapia queda reservada para la paliación de síntomas en casos de masas ulceradas, sangrantes o dolorosas.
Volúmenes de irradiación recomendados en BIA-ALCL- a)
En caso de indicaciones de radioterapia en estadios IC y IIA por masa palpable o en estadios más iniciales por bordes afectos o no operabilidad, el volumen diana será similar al volumen de irradiación mamario, teniendo en cuenta incluir bien toda la zona subpectoral en todo el recorrido muscular, hasta su inserción craneal.
- b)
En cuanto a la indicación de radioterapia sobre las cadenas ganglionares locorregionales, se ha descrito que el drenaje ganglionar del BIA-ALCL está alterado y es errático comparado con el drenaje habitual en patología mamaria, por lo que la afectación axilar, si bien es más frecuente, puede no estar presente en casos de afectación de fosa supraclavicular, o puede afectarse la cadena mamaria interna en tumores periféricos. Por tanto, en caso de incluir radioterapia sobre las cadenas ganglionares locorregionales si presentan afectación, serán los niveles I, II y III, la fosa supraclavicular y la cadena mamaria interna.
- c)
En los casos con irradiación previa de cáncer de mama, la aparición del BIA-ALCL suele desarrollarse de manera tardía tras la colocación de la prótesis y, por tanto, de la administración de radioterapia post-mastectomía en el caso de que hubiera sido necesaria. Al tratarse de pacientes habitualmente mastectomizadas no se realiza sobredosificación, por lo que suelen haber recibido dosis máximas de 50Gy en 25 fracciones o de 40Gy en 15 fracciones en pared torácica y áreas ganglionares. Considerando el tratamiento previo, la dosis total administrada y el tiempo transcurrido, realizar una reirradiación es seguro en las pacientes diagnosticadas de linfoma que requieran nueva administración de radioterapia local y/o locorregional.
La dosis total administrada varía dependiendo de los distintos estudios analizados, aunque pueden establecerse claramente dos niveles de dosis13,18:
- a)
Entre 24-36Gy en fracciones de 2Gy/día: rango de dosis recomendado para pacientes que reciben radioterapia tras cirugía completa por factores de riesgo como la presencia de masa al diagnóstico. También puede ser empleado en pacientes con radioterapia previa.
- b)
Entre 36 y 40Gy en fracciones de 2Gy/día o 40Gy en fracciones de 2,67Gy/día: rango de dosis recomendado para pacientes con resección incompleta o ganglios afectos. El uso del hipofraccionamiento ha quedado documentado con buen control y perfil de tolerancia y, en pacientes de alto riesgo, permite administrar dosis equivalentes mayores19.
Habitualmente los pacientes que tienen indicación de radioterapia comparten esta indicación con los tratamientos sistémicos más utilizados, fundamentalmente con el esquema CHOP, si bien este esquema presenta cifras de control muy por debajo de lo que lo hacen en los linfomas anaplásicos periféricos no asociados a prótesis, incluso en los ALK−.
En los últimos años se está empleando el anticuerpo anti-CD30 brentuximab, ya utilizado en ciertos tipos de linfoma de Hodgkin resistente a quimioterapia, micosis fungoide, etc., en muchos casos con radioterapia secuencial y, en algunos pocos casos referidos en la literatura, con radioterapia concurrente. Su perfil de seguridad es bueno, y el control en las pacientes con BIA-ALCL en casos avanzados es muy prometedor, presentando toxicidad en forma de neutropenia o polineuropatía periférica que no se vería incrementada por la adición de radioterapia concurrente. En cuanto a la neumonitis, parece que se ha visto incrementada con el uso concomitante de bleomicina, ya que brentuximab podría predisponer a desarrollar esta complicación ante agentes que la ocasionan habitualmente20,21.
Por tanto, y teniendo en cuenta la precisión alcanzada en la planificación y la administración de la radioterapia moderna, el empleo de brentuximab en concurrencia con radioterapia podría plantearse como alternativa para pacientes con tumores en estadios I-C o más avanzado, dentro de ensayos clínicos multicéntricos nacionales o internacionales.
QuimioterapiaLos regímenes quimioterápicos más utilizados en los casos en los que es necesaria la terapia sistémica se muestran en las tablas 1-5.
CHOEP
| Ciclofosfamida | 750 mg/m2 en SG 5% (500 ml) - i.v. 1 h | Día 1/21 días |
| Etopósido | 100 mg/m2 en SF (100 ml) - en 1 h | Día 1-3/21 días |
| Vincristina | 1.4 (máximo 2) en SF (500 ml) - i.v. en 10min | Día 1/21 días |
| Adriamicina | 50 mg/m2 en SF (100ml) - i.v. en 30min | Día 1/21 días |
| Prednisona | 100 mg/m2 v.o. | Dias 1 al 5 |
GCSF 300-400 μg los días 6-11.
DA-EPOCH
| Ciclofosfamida | 750 mg/m2 en SG 5% (500 ml) - i.v. en 1 h | Día 5/21 días |
| Etopósido | 50 mg/m2 en SF (100 ml) - i.v. en 1 h | 1-2-3-4/21 días |
| Vincristina | 1,4 (máximo 2) en SF (00 ml) - i.v. en 10min | 1-2-3-4/21 días |
| Adriamicina | 10 mg/m2 en SF (100 ml) - i.v. en 30min | 1-2-3-4/21 días |
| Prednisona | 120 mg/m2 v.o. | 1-2-3-4-5/21 días |
GCSF 300-400 μg desde el día 6 hasta CAN > 0,5*10 elevado a 9/l.
Brentuximab Vedotin
| Brentuximab-Vedotin | 1,8 mg/kg (máximo 180 mg) en SF (500 ml), en 30min i.v. | /21 días |
Brentuximab está aprobado para los linfomas T anaplásicos CD30+ a partir de una primera recaída, pero no en una primera línea22.
BV+CHP (combinación pendiente de autorización)
| Brentuximab-Vedotin | 1,8 mg/kg (máximo 180 mg) en SF (500 ml), en 30min i.v. | /21 días |
| Ciclofosfamida | 750 mg/m2 en SG 5% (500 ml) – i.v. en 1 h | /21 días |
| Adriamicina | 50 mg/m2 en SF (100 ml) – i.v. en 30min | /21 días |
| Prednisona | 60 mg/m2 v.o. | /21 días |
Como tratamiento sistémico posterior a la detección de una recaída, debe valorarse el tiempo transcurrido desde el primer tratamiento y se puede considerar el uso de un anticuerpo conjugado formado por un anticuerpo monoclonal dirigido a CD30 (Brentuximab Vedotin), una de cuyas indicaciones, fuera del contexto del implante mamario, es el tratamiento en adultos del linfoma anaplásico de células grandes sistémico en recaída o refractario a otros tratamientos.
Pronóstico y seguimientoEl BIA-ALCL es una enfermedad con excelente pronóstico en la mayoría de los casos, en la que es fundamental una sospecha clínica y un diagnóstico precoz. En este sentido se reconocen variables con valor pronóstico, como las que se señalan en la tabla 6, si bien debe enfatizarse que ninguno de los índices pronósticos tiene impacto en la elección del tratamiento ni, por tanto, valor predictivo.
Variables con valor pronóstico asociadas al BIA-ALCL
| Variable con valor pronóstico | Nivel de corte | |
|---|---|---|
| Edad del paciente | ≤ 60 años | > 60 años |
| Actividad del paciente según criterios ECOG | < 2 | ≥ 2 |
| Estadio clínico del linfoma | I/II | III/IV |
| Número de áreas ganglionares afectas | ≤ o igual a 2 | > 2 |
| Actividad de LDH en suero | ≤ normalidad | > normalidad |
En relación con el seguimiento postratamiento de estos casos, las guías clínicas de la NCCN recomiendan un seguimiento clínico y examen físico cada 3 a 6meses durante 2años y, posteriormente, según evolución clínica.
En cuanto a las exploraciones complementarias de imagen, puede recomendarse realizar una PET-TC cada 6meses durante 2años, y posteriormente según la evolución clínica y el estadio inicial, con la finalidad de detectar la recurrencia sistémica. Aunque se pueden considerar otras modalidades de técnicas de diagnóstico por imagen que minimizan la radiación, como la RM o la ecografía, estas son menos útiles para detectar recaídas fuera de la mama16,23.
Debe resaltarse la importancia de comunicar los casos a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) mediante la cumplimentación del Formulario de Notificación de Incidentes y el Formulario de Información Adicional de Casos BIA-ALCL (Anexo 2).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Acea B(CU A Coruña), Albi B (HU Fundación Jiménez Díaz, Madrid) Albi M (HU Fundación Jiménez Díaz, Madrid), Andrés-Luna R (H Santa Maria, Lisboa), Ara C (C Dexeus, Barcelona), Arranz M (HU La Princesa, Madrid), Caba M (Fundación Tejerina, Madrid), Camps J (HU Ribera, Alzira), Carcamo C (HU Fundación Jiménez Díaz, Madrid), Ciérvide R (HM CIO Clara Campal, San Chinarro, Madrid),Comin L (HG Teruel Obispo Polanco), Cordeiro P (Memorial Sloan Kettering Cancer Centre, Nueva York), De Castro G (CHU de Vigo), Delgado M (HGU Ciudad Real), Durán Poveda M (HU Rey Juan Carlos, Móstoles), Estelles N (HU Dr Peset, Valencia), Estrada N (Fundación Tejerina, Madrid), Fernández E (HU Ramón y Cajal, Madrid), Fuster G (HGU de Valencia), García-Foncillas J (HU Fundación Jiménez Díaz, Madrid), García I (HU Virgen de la Victoria, Málaga), García Mur C (HU Miguel Servet, Zaragoza), García Pardo L (HU Fundación Jiménez Díaz, Madrid), Gil Olarte MA (HGU Ciudad Real), González A (HGU Valencia), Gutierrez I (HU Insular de Gran Canaria), Hernanz F (HU Valdecilla, Santander), Izarzugaza Y (HU Fundación Jiménez Díaz, Madrid), Jimeno J (HU Valdecilla, Santander), Lobo F (HU Fundación Jiménez Díaz, Madrid), Martínez D (HG de Castellón), Martínez M (HU Morales Meseguer, Murcia), Martínez R (HU Dr Peset, Valencia), Matei P (Wolwerhampton, Reino Unido), Masià J (H de la Santa Creu i Sant Pau, Barcelona), Menjón S (HU Virgen de las Nieves, Granada), Murillo J (H San Juan de Dios, Pamplona), Orihuela P (HU Fundación Jiménez Díaz, Madrid), Osorio I (HU Fundación Jiménez Díaz, Madrid), Peña y Lillo A (HU Fundación Jiménez Díaz, Madrid), Pérez S (HU Ramón y Cajal, Madrid), Pinardo A (HGU Ciudad Real), Piris MA (HU Fundación Jiménez Díaz, Madrid), Pla MJ (HU Bellvitge, Hospitalet de Llobregat), Ramón y Cajal T (H de la Santa Creu i Sant Pau, Barcelona), Ramos M (HU de Salamanca), Ramos T (HU de Salamanca), Rivas S (HU Ramón y Cajal, Madrid), Rodriguez I (HU Insular de Gran Canaria), Rodríguez N (CU Navarra), Romero C (HG Virgen de la Salud, Toledo), Rojo F (HU Fundación Jiménez Díaz, Madrid), Sanromán JM (HU Fundación Jiménez Díaz, Madrid), Sanz J (IMIM Institut Hospital del Mar, Barcelona), Salvatierra V (HU Fundación Jiménez Díaz, Madrid), Salido S (HU Fundación Jiménez Díaz, Madrid), Sánchez JI (HU La Paz, Madrid), Serra JM (C Quirón, Barcelona), Serrano C (HU Fundación Jiménez Díaz, Madrid), Socorro M (HU Fundación Jiménez Díaz, Madrid), Tejerina Alejandro (Fundación Tejerina, Madrid), Tejerina Antonio (Fundación Tejerina, Madrid), Treserra F (H Dexeus, Barcelona), Valadas G (H de Portimão, Portugal), Vernet M (HU del Mar, Barcelona), Vega V (HU Insular de Gran Canaria), Vidal S (H Clínic, Barcelona), Zarain L (HU Rey Juan Carlos, Móstoles).
Se deberá cumplimentar el Formulario de Notificación de Incidentes y el Formulario de Información Adicional Caso BIA-ALCL. Ambos se incluyen en el siguiente enlace: https://www.aemps.gob.es/vigilancia/productosSanitarios/linfoma-anaplasico-LACG/docs/Protocolo_Clinico_ALCL_implantes_mamarios.pdf