La mastectomía ahorradora de piel y pezón (MAP-CAP) es una técnica quirúrgica cada vez más empleada en el tratamiento del cáncer de mama. Nuestro objetivo es describir la técnica quirúrgica y exponer nuestros resultados.
MétodosSe analizaron retrospectivamente 46 MAP-CAP con reconstrucción inmediata con implante definitivo, realizadas en 35 pacientes con cáncer de mama.
ResultadosSe realizaron 46 MAP-CAP entre 2010 y 2015. En 9 casos se realizó una mastectomía contralateral reductora de riesgo por mutaciones en los genes BRCA o acúmulo de riesgo familiar. La edad media fue de 48 años. El tipo histológico más frecuente fue el carcinoma ductal infiltrante (58%). El 26% de las neoplasias fueron carcinoma ductal in situ. Se evidenció multicentricidad en el 44,7% de los casos. Se administró neoadyuvancia en el 41% de los casos y radioterapia adyuvante (RT) en 24 casos (63%). En 4 casos aparecieron complicaciones postoperatorias (8,7%). En 13 casos se produjo una contractura capsular, habiéndose administrado RT en todos ellos. En 7 casos (15%) se requirió una segunda intervención quirúrgica para recambio de la prótesis inicial por contractura o alteraciones estéticas significativas. Existió un único caso de recidiva regional en axila (2,2%), con una mediana de seguimiento de 44 meses.
ConclusionesLa MAP-CAP con prótesis definitiva es una técnica oncológicamente segura, con una tasa de recidivas similar a la mastectomía clásica. La administración de RT eleva la tasa de contractura capsular, implicando una segunda intervención en el 15% de los casos, por lo que debemos restringir su administración a los casos estrictamente necesarios.
Nipple-sparing mastectomy (NSM) is a surgical procedure that is increasingly used for the treatment of breast cancer. Our aim was to describe the technique performed at our institution and to present our results.
MethodsWe retrospectively analysed data from 46 NSM with immediate breast reconstruction with definitive implants performed in 35 patients with breast cancer.
ResultsWe performed 46 NSMs between 2010 and 2015. Nine of these patients received a contralateral prophylactic NSM because of BRCA mutations or high familial cancer risk. The median age was 48 years. The most frequent histologic type was ductal invasive carcinoma (58%). A total of 26% of the neoplasms were ductal carcinoma in situ. Neoadjuvant treatment was administered to 41% of the patients and adjuvant radiotherapy was administered in 24 (63%). Early complications appeared in 4 patients (8.7%). Capsular contracture occurred in 13 patients. All of them had received radiotherapy. In 7 of the 46 patients (15%), a second surgery to change the initial prosthesis was required because of high-grade capsular contracture or to improve cosmetic results. There was only one case of regional recurrence (2.2%) in the axilla, with a median of follow-up of 44 months.
ConclusionsNSM is an oncologically safe technique for breast cancer, with a similar recurrence rate to classic mastectomy. Radiotherapy increases the rate of capsular contracture, requiring a second intervention in 15% of patients. Consequently, its use should be restricted to cases in which it is strictly necessary.
El cáncer de mama constituye uno de los principales problemas de salud en la población femenina a nivel mundial, siendo el tipo de cáncer más frecuente en la mujer1. Su tratamiento ha experimentado importantes cambios en las últimas décadas.
La mastectomía ahorradora de piel y pezón (MAP-CAP) fue descrita por Freeman en la década de 1960, inicialmente como tratamiento para lesiones benignas de la mama2. Actualmente, es una técnica en auge, empleada fundamentalmente como cirugía reductora de riesgo y, cada vez más frecuentemente, como tratamiento en el cáncer de mama ya establecido3,4.
Esta técnica, a diferencia de la mastectomía ahorradora de piel (MAP), permite extirpar por completo la glándula mamaria conservando el envoltorio cutáneo incluyendo el complejo areola-pezón (CAP), lo que minimiza el impacto emocional de las pacientes al modificar en el menor grado posible su anatomía mamaria5-7 y evita la necesidad de posteriores intervenciones para la reconstrucción del mismo.
Los objetivos de nuestro estudio son: describir la técnica quirúrgica y exponer los resultados de nuestra serie en términos de complicaciones, así como de recidiva local con una media de seguimiento de 44 meses.
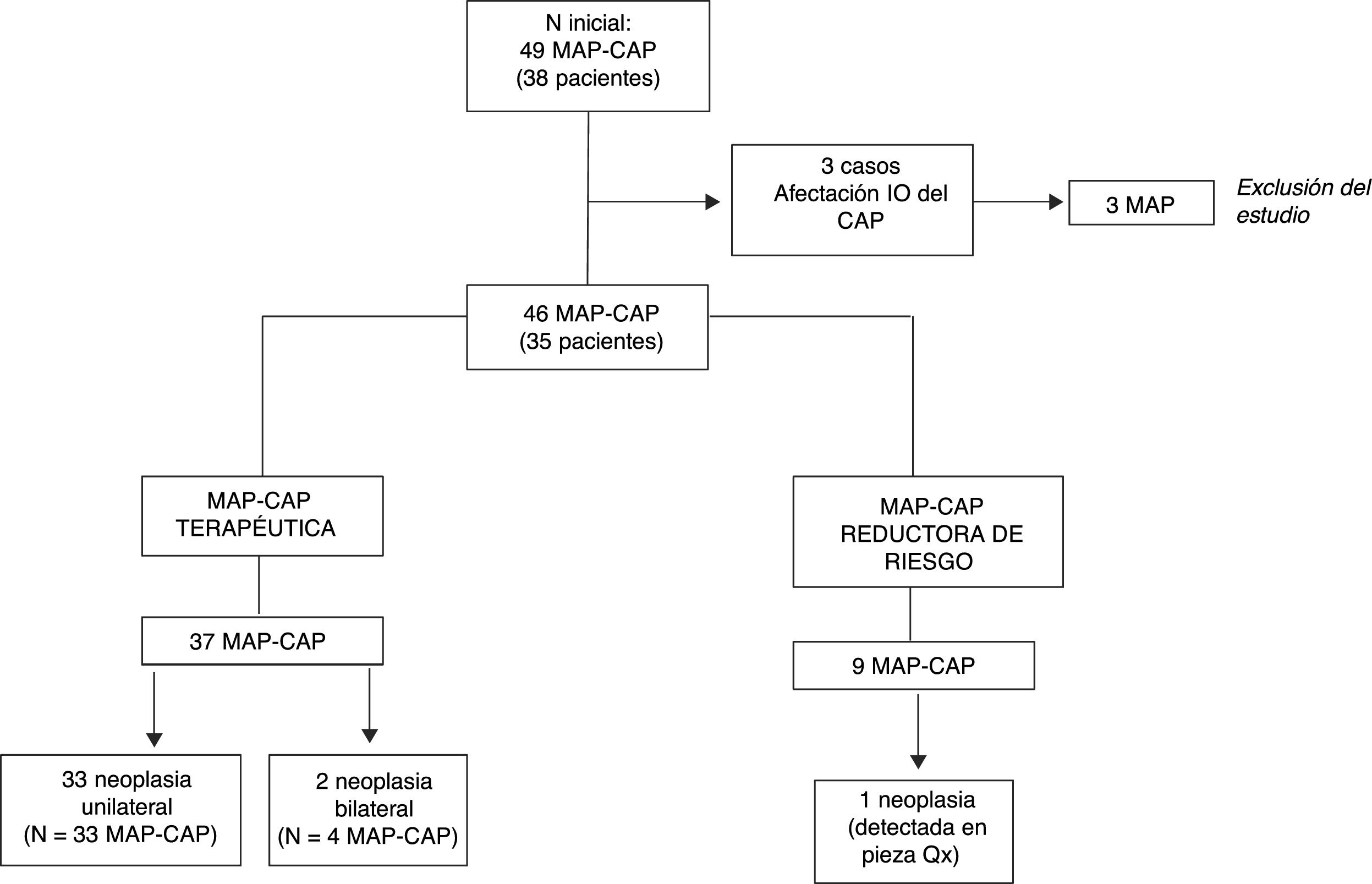
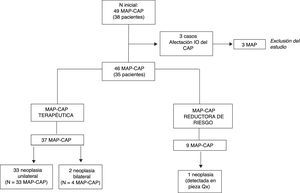
MétodosEstudio descriptivo realizado a partir de un base de datos prospectiva, que incluye 46 MAP-CAP con colocación de prótesis definitiva en el mismo tiempo quirúrgico, realizadas en 35 pacientes con cáncer de mama intervenidas entre enero de 2010 y junio de 2015 (fig. 1).
Se recogieron datos clínicos de las pacientes (edad, estado del BRCA), características tumorales (tamaño, localización, tipo histológico, subtipo molecular, etc.), relativos a la técnica quirúrgica (tipo de incisión, colocación de malla), complicaciones precoces (en los primeros 6 meses tras la intervención quirúrgica) y tardías (a partir de los 6 meses de la cirugía) y recidiva local.
Criterios de selecciónLa técnica se indicó en pacientes con mamas pequeñas/medianas y ptosis leve, con carcinomas infiltrantes o in situ (CIS) localizados en cualquier cuadrante mamario, independientemente de su distancia al CAP, o multicéntricos, sin afectación clínica ni radiológica de piel ni de CAP. En pacientes con mutaciones de los genes BRCA1 o BRCA2, se ofertó además la realización de una MAP-CAP contralateral reductora de riesgo.
La MAP-CAP fue contraindicada en pacientes con evidencia de afectación clínica, radiológica o histológica de piel o CAP, carcinoma inflamatorio, pacientes con mamas muy voluminosas y en aquellas que, una vez informadas de la posibilidad de recidiva local en el CAP preservado, las complicaciones posquirúrgicas y los posibles efectos secundarios de la radioterapia (RT) postoperatoria, la rechazaron.
El estudio preoperatorio incluyó en todos los casos exploración física, mamografía, ecografía mamaria y axilar y resonancia magnética nuclear (RMN) con el objeto de descartar una eventual afectación de la piel o el CAP y multicentricidad. En las pacientes que recibieron quimioterapia neoadyuvante (NA) se realizó una RMN posneoadyuvancia para valorar la respuesta a la misma.
Los criterios de indicación de RT adyuvante variaron durante el periodo de estudio. Durante los 2 primeros años, se irradiaron la totalidad de las MAP-CAP terapéuticas con conservación del CAP, atendiendo al riesgo de recidiva en el remanente tisular, incluyendo los casos de CIS. A partir de 2013, se indicó la administración de RT en casos de tumores >5cm y/o ≥4 ganglios axilares afectos, o con márgenes de resección muy próximos. Asimismo, se indicó en tumores no localmente avanzados cuando coexistieron factores de mal pronóstico, como extensa invasión linfovascular, tumores multifocales o multicéntricos, alto componente proliferativo o edad menor de 50 años.
Se indicó NA en pacientes con afectación axilar al diagnóstico o tamaño tumoral >5cm, así como en los casos de tumor Her2+ o triple negativo.
Técnica quirúrgicaLas incisiones realizadas fueron: en raqueta externa superior y periareolar completa (tipo Roundblock). La indicación de las mismas dependió tanto del tamaño como del grado de ptosis mamaria. En mamas pequeñas con ptosis leve, la incisión elegida fue la raqueta superior, que facilita el abordaje a todos los cuadrantes mamarios. La incisión tipo Roundblock se indicó en mamas que requerían disminuir el grado de ptosis. Con ambas incisiones, en caso de evidenciarse intraoperatoriamente una afectación del CAP, se podría convertir a una MAP sin necesidad de realizar nuevas incisiones.
La biopsia selectiva de ganglio centinela (BSGC) se realizó en todos los casos mediante una incisión axilar independiente, atendiendo a la mayor rapidez y facilidad técnica. La linfadenectomía axilar se llevó a cabo mediante la ampliación de la incisión de la BSGC, siempre que existiera afectación del ganglio centinela, incluyendo los casos de micrometástasis.
En todos los casos se efectuó una biopsia intraoperatoria de la base del pezón mediante cortes por congelación. Se resecó la zona retroareolar y posterior al pezón mediante la eversión del mismo. Se completó la mastectomía conservando todo el envoltorio cutáneo, tratando los colgajos con la máxima delicadeza para evitar lesionar la dermis y garantizar un adecuado aporte vascular. Para ello se siguió el plano de los ligamentos de Cooper con bisturí eléctrico a baja frecuencia y/o tijera.
Para la creación del bolsillo retropectoral que albergaría la prótesis se desinsertaron las fibras del músculo pectoral mayor por su parte posterior, creando continuidad con la aponeurosis del músculo recto anterior y con el músculo serrato, constituyendo así la parte inferior y lateral del bolsillo. En todos los casos se intentó preservar el surco mamario durante la mastectomía para evitar así la separación de las fibras del pectoral de la aponeurosis anterior de los rectos.
En caso de lesión o desinserción traumática del músculo pectoral durante estas maniobras, o desproporción entre el volumen de la prótesis y el espacio disponible retropectoral, se emplearon mallas titanizadas para crear la parte inferior del bolsillo, uniendo la malla al surco mamario por una parte y, por otra, al pectoral mayor.
Las prótesis utilizadas fueron anatómicas de gel cohesivo. Se colocaron 2 drenajes aspirativos de silicona, de baja presión, uno subpectoral y otro subcutáneo. En los casos que requirieron linfadenectomía axilar, se colocó un tercer drenaje.
Análisis estadísticoSe realizó un estudio descriptivo de las variables. Para evaluar la normalidad de las mismas utilizamos el test de Shapiro-Wilks. En cuanto a las variables cualitativas, calculamos su frecuencia y porcentaje. Se realizaron pruebas de Chi2 y riesgo relativo. Se utilizó para ello el programa estadístico SPSS Statistics v. 22.
ResultadosSe realizaron 46 MAP-CAP con reconstrucción inmediata con prótesis definitiva en 35 pacientes. En 24 pacientes se realizó una MAP-CAP terapéutica unilateral, en 2 pacientes una MAP-CAP terapéutica bilateral por neoplasia de mama bilateral y en 9 pacientes una MAP-CAP terapéutica asociada a una MAP-CAP contralateral reductora de riesgo por presentar mutaciones en los genes BRCA1 o BRCA2 o acúmulo familiar de cáncer de mama. En una de las cirugías considerada de inicio como reductora de riesgo, se evidenció un foco de carcinoma ductal in situ en el análisis histológico de la pieza de mastectomía (fig. 1).
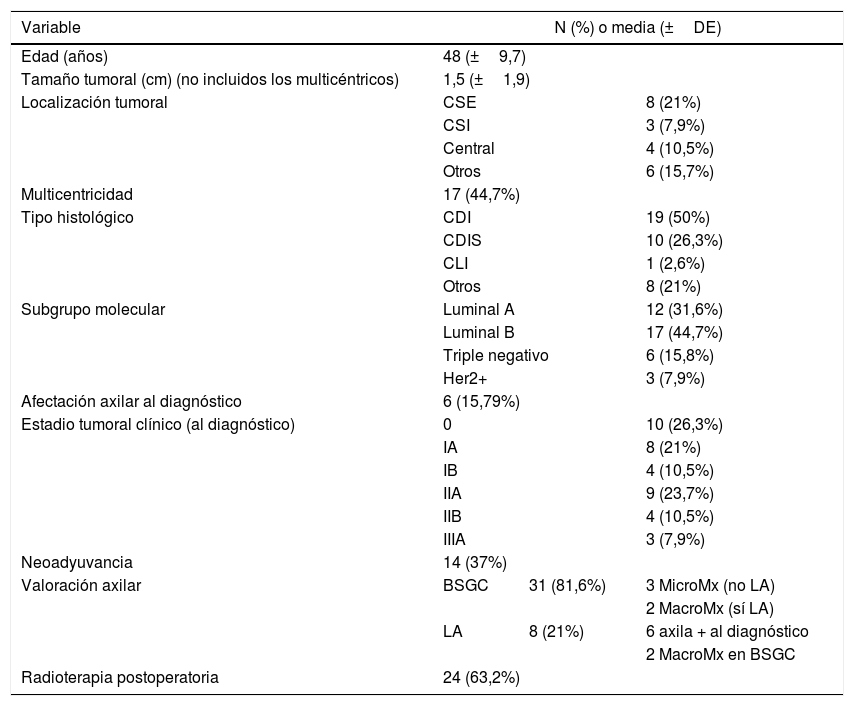
Las características clínicas de las pacientes con neoplasia mamaria, así como los tratamientos complementarios administrados, se recogen en la tabla 1.
Características de los casos de MAP-CAP terapéutica (N=38; se ha incluido el CDIS evidenciado en la pieza de mastectomía en un caso de MAP-CAP reductora de riesgo)
| Variable | N (%) o media (±DE) | ||
|---|---|---|---|
| Edad (años) | 48 (±9,7) | ||
| Tamaño tumoral (cm) (no incluidos los multicéntricos) | 1,5 (±1,9) | ||
| Localización tumoral | CSE | 8 (21%) | |
| CSI | 3 (7,9%) | ||
| Central | 4 (10,5%) | ||
| Otros | 6 (15,7%) | ||
| Multicentricidad | 17 (44,7%) | ||
| Tipo histológico | CDI | 19 (50%) | |
| CDIS | 10 (26,3%) | ||
| CLI | 1 (2,6%) | ||
| Otros | 8 (21%) | ||
| Subgrupo molecular | Luminal A | 12 (31,6%) | |
| Luminal B | 17 (44,7%) | ||
| Triple negativo | 6 (15,8%) | ||
| Her2+ | 3 (7,9%) | ||
| Afectación axilar al diagnóstico | 6 (15,79%) | ||
| Estadio tumoral clínico (al diagnóstico) | 0 | 10 (26,3%) | |
| IA | 8 (21%) | ||
| IB | 4 (10,5%) | ||
| IIA | 9 (23,7%) | ||
| IIB | 4 (10,5%) | ||
| IIIA | 3 (7,9%) | ||
| Neoadyuvancia | 14 (37%) | ||
| Valoración axilar | BSGC | 31 (81,6%) | 3 MicroMx (no LA) |
| 2 MacroMx (sí LA) | |||
| LA | 8 (21%) | 6 axila + al diagnóstico | |
| 2 MacroMx en BSGC | |||
| Radioterapia postoperatoria | 24 (63,2%) | ||
BSGC: biopsia selectiva de ganglio centinela; CDI: carcinoma ductal infiltrante; CDIS: carcinoma ductal in situ; CLI: carcinoma lobulillar infiltrante; CSE: cuadrante supero-externo; CSI: cuadrante supero-interno; LA: linfadenectomía axilar; MAP-CAP: mastectomía ahorradora de piel y pezón; MicroMx: micrometástasis; MacroMx: macrometástasis.
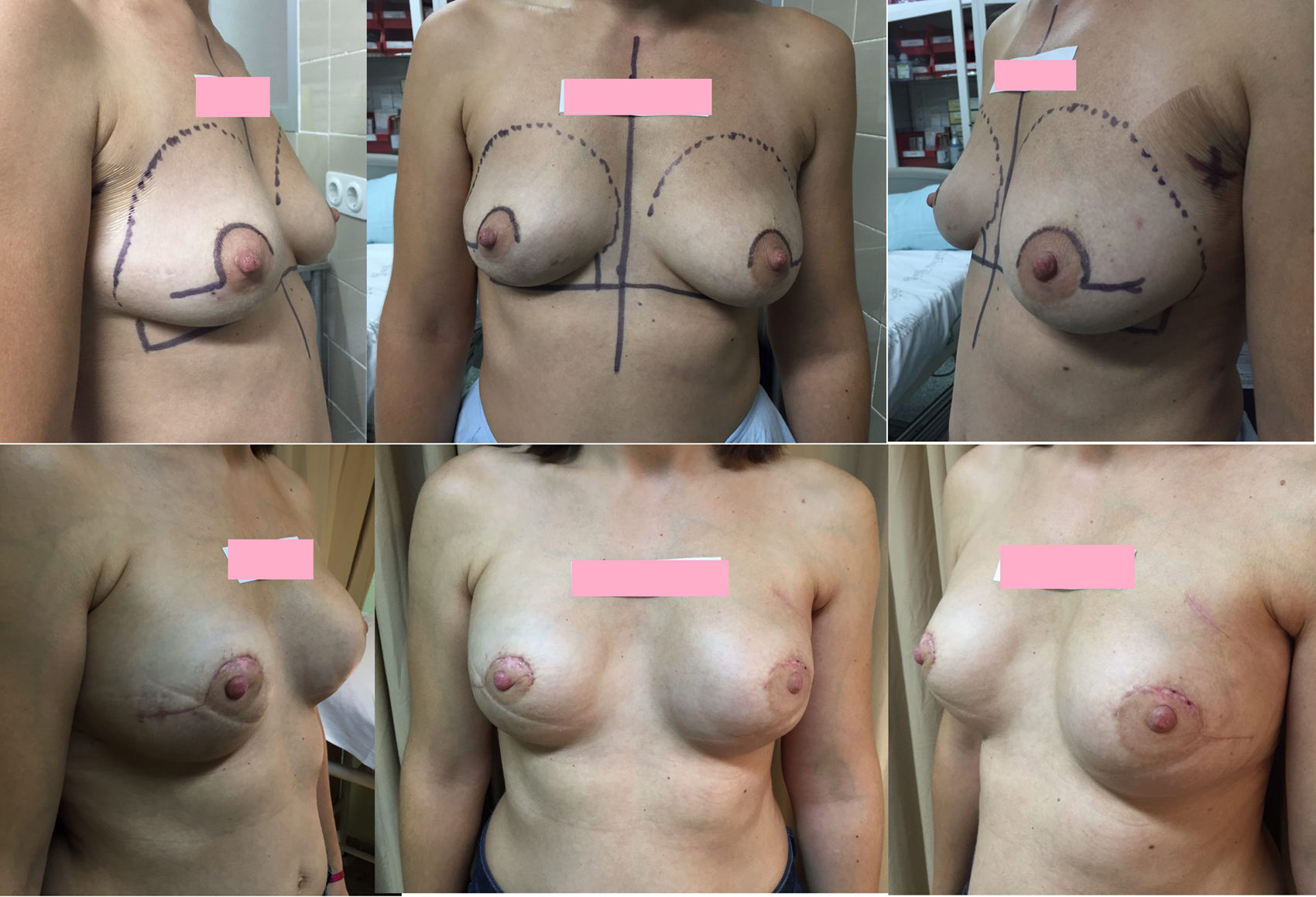
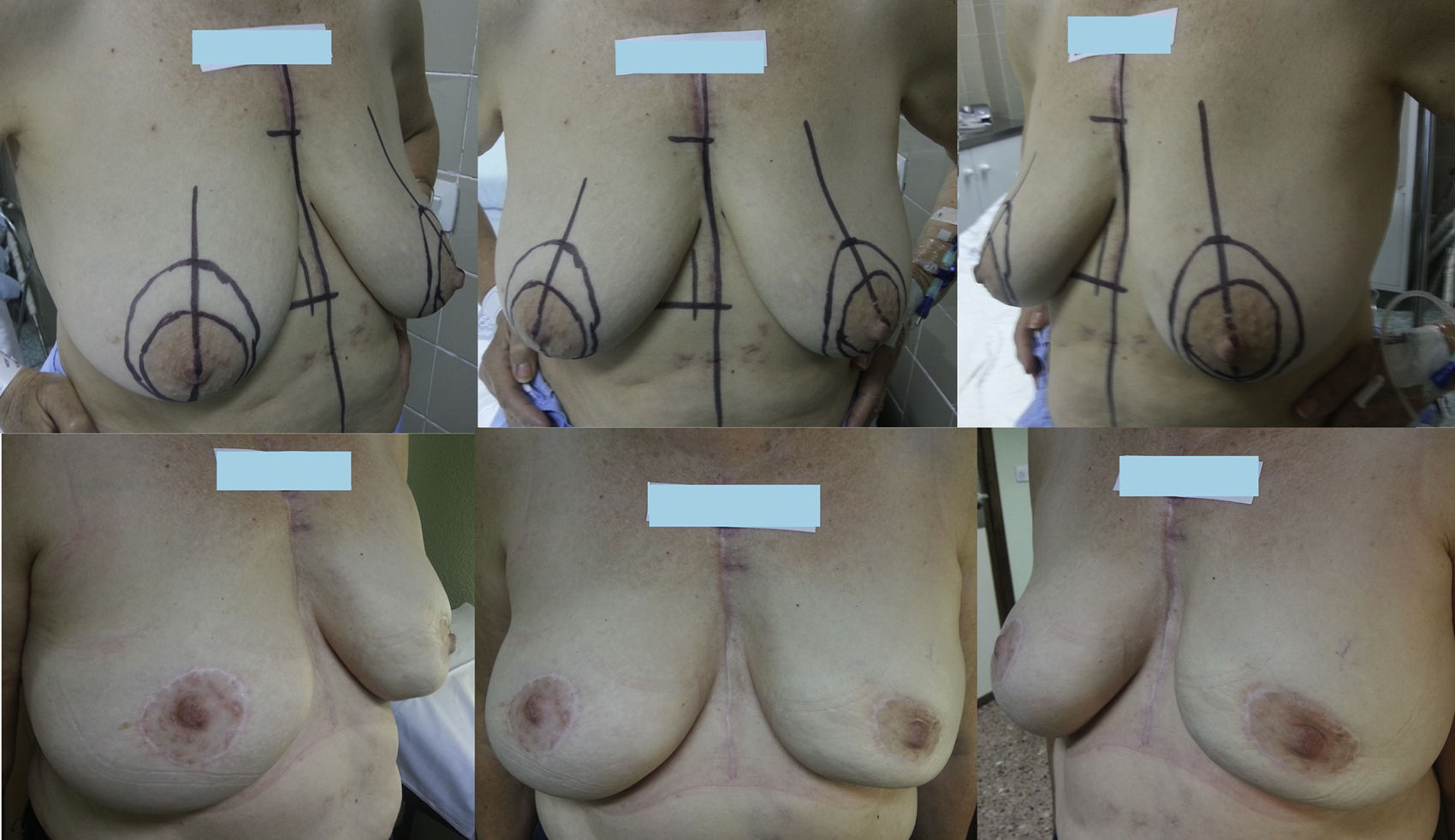
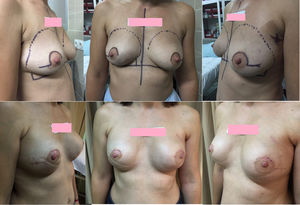
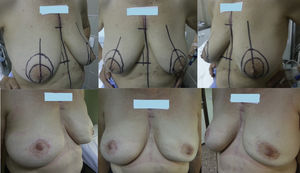
En 40 casos (87%) se empleó la incisión en raqueta externa superior (fig. 2), realizándose en los 6 casos restantes (13%) una incisión tipo Roundblock (fig. 3).
Se produjeron complicaciones postoperatorias precoces en 4 de los 46 casos (8,7%). Dos casos (4,3%) presentaron absceso posquirúrgico: uno mejoró con tratamiento antibiótico oral, el segundo requirió antibioterapia intravenosa y drenaje percutáneo. Ambos casos eran procesos neoplásicos, sin NA y sin malla. Ambos evolucionaron favorablemente y no se requirió extracción de la prótesis en ningún caso. En otros 2 casos (4,3%) se produjo una necrosis superficial de la areola que precisó curas locales, con buena evolución. Ninguna de estas complicaciones ocasionó un retraso en el tratamiento oncológico.
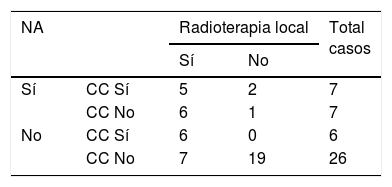
La complicación más frecuente a partir de los 6 meses de la cirugía fue la contractura capsular. Esta se desarrolló en el 28,3% del total de los casos. No se evidenció ningún caso en las pacientes que no habían recibido RT. Las mujeres que recibieron RT tenían un riesgo de contractura capsular 3,7 veces superior que las que no recibían RT (IC95%: 1,9 a 6,9). Sin embargo, este riesgo no se constató al asociar NA y RT (tabla 2).
Dentro de los casos de contractura capsular, 4 casos presentaron contractura de grados III-IV, con clínica de dolor o deformidad evidente, por lo que se realizó recambio de la prótesis con el objetivo de aliviar la sintomatología y mejorar el resultado estético final. Los casos restantes presentaron grados I-II, por lo que se trataron de manera conservadora.
En 3 casos sin contractura capsular, se realizó en un segundo tiempo un recambio de la prótesis por desproporción de tamaño con la mama contralateral o alteraciones estéticas significativas.
En 10 de los 46 casos (21,7%) se implantaron mallas titanizadas por lesión o incompetencia del músculo pectoral mayor, sin evidenciar complicaciones de las mismas en ningún caso.
El tiempo de seguimiento medio ha sido de 44 meses, con un seguimiento mínimo de 24 meses y máximo de 90 meses, sin evidenciar ningún caso de recidiva local a nivel de la mama ni en el CAP. En un caso, en el cual la BSGC fue negativa, existió una recidiva axilar a los 2 años de la cirugía inicial. Se realizó una linfadenectomía axilar, que evidenció un único ganglio afecto, con informe de adenocarcinoma apocrino. Durante el tiempo de seguimiento la paciente ha permanecido libre de enfermedad.
DiscusiónExiste alrededor de un 25% de pacientes con cáncer de mama en las cuales no está indicada la cirugía conservadora y son subsidiarias de mastectomía8. La cirugía radical conlleva una alteración completa de la anatomía mamaria y, a pesar de existir múltiples opciones reconstructivas con buenos resultados estéticos, la pérdida del pezón aumenta la sensación de mutilación y asocia una disconformidad importante en las pacientes9,10.
Con el objeto de evitar estos defectos estéticos posquirúrgicos y sus implicaciones emocionales, existe un interés creciente en técnicas como la MAP-CAP con reconstrucción inmediata en uno o 2 tiempos. Aunque persiste la duda acerca de su seguridad oncológica, ya se han publicado estudios y revisiones sistemáticas recientes que no evidencian diferencias con respecto a las técnicas clásicas en cuanto a recidiva local y supervivencia global11-13.
En nuestro centro se realiza esta técnica desde 2010. Inicialmente, se indicó en pacientes con mutaciones de los genes BRCA afectas por cáncer de mama. Aunque en un primer momento se contraindicó la técnica en tumores localmente avanzados, en los últimos años hemos incluido pacientes con tumores de mayor tamaño (T3) y afectación axilar (N1, N2) que han recibido quimioterapia NA con buena respuesta.
Uno de los principales inconvenientes clásicamente atribuidos a esta técnica es la posibilidad de recidiva local en el pezón. Muchos estudios han evaluado las tasas de afectación tumoral del pezón mediante el análisis del mismo en las piezas de mastectomía, con resultados muy dispares, que van desde el 0 al 58% en función de las series14,15, encontrándose en la mayoría de estudios en torno al 5-12% de casos de afectación16,17. En nuestro estudio, de todos los casos propuestos inicialmente para esta técnica, solo en 3 de los 49 casos se evidenció una afectación del CAP en el análisis intraoperatorio de la zona retroareolar, por lo que se realizó una conversión a MAP. La biopsia intraoperatoria del tejido retroareolar mediante cortes por congelación es una técnica con alta especificidad y sensibilidad para detectar afectación del CAP18-21. A pesar de la existencia de una minoría de falsos negativos, que se encuentra en torno al 8%18,22,23, las tasas de recidiva local en el CAP en la mayoría de las series no superan el 4%17,18,23-26, con un seguimiento medio de 52 meses.
En el momento actual, todavía no existe un consenso internacional para los criterios de indicación de esta técnica. En muchos grupos, todavía recomiendan la estricta selección de casos para minimizar el riesgo de recidiva local, indicándose la técnica en tumores pequeños (≤4cm), periféricos, alejados del CAP en >2cm, en pacientes sin afectación axilar17,27,28. Existen, sin embargo, artículos recientes que apoyan la realización de la MAP-CAP en casos de tumores localmente avanzados con buena respuesta al tratamiento NA, sin que esto implique un mayor número de recidivas locales21,26,29-36, lo cual coindice con nuestros resultados. En nuestra serie, con una media de seguimiento de 44 meses, ha existido un único caso de recidiva a nivel axilar.
La indicación de RT en este tipo de cirugía es un tema controvertido. Las indicaciones en nuestro centro han variado desde el inicio de la realización de la MAP-CAP. En el presente estudio se aplicó RT a más del 60% de los casos, un porcentaje superior a la mayoría de series21,37,38, con una alta tasa de contractura capsular asociada. En la literatura, encontramos estudios a favor de la administración de RT en estadios tumorales avanzados. Benediktsson et al.21, en un estudio que incluye 216 pacientes, evidencian la reducción de la tasa de recidiva local en al CAP con la aplicación de RT adyuvante en tumores en estadios avanzados. Otros autores, como Petit et al.16, apoyan la administración de RT intra o postoperatoria en tumores avanzados tras la MAP-CAP, consiguiendo resultados similares a la mastectomía clásica en términos de recidiva local y supervivencia. En el resto de casos, sin embargo, no existe un consenso sobre los criterios de indicación38. Es fundamental la individualización de cada caso atendiendo a dos puntos principales: por una parte, la existencia de factores de riesgo que puedan aumentar el riesgo de recidiva local en la paciente, tales como la edad menor de 50 años, la presencia de tumores de gran tamaño, de localización central o próximos al CAP, con afectación linfovascular, biología tumoral desfavorable, tumores multicéntricos o multifocales, y la afectación axilar37-40. Por otra parte, la técnica quirúrgica: resulta clave realizar una adecuada resección de la zona retroareolar, mediante la técnica de eversión del pezón, dejando el mínimo tejido indispensable para garantizar una adecuada vascularización del CAP41, así como un exhaustivo estudio intraoperatorio del tejido resecado. En la mayoría de estudios, las tasas publicadas de recidiva local en el pezón tras la MAP-CAP sin aplicación de RT oscilan entre un 0-4%24 en pacientes sin factores de riesgo. Con una adecuada selección de pacientes, un completo estudio preoperatorio y una técnica quirúrgica minuciosa, incluyendo el análisis intraoperatorio de la base del pezón, cabría la posibilidad de plantear la no irradiación mamaria, evitando así la toxicidad y las elevadas complicaciones derivadas de la misma, sin aumentar el riesgo de recidiva local. En nuestra serie ha existido un claro sobretratamiento de las pacientes, con el consiguiente aumento de las complicaciones asociadas a la RT. Aunque durante el periodo de estudio ya se realizó una modificación de los criterios de indicación, creemos que estos deberían ser más estrictos, restringiendo la irradiación a casos de tumores localmente avanzados o con márgenes próximos, lo que reduciría la morbilidad sin aumentar la recidiva local.
La tasa de complicaciones asociadas a la MAP-CAP es muy variable. La necrosis parcial del CAP se cifra en muchas series en torno al 5-20%, siendo escasos los casos de necrosis grave que requieren exéresis del CAP42,43. Como factores de riesgo se han descrito el volumen mamario42, el tabaquismo, el tipo de incisión43 y la administración de RT, entre otros. En nuestra serie solo en 2 casos (4,3%) se produjo una necrosis superficial de la areola que evolucionó favorablemente con tratamiento conservador, sin poder establecerse relación con el tipo de incisión ni con otros factores de riesgo.
En nuestra serie, en todos los casos se ha realizado una reconstrucción mamaria inmediata con prótesis definitiva en un único acto quirúrgico. Esta es una de las principales ventajas de esta técnica, la posibilidad de evitar un segundo tiempo quirúrgico para el recambio del expansor por la prótesis definitiva. Si bien es cierto que 7 de 46 casos (15,2%) han requerido un recambio de prótesis por contractura capsular de alto grado que ocasionaba molestias, o por la existencia de una asimetría mamaria importante, en los 39 casos restantes se ha conseguido evitar un segundo tiempo quirúrgico, con el impacto emocional y la posibilidad de morbilidad asociada que este conlleva. Es fundamental informar previamente a las pacientes acerca de los tratamientos complementarios, las posibles complicaciones, y la necesidad de reintervención en determinados casos.
Como conclusión, la MAP-CAP con reconstrucción inmediata en un solo tiempo constituye una opción terapéutica a valorar en casos seleccionados. Con un adecuado estudio preoperatorio y el análisis intraoperatorio de la base del pezón se consiguen bajas tasas de recidiva local, por lo que puede considerarse una técnica con adecuada seguridad oncológica. Con la reconstrucción inmediata con prótesis definitiva se evita un segundo tiempo quirúrgico en más del 80% de los casos. La tasa de contractura capsular posradioterapia es elevada, condicionando en los casos graves la necesidad de recambio de la prótesis, por lo que es importante restringir la administración de RT a los casos estrictamente necesarios en los que exista un claro beneficio oncológico.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesNo existe ningún conflicto de intereses.