Determinar las características de las metástasis mamarias colorrectales para realizar un diagnóstico diferencial y un tratamiento adecuados.
Caso clínicoSe presenta un caso de metástasis mamaria de un adenocarcinoma mucinoso de colon y se realiza un análisis de las características patológicas, radiológicas, de localización, latencia y supervivencia de los otros 34 casos publicados en la literatura.
ResultadosLa edad media al diagnóstico es de 53,3 años. Son tumores avanzados (el 48% en estadio C de Dukes y el 24% en estadio D) y el 75%, asociados a enfermedad metastásica difusa. Existe disparidad en el tratamiento realizado; en 12 no se realiza cirugía, en 7 se trata solo la lesión y en 4 casos más se estadifica también la axila.
ConclusionesLas metástasis en la mama de un primario de colon es una afección a tener en cuenta en el diagnóstico diferencial de las tumoraciones mamarias. La imagen radiológica características es una masa mamaria bien definida sin microcalcificaciones. El uso de citoqueratina 7 y 20 y los anticuerpos CDX2 y mamoglobina permiten diagnosticar el origen de la tumoración. El tratamiento debe ser individualizado y llevado a cabo por un equipo multidisciplinar, ya que en el caso de metástasis única no debe ser considerada una enfermedad diseminada.
To determine the characteristics of breast metastasis of colorectal origin in order to aid suitable differential diagnosis and treatment.
Case reportWe present a case of breast metastasis from a mucinous colon adenocarcinoma and describe the pathological and radiological characteristics, location, latency and survival of the other 34 cases reported in the literature.
ResultsThe mean age at diagnosis was 53.3 years. The tumours were typically advanced (Dukes stage C in 48% and stage D in 24%) and 75% were associated with metastatic disease in other locations. There was wide disparity in the treatment provided; surgery was not performed in 12, only the lesion was treated in 7, and the axilla was also staged in 4.
ConclusionsMetastases to the breast from a primary colon cancer is rare but should be considered in the differential diagnosis of mammary tumours. The radiological image is a well-defined breast mass usually without microcalcifications. Currently, the use of cytokeratin 7 and 20, CDX2 monoclonal antibodies and mammaglobin allows clear differentiation of the origin of the tumour. Treatment must be individualized and undertaken by a multidisciplinary team, because, in the case of single metastasis, they should not be considered a widely disseminated disease.
Las metástasis en la mama de origen extramamario son raras, entre un 2 y un 6%1. Los linfomas, las leucemias, los melanomas y los carcinomas bronquiales son los que más frecuentemente las causan2, siendo los de origen colorrectal extremadamente raros. Su diagnóstico precoz es muy importante, ya que el tratamiento en sí y sobre todo su pronóstico difieren en función del origen de estas lesiones.
Caso clínicoSe presenta un caso de una metástasis en la mama de un adenocarcinoma mucinoso de colon y se realiza un análisis estadístico descriptivo de los otros 34 casos publicados en la literatura.
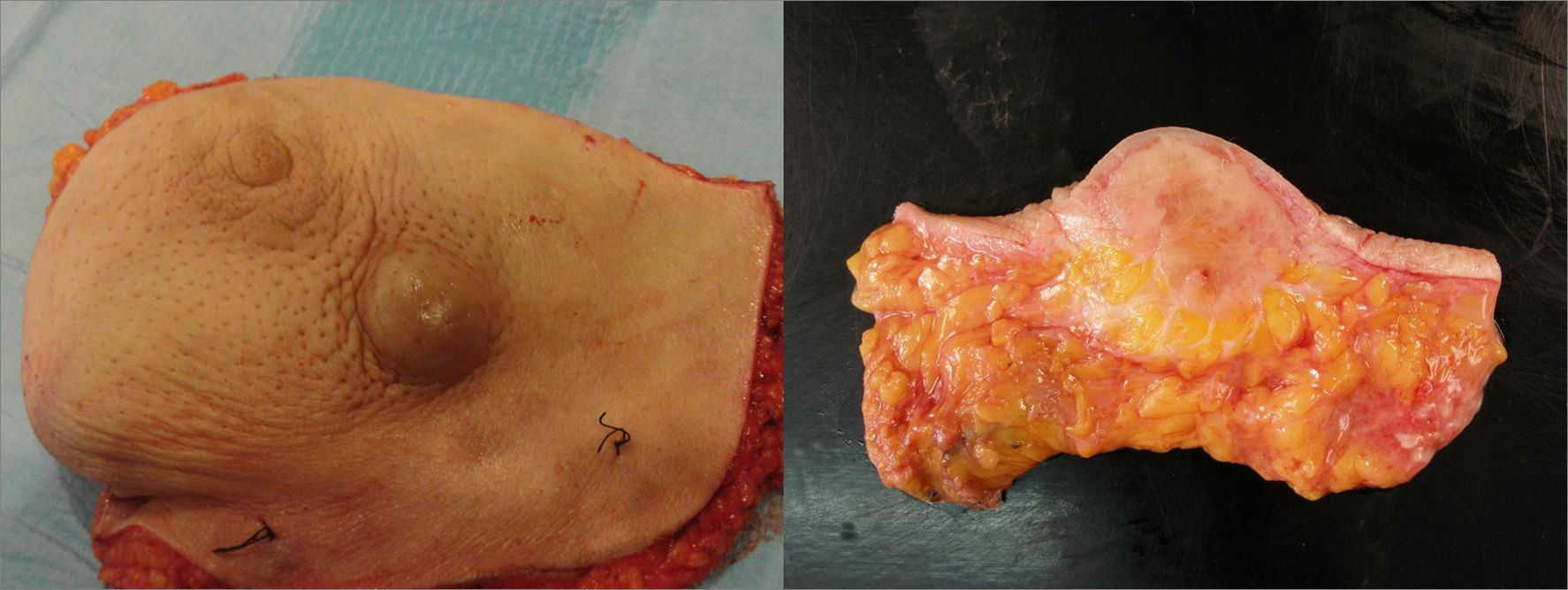
Se trata de una mujer de 92 años, que en la consulta de seguimiento tras ser intervenida de un adenocarcinoma mucinoso de colon derecho (T4N0M0) 7 meses antes, presenta una tumoración en el borde areolar inferior de la mama izquierda. En la mamografía se evidencia una masa con edema circundante y se diagnostica de un carcinoma mucinoso de 2,5cm que puede ser compatible con el primario de colon ya intervenido. Se descartan otras metástasis en el estudio de extensión y se realiza una mastectomía por la importante exteriorización y el riesgo de ulceración de la lesión (fig. 1).
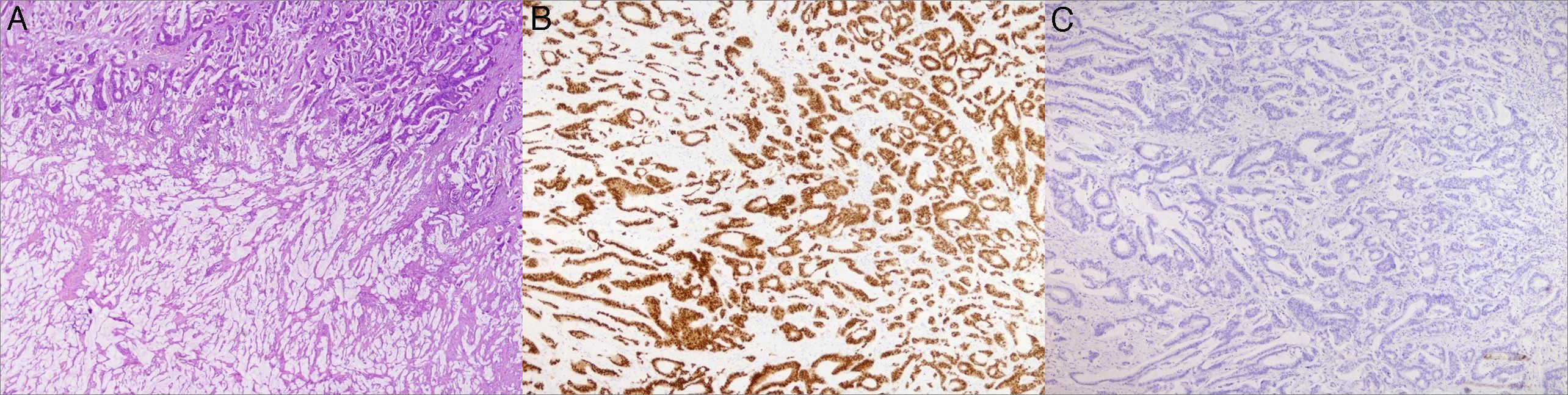
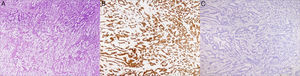
La anatomía patológica definitiva evidencia un adenocarcinoma mucinoso con positividad para citoqueratina de amplio espectro (AE1/AE2) y el anticuerpo monoclonal CDX-2, positividad focal para la citoqueratina 20 y negatividad para receptores estrogénicos, de progesterona, para la citoqueratina 7 y el anticuerpo mamoglobina; se confirma así que se trata de una metástasis del tumor primario ya intervenido (fig. 2). Por la edad de la paciente no se administra terapia adyuvante, y tras un seguimiento de 17meses permanece viva y libre de enfermedad.
Izquierda: lesión tumoral de la mama donde se puede apreciar la amplia cantidad de material de mucina (zona central) (HE, ×40).
Centro: lesión tumoral de la mama (zona periférica), con positividad nuclear para CDX-2 (monoclonal de ratón antihumano CDX-2, clon DAK-CDX-2; Dako Corp.) para la identificación de adenocarcinomas y tumores carcinoides del tracto gastrointestinal (HE, ×40).
Derecha: lesión tumoral de la mama (zona periférica), con ausencia de tinción para la mamoglobina (monoclonal de ratón antihumano mamoglobina, clon 304-1A5; Dako Corp.) para la identificación del carcinoma ductal de mama (HE, ×40).
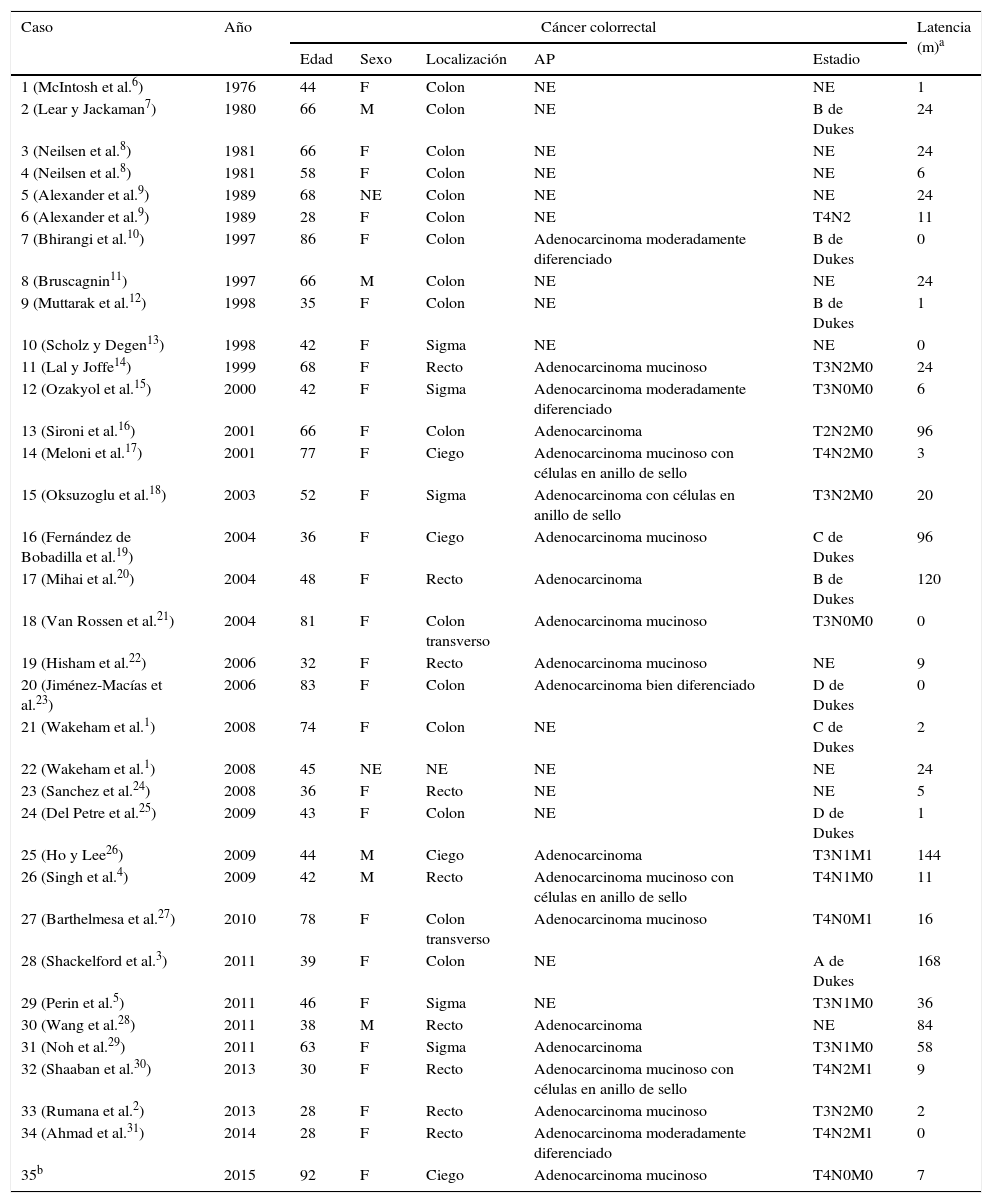
En la tabla 1 se resumen los casos publicados hasta el momento con sus principales características patológicas, radiológicas, de localización, tiempo de latencia y supervivencia.
Metástasis en la mama de adenocarcinoma primario colorrectal
| Caso | Año | Cáncer colorrectal | Latencia (m)a | ||||
|---|---|---|---|---|---|---|---|
| Edad | Sexo | Localización | AP | Estadio | |||
| 1 (McIntosh et al.6) | 1976 | 44 | F | Colon | NE | NE | 1 |
| 2 (Lear y Jackaman7) | 1980 | 66 | M | Colon | NE | B de Dukes | 24 |
| 3 (Neilsen et al.8) | 1981 | 66 | F | Colon | NE | NE | 24 |
| 4 (Neilsen et al.8) | 1981 | 58 | F | Colon | NE | NE | 6 |
| 5 (Alexander et al.9) | 1989 | 68 | NE | Colon | NE | NE | 24 |
| 6 (Alexander et al.9) | 1989 | 28 | F | Colon | NE | T4N2 | 11 |
| 7 (Bhirangi et al.10) | 1997 | 86 | F | Colon | Adenocarcinoma moderadamente diferenciado | B de Dukes | 0 |
| 8 (Bruscagnin11) | 1997 | 66 | M | Colon | NE | NE | 24 |
| 9 (Muttarak et al.12) | 1998 | 35 | F | Colon | NE | B de Dukes | 1 |
| 10 (Scholz y Degen13) | 1998 | 42 | F | Sigma | NE | NE | 0 |
| 11 (Lal y Joffe14) | 1999 | 68 | F | Recto | Adenocarcinoma mucinoso | T3N2M0 | 24 |
| 12 (Ozakyol et al.15) | 2000 | 42 | F | Sigma | Adenocarcinoma moderadamente diferenciado | T3N0M0 | 6 |
| 13 (Sironi et al.16) | 2001 | 66 | F | Colon | Adenocarcinoma | T2N2M0 | 96 |
| 14 (Meloni et al.17) | 2001 | 77 | F | Ciego | Adenocarcinoma mucinoso con células en anillo de sello | T4N2M0 | 3 |
| 15 (Oksuzoglu et al.18) | 2003 | 52 | F | Sigma | Adenocarcinoma con células en anillo de sello | T3N2M0 | 20 |
| 16 (Fernández de Bobadilla et al.19) | 2004 | 36 | F | Ciego | Adenocarcinoma mucinoso | C de Dukes | 96 |
| 17 (Mihai et al.20) | 2004 | 48 | F | Recto | Adenocarcinoma | B de Dukes | 120 |
| 18 (Van Rossen et al.21) | 2004 | 81 | F | Colon transverso | Adenocarcinoma mucinoso | T3N0M0 | 0 |
| 19 (Hisham et al.22) | 2006 | 32 | F | Recto | Adenocarcinoma mucinoso | NE | 9 |
| 20 (Jiménez-Macías et al.23) | 2006 | 83 | F | Colon | Adenocarcinoma bien diferenciado | D de Dukes | 0 |
| 21 (Wakeham et al.1) | 2008 | 74 | F | Colon | NE | C de Dukes | 2 |
| 22 (Wakeham et al.1) | 2008 | 45 | NE | NE | NE | NE | 24 |
| 23 (Sanchez et al.24) | 2008 | 36 | F | Recto | NE | NE | 5 |
| 24 (Del Petre et al.25) | 2009 | 43 | F | Colon | NE | D de Dukes | 1 |
| 25 (Ho y Lee26) | 2009 | 44 | M | Ciego | Adenocarcinoma | T3N1M1 | 144 |
| 26 (Singh et al.4) | 2009 | 42 | M | Recto | Adenocarcinoma mucinoso con células en anillo de sello | T4N1M0 | 11 |
| 27 (Barthelmesa et al.27) | 2010 | 78 | F | Colon transverso | Adenocarcinoma mucinoso | T4N0M1 | 16 |
| 28 (Shackelford et al.3) | 2011 | 39 | F | Colon | NE | A de Dukes | 168 |
| 29 (Perin et al.5) | 2011 | 46 | F | Sigma | NE | T3N1M0 | 36 |
| 30 (Wang et al.28) | 2011 | 38 | M | Recto | Adenocarcinoma | NE | 84 |
| 31 (Noh et al.29) | 2011 | 63 | F | Sigma | Adenocarcinoma | T3N1M0 | 58 |
| 32 (Shaaban et al.30) | 2013 | 30 | F | Recto | Adenocarcinoma mucinoso con células en anillo de sello | T4N2M1 | 9 |
| 33 (Rumana et al.2) | 2013 | 28 | F | Recto | Adenocarcinoma mucinoso | T3N2M0 | 2 |
| 34 (Ahmad et al.31) | 2014 | 28 | F | Recto | Adenocarcinoma moderadamente diferenciado | T4N2M1 | 0 |
| 35b | 2015 | 92 | F | Ciego | Adenocarcinoma mucinoso | T4N0M0 | 7 |
| Caso | Metástasis en la mama | Otras metástasis | Supervivencia (m)c | Vivo d | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Localización | Mama | Imagen mamográfica | Método diagnóstico | Tamaño (cm) | Técnica quirúrgica | AP | ||||
| 1 | NE | NE | NE | BE | NE | NE | NE | NE | 4 | Sí |
| 2 | NE | Izquierda | NE | NE | 3 | NE | NE | NE | NE | NE |
| 3 | Cuadrante inferoexterno | Derecha | NE | NE | 4 | NE | NE | Peritoneo, piel | 6 | No |
| 4 | Cuadrante inferoexterno | Izquierda | NE | NE | 3 | NE | NE | Peritoneo, hígado | 4 | No |
| 5 | NE | NE | NE | NE | NE | NE | NE | NE | 6 | Sí |
| 6 | NE | NE | NE | BE | NE | NE | NE | NE | 24 | No |
| 7 | Cuadrante superoexterno | Derecha | NE | PAAF | 2 | Tumorectomía y linfadenectomía | Adenocarcinoma pobremente diferenciado | No | 18 | Sí |
| 8 | Central | Izquierda | Masa | NE | 2,2 | NE | NE | NE | NE | NE |
| 9 | Bilateral | Masa | NE | NE | NE | NE | NE | NE | NE | |
| 10 | Unión cuadrantes externos | Derecha | Calcificación | NE | NE | NE | NE | NE | NE | NE |
| 11 | Cuadrante superoexterno | Izquierda | NE | BE | NE | Tumorectomía | Adenocarcinoma moderadamente diferenciado | Hígado, pulmón, cerebro, piel | 4 | No |
| 12 | Cuadrante superoexterno | Derecha | NE | BE | 3 | Tumorectomía | Adenocarcinoma mucinoso | Retroperitoneo, colon | 14 | NE |
| 13 | NE | Derecha | NE | PAAF | NE | No cirugía | Adenocarcinoma | Pulmón, piel | NE | Sí |
| 14 | Cuadrante superoexterno | Izquierda | Masa | PAAF | 2 | Tumorectomía | Adenocarcinoma mucinoso | No | 6 | Sí |
| 15 | Cuadrante superoexterno | Izquierda | Masa | NE | 1,4 | No cirugía | Adenocarcinoma mucinoso con células en anillo de sello | Hueso, pleura, ganglios | 2 | Sí |
| 16 | Cuadrante superoexterno | Izquierda | Masa | BE | 4 | Mastectomía simple | Adenocarcinoma mucinoso con células en anillo de sello | Peritoneo, retroperitoneo | 6 | NE |
| 17 | Cuadrante inferointerno | Izquierda | Masa | BAG | 1 | Tumorectomía | Adenocarcinoma pobremente diferenciado | Pulmón, útero, ovario | 4 | Sí |
| 18 | NE | Derecha | Masa | PAAF | 2,5 | Mastectomía radical | Adenocarcinoma mucinoso | No | 16 | No |
| 19 | NE | Izquierda | NE | NE | 2 | No cirugía | NE | Ocular, vértebra | 2 | NE |
| 20 | NE | Izquierda | Masa | BAG | NE | No cirugía | Adenocarcinoma | Peritoneo, ganglionar cuello | NE | NE |
| 21 | Bilateral | Masa | BE | 6 | NE | NE | NE | NE | NE | |
| 22 | Bilateral | Masa | BAG | 2 | NE | NE | Retroperitoneo, hígado, pulmón, pelvis | NE | NE | |
| 23 | Cuadrante superoexterno | Izquierda | NE | BAG | 6 | NE | NE | Perineo, vulva | NE | NE |
| 24 | Cuadrante superoexterno | Derecha | NE | NE | 4,5 | No cirugía | NE | NE | NE | NE |
| 25 | Cuadrante superoexterno | Derecha | Masa | BAG | 1,5 | No cirugía | Adenocarcinoma | Hígado, pulmón | 12 | No |
| 26 | Cuadrante superoexterno | Derecha | Masa | BAG | 5 | NE | Adenocarcinoma mucinoso con células en anillo de sello | Hígado, pulmón, vértebra | 2 | No |
| 27 | Cuadrante superoexterno | Izquierda | Masa | BAG | 1 | No cirugía | Adenocarcinoma mucinoso | Peritoneo | 4 | No |
| 28 | Cuadrante superoexterno | Izquierda | NE | BAG | 11 | NE | Adenocarcinoma | NE | NE | NE |
| 29 | Cuadrante inferoexterno | Derecha | Negativa | PAAF | 1 | Tumorectomía | NE | Pulmón | 16 | No |
| 30 | Central | Derecha | NE | BAG | 6 | Mastectomía radical | Adenocarcinoma moderadamente diferenciado | Hígado | 2 | No |
| 31 | Cuadrante inferointerno | Derecha | Negativa | BAG | 1,1 | Tumorectomía y BSGC | Adenocarcinoma | Pulmón | NE | NE |
| 32 | Bilateral | Masa | PAAF | 1,5 | No cirugía | Adenocarcinoma mucinoso con células en anillo de sello | Hueso | 6 | No | |
| 33 | Bilateral | Masa | PAAF | 3 | No cirugía | Adenocarcinoma mucinoso | No | 2 | Sí | |
| 34 | Cuadrante superointerno | Derecha | Masa y microcalcificación | BAG | 2 | No cirugía | Adenocarcinoma moderadamente diferenciado | Hígado | NE | NE |
| 35 | Central | Izquierda | Masa | BAG | 3 | Mastectomía simple | Adenocarcinoma mucinoso | No | 17 | Sí |
AP: Anatomía Patológica; BAG: biopsia con aguja gruesa; BE: biopsia escisional; BSGC: biopsia selectiva del ganglio centinela; F: femenino; M: masculino; NE: no especificado en el artículo; PAAF: punción-aspiración con aguja fina.
Las metástasis mamarias de origen colorrectal con frecuencia se diagnostican junto con otras metástasis, por lo que se consideran sinónimo de enfermedad metastásica diseminada y un marcador de mal pronóstico. Tanto en nuestro caso como en otros 6 más de la literatura esta metástasis es única, por lo que conviene reconsiderar el tratamiento habitualmente administrado y realizar uno individualizado, sobre todo para los casos de metástasis mamaria única, pero también para pacientes con una aceptable calidad de vida.
En la revisión de la literatura se han evidenciado 34 casos publicados con una edad media en el momento del diagnóstico de 53,3 años, de los cuales el 75,7% son mujeres.
El origen primario del tumor fue el colon en 25 casos (sobre todo ciego y sigma) y en otros 10 el origen fue rectal. En el 48% de los casos el tumor primario se diagnostica en un estadio C de Dukes. La mayoría son adenocarcinomas mucinosos típicos (20%) y otros están asociados a adenocarcinomas con células en anillo de sello (otro 20% más). Estos porcentajes apoyan el peor pronóstico asociado a la diferenciación mucinosa, ya establecida previamente en el carcinoma colorrectal.
La mediana de latencia entre el diagnóstico del carcinoma colorrectal y la metástasis mamaria es de 30,17meses (rango entre 0 y 7 años). En 5 de los 35 casos este diagnóstico es sincrónico y en uno de ellos la enfermedad mamaria fue la primera manifestación clínica del tumor colorrectal.
En cuanto al lugar de asentamiento, a diferencia de la preferencia por la mama izquierda descrita por Shackelford et al.3, se distribuyen por igual. Aunque en la casi totalidad de los casos el tumor asienta en el cuadrante superoexterno.
Estas lesiones suelen presentarse como nódulos solitarios que no provocan retracción del complejo aréola-pezón y que mamográficamente se corresponden a una masa, generalmente sin microcalcificaciones. En la revisión se evidencia esta masa en 16 casos, en uno solo se observan microcalcificaciones y en otros 2 no se evidencia mamográficamente la lesión. Wakeham et al.1, en una revisión de las imágenes mamográficas de estos tumores, concluyen que pueden mimetizar la apariencia de un carcinoma mamario multifocal e incluso un proceso benigno de la mama, sobre todo cuando los tumores son productores de mucina.
El carcinoma colorrectal que metastatiza en la mama necesita ser distinguido del adenocarcinoma primario de la mama, ya que este puede mimetizar con un adenocarcinoma primario mal diferenciado. Las características histológicas de estas metástasis son: histología atípica o inusual, distribución periductal y perilobulillar, ausencia de componente in situ, múltiples nódulos satélites asociados a la masa principal, infiltración linfovascular extensa y fenotipo triple negativo4.
Generalmente, cuando se confirma una metástasis de un carcinoma colorrectal se realiza un tratamiento adyuvante mediante quimioterapia. A lo largo de los casos publicados, de no tratar quirúrgicamente (12 casos) o realizar solo un tratamiento local con tumorectomía (5) o mastectomía simple (2) se ha empezado a realizar no solo el tratamiento de la lesión mamaria, sino a tratar o estadificar la axila mediante linfadenectomías (3) o mediante biopsia selectiva del ganglio centinela (1). Anecdóticamente se ha publicado un caso en donde se evidencia una metástasis linfática axilar tras una metástasis mamaria de origen colorrectal5, en el que se plantea que las metástasis mamarias de tumores sólidos son capaces a su vez de metastatizar a través de las mismas vías en las que lo hace un tumor primario de mama.
La asociación entre las metástasis en la mama y una enfermedad metastásica en otras localizaciones es un hecho, y la localización más frecuente es el pulmón, seguido del hígado y el peritoneo. El tiempo medio de supervivencia de los que fallecen a lo largo del seguimiento es de 6,5 meses, estando 9 pacientes vivos al final de este. De ellos, 3 tienen enfermedad en otras localizaciones y 5 permanecen libres de enfermedad. Todo ello tras un periodo de seguimiento medio de 7,55meses (rango entre 2 y 17meses).
Como hemos visto previamente, en el 33% de los casos la metástasis mamaria es única, por lo que es aquí donde hay que plantearse que un tratamiento quirúrgico con intención curativa y una estadificación axilar puede ser adecuado, además de asociar el tratamiento adyuvante necesario por tratarse de una afectación metastásica.
Conclusiones- 1.
En el seguimiento tras el diagnóstico y el tratamiento de un carcinoma colorrectal se debe incluir una exploración física de todos los aparatos tanto en mujeres como en varones.
- 2.
El tipo histológico de adenocarcinoma mucinoso es el más frecuentemente asociado a las metástasis en la mama.
- 3.
La imagen radiológica suele ser una masa bien definida, generalmente sin microcalcificaciones o distorsión parenquimatosa, aunque pueden mimetizar un cáncer de mama multifocal o incluso procesos benignos.
- 4.
El uso de citoqueratina 7, citoqueratina 20, los anticuerpos CDX2 y mamoglobina permite diferenciar claramente el origen de la tumoración. Si es el colon, presentará positividad para citoqueratinas de amplio espectro (AE1/AE3), citoqueratina 20 y el anticuerpo CDX2 y negatividad para el anticuerpo mamoglobina y la citoqueratina 7. Aunque por ello no se debe dejar de informar claramente al patólogo acerca de los antecedentes, sobre todo oncológicos, del paciente.
- 5.
El tratamiento debe ser individualizado, considerando el local e incluso el regional de la axila, además del sistémico cuando no se evidencia enfermedad en otras localizaciones o cuando el paciente tiene una supervivencia total esperada moderada, ya que se recogen casos de supervivencias mayores de los 2 años.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.