El objetivo de nuestro estudio es evaluar el impacto combinado de cada uno de los perfiles moleculares del cáncer de mama, subrogados inmunohistoquímicamente junto con la carga tumoral total del ganglio centinela como predictores de afectación metastásica en los ganglios axilares no centinela.
Material y métodosSe incluyeron 373 pacientes de carcinoma infiltrante de mama con ganglio centinela metastásico y linfadenectomía axilar, procedentes de seis hospitales españoles. Se aplicaron los criterios de ST Gallen para definir el perfil molecular. Se realizó un análisis multivariante para definir diferentes modelos predictivos y se estudiaron las distribuciones de densidad de probabilidad de la carga tumoral para cada perfil molecular en los casos con axila metastásica y no metastásica en los ganglios no centinela.
ResultadosHubo un 66% de linfadenectomías axilares metastásicas. Se obtuvieron 7 modelos predictivos cuyas áreas bajo la curva ROC oscilaron entre 0,65 y 0,77. El mejor modelo fue el basado en la carga tumoral total, tipo histológico, diámetro tumoral, grado, invasión linfovascular, perfil molecular y número total de ganglios centinela. Las mayores diferencias de densidad de probabilidad de la carga tumoral total se producen entre las distribuciones de casos positivos y negativos de los perfiles moleculares BH, TN y HER2.
ConclusiónLa inclusión del perfil molecular en el modelo mejora el área bajo la curva ROC, especialmente si se incluye también el número total de cganglios centinela. Se observan diferencias entre los distintos perfiles moleculares para el valor predictivo de la carga tumoral total.
To evaluate the combined impact of each of the immunohistochemically surrogated molecular signatures (PM) of breast cancer subtype along with the total tumor load (CTT) of the sentinel node (SN) as a predictor of non-SN metastatic involvement.
MethodsWe included 373 patients diagnosed with infiltrating breast cancer with metastatic SN who underwent subsequent axillary lymph node dissection (ALND) from six hospitals. The surrogate MS for each case was defined as per ST Gallen definitions. A multivariate analysis was conducted to estimate the predictive model and normal kernel functions to fit the density distributions of the total tumoral load for each molecular signatures.
ResultsMetastatic involvement of the axillary lymph node was identified in 66% of the patients. We obtained seven different predictive models with an area under curve (AUC) ranging from 0.65 to 0.77. The best model was based on the CTT, histological type, tumor size, stage, lymphatic invasion, MS, and the total number of SN. The greatest differences in the density functions of the CTT were found in the PM for positive and negative cases of the BH, TN and HER2 subtypes.
ConclusionsThe inclusion of PM in the multivariate model improved the AUC, especially when the total number of sentinel nodes were included. Differences were observed in the impact of the CTT among the different smolecular profiles subtypes.
El tratamiento regional de pacientes con ganglio centinela (GC) metastásico es controvertido ya que los impactos de la linfadenectomía en la recidiva locorregional, intervalo libre de enfermedad y supervivencia global no están totalmente definidos1–4.
El ensayo NSABP-B32 demostró que la linfadenectomía axilar (LA) no beneficiaba a las pacientes con GC negativo5,6 pero existen dudas acerca de si la LA es necesaria en todos los casos de GC metastásico. Los datos de la literatura muestran que, en aproximadamente el 60% de las pacientes, el GC es el único metastásico por lo que la LA podría ser innecesaria. A pesar de que el estudio molecular de la axila muestra mayores tasas de afectación que el estudio convencional7, las tasas de recidiva axilar oscilan alrededor del 1% a los 5 años, lo cual cuestiona la indicación sistemática de la LA en todos los casos con ganglios centinela metastásico y sugiere la posibilidad de seleccionar un grupo de bajo riesgo en el que podría evitarse la cirugía axilar8–11. El ensayo ACOSOG Z0011 mostró que la LA no ofrece beneficio a las pacientes de bajo riesgo con uno o 2 GC metastásicos, datos que han sido confirmados en estudios posteriores4,12.
Ello ha dado lugar al desarrollo de nomogramas basados fundamentalmente en el diámetro tumoral, tipo histológico de tumor, invasión linfovascular e índice de proliferación (Ki-67)13–16 para seleccionar pacientes de bajo riesgo de afectación axilar en los que podría evitarse la LA. Aunque el valor predictivo de la mayoría de ellos es bastante bajo, mejora cuando se incluye el diámetro de la metástasis de acuerdo con los criterios del TNM17.
La carga tumoral total (CTT) es un concepto derivado del estudio OSNA del GC y estima el volumen de la metástasis de manera más precisa que el TNM, que se basa en la medición en milímetros del tumor, sobre el corte histológico. Se define la CTT como la suma del número de copias de ARNm de la citoqueratina 19 (ARNm-CK-19) de todos los GC y ha sido identificada por algunos autores como el factor independiente predictivo de metástasis en los ganglios axilares no centinela de mayor potencia18,19.
La inclusión de la CTT en el modelo predictivo de afectación axilar mejora los valores del área bajo la curva ROC (AUC) permitiendo una mejor individualización diagnóstica y terapéutica20–22. Por otra parte, se ha descrito que la tasa de metástasis axilares no centinelas varía en relación al inmunofenotipo tumoral (PM)19,20.
Nuestra hipótesis consiste en que la introducción tanto de la CTT como del PM en el modelo predictivo puede mejorar la predicción individual de metástasis en la linfadenectomía axilar, en los casos con GC positivo.
Nuestro objetivo principal es caracterizar el valor del PM y la CTT, mediante su inclusión en distintos modelos predictivos, para predecir el estado ganglionar del resto de la axila tras la biopsia de GC. El objetivo secundario del estudio es la caracterización de las densidades de probabilidad de la CTT en casos con metástasis positiva y negativa para cada PM. El impacto de este estudio es evitar linfadenectomías axilares innecesarias cuando el GC es positivo dadas las condiciones específicas del inmunofenotipo tumoral y el CTT.
Material y métodosDiseño del estudioEstudio retrospectivo observacional, multicéntrico, en pacientes diagnosticadas de carcinoma infiltrante de mama con GC metastásico (protocolo OSNA) y linfadenectomía axilar.
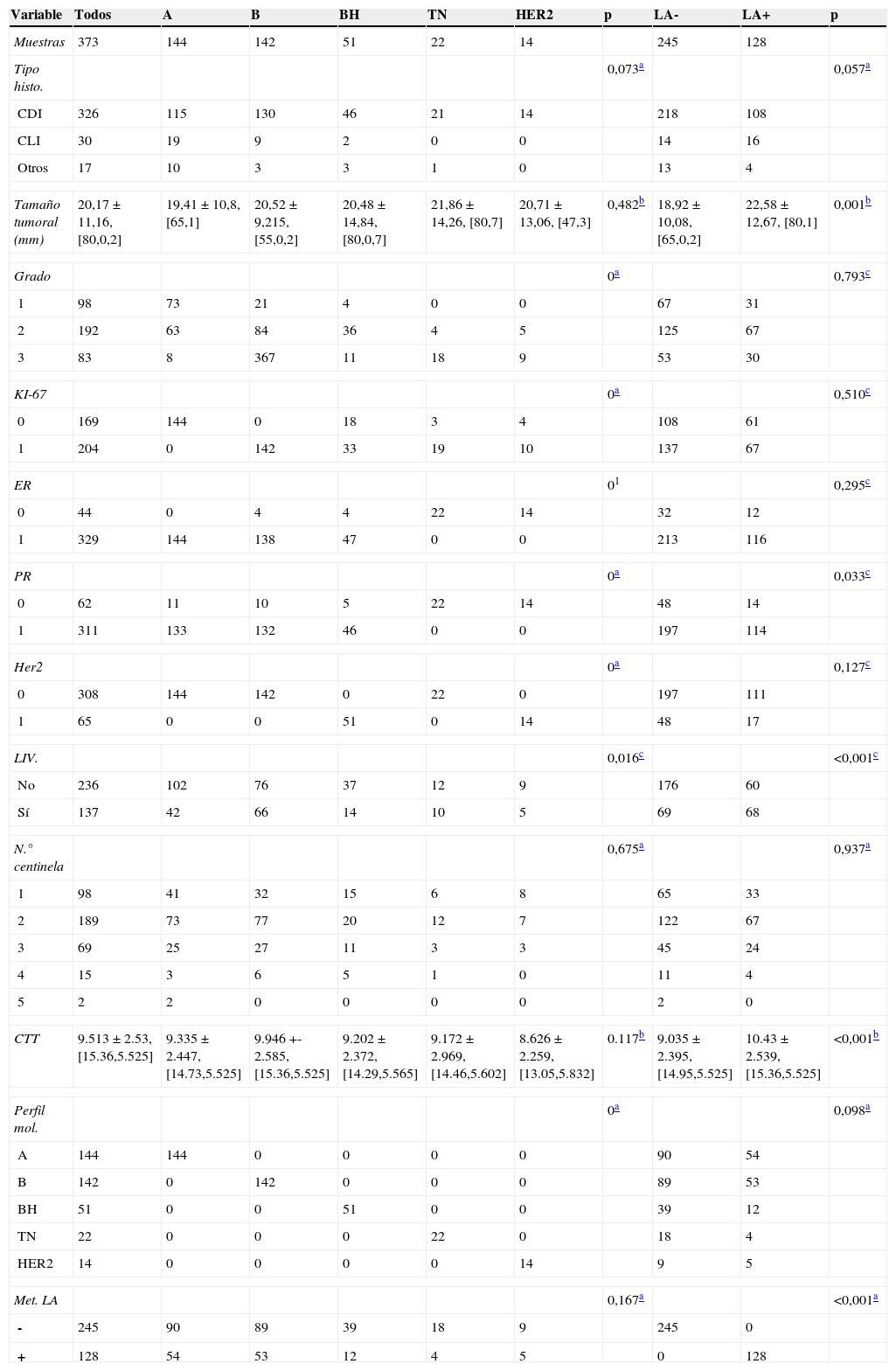
PacientesFueron seiscientos cuarenta y siete (647) pacientes procedentes de seis hospitales españoles. Se consideraron criterios de inclusión: tener un diagnóstico patológico de carcinoma infiltrante de mama, cN0, sin terapia sistémica primaria, sometidas a cirugía conservadora o mastectomía y biopsia selectiva de ganglio centinela. Todos los tumores primarios fueron clasificados según el subtipo molecular de acuerdo con los criterios inmunohistoquímicas subrogados aprobados en ST, Gallen 201322. De los 647 pacientes, solo 373 cumplieron los criterios de inclusión (tabla 1).
Descripción de las características de los pacientes
| Variable | Todos | A | B | BH | TN | HER2 | p | LA- | LA+ | p |
|---|---|---|---|---|---|---|---|---|---|---|
| Muestras | 373 | 144 | 142 | 51 | 22 | 14 | 245 | 128 | ||
| Tipo histo. | 0,073a | 0,057a | ||||||||
| CDI | 326 | 115 | 130 | 46 | 21 | 14 | 218 | 108 | ||
| CLI | 30 | 19 | 9 | 2 | 0 | 0 | 14 | 16 | ||
| Otros | 17 | 10 | 3 | 3 | 1 | 0 | 13 | 4 | ||
| Tamaño tumoral (mm) | 20,17±11,16, [80,0,2] | 19,41±10,8, [65,1] | 20,52±9,215, [55,0,2] | 20,48±14,84, [80,0,7] | 21,86±14,26, [80,7] | 20,71±13,06, [47,3] | 0,482b | 18,92±10,08, [65,0,2] | 22,58±12,67, [80,1] | 0,001b |
| Grado | 0a | 0,793c | ||||||||
| 1 | 98 | 73 | 21 | 4 | 0 | 0 | 67 | 31 | ||
| 2 | 192 | 63 | 84 | 36 | 4 | 5 | 125 | 67 | ||
| 3 | 83 | 8 | 367 | 11 | 18 | 9 | 53 | 30 | ||
| KI-67 | 0a | 0,510c | ||||||||
| 0 | 169 | 144 | 0 | 18 | 3 | 4 | 108 | 61 | ||
| 1 | 204 | 0 | 142 | 33 | 19 | 10 | 137 | 67 | ||
| ER | 01 | 0,295c | ||||||||
| 0 | 44 | 0 | 4 | 4 | 22 | 14 | 32 | 12 | ||
| 1 | 329 | 144 | 138 | 47 | 0 | 0 | 213 | 116 | ||
| PR | 0a | 0,033c | ||||||||
| 0 | 62 | 11 | 10 | 5 | 22 | 14 | 48 | 14 | ||
| 1 | 311 | 133 | 132 | 46 | 0 | 0 | 197 | 114 | ||
| Her2 | 0a | 0,127c | ||||||||
| 0 | 308 | 144 | 142 | 0 | 22 | 0 | 197 | 111 | ||
| 1 | 65 | 0 | 0 | 51 | 0 | 14 | 48 | 17 | ||
| LIV. | 0,016c | <0,001c | ||||||||
| No | 236 | 102 | 76 | 37 | 12 | 9 | 176 | 60 | ||
| Sí | 137 | 42 | 66 | 14 | 10 | 5 | 69 | 68 | ||
| N.° centinela | 0,675a | 0,937a | ||||||||
| 1 | 98 | 41 | 32 | 15 | 6 | 8 | 65 | 33 | ||
| 2 | 189 | 73 | 77 | 20 | 12 | 7 | 122 | 67 | ||
| 3 | 69 | 25 | 27 | 11 | 3 | 3 | 45 | 24 | ||
| 4 | 15 | 3 | 6 | 5 | 1 | 0 | 11 | 4 | ||
| 5 | 2 | 2 | 0 | 0 | 0 | 0 | 2 | 0 | ||
| CTT | 9.513±2.53, [15.36,5.525] | 9.335±2.447, [14.73,5.525] | 9.946 +-2.585, [15.36,5.525] | 9.202±2.372, [14.29,5.565] | 9.172±2.969, [14.46,5.602] | 8.626±2.259, [13.05,5.832] | 0.117b | 9.035±2.395, [14.95,5.525] | 10.43±2.539, [15.36,5.525] | <0,001b |
| Perfil mol. | 0a | 0,098a | ||||||||
| A | 144 | 144 | 0 | 0 | 0 | 0 | 90 | 54 | ||
| B | 142 | 0 | 142 | 0 | 0 | 0 | 89 | 53 | ||
| BH | 51 | 0 | 0 | 51 | 0 | 0 | 39 | 12 | ||
| TN | 22 | 0 | 0 | 0 | 22 | 0 | 18 | 4 | ||
| HER2 | 14 | 0 | 0 | 0 | 0 | 14 | 9 | 5 | ||
| Met. LA | 0,167a | <0,001a | ||||||||
| - | 245 | 90 | 89 | 39 | 18 | 9 | 245 | 0 | ||
| + | 128 | 54 | 53 | 12 | 4 | 5 | 0 | 128 | ||
Las columnas A, B, BH, TN, y HER2 son los perfiles moleculares. Las columnas LA+y LA- indican el estado de la linfadenectomía axilar. La tabla muestra tablas cruzadas para las variables discretas y la media±desviación estándar [y el rango] para las variables continuas. Se han calculado las diferencias significativas de cada variable con respecto al perfil molecular y el estado de la linfadenectomía mediante:
Todos los GC fueron estudiados siguiendo el protocolo OSNA recomendado por la SESPM23. Los GC metastásicos fueron clasificados, de acuerdo con el número de copias de ARNm-CK-19, en micrometástasis o macrometástasis24. Cada uno de los ganglios de la LA fue procesado para estudio histológico siguiendo el método convencional.
Variables y definicionesPara cada uno de los casos, se incluyeron en una base de datos electrónica, las siguientes variables: tipo histológico (WHO), diámetro tumoral (enmm), grado (1,2 o 3 siguiendo los criterios de Bloom-Ricardson), invasión linfovascular (sí/no) evaluada en la periferia del tumor, expresión inmunohistoquímica de receptores de estrógenos (RE) y de progesterona (RP) (positivo >1%, negativo <1%) de proliferación Ki67 (0 <14%, 1 >14%) HER2 (Hercep-Test™) (0/1+, 2+, 3+, siguiendo los criterios de la guía 2013)25 CTT y perfil molecular subrogado inmunohistoquímicamente (PM). Todos los datos fueron sometidos a un programa de control de calidad en referencia al cumplimiento y estabilidad especial de los mismos26.
Las definiciones aplicadas fueron las consensuadas en ST Gallen-2013 con mínimas modificaciones:
- •
Luminal A (A): positivo para RE y RP, negativo para HER2 y ki67<14%.
- •
Luminal B (B): positivo para RE, positivo para RP<al 20%, negativo para HER2, Ki-67 ≥ 14%.
- •
Luminal B/HER2 (B-H): positivo para RE, y positivo para HER2 (RP y Ki-67 no considerado en este grupo).
- •
HER2 (HER2): negativo para RE y RP, positivo para HER2 (Ki67 no considerado en este grupo).
- •
Triple negativo (TN): negativo para RE, RP y HER2 (Ki67 no considerado en este grupo).
Se aplicaron test de significación estadística para investigar diferencias significativas en variables individuales entre las pacientes LA+ y LA- y entre los distintos PM. Para el análisis de variables continuas (diámetro tumoral y CTT), se aplicó el test de varianza Kruskal–Wallis.
Para las variables discretas, se aplicó el test de Pearson's μL test o el test exacto de Fisher según el número de casos por grupo.
Para los modelos multivariantes, se aplicaron modelos gaussianos. Los modelos gaussianos se estimaron por máxima verosimilitud asumiendo matrices de covarianzas independientes entre clases. Además, se prepararon modelos basados en regresión logística para poder comparar nuestros resultados con los de estudios de la literatura. La evaluación de los modelos se realizó por medio del área bajo la curva ROC (AUC-ROC). Finalmente, se calcularon las distribuciones de densidad de probabilidad de la CTT para LA+ y LA- para cada PM mediante «kernel-density functions». Los modelos estudiados fueron evaluados mediante resustitución. Todos los análisis fueron realizados por medio de Matlab R2011a para Mac OS X.
ResultadosAnálisis univarianteSegún el PM, la mayoría de los casos fueron clasificados como luminal A y luminal B (144, 39 y 142, 38% respectivamente, de un total de 373 casos). Doscientos cuarenta y cinco casos (66%) tuvieron metástasis en la LA. El tipo histológico más frecuente fue ductal infiltrante (CDI, NOS) (326 de 373, 87%). El diámetro tumoral se asoció a LA+ (p=0,0014). El grado se asoció al PM (p≈0). La invasión linfovascular se asoció tanto al PM (p=0,0165) como al estado de la LA (p=2e-6). El número medio de GC fue de 2.
Tal y como se esperaba, la CTT se asoció al estado de la LA (p=1,3269e-06).
No se encontró relación entre el PM y el estado de la LA (p=0,1), siendo RP la única variable que mostró diferencias significativas en nuestro estudio.
Modelo multivarianteTodos los modelos multivariantes del estudio incluyeron únicamente variables conocidas o disponibles en el momento de la cirugía.
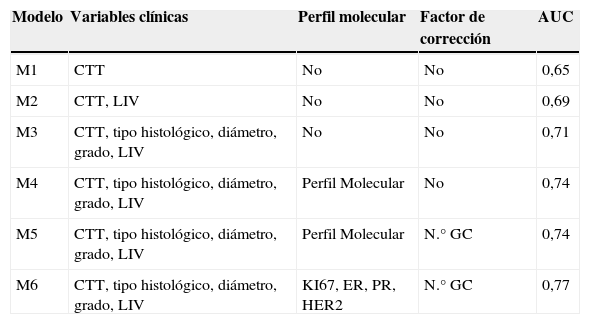
Inicialmente, se usó en modelo sencillo basado en la CTT (M1) para establecer nuestra línea basal. Para M1, se obtuvo una AUC-ROC de 0,65. Con la inclusión de la invasión linfovascular en el modelo (M2), el AUC-ROC fue de 0,69. El modelo M3 incluyó las variables del modelo M2 más el tipo histológico, el diámetro tumoral y el grado tumoral y se obtuvo una AUC-ROC de 0,71.
En el modelo 4 (M4), se incluyó, además, el PM y se obtuvo un AUC-ROC de 0,74. La inclusión del número de GC en el modelo predictivo (M5) no mejoró el AUC-ROC. En el modelo 6 (M6), se sustituyó el PM por las variables Ki-67, RE, RP y HER2, observándose una ligera mejora del AUC-ROC a 0,77. La tabla 2 describe las variables clínicas, las variables del inmunofenotipo y los factores correctivos incluidos en cada modelo predictivo, junto con su área bajo la curva ROC (AUC-ROC).
Modelos multivariados basados en variables clínicas, el perfil molecular y factores de corrección
| Modelo | Variables clínicas | Perfil molecular | Factor de corrección | AUC |
|---|---|---|---|---|
| M1 | CTT | No | No | 0,65 |
| M2 | CTT, LIV | No | No | 0,69 |
| M3 | CTT, tipo histológico, diámetro, grado, LIV | No | No | 0,71 |
| M4 | CTT, tipo histológico, diámetro, grado, LIV | Perfil Molecular | No | 0,74 |
| M5 | CTT, tipo histológico, diámetro, grado, LIV | Perfil Molecular | N.° GC | 0,74 |
| M6 | CTT, tipo histológico, diámetro, grado, LIV | KI67, ER, PR, HER2 | N.° GC | 0,77 |
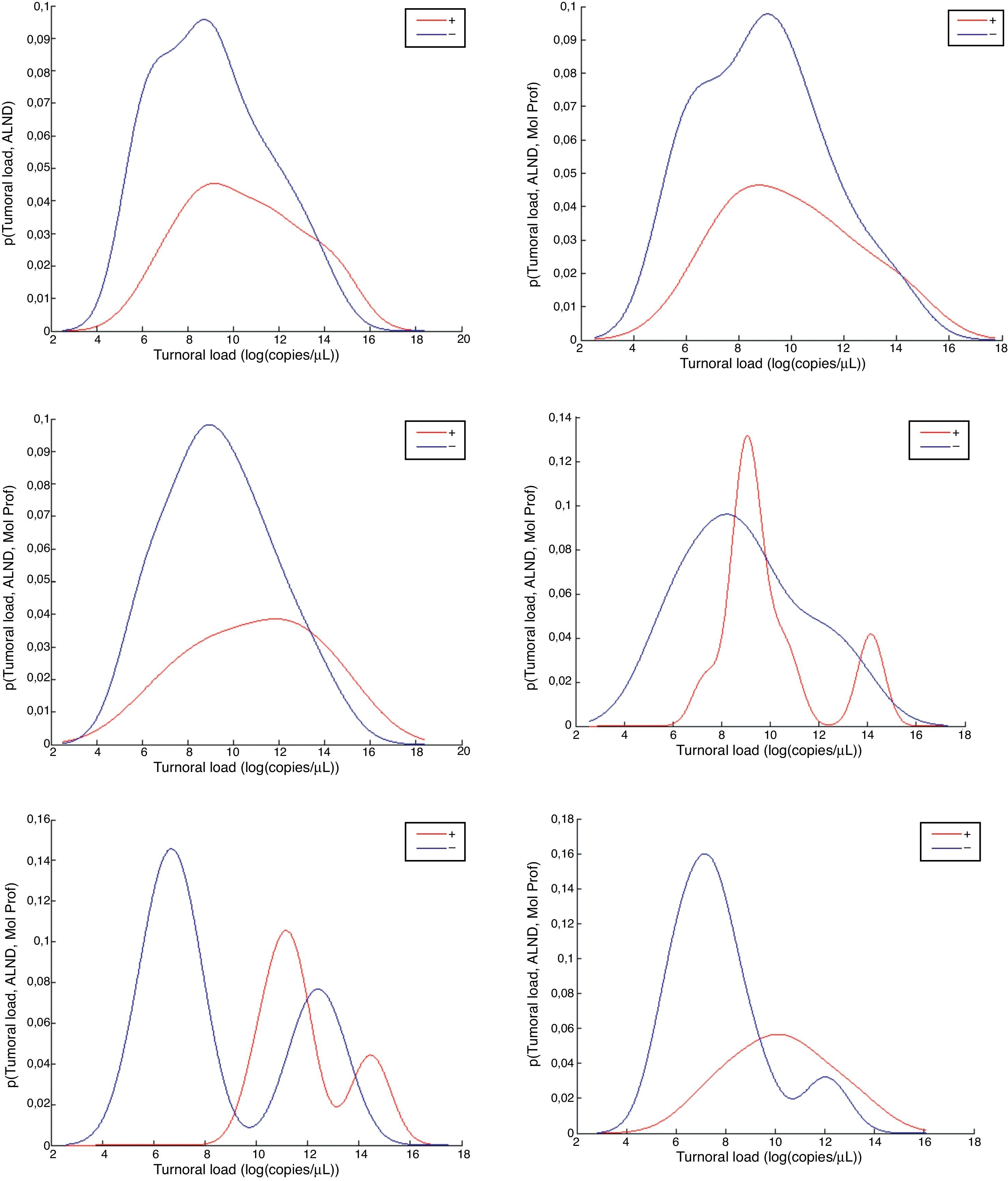
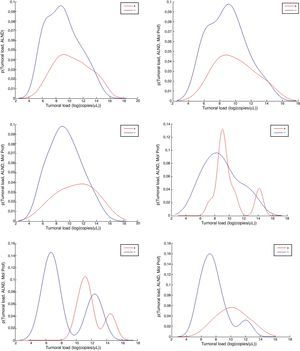
El interés de esta parte del estudio es encontrar el punto de corte de la CTT cuya densidad de función de los casos positivos estuviera por encima de la densidad de función de los negativos para cada PM. La figura 1 muestra las distribuciones de densidad de probablidad de la CTT para cada nivel de PM (todos, luminal A, luminal B, luminal B-Her2, triple negativo, HER2). Las distribuciones de los casos positivos se muestran en rojo y las distribuciones de los casos negativos en color azul (el color de esta figura solo puede apreciarse en la versión electrónica del artículo).
Distribuciones de densidad de probabilidad de la carga tumoral total para todos los casos y por perfiles moleculares.
Fila 1: todos, tipo A; fila 2: B, BH; fila 3: TN, y HER2). Se ha diferenciado entre casos LA+ (en rojo) y LA- (en azul). Los colores de esta figura solo pueden apreciarse en la versión electrónica del artículo.
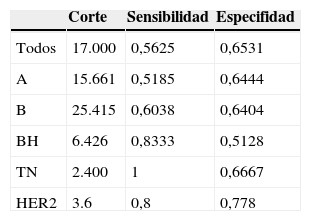
La tabla 3 muestra los valores de corte de CTT para cada PM en log(#/μL), obtenidas a partir de las densidades de probabilidad mostradas en la figura 1. Para cada corte, hemos extraído la sensibilidad (LA+) y especifidad (LA-) sobre los casos de cada PM incluidos en nuestra muestra. El punto de corte para cada PM se ha seleccionado como el primer valor donde la función de densidad de probabilidad de LA+ es mayor que la función de densidad de LA-.
Valores de corte para CTT en log(#/μL)para cada PM, así como los valores de sensibilidad y especifidad de los cortes evaluados mediante los casos de cada PM
| Corte | Sensibilidad | Especifidad | |
|---|---|---|---|
| Todos | 17.000 | 0,5625 | 0,6531 |
| A | 15.661 | 0,5185 | 0,6444 |
| B | 25.415 | 0,6038 | 0,6404 |
| BH | 6.426 | 0,8333 | 0,5128 |
| TN | 2.400 | 1 | 0,6667 |
| HER2 | 3.6 | 0,8 | 0,778 |
Aunque el impacto de un GC metastásico3 ha justificado el gesto de la LA durante años, en aproximadamente la mitad de los casos no se observan otros ganglios metastásicos, por lo que se cuestiona si la LA es necesaria para todos los pacientes con GC positivo4,27. Identificar qué pacientes con GC metastásico no se beneficiarán de la LA se ha convertido en un importante reto en el tratamiento del cáncer de mama. Para ello, se han desarrollado numerosos nomogramas, la mayoría de los cuales se basan en variables clínicas y morfológicas como el diámetro tumoral, el grado histológico, el índice mitótico y la invasión linfovascular28. Todos los modelos predictivos utilizados se basan en modelos multivariantes de regresión logística y su evaluación discriminante ha sido realizada mediante áreas bajo la curva ROC.
Berrang et al. revisan los modelos predictivos publicados y concluyen que la mayoría de ellos sobrestiman el riesgo de macrometástasis y, por el contrario, infraestiman el riesgo de micrometástasis sin que ninguno de ellos alcance valores de AUC ≥ 0,80, considerados «excelentes». La inclusión de la variable «diámetro de la metástasis» en alguno de los modelos mejoró los valores del AUC hasta el 0,7516,28,29. Sin embargo, la medida de la metástasis sobre el corte histológico es imprecisa, lo cual dificulta la estandarización y la reproducibilidad de los resultados, limitando el uso de estos modelos.
A pesar de que el estudio molecular del GC detecta mayor número de metástasis que el estudio histológico7, la tasa de recidiva axilar oscila alrededor del 1%12 lo cual puede atribuirse no solo al efecto de la terapia sistémica sino también a la biología inherente a la metástasis, cuya agresividad puede estar determinada, al menos en parte, por el PM del tumor primario. Ello podría implicar que volúmenes tumorales semejantes podrían tener diferente impacto clínico en función del PM.
OSNA, validada como la técnica de elección para el diagnóstico intraoperatorio del GC30,31, ha dado lugar al concepto de CTT, definida como la suma del número de copias de cada uno de los GC del paciente y que ha sido considerada por algunos investigadores como la variable independiente con mayor poder predictivo de afectación de los ganglios axilares no centinela18,19, y más exacta, precisa y reproducible que la medida histológica sobre el corte de tejido. Nuestro objetivo es caracterizar el valor del PM y la CTT, mediante su inclusión en distintos modelos predictivos, para predecir el estado ganglionar del resto de la axila tras la biopsia de GC.
Hasta donde conocemos, hay muy pocos modelos predictivos que incluyan la CTT. Peg et al. proponen un punto de corte de 15.000 copias para indicar la LA, independientemente del número de GC examinados, con un VPN del 85%, alcanzando valores AUC de 0,7119. Piñero et al., siguiendo los criterios del Z0011, proponen un punto de corte de 10.000 copias como valor predictivo de 2 o más ganglios adicionales32. Ambos autores encuentran diferencias entre la afectación de los ganglios axilares no centinela y la sobreexpresión de Her2 en el tumor primario19, siendo el riesgo mayor para estos tumores que para los luminales A20.
Recientemente, el subtipo intrínseco de cáncer de mama, evaluado a partir del subrogado inmunohistoquímico, ha sido relacionado con el estatus del GC33–35. El 12th ST Gallen International Breast Cancer Conference Expert Panel recomienda aplicar la clasificación del subtipo molecular para planificar las decisiones acerca de la terapia sistémica34 y propone los siguientes grupos: grupo «HR positivo» (luminal A and luminal B), «HER2 amplified» y «triple negativo».
Nuestros resultados apoyan la inclusión de la CTT y del PM en la toma de decisiones terapéuticas sobre la axila, dado que se observan diferentes puntos de corte en la CTT predictivos de afectación axilar en función del subtipo molecular subrogado inmunohistoquímicamente. La inclusión del PM en el modelo predictivo diferencia grupos de pacientes con CTT y morfología semejantes pero con distinta probabilidad de metástasis axilares no centinela.
Nuestros resultados, considerando todos los casos en conjunto, están en concordancia con los de Peg et al.19 que proponen un punto de corte de 15.000 copias por encima del cual existe mayor probabilidad de afectación axilar. Correlacionan también con los de Piñero et al32, que encuentran, para la predicción de 2 o más ganglios axilares metastásicos (criterios Z0011) un punto de corte de 10.000 copias.
Al diferenciar por subtipo molecular, nuestros resultados muestran que el punto de corte para los tumores luminales es mucho más alto que para el resto de PM, lo cual puede estar en relación con el comportamiento menos agresivo de estos tumores. El punto de corte para los tumores luminal B es ligeramente mayor que para los luminal A, aunque, dado que las cifras de OSNA se expresan logarítmicamente, estas diferencias son mínimas y probablemente atribuibles a la subjetividad inherente a la interpretación del Ki-67, criterio subrogado mayor, junto con la expresión de RP, para distinguir entre luminal A y B. A su vez, observamos que los tumores de subtipo molecular luminal B-HER2 muestran un punto de corte de 6.426 copias, menor que luminal A y B pero mayor que para los tumores HER2, cuyo punto de corte es de 3.595 copias, mayor a su vez que las 2.400 copias de los tumores triple negativos. Estos resultados están en concordancia con los tres subtipos predictivos propuestos en ST Gallen para la terapia sistémica34 y apoyan la evidente relación entre el PM y la capacidad metastásica del tumor.
En base a nuestros hallazgos, existe un cierto número de pacientes con tumores de tipo luminal que, aun con macrometástasis en el GC (n.° copias ≥ 5.000 copias) siguen teniendo un riesgo muy bajo de metástasis axilares adicionales mientras que, por el contrario, en tumores triple negativos, el mismo número de copias indicaría un riesgo mucho mayor de metástasis adicionales y podría constituir indicación de LA. La inclusión del PM en el modelo predictivo mejora el AUC y permite por tanto mejorar la individualización terapéutica de la paciente. A pesar de estar bien establecidas las diferencias pronósticas entre los distintos PM, son muy escasos los estudios que lo aplican en la evaluación de riesgo de axila metastásica21,35. Buglioni et al. demuestran, incluyendo el PM en el estudio multivariante, que los subtipos agresivos como el HER2, se asocian a mayor porcentaje de metástasis axilares20.
De acuerdo con estas observaciones, podemos asumir que el PM del tumor primario puede ser clave en el patrón de metástasis y que su inclusión en los modelos predictivos puede mejorar los valores del AUC.
En conclusión, nuestros resultados apoyan el uso de la técnica OSNA como método de elección para el diagnóstico intraoperatorio del GC23,29,30,36. A pesar de que el análisis univariante del PM no muestra diferencias estadísticamente significativas entre los grupos LA+ y LA-, la incorporación del PM al modelo predictivo multivariante mejora el AUC (de 0,71 a 0,74), más aún si el PM se incluye desglosado por medio de las variables ER, EP y Ki67 individualizadamente y se aplica el factor de corrección «número de GC» (AUC=0,77).
La incorporación de factores de corrección al modelo como «número total de GC» permite alcanzar valores de AUC dentro del rango moderadamente predictivo (0,7<AUC<0,9). A pesar de que estos valores son comparables a los del estado del arte en relación al GC, es necesario validar prospectivamente nuestros resultados antes de su aplicación clínica. El análisis para los PM luminal B-Her2, TN and HER2 deben ser interpretados teniendo en cuenta el escaso número de casos incluidos para algunas de estas categorías, dada su prevalencia. La implementación de un modelo predictivo del número total de ganglios afectos puede ser imprescindible para planificar el tratamiento radioterápico posterior a la cirugía.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría/colaboradores- 1.
Concepción y diseño: Laia Bernet, Juan Miguel García-Gómez, Rafael Cano.
- 2.
Provisión de casos: Antonio Piñero, Juan M. de la Cámara de las Heras, Maximiliano Rodrigo, Octavi Burgués, Irune Ruiz, Bárbara Tormos.
- 3.
Análisis de datos e interpretación: Laia Bernet, Juan Miguel García-Gómez, Rafael Cano.
- 4.
Soporte administrativo: Laia Bernet, Juan Miguel García-Gómez, Mansur Ata.
- 5.
Escritura del manuscrito: Laia Bernet, Juan Miguel García-Gómez, Rafael Cano.
Los autores declaran no tener ningún conflicto de intereses.