INTRODUCCION
La definición de carcinoma de mama localmente avanzado ha ido evolucionando. En el pasado, muchos autores habían agrupado tumores primarios de la mama de gran tamaño y casos con grandes adenopatías satélites juntamente con el carcinoma inflamatorio de mama. Los estudios más recientes sugieren, sin embargo, que el carcinoma inflamatorio de la mama se diferencia del cáncer de mama localmente avanzado no inflamatorio por sus características, patrón de crecimiento, opciones terapéuticas y pronóstico1.
En la actualidad, el cáncer de mama localmente avanzado se define por la apariencia clínica de infiltración de la piel o de la pared torácica por el tumor, o por tener ganglios axilares amazacotados2. Esta definición se basa en la clasificación TNM, en la que el carcinoma de mama localmente avanzado se equipara al estadio IIIB del cáncer de mama. El estadio IIIB incluye, o bien un T4 con cualquier tipo de afectación ganglionar, o bien cualquier tamaño o extensión tumoral juntamente con N3, excluyendo en ambos casos la presencia de metástasis a distancia. T4 implica tumor de cualquier tamaño con extensión directa a la piel o a la pared torácica, y N3 supone metástasis a los ganglios de la cadena mamaria interna ipsilateral3. Así pues, los pacientes con cáncer de mama localmente avanzado pueden tener diferentes combinaciones de extensión del tumor e infiltración ganglionar, pero se incluyen conjuntamente en los protocolos de terapia multimodal, constituyendo un grupo heterogéneo que hace que la comparación de resultados sea bastante dificultosa4. Esta comparación se complica aún más por cuanto los criterios de infiltración de la piel o de la pared torácica no se definen ni siquiera en los ensayos terapéuticos5-8.
La infiltración neoplásica de la piel en la histopatología sería el criterio definitivo de infiltración de la piel en el cáncer de mama y su conocimiento podría mejorar la clasificación de pacientes de cara a su inclusión en ensayos terapéuticos, pero documentar dicha infiltración requiere una biopsia quirúrgica. Nuestro objetivo ha sido averiguar si los signos clínicos y mamográficos son buenos predictores de infiltración neoplásica de la piel en el cáncer de mama.
PACIENTES Y MÉTODOS
Revisamos las historias clínicas de los 118 pacientes (116 mujeres y 2 varones) con cáncer de mama a quienes se hizo biopsia de la piel de la mama en nuestros hospitales entre los años 1989 y 1997. En nuestro medio se toma habitualmente biopsia de la piel de la mama previamente a la intervención quirúrgica de un cáncer de mama si se han observado cambios en el aspecto de la piel en la exploración clínica o se ha visto engrosamiento de la piel o deformidad del contorno de la mama en la mamografía.
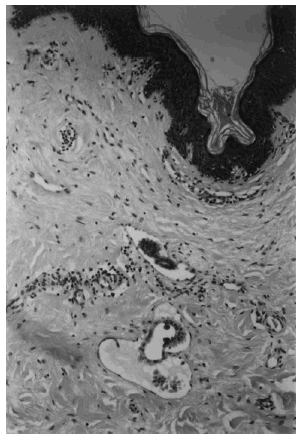
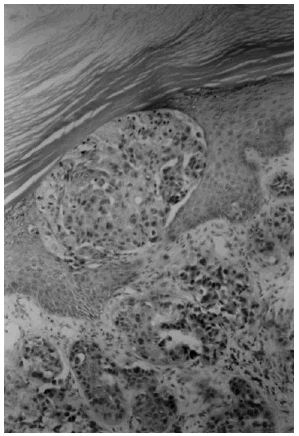
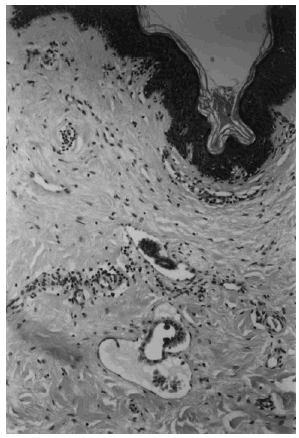
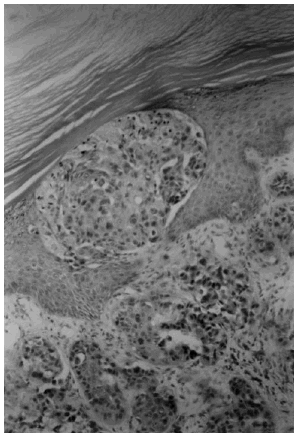
Todos los casos tenían un carcinoma de mama confirmado anatomopatológicamente. La infiltración neoplásica de la piel se definió por la presencia de invasión tumoral de los vasos linfáticos de la dermis (fig. 1), o por la existencia de regueros o nidos de células tumorales en la dermis papilar (superficial) o reticular (profunda) (fig. 2). En las muestras de biopsia que contenían tejido adiposo, la infiltración tumoral a ese nivel también se tomó en consideración.
Fig. 1. Invasión tumoral de los vasos linfáticos dérmicos. (Hematoxilina-eosina, ×400.)
Fig. 2. Nidos de células tumorales en la dermis y en la epidermis. (Hematoxilina-eosina, ×400.)
Las alteraciones de la piel en la exploración física se transcribieron de las anotaciones en la historia clínica. Se registraron los siguientes hallazgos clínicos: tamaño clínico del tumor, retracción cutánea, cambio de coloración de la piel, piel de naranja y ganglios linfáticos.
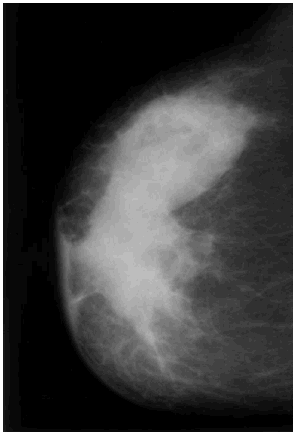
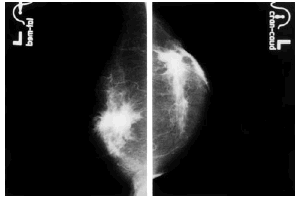
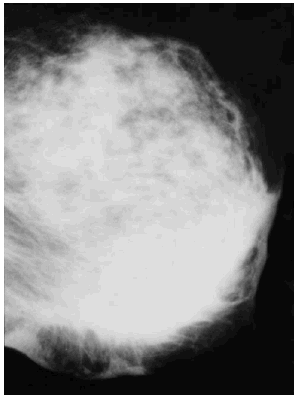
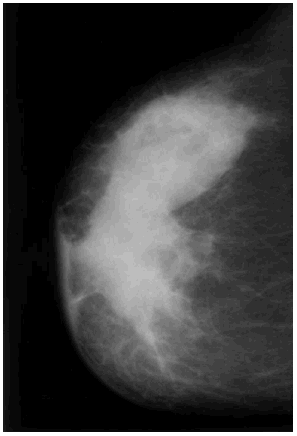
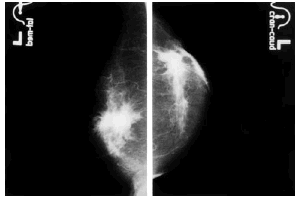
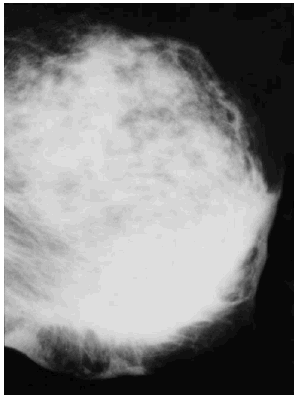
Se revisaron las mamografías y los informes mamográficos de todos los pacientes, y se catalogó como engrosamiento difuso (fig. 3) o focal (fig. 4) de la piel, o como deformidad de la silueta mamográfica (fig. 5) cuando dos radiólogas experimentadas estuvieron de acuerdo sobre ello. Además se registraron los siguientes hallazgos mamográficos: asimetría del parénquima mamario, borrosidad del contorno del nódulo mamario, presencia de microcalcificaciones y tamaño mamográfico del nódulo.
Fig. 3. Engrosamiento difuso de la piel.
Fig. 4. Engrosamiento localizado de la piel.
Fig. 5. Deformidad de la silueta mamaria.
Las variables cuantitativas se compararon mediante la prueba t de Student para muestras no apareadas, y los porcentajes se compararon con la prueba de chi-cuadrado9. Se construyó un modelo de regresión logística10, incluyendo la presencia o ausencia de infiltración neoplásica de la piel como variable dependiente y los hallazgos clínicos y mamográficos como variables independientes. Las variables independientes no significativas fueron eliminadas del modelo mediante un procedimiento de retroceso escalonado. Se consideró significativa una p < 0,05.
RESULTADOS
La edad de los 118 pacientes osciló entre los 28 y los 89 años, con un promedio de 61,7 años y una desviación estándar (DE) de 13,8 años. Entre las 116 mujeres hubo 27 (23,3 %) que eran premenopáusicas.
En la exploración clínica se encontró retracción cutánea en 97 pacientes (82,2 %), cambios de coloración en la piel en 50 casos (42,4 %), y piel de naranja en 48 (40,7 %) de nuestros pacientes biopsiados.
El engrosamiento de la piel observado en la mamografía fue focal en 72 casos (61,0 %), difuso en 41 (34,7 %), y ausente en 5 casos (4,2 %). El máximo grosor de la piel medido en la mamografía osciló entre los 2 y los 15 mm, con un promedio de 4,9 mm (DE, 2,4). En los 72 casos con engrosamiento focal el máximo grosor de la piel osciló entre los 3 y los 11 mm, con un promedio de 4,5 mm (DE, 1,7), significativamente menor (p < 0,01) a los valores correspondientes al engrosamiento difuso, que oscilaron entre 3 y 15 mm, con un promedio de 6,0 mm (DE, 3,0). Los 5 casos sin engrosamiento cutáneo tenían un grosor máximo de la piel de 2 mm.
La deformidad mamográfica de la silueta mamaria se consideró presente en 82 pacientes (69,5 %).
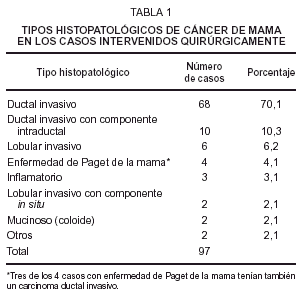
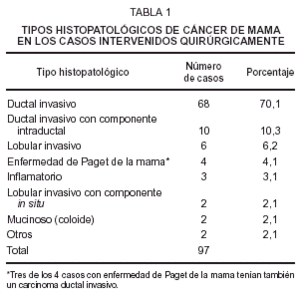
Entre los 118 casos hubo 97 que fueron intervenidos y a quienes se estudió anatomopatológicamente el cáncer mamario. La clasificación de estos tumores en tipos histológicos se muestra en la tabla 1, observándose que el más frecuente es el carcinoma ductal invasivo. A los 21 casos restantes sólo se les hizo biopsia de la piel.
La disección axilar se llevó a cabo en 67 pacientes, y en 61 de ellos figuraba el número de ganglios linfáticos remitidos, que osciló entre 4 y 30 (promedio 13,9, DE, 6,1). La media del porcentaje de infiltración ganglionar en esos 61 casos fue del 27,5 %, con 21 casos (34,4 %) sin infiltración, y 2 (3,3 %) con infiltración en todos los ganglios analizados.
En el estudio histopatológico de las muestras de biopsia de piel se encontró infiltración neoplásica en 58 (49,2 %) de los casos.
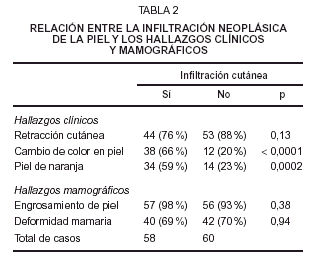
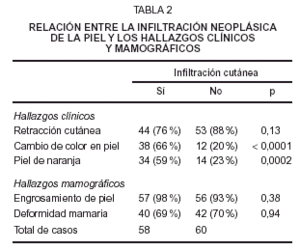
La relación bivariada entre la infiltración neoplásica cutánea y los hallazgos clínicos y mamográficos se muestra en la tabla 2.
El promedio de máximo grosor mamográfico de la piel en los 58 casos con infiltración neoplásica cutánea fue de 5,9 mm (DE, 2,8), mientras que la media en los 60 casos sin infiltración fue de 4,0 mm (DE, 1,4), siendo este máximo grosor significativamente diferente (p < 0,0001).
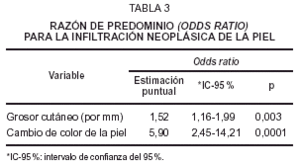
En el modelo logístico multivariado para la infiltración neoplásica cutánea incluimos inicialmente como variables dependientes todos los hallazgos clínicos y mamográficos, así como el máximo grosor mamográfico de la piel. Tras el procedimiento escalonado de eliminación las únicas variables que continuaron siendo significativas fueron el cambio de coloración de la piel (p = 0,0001) y el máximo grosor de la piel en mm (p = 0,003). La razón de predominio (odds ratio) para la infiltración neoplásica de cada una de estas variables significativas se muestra en la tabla 3.
DISCUSION
Hemos demostrado que el aumento del grosor mamográfico de la piel predice la infiltración neoplásica de la piel en la histopatología. De todos los demás hallazgos clínicos y mamográficos clásicos, el único que se asocia con infiltración neoplásica cutánea es el cambio de coloración de la piel.
En mamografía se ha prestado mucha menos atención al aspecto de la piel y del tejido subcutáneo que a los cambios en el parénquima glandular mamario11. Según Kopans, el grosor mamográfico de la piel de la mama normal por fuera de la areola es de aproximadamente 0,5 a 2 mm. Aunque en raros casos el grosor de la piel normal puede llegar a los 3 mm, cuando esto ocurre hay que sospechar alguna anomalía subyacente12. En nuestro estudio, sólo los 5 casos en los que consideramos que no había engrosamiento cutáneo tenían un grosor máximo de 2 mm. El aumento del grosor cutáneo mamográfico se ha considerado un indicador de recurrencia del cáncer mamario13.
En la mayoría de los ensayos de cribado de cáncer de mama, la mamografía ha demostrado ser más sensible que la exploración clínica aislada. No obstante, la sensibilidad del método combinado es mayor que la de la mamografía aislada, porque la exploración clínica puede detectar cánceres que pasan desapercibidos en la mamografía. Aunque la exploración clínica de la mama no ha sido en general estandarizada, la proporción de cánceres mamarios detectados en la exploración clínica pero pasados por alto en la mamografía oscila entre el 5 y el 29 %14. Por consiguiente, la exploración clínica de la mama es un útil complemento de la mamografía para la detección y el diagnóstico del cáncer de mama en general, y especialmente en el caso de infiltración cutánea.