La quimioterapia neoadyuvante (QTN) es una modalidad de tratamiento fundamental en el cáncer de mama (CM). El objetivo de este estudio es analizar las respuestas radiológica (RR) y patológica (RP) de pacientes con CM sometidas a QTN, estudiar su concordancia y las variables relacionadas con dichas respuestas.
Pacientes y métodosSe incluyen 63 pacientes tratadas con QTN en las que se evaluó la RR con RM pre y post-QTN, y la RP, mediante la clasificación de Miller y Payne, tanto para la enfermedad mamaria como para la axilar. Se realizó un análisis univariante y multivariante de las variables clinicopatológicas para la RR y RP, así como un análisis de concordancia entre respuestas.
ResultadosLos porcentajes de respuesta fueron del 52,4% para RR, del 63,5% para RP local y del 57,2% para RP axilar. Resultaron factores predictivos independientes de la RR: un BRCA+ y el tipo de curva en la RM post-QTN. El único factor predictivo para la RP en la mama fue el realce tumoral en la RM post-QTN y para la RP axilar: realizar la BSGC y receptores hormonales negativos. Aunque se identifica correlación entre RR y RP, esta solo fue significativa en la enfermedad axilar.
ConclusionesExisten factores predictivos de RR, RP en mama y RP axilar que hacen útil el uso de la RM en la valoración de la QTN. La concordancia entre RR y RP fue mayor a nivel axilar.
Neoadjuvant chemotherapy (NAC) is a fundamental treatment in breast cancer (BC). The objective of this study was to analyse the radiological response (RR) and pathological response (PR) of patients with BC by studying the agreement between RR and PR and response-related variables.
Patients and methodsThe study included 63 patients treated with NAC. We evaluated RR with pre- and post-CT MRI and PR by the Miller and Payne classification, both for breast and axillary disease. Univariate and multivariate analyses of the clinicopathological variables for RR and PR were carried out, as well as an analysis of the concordance between responses.
ResultsThe response rates were 52.4% for RR, 63.5% for local PR and 57.2% for axillary PR. Independent predictive factors of RR were BRCA positivity and the type of curve post-NAC on MRI. The only independent predictor of PR in the breast was tumor enhancement post-NAC on MRI, while independent predictors of axillary PR were performing SSNB and negative hormone receptors. Although there was a correlation between RR and PR, it was only significant in axillary disease.
ConclusionsThis study found predictive factors of RR, PR in the breast and axillary PR and consequently RMI is useful in the assessment of NAC. The concordance between RR and PR was greater in the axilla.
La quimioterapia ha demostrado beneficios en términos de supervivencia global (SG), tanto si es administrada antes como tras la cirugía en el cáncer de mama (CM)1. La administración de quimioterapia neoadyuvante (QTN) es un gesto fundamental en el manejo del CM localmente avanzado y es esencial la valoración de la respuesta a la QTN a la hora de planificar el tratamiento locorregional posterior. Así pues, la resonancia magnética (RM) se ha convertido en imprescindible para la evaluación de la respuesta tumoral al tratamiento con quimioterapia neoadyuvante (QTN), mejorando a la mamografía y la ecografía2,3.
Son cuatro los aspectos de relevancia que juegan un papel importante en la evaluación de dicha respuesta actualmente:
Primero, la RM ha pasado de ser una exploración muy restrictiva a ser una técnica de rutina en el estudio de cualquier CM4.
En segundo lugar, los avances técnicos de la RM. Hoy disponemos de tres tipos de RM (contraste, difusión y espectroscopia)5, múltiples biomarcadores de imagen6,7, como potenciales factores predictivos de respuesta para planificar el tratamiento8.
Tercero, el impacto que tiene la QTN en el tratamiento del CM. Permite un aumento en la indicación de tratamientos conservadores tras respuestas a la QTN, y ayuda a conocer la biología de cada tumor, según los cambios experimentados con el tratamiento y la respuesta observada9,10.
Por último, la nueva clasificación molecular y las plataformas genéticas, que permiten una mejor estratificación pronóstica y predictiva en el CM11,12.
Los objetivos de este trabajo fueron valorar la respuesta radiológica (RR) y la respuesta patológica (RP) de tumores malignos de mama tratados con QTN, conocer la influencia de variables de diversa índole sobre ellas, así como la correlación entre ambas formas de respuesta, tanto en el tumor primario como en la enfermedad axilar.
Material y métodosPacientesEstudio clínico observacional, transversal y retrospectivo que incluyó a 63 mujeres con CM T2-T4 y N0-N3 (TNM 7.0), tratadas con QTN, confirmado mediante biopsia con aguja gruesa (BAG) o biopsia asistida por vacío (BAV), estudio inmunohistoquímico, sometidas a RM para evaluar la respuesta antes y después del tratamiento, y una correcta valoración anatomopatológica de la respuesta tras la cirugía.
Se recogieron variables clínicas, radiológicas y patológicas, así como otras relacionadas con la afectación ganglionar. Las categorías de las variables histopatológicas y de estadificación, así como inmunohistoquímicas, se clasificaron según criterios de St Gallen 2015 (luminales A y B, luminal-Her, Her-2+ y TN)13 y la clasificación TNM de la AJCC14, respectivamente. Dentro de las variables relacionadas con la RM se registraron el tamaño de la lesión, su morfología y bordes, el realce tumoral y de fondo, así como la curva cinética y el pico de máximo realce.
La descripción de las lesiones en RM se efectuó en base a los informes descritos de la misma.
El tratamiento sistémico neoadyuvante incluyó los protocolos asistenciales vigentes en cada momento. Se utilizaron los esquemas con antraciclinas, taxanos, antraciclinas +taxanos y tratamientos especiales como la eribulina. A partir del año 2010 se administró trastuzumab en las pacientes Her2 positivo (sobreexpresión 3+ o 2+ si la técnica CISH era positiva mediante el test Dako)15, y en las pacientes con receptores hormonales positivos se valoró el tratamiento con terapia hormonal adyuvante.
Respuestas radiológica y patológicaLa valoración de la RR mediante RM se realizó mediante los criterios RECIST 1.116, que valoran la respuesta de lesiones diana, no diana y nuevas lesiones, definiéndose los criterios siguientes:
- -
Respuesta completa: desaparición de todas las lesiones.
- -
Respuesta parcial: reducción ≥30% en la suma de diámetros de lesiones diana, definiendo respuesta parcial menor como una reducción del tamaño tumoral <30% y respuesta parcial mayor una reducción del mismo, entre el 30 y el 90%.
- -
Progresión de enfermedad: incremento ≥20% en la suma de diámetros de lesiones diana con un aumento absoluto ≥5 mm.
- -
Enfermedad estable: sin evidencia suficiente para respuesta parcial ni progresión de enfermedad.
La RM es una técnica limitada en la valoración de ganglios axilares, utilizando como criterios de sospecha de malignidad, su tamaño (>1cm) y el grado de hipertrofia cortical excéntrica.
Así pues, las pacientes fueron clasificadas en dos grupos:
- -
No respondedoras (ausencia de RR, cuando el tumor no ha experimentado variación tras la QTN, y respuesta parcial menor, cuando la reducción del tumor es menor del 50%).
- -
Respondedoras (respuesta completa radiológica, considerada como no evidencia de tumor, y respuesta parcial mayor, cuando la reducción del tumor es mayor del 50%).
Se utilizó un equipo de RM de 1,5T (New Intera Nova, Philips Medical System, Best, Países Bajos) mediante estudio multiplanar y con localizador múltiple (axial, sagital y coronal) y secuencias en T1, T2, STIR y supresión grasa. El contraste utilizado fue gadobutrol (Gadovist 1mmol/ml), obteniendo la primera serie sin contraste, seguida de 5 registros dinámicos con el mismo.
En la valoración de la RP se siguieron los criterios de Miller y Payne17. Estos evalúan la respuesta en mama (1, 2, 3, 4, 5) y axila (A, B, C, D) de forma independiente:
- -
Grado 1: no respuesta
- -
Grado 2: respuesta parcial menor, reducción <30%.
- -
Grado 3: respuesta parcial mayor, reducción 30-90%.
- -
Grado 4: respuesta casi completa, reducción >90%.
- -
Grado 5: respuesta completa (puede haber carcinoma in situ).
- -
N-A: axila negativa verdadera.
- -
N-B: ganglios axilares positivos sin respuesta terapéutica.
- -
N-C: ganglios axilares positivos con evidencia de respuesta terapéutica.
- -
N-D: ganglios axilares positivos inicialmente pero negativos tras QTN.
En base a ellos, se agrupó a las pacientes en dos grupos:
- -
No respondedoras (grados 1 y 2 y B-C de Miller y Payne).
- -
Respondedoras (grados 3, 4 y 5 y A y D de Miller y Payne).
En el análisis descriptivo, las variables cuantitativas se describen con su media y desviación estándar, y las variables cualitativas se presentan con su distribución de frecuencia y porcentaje relativo en la población.
Para el análisis univariante con las respuestas, se evaluó la asociación entre variables cualitativas mediante tablas de contingencia con el test de χ2 de Pearson. En las variables cuantitativas, para la comparación de las medias de muestras independientes se ha utilizado la t de Student, considerando estadísticamente significativo un valor de p<0,05. Se realizó un análisis multivariante mediante regresión logística para las variables que resultaron significativas en el univariante, incluyendo también aquellas con tendencia a la significación.
Además se realizó un análisis de concordancia entre las respuestas mediante el coeficiente de correlación de Pearson. Los programas informáticos empleados fueron SPSS versión 19.0.
ResultadosEntre abril de 2008 y enero de 2016 se han registrado 63 pacientes con CM que cumplen los criterios de inclusión.
Los datos descriptivos del estudio se recogen en la tabla 1. La edad media de las pacientes que recibieron QTN fue de 46,4años. Treinta y ocho pacientes (60,2%) presentaron tumores receptores hormonales positivos, 10 (15,8%) Her2 positivo y 15 (23,8%) triple negativo.
Datos descriptivos de la serie
| Casos (%) | |
|---|---|
| n | 63 (100) |
| Edad media (años) | 46,41 |
| Menopausia | 16 (25,4) |
| Gestaciones previas | 44 (69,8) |
| Lactancia | 35 (55,6) |
| Tratamientos hormonales (anticonceptivos hormonales, terapia hormonal sustitutiva) | 17 (27) |
| Antecedentes familiares | 19 (30,2) |
| Mutación BRCA | 7 (11,1) |
| Origen | |
| Demanda | 53 (84,1) |
| Cribado | 10 (15,9) |
| Lesión | |
| Nódulo palpable | 52 (82,5) |
| Retracción piel/pezón | 10 (15,9) |
| Telorragia | 1 (1,6) |
| BIRADS | |
| 3 | 2 (3,2) |
| 4 | 25 (39,7) |
| 5 | 36 (57,1) |
| Grado de diferenciación | |
| 1 | 3 (5) |
| 2 | 21 (33) |
| 3 | 39 (62) |
| Tipo histológico | |
| Ductal NOS | 52 (82) |
| Lobulillar | 8 (13) |
| CDI especial | 3 (5) |
| Foco único | 40 (63) |
| TNM pre-QTN | |
| 0 | 0 (0) |
| I | 0 (0) |
| II | 37 (58,70) |
| III | 25 (39,68) |
| IV | 1 (1,60) |
| TNM post-QTN | |
| 0 | 14 (22,20) |
| I | 8 (12,60) |
| II | 26 (41,20) |
| III | 14 (22,20) |
| IV | 0 (0) |
| Inmunofenotipo | |
| Luminales | 30 (57,6) |
| Luminal-Her | 8 (12,6) |
| Her | 10 (15,8) |
| TN | 15 (23,8) |
| Régimen QTN | |
| AC | 1 (1) |
| AC + T | 46 (73) |
| T | 10 (16) |
| Otros | 6 (10) |
| Trastuzumab | 17 (27) |
| Cirugía | |
| Conservadora | 18 (29) |
| Radical | 45 (71) |
| Reconstrucción Inmediata | 8 (13) |
| Afectación axilar | 38 (60,3) |
| Terapia hormonal | 36 (57) |
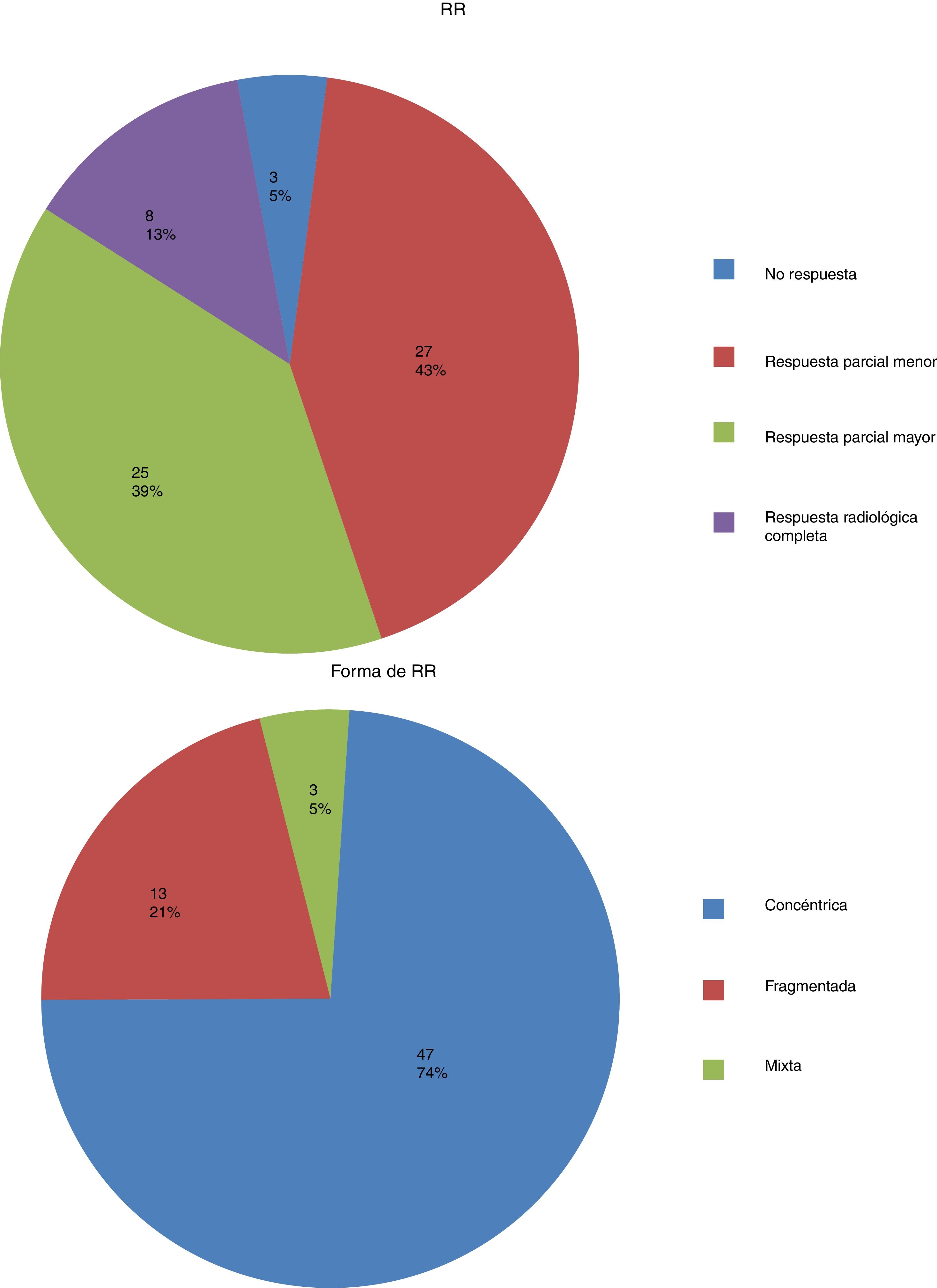
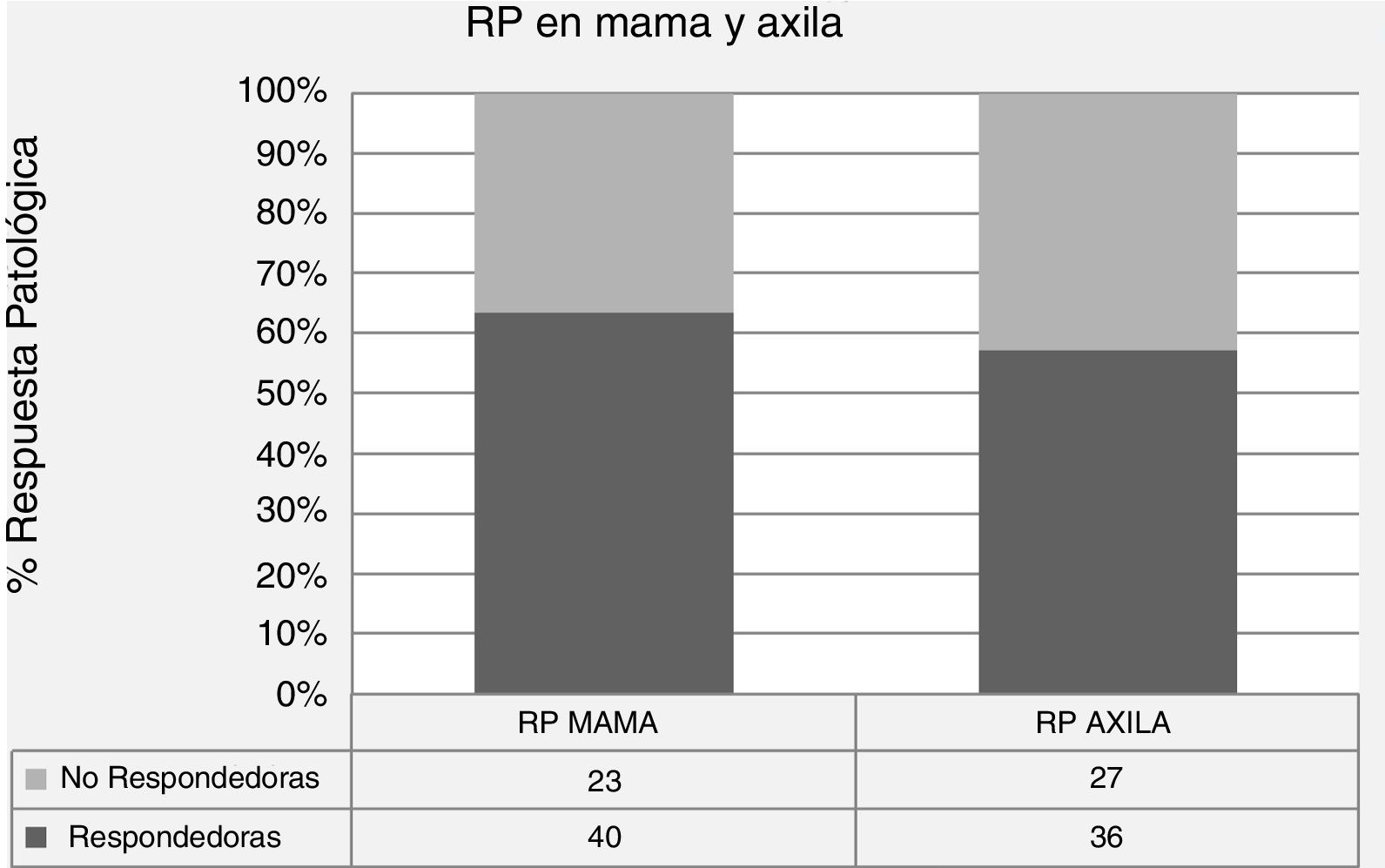
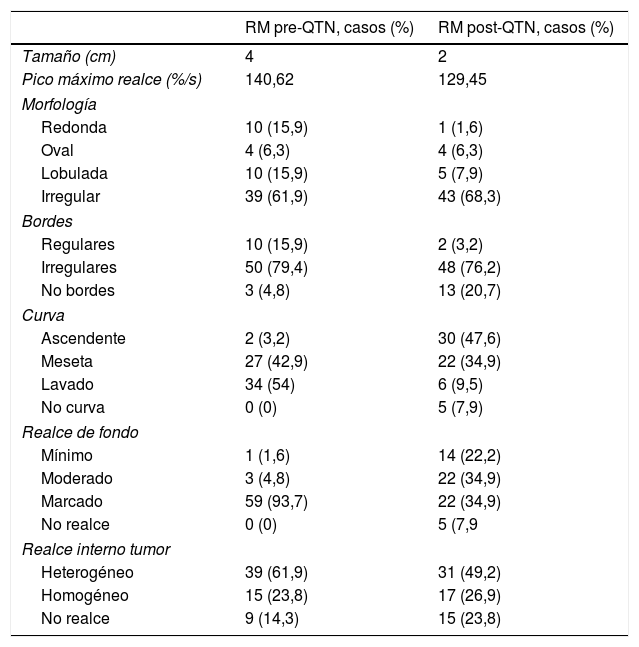
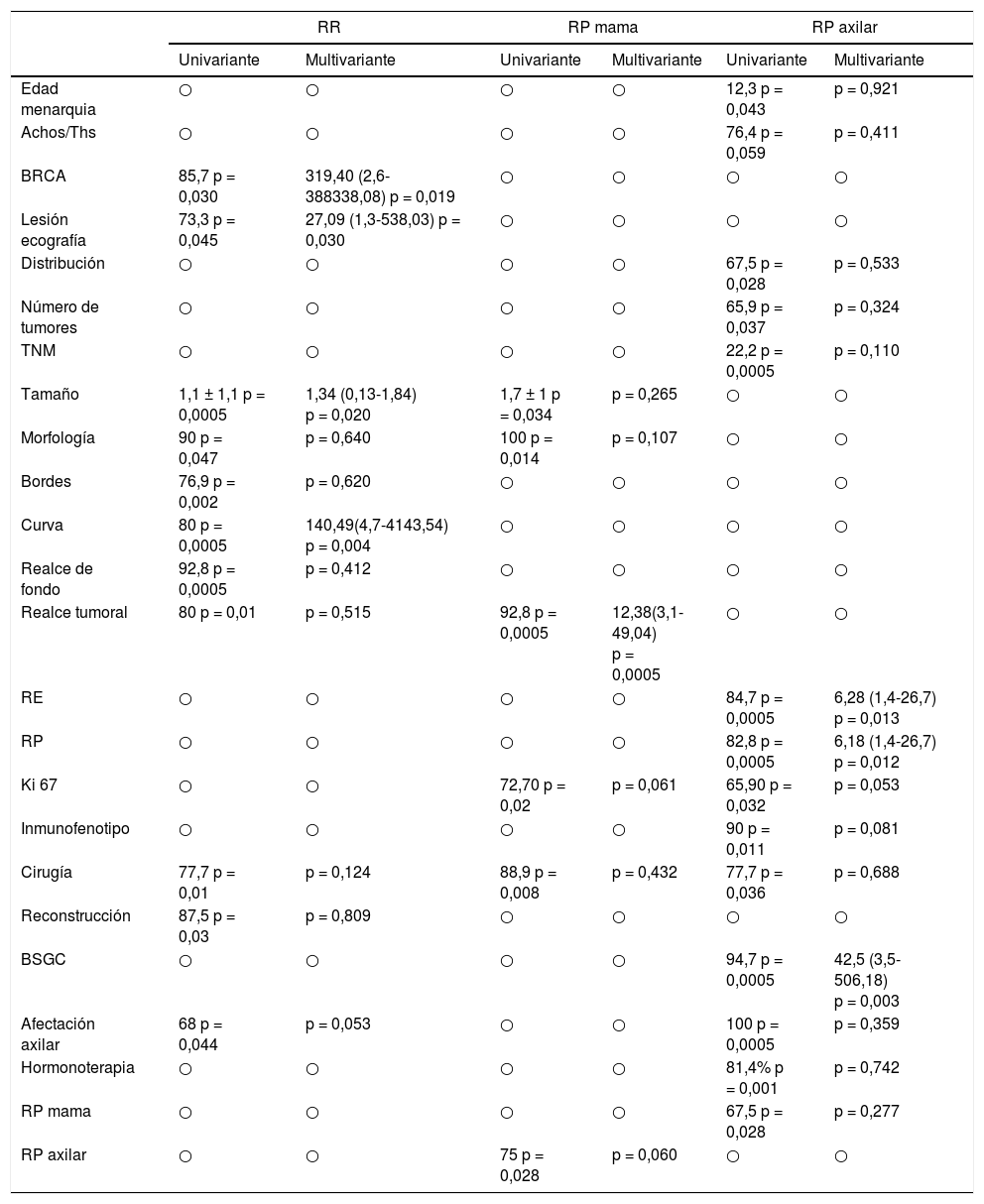
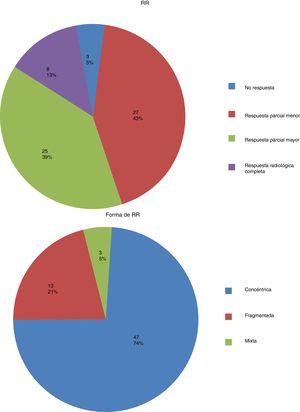
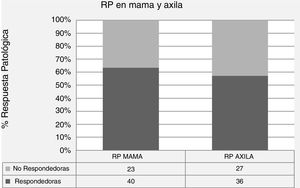
En la tabla 2 se presentan los datos descriptivos relacionados con el tumor en la RM pre y post quimioterapia neoadyuvante, y los diferentes tipos y patrones de RR y RP en mama y axila. Los porcentajes de respuesta fueron del 52,4% para RR (12,7% de rRC), del 63,5% para RP local y del 57,2% para RP axilar, siendo la tasa de pRC global en mama y axila del 22,2% (figs. 1 y 2).
Datos descriptivos en relación con la RM
| RM pre-QTN, casos (%) | RM post-QTN, casos (%) | |
|---|---|---|
| Tamaño (cm) | 4 | 2 |
| Pico máximo realce (%/s) | 140,62 | 129,45 |
| Morfología | ||
| Redonda | 10 (15,9) | 1 (1,6) |
| Oval | 4 (6,3) | 4 (6,3) |
| Lobulada | 10 (15,9) | 5 (7,9) |
| Irregular | 39 (61,9) | 43 (68,3) |
| Bordes | ||
| Regulares | 10 (15,9) | 2 (3,2) |
| Irregulares | 50 (79,4) | 48 (76,2) |
| No bordes | 3 (4,8) | 13 (20,7) |
| Curva | ||
| Ascendente | 2 (3,2) | 30 (47,6) |
| Meseta | 27 (42,9) | 22 (34,9) |
| Lavado | 34 (54) | 6 (9,5) |
| No curva | 0 (0) | 5 (7,9) |
| Realce de fondo | ||
| Mínimo | 1 (1,6) | 14 (22,2) |
| Moderado | 3 (4,8) | 22 (34,9) |
| Marcado | 59 (93,7) | 22 (34,9) |
| No realce | 0 (0) | 5 (7,9 |
| Realce interno tumor | ||
| Heterogéneo | 39 (61,9) | 31 (49,2) |
| Homogéneo | 15 (23,8) | 17 (26,9) |
| No realce | 9 (14,3) | 15 (23,8) |
Con respecto a la RR (tabla 3), en el análisis univariante resultaron significativas en la valoración del grado de la misma: la presencia de mutación BRCA: de los 7 casos que presentaban esta mutación, 6 de ellos (85,7%) se asociaron a mayor RR (p=0,030). Entre los datos de la RM post-QTN: el tamaño, la forma y los bordes tumorales, así como los realces tumorales y de fondo y el tipo de curva cinética, presentaron una asociación significativa para una mayor RR.
Análisis univariante y multivariante para cada respuesta (datos con resultados significativos)
| RR | RP mama | RP axilar | ||||
|---|---|---|---|---|---|---|
| Univariante | Multivariante | Univariante | Multivariante | Univariante | Multivariante | |
| Edad menarquia | ○ | ○ | ○ | ○ | 12,3 p = 0,043 | p = 0,921 |
| Achos/Ths | ○ | ○ | ○ | ○ | 76,4 p = 0,059 | p = 0,411 |
| BRCA | 85,7 p = 0,030 | 319,40 (2,6-388338,08) p = 0,019 | ○ | ○ | ○ | ○ |
| Lesión ecografía | 73,3 p = 0,045 | 27,09 (1,3-538,03) p = 0,030 | ○ | ○ | ○ | ○ |
| Distribución | ○ | ○ | ○ | ○ | 67,5 p = 0,028 | p = 0,533 |
| Número de tumores | ○ | ○ | ○ | ○ | 65,9 p = 0,037 | p = 0,324 |
| TNM | ○ | ○ | ○ | ○ | 22,2 p = 0,0005 | p = 0,110 |
| Tamaño | 1,1 ± 1,1 p = 0,0005 | 1,34 (0,13-1,84) p = 0,020 | 1,7 ± 1 p = 0,034 | p = 0,265 | ○ | ○ |
| Morfología | 90 p = 0,047 | p = 0,640 | 100 p = 0,014 | p = 0,107 | ○ | ○ |
| Bordes | 76,9 p = 0,002 | p = 0,620 | ○ | ○ | ○ | ○ |
| Curva | 80 p = 0,0005 | 140,49(4,7-4143,54) p = 0,004 | ○ | ○ | ○ | ○ |
| Realce de fondo | 92,8 p = 0,0005 | p = 0,412 | ○ | ○ | ○ | ○ |
| Realce tumoral | 80 p = 0,01 | p = 0,515 | 92,8 p = 0,0005 | 12,38(3,1-49,04) p = 0,0005 | ○ | ○ |
| RE | ○ | ○ | ○ | ○ | 84,7 p = 0,0005 | 6,28 (1,4-26,7) p = 0,013 |
| RP | ○ | ○ | ○ | ○ | 82,8 p = 0,0005 | 6,18 (1,4-26,7) p = 0,012 |
| Ki 67 | ○ | ○ | 72,70 p = 0,02 | p = 0,061 | 65,90 p = 0,032 | p = 0,053 |
| Inmunofenotipo | ○ | ○ | ○ | ○ | 90 p = 0,011 | p = 0,081 |
| Cirugía | 77,7 p = 0,01 | p = 0,124 | 88,9 p = 0,008 | p = 0,432 | 77,7 p = 0,036 | p = 0,688 |
| Reconstrucción | 87,5 p = 0,03 | p = 0,809 | ○ | ○ | ○ | ○ |
| BSGC | ○ | ○ | ○ | ○ | 94,7 p = 0,0005 | 42,5 (3,5-506,18) p = 0,003 |
| Afectación axilar | 68 p = 0,044 | p = 0,053 | ○ | ○ | 100 p = 0,0005 | p = 0,359 |
| Hormonoterapia | ○ | ○ | ○ | ○ | 81,4% p = 0,001 | p = 0,742 |
| RP mama | ○ | ○ | ○ | ○ | 67,5 p = 0,028 | p = 0,277 |
| RP axilar | ○ | ○ | 75 p = 0,028 | p = 0,060 | ○ | ○ |
En cuanto a la forma en RM post-QTN, se evidenció un mayor porcentaje de respuesta a favor de las formas redondeadas (100%), desaparición total por rRC (90%) y formas ovales (75%) en el grupo de las respondedoras. Por el contrario, entre el grupo de no respondedoras hubo de forma más frecuente las morfologías lobuladas (60%) e irregulares (58,1%), siendo estas asociaciones estadísticamente significativas (p=0,047). Al analizar los bordes del tumor, encontramos que hubo menor respuesta en tumores con bordes irregulares (47,9%).
Quince de las 63 pacientes del estudio mostraron desaparición total del realce tumoral tras QTN, y 12 de ellas (80%) presentaron RR de forma significativa (p=0,01). El realce de fondo desaparece cuando se obtiene una rRC en el 100% de los casos, aparece un realce mínimo en porcentajes altos de RR (92,8%) y va aumentando conforme la RR es peor, (p=0,0005). La curva predominante cuando hubo mayor respuesta tras la QTN es la tipo1 o ascendente (80% de RR, p=0,0005).
En el análisis de regresión logística multivariante resultaron factores independientes predictivos de la misma la presencia de mutación BRCA y el tipo de curva en la RM post-QTN, ambos con gran fuerza asociativa (OR de 319,40 y 140,49, respectivamente). También explicaron la RR el tamaño tumoral en la RM post-QTN y el tipo de lesión ecográfica.
Respuesta patológicaEn el análisis univariante (tabla 3) se obtuvo significación estadística para la morfología tumoral en la RM pre-QTN: las formas ovales y lobuladas se asociaron a mayores tasas de RP local (100%, p=0,014) frente a las formas irregulares (48,7%). También se encontraron mayores tasas de RP (32 casos, 72,7%) en los tumores que presentaban el Ki67 elevado (codificado sobre el 14%), con una p=0,02. Se objetivaron diferencias significativas en RP cuando se realizó cirugía conservadora, con porcentajes de RP de hasta el 88,9% (p=0,008). Cuando se realizó RM, la RP descendió al 53,4%.
Se ha encontrado asociación entre las respuestas patológicas en mama y axila, de manera que existe una mayor RP del tumor en la mama cuando hay mayor RP en axila (p=0,028).
El análisis multivariante mostró que fue 12,38 veces más probable (IC95%: 3,1-49,04) hallar RP en los casos donde la RM post-QTN muestra un realce tumoral homogéneo o inexistente, que cuando el tumor presenta un realce intenso y heterogéneo. El resto de variables significativas en el análisis univariante, dejaron de serlo.
En el modelo univariante para la respuesta patológica axilar (RPA) las pacientes que respondieron presentaron la menarquia o primera menstruación (MQ) un año más tarde que las no respondedoras (12,3 vs 11,7años, p=0,043). La RPA fue significativamente mayor (p=0,05) en pacientes que habían usado achos y/o ths previamente (76,4% frente al 50%, respectivamente). Se han encontrado diferencias estadísticamente significativas en relación con la RPA cuando existe un solo tumor de mama (65,9%; p=0,037) y de distribución única (67,5%; p=0,028).
Existe asociación estadísticamente significativa entre los valores de los RH codificados sobre el 10% y la RPA. Hay mayor RPA cuando los tumores son RH negativos, con una respuesta para REc (10%) y RPc (10%) del 84,7 y del 82,8%, respectivamente (p=0,0005). Análogamente, los tumores con Ki 67>14% presentan mayor porcentaje de RPA (65,9%, p=0,032). Existe asociación estadísticamente significativa entre el inmunofenotipo tumoral y la RPA a favor del subtipo HER-2+ (90%; p=0,011).
El análisis multivariante y de regresión logística para esta respuesta mostró que son factores predictivos independientes realizar la BSGC y la negatividad de los RH con valores de OR de 42,5 (IC95%: 3,5-50,6) y 6,28 (RE) y 6,18 (RP) (IC95%: 1,4-26,7), respectivamente.
ConcordanciaFinalmente, el análisis de correlación entre las diversas respuestas a QTN mostró que existe concordancia no significativa entre RR y RP (p=0,10; r=0,209), siendo mayor la establecida en axila que en mama (p=0,082; r=0,221). La RP en mama y axila presentaron una correlación significativa entre ambas (p=0,029; r=0,276), de modo que cuando hay respuesta en la mama, la hay también en los ganglios axilares.
DiscusiónLa RM es una excelente herramienta para valorar in vivo la quimiosensibilidad tumoral, permitiendo orientar el pronóstico3; pero no todos los tumores presentan una misma quimiosensibilidad, basándose las diferencias en el tamaño tumoral y en el inmunofenotipo18,19. En este trabajo, en la RM basal prima la morfología irregular (61,9%) sobre las formas lobuladas o redondas y de bordes indefinidos (79,4%) frente a definidos (15,9%). En un estudio japonés de 201020 de 120 pacientes estos datos difieren, ya que priman los tumores con formas lobuladas (59%) y ovales (63%) sobre las irregulares (49%); sin embargo, los bordes irregulares son también los más frecuentes (56%). En ambos estudios han prevalecido las formas con realces hipercaptantes y heterogéneos en la RM (42,9 y 33,3%).
Las diferencias encontradas entre los diversos tipos de realce en la literatura podrían ser debidas, por una parte, a las características de los tumores, objetivándose en el trabajo japonés tumores menos agresivos (en función de inmunofenotipo o grado tumoral), que realzan menos que los más prevalentes en este análisis, en su mayoría G3 y con perfil de peor pronóstico. Por otro lado, están los aspectos técnicos en cada medio al realizar la RM, como son la isotropía, la homogeneidad de la saturación grasa, el timing y la calidad de las herramientas post-procesado.
Schmitz et al.21 analizan el realce tumoral «en anillo», o rim enhancement, en 556 pacientes. Encuentran asociación de esta forma de realce con un peor pronóstico, concluyendo que está ligado a tumores de mayor tamaño, TN, G3, N+ y RH negativos21,22.
Globalmente, obtuvimos un 52,4% de RR, un 63,5% de RP en la mama y un 57,1% de RPA. La variabilidad en la literatura con respecto a las respuestas se debe a la distinta representación de los inmunofenotipos, ya que la tasa de pRC puede variar en función de los mismos del 6 al 33%12,23.
Con respecto a los factores que influyen en la RR, existe concordancia con lo expuesto en la literatura, de modo que los patrones morfológicos que adoptan los tumores en la RM inicial son factores predictivos de respuesta al tratamiento sistémico primario18,24. Entre ellos, el tipo de lesión ecográfica resulta significativo tanto en el análisis univariado como en el multivariado, asociándose las alteraciones estructurales a una mayor respuesta. Se precisan más estudios que comparen ecografía y RM para valorar la respuesta a QTN.
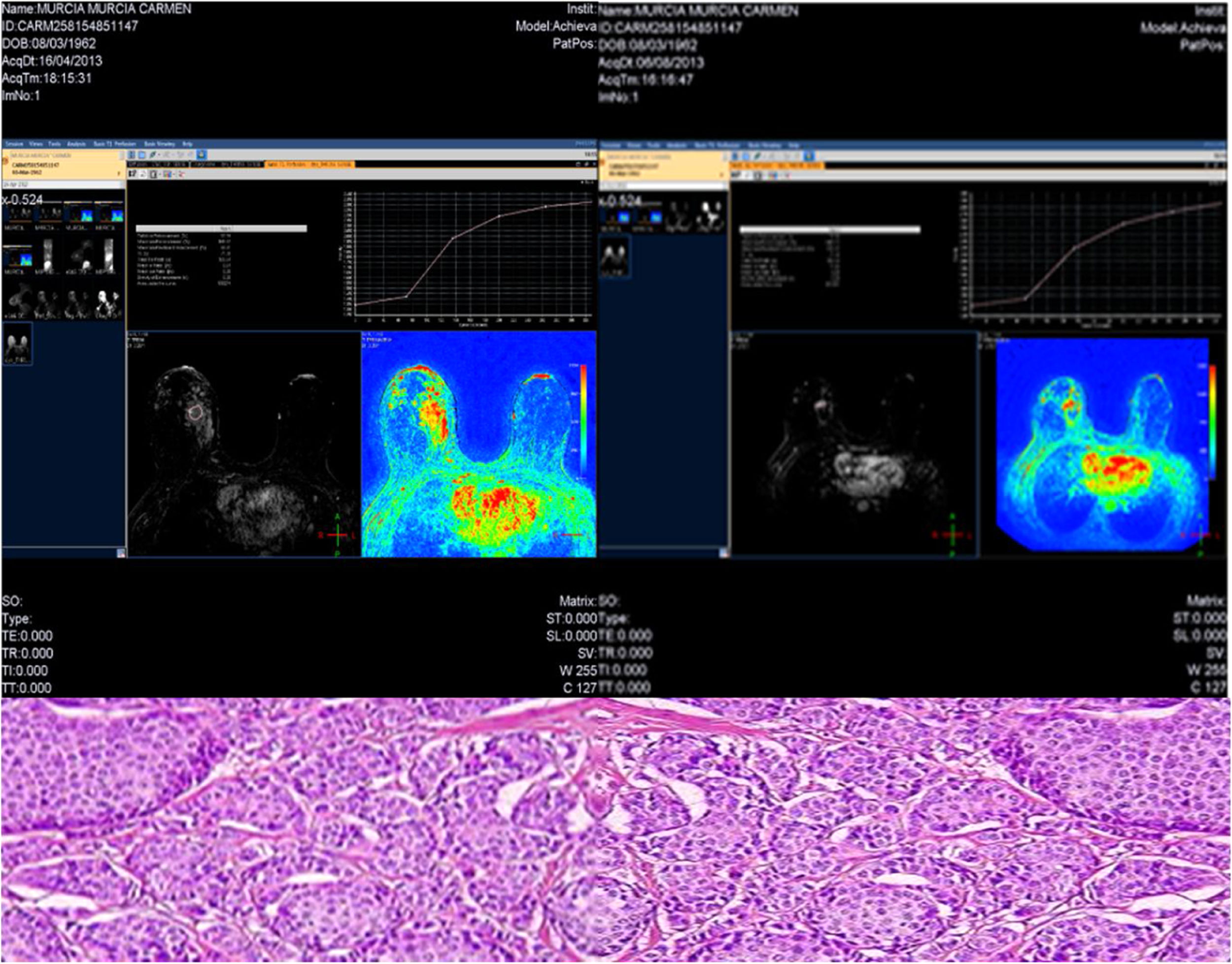
El tipo lobulillar invasivo se asocia a una mayor RR que el carcinoma ductal infiltrante. Uematsu et al.20, en cambio, encuentra que los tumores ductales infiltrantes son los más respondedores en RM (realces nodulares), a diferencia de los lobulillares (realces no nodulares y respuesta fragmentada)25,26, que tienden a una menor concordancia entre RR y RP, con un 25% de correlación27. En nuestros resultados la RM infraestima el tamaño tumoral residual (fig. 3), concluyendo pues que en este trabajo que presentamos se obtiene una concordancia para este subtipo inferior a la publicada. Según Mann et al.28, esto se debe a las características biológicas propias del carcinoma lobulillar infiltrante, pudiendo encontrar este aspecto discordante por las propias características de las pacientes del estudio, así como de la técnica de realización de la RM en nuestro medio.
La pRC es el factor pronóstico subrogado más importante de QTN, ya que ha demostrado un aumento en SLE y SG12,17. Si se analiza la RP en función de los inmunofenotipos, existe unanimidad al argumentar que los subtipos HER-2 y TN son los que más se asocian a una mayor respuesta a la QTN. En este estudio se han obtenido porcentajes de RP mayores entre los tumores HER-2+ (80%), seguido por los TN (73,40%). En otros trabajos29, el inmunofenotipo es el único factor independiente asociado a RP tumoral, a favor de los tumores HER-2+. Sin embargo, en este estudio ese dato no permanece significativo en el análisis mulitivariado.
El porcentaje global de RP axilar tras la QTN fue del 57,2%, semejante a lo publicado en la literatura (20-60%)30,31; además, está ajustado al porcentaje de RP tumoral local (63,5%), indicando la importante correlación existente entre ambas.
Al analizar las variables que influyen en la RPA, destaca el uso de anticoncepción hormonal o terapia hormonal sustitutiva (p=0,05) a favor de su uso para una mayor respuesta a QTN en axila. En la literatura no se han encontrado publicaciones que argumenten esta asociación, pero teniendo en cuenta que la mayor tasa de afectación axilar aparece en los tumores luminales32, que expresan receptores hormonales, esta relación y la influencia de dicha hormonoterapia en estos tumores podría explicarlo. Además, este estudio incluye pacientes en edades jóvenes, en donde es más frecuente la toma de este tipo de fármacos.
Existe un comportamiento similar en cuanto a inmunohistoquímica y RPA a lo obtenido al estudiar la RP en la mama, donde siguen siendo los tumores HER-2+ los que más responden (90%), seguidos de los tumores TN (73,4%). A diferencia de lo que ocurría en la RP local, en la axila estos resultados sí alcanzan significación estadística (p=0,011). En la literatura existe acuerdo con estos datos25,29, donde los tumores HER-2+ se asocian a mayor respuesta. Sin embargo, en un trabajo reciente33, además de no obtener significación estadística acerca del subtipo molecular y RPA, el mayor porcentaje de respuesta lo obtuvieron los tumores TN (69%) seguidos de los HER-2+ (62%) y luminales (47%).
Al relacionar la pRC en el tumor y en la axila encontramos en ambas un comportamiento similar, de modo que a mayor RP en la mama existirá mayor RPA (67,5%, p=0,028), no encontrando la misma significación en relación con la RR, aunque sí hay una asociación en el mismo sentido, como en los trabajos de McVeigh et al.34 y de Caudle et al.35. Por ello, se deberían aplicar técnicas diagnósticas en la axila que permitan realizar una cirugía conservadora de la misma cuando se objetive una respuesta favorable al tratamiento QTN.
En la serie que se presenta, el coeficiente de correlación encontrado entre RR y RP en mama y axila es de 0,209 y 0,221, respectivamente, presentando este último una tendencia a la significación estadística, de modo que la RM tiene una mayor capacidad predictiva de respuesta en ganglios que en la mama.
Como limitaciones del estudio, se trata de un estudio retrospectivo con un número de pacientes relativamente pequeño; heterogeneidad en los regímenes de QTN y clasificación de los subtipos moleculares en la serie mediante inmunohistoquímica en lugar de utilizar microarrays, aunque sea una alternativa adecuada.
En conclusión, la RM es un buen método para la valoración de la respuesta al tratamiento con QTN, con una mejor concordancia entre RR y RP a nivel axilar.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.