Determinar la variabilidad entre 2 sistemas de gradación a la hora de catalogar la respuesta patológica a la quimioterapia neoadyuvante en una misma lesión.
Material y métodosEn 8 años se han estudiado 51 pacientes con cáncer infiltrante de la mama sometidas a quimioterapia neoadyuvante de forma consecutiva. Se ha establecido la respuesta patológica de cada caso siguiendo el sistema de Miller y Payne (MyP) y el de la carga tumoral residual (RCB) correlacionando los resultados de ambos sistemas en la misma lesión.
ResultadosSegún el sistema de gradación de MyP las lesiones se clasificaron en grado 1 (6%), 2 (25%), 3 (27%), 4 (27%) y 5 (14%). La clase RCB fue 0 (13%), I (13%), II (54%) y III (20%). La correlación entre MyP 5 y RCB 0, entre MyP 4 y RCB I, y entre MyP 2 y RCB III fue buena. Se detectaron más discrepancias entre MyP 1, 2, 3 y RCB II.
ConclusiónLa correlación en la respuesta completa es buena entre los 2 sistemas de gradación. Hay discrepancias en la clasificación en la ausencia de respuesta entre ambos sistemas. Estas discrepancias pueden ser debidas a la inclusión del estado ganglionar en el sistema RCB.
To determine the variability between 2 grading systems in the classification of pathologic response to neoadjuvant chemotherapy in the same lesion.
Material and methodsFifty-one patients with invasive breast cancer were consecutively treated with neoadjuvant chemotherapy in an 8-year period. Pathologic response in each patient was established according to the Miller and Payne (MP) and the residual cancer burden (RCB) systems and the results were correlated.
ResultsIn the MP system, the lesions were classified in grade 1 (6%), 2 (25%), 3 (27%), 4 (27%) and 5 (14%). RCB class was 0 (13%), I (13%), II (54%) and III (20%). The correlation between MP 5 and RCB 0, between MP 4 and RCB I, and between MP 2 and RCB III was good. There were more discrepancies between MP 1, 2, 3 and RCB II.
ConclusionsThe correlation between the 2 grading systems is good. There are discrepancies in the assessment of lack of response between the 2 systems. This disagreement could be due to the inclusion of lymph node status in the RCB system.
El cáncer de mama es una enfermedad heterogénea, por lo que la respuesta a los diferentes tratamientos es variable entre los diferentes casos. Aunque la quimioterapia neoadyuvante (QNA) proporciona los mismos beneficios en términos de curación que la quimioterapia adyuvante, en el caso de la neoadyuvancia existen ventajas que hacen de ella una aproximación terapéutica muy atractiva. En primer lugar, la QNA permite aumentar la tasa de cirugía conservadora de la mama al lograr una reducción en el tamaño de la enfermedad. En segundo lugar, permite la valoración in vivo de la respuesta tumoral al agente quimioterápico, lo que informa sobre la biología propia de cada caso y sobre el pronóstico de la paciente1,2.
Es ampliamente aceptado que la respuesta completa a la quimioterapia, a nivel anatomopatológico3, guarda una estrecha relación con las tasas de supervivencia libre de progresión y de supervivencia global, siendo en todas las series estudiadas de mejor pronóstico las pacientes que alcanzan respuesta patológica a la quimioterapia4–6. La remisión patológica en el tumor primario parece, por tanto, ser un fiel reflejo de la respuesta de las posibles micrometástasis a distancia. La respuesta patológica a la QNA, tanto del tumor primario como de las metástasis ganglionares3, se correlaciona con la supervivencia libre de enfermedad y la recidiva4–6, y se propone actualmente por muchos expertos como un referente válido para la aprobación de fármacos en cáncer de mama, dada la excelente correlación con la evolución a largo plazo.
Por la importancia del concepto se han desarrollado múltiples definiciones de respuesta anatopatológica por diferentes autores. Estas clasificaciones tienen en cuenta el tamaño tumoral, la presencia de carcinoma in situ, la cantidad de celularidad residual, la apariencia histológica y el grado, y la respuesta ganglionar, entre otras variables, todas ellas características relacionadas con el efecto de la quimioterapia. Sin embargo, existe controversia a la hora de definir la respuesta patológica y no existe acuerdo sobre la mejor definición de la respuesta patológica completa4,7,8.
Hay por lo menos 11 clasificaciones publicadas para gradar la respuesta patológica a la QNA9–19 y existe una gran variabilidad en la interpretación, la aplicación y el significado de cada una20 (tabla 1). Entre estas clasificaciones destacan el sistema de Miller y Payne (MyP)15 y el de la carga tumoral residual (RCB)19.
Sistemas de clasificación de la respuesta patológica
| Clasificación | Año | N | Descripción |
| Chevallier et al.9 | 1993 | 45 | Clase 1 (pCR): desaparición de todo el tumor |
| Clase 2 (pCR): presencia de CIS, ausencia de tumor infiltrante y ganglios negativos | |||
| Clase 3 (pPR): presencia de carcinoma infiltrante con alteraciones estromales | |||
| Clase 4 (pNR): pequeñas alteraciones de la apariencia inicial del tumor | |||
| Sinn et al.10 | 1994 | 51 | Grado 0: no efecto |
| Grado 1: resorción y esclerosis tumoral | |||
| Grado 2: foco infiltrante mínimo de 5mm o menor | |||
| Grado 3: solo focos no invasivos residuales | |||
| Grado 4: no se detectan células tumorales viables | |||
| Sataloff et al.11 | 1995 | 23 | T-A (pCR): efecto terapéutico total o casi total |
| T-B (pPR): más del 50% de efecto terapéutico, pero menos de un efecto total o casi total | |||
| T-C (pPR): menos del 50% de efecto terapéutico, pero evidente | |||
| T-D (pNR): ausencia de efecto terapéutico | |||
| Honkoop et al.12 | 1998 | 42 | Respuesta completa: ausencia de enfermedad residual en la mama y en la axila |
| Enfermedad residual mínima: presencia solo microscópica de enfermedad residual en la mama o en la axila | |||
| Enfermedad residual macroscópica: enfermedad macroscópica residual en la mama o en la axila | |||
| Kuerer et al.13 | 1998 | 156 | pCR: ausencia de tumor residual |
| pPR: 1cm3 o menos de tumor macroscópico residual (se incluyen los focos microscópicos de células residuales) | |||
| pNR: más de 1cm3 de tumor macroscópico residual | |||
| NSABP B-1814 | 2002 | 1523 | pCR: ausencia de células tumorales infiltrantes |
| pPR: presencia de células tumorales individuales o en pequeños grupos en un estroma desmoplásico o hialinizado | |||
| pNR: el tumor no muestra ninguno de los cambios descritos anteriormente | |||
| Miller y Payne15 | 2003 | 176 | Grado 1 (pNR): ausencia de respuesta |
| Grado 2 (pPR): reducción menor (inferior al 30%) | |||
| Grado 3 (pPR): algo de reducción (entre el 30 y el 90%) | |||
| Grado 4 (casi pCR): reducción marcada (superior al 90%) | |||
| Grado 5 (pCR): ausencia de cáncer infiltrante residual. Puede haber CIS | |||
| Propuesta estatus axilar7 | N-A: axila negativa verdadera | ||
| N-B: ganglios axilares positivos sin respuesta terapéutica | |||
| N-C: ganglios axilares positivos, pero con evidencias de respuesta terapéutica | |||
| N-D: ganglios axilares positivos inicialmente, pero negativizados tras tratamiento | |||
| International Expert Panel16 | 2003 | NE | Próximo a pCR: desaparición casi total del tumor infiltrante |
| Casi pCR: desaparición total o casi total del tumor infiltrante | |||
| Extensa pCR: ausencia de tumor infiltrante residual | |||
| Estricta pCR: ausencia de células tumorales en la mama | |||
| pCRinf: presencia de solo CIS | |||
| Extensa pCRm+g: ausencia de tumor infiltrante residual en la mama y en los ganglios | |||
| Estricta pCRm+g: ausencia de células tumorales en la mama y en los ganglios | |||
| Japanese Breast Cancer Society17 | 2004 | NE | Grado 0: ausencia de respuesta |
| Grado 1: escasa respuesta. (a) Respuesta leve. (b) Respuesta moderada superior a 1/3 de células tumorales, pero inferior a los 2/3 | |||
| Grado 2: respuesta acentuada, superior a los 2/3 de las células tumorales | |||
| Grado 3: respuesta completa | |||
| American Joint Committee on Cancer18 | 2005 | 132 | yT1: tumor residual de 2cm o menos |
| yT2: tumor residual de más de 2cm, pero de no más de 5cm | |||
| yT3: tumor residual de más de 5cm | |||
| yT4: tumor residual que invade pared torácica o piel | |||
| yN0: ausencia de metástasis ganglionares | |||
| yN1: metástasis en 3 o menos ganglios | |||
| yN2: metástasis en 4-10 ganglios | |||
| yN3: metástasis en más de 10 ganglios | |||
| Carga tumoral residual19 | 2007 | 382 | RCB-0 (pCR): ausencia de tumor mamario y ganglionar |
| RCB-I (pPR): respuesta parcial | |||
| RCB-II (pPR): respuesta parcial | |||
| RCB-III (pNR): quimiorresistencia |
CIS: carcinoma in situ; g: ganglios; inf: infiltrante; m: mama; NE: no especificado; pCR: respuesta patológica completa; pNR: ausencia de respuesta patológica; pPR: respuesta patológica parcial.
El objetivo de este estudio es determinar la variabilidad entre ambos sistemas a la hora de catalogar la respuesta patológica de una misma lesión.
Material y métodosDesde mayo de 2005 hasta febrero de 2012 se han estudiado 51 carcinomas infiltrantes de la mama sometidos a QNA de forma consecutiva en nuestro centro. Las variables anatomopatológicas que se consideraron en las piezas quirúrgicas tras el tratamiento quimioterápico fueron: tipo histológico, grado histológico (formación de túbulos, pleomorfismo nuclear, índice mitótico), número de ganglios extirpados, número de ganglios metastásicos, respuesta patológica según MyP15 (grado 1: ausencia de respuesta; grado 2: reducción menor [≤30%]; grado 3: algo de reducción [30-90%]; grado 4: reducción marcada [>90%]; grado 5: ausencia de cáncer infiltrante residual aunque puede haber carcinoma in situ), índice RCB19 (diámetro mayor del lecho tumoral, diámetro menor del lecho tumoral, porcentaje de cáncer infiltrante, porcentaje de la celularidad tumoral que corresponde a carcinoma in situ, número de ganglios, número de ganglios positivos y tamaño de la metástasis mayor) y clase RCB (0 respuesta completa, i, ii y iii ausencia de respuesta). El cálculo del RCB y el establecimiento de la clase RCB se efectuaron mediante la fórmula suministrada on-line por el M. D. Anderson Cancer Centre de la Universidad de Texas21. Para el cálculo de RCB se eliminaron aquellos casos en los que se practicó biopsia selectiva del ganglio centinela previa al tratamiento quimioterápico y este resultó positivo, independientemente de que se efectuase posteriormente linfadenectomía o no, por la limitación en la eficacia del cálculo del RCB que ello supone21.
Se correlacionaron los resultados de ambos sistemas de gradación en la misma lesión utilizando el análisis de correspondencias simples. También se correlacionó la regresión entre ambos sistemas y el tipo histológico, el grado histológico y la presencia o no de carcinoma in situ mediante la prueba de chi-cuadrado.
ResultadosLa edad media de las pacientes fue de 49,4±9,5 años. El tipo histológico de los tumores tras el tratamiento quimioterápico fue ductal en 42 (82%), lobulillar en 2 (4%), ductal in situ en 2 (4%), y en 5 (10%) casos no había tumor residual. El grado histológico fue i en 20 casos (45%), ii en 22 casos (50%) y iii en 2 casos (5%); no se determinó en 7 casos por la nula o escasa representación de tumor residual. El diámetro máximo de los tumores fue de 17,1±15,3mm y se identificaron metástasis ganglionares en 24 (47%) casos (tabla 2).
Edad de las pacientes y características histológicas de las lesiones
| Variable | ||
| Edad (años) | 49,4±9,5 | 32-68 |
| Tipo histológico | ||
| No | 5 | 10% |
| Ductal | 42 | 82% |
| Lobulillar | 2 | 4% |
| Ductal in situ | 2 | 4% |
| Formación de túbulosa | ||
| ND | 7 | |
| 1 | 7 | 16% |
| 2 | 15 | 34% |
| 3 | 22 | 50% |
| Pleomorfismo nucleara | ||
| ND | 7 | |
| 1 | 9 | 20% |
| 2 | 23 | 52% |
| 3 | 12 | 27% |
| Índice mitóticoa | ||
| ND | 7 | |
| 1 | 40 | 91% |
| 2 | 4 | 9% |
| 3 | 0 | 0% |
| Grado histológicoa | ||
| ND | 7 | |
| I | 20 | 45% |
| II | 22 | 50% |
| III | 2 | 5% |
| Tamaño tumoral (mm) (n=44)a | 17,1±15,3 | 1-95 |
| Metástasis ganglionares | ||
| No | 27 | 53% |
| Sí | 24 | 47% |
| Número de ganglios aislados | 12±7 | 0-27 |
| Número de ganglios positivos (n=24) | 4±5 | 1-21 |
ND: no determinado.
aSe eliminan 7 casos: 2 carcinomas in situ y 5 en los que no hay tumor residual.
Según el sistema de gradación de MyP, 3 (6%) lesiones fueron grado 1, 13 (25%) grado 2, 14 (27%) grado 3, 14 (27%) grado 4 y 7 (14%) grado 5.
La clase RCB fue 0 en 6 casos (13%), i en 6 casos (13%), ii en 26 casos (54%) y iii en 10 (20%) casos (tabla 3).
Gradación de los tumores según Miller y Payne y carga tumoral residual
| Clasificación de Miller y Payne | N | % |
| Grado 1 | 3 | 6 |
| Grado 2 | 13 | 25 |
| Grado 3 | 14 | 27 |
| Grado 4 | 14 | 27 |
| Grado 5 | 7 | 14 |
| Clasificación RCB | Media±DE | Rango |
| Diámetro mayor (mm) (n=44)a | 17,1±15,3 | 1-95 |
| Diámetro menor (mm) (n=44)a | 9,2±6,3 | 1-30 |
| % Carcinoma infiltrante (n=44)a | 49±35 | 1-100 |
| % Carcinoma in situ (n=28) | 16±29 | 2-100 |
| Número de ganglios positivos (n=24) | 4±5 | 1-21 |
| Tamaño metástasis (n=24) | 9,6±10,4 | 0,2-50 |
| Índice RCB≠0 (n=42)b | 2,5±1 | 0,615-4,219 |
| Clase RCB (n=48)c | N | % |
| 0 | 6 | 13 |
| I | 6 | 13 |
| II | 26 | 54 |
| III | 10 | 20 |
DE: desviación estándar; RCB: carga tumoral residual.
Se correlacionaron los resultados de ambos sistemas teniendo en cuenta la respuesta patólogica completa (MyP grado 5 y clase RCB 0), la ausencia de respuesta (MyP grado 1 y clase RCB III), y respuesta parcial (MyP grados 2 a 4 y clase RCB I y II). La correlación entre MyP 5 y RCB 0 (fig. 1a), entre MyP 4 y RCB I (fig. 1b), y entre MyP 2 y RCB III fue buena, detectándose más discrepancias entre MyP 1, 2, 3 y RCB II (tabla 4).
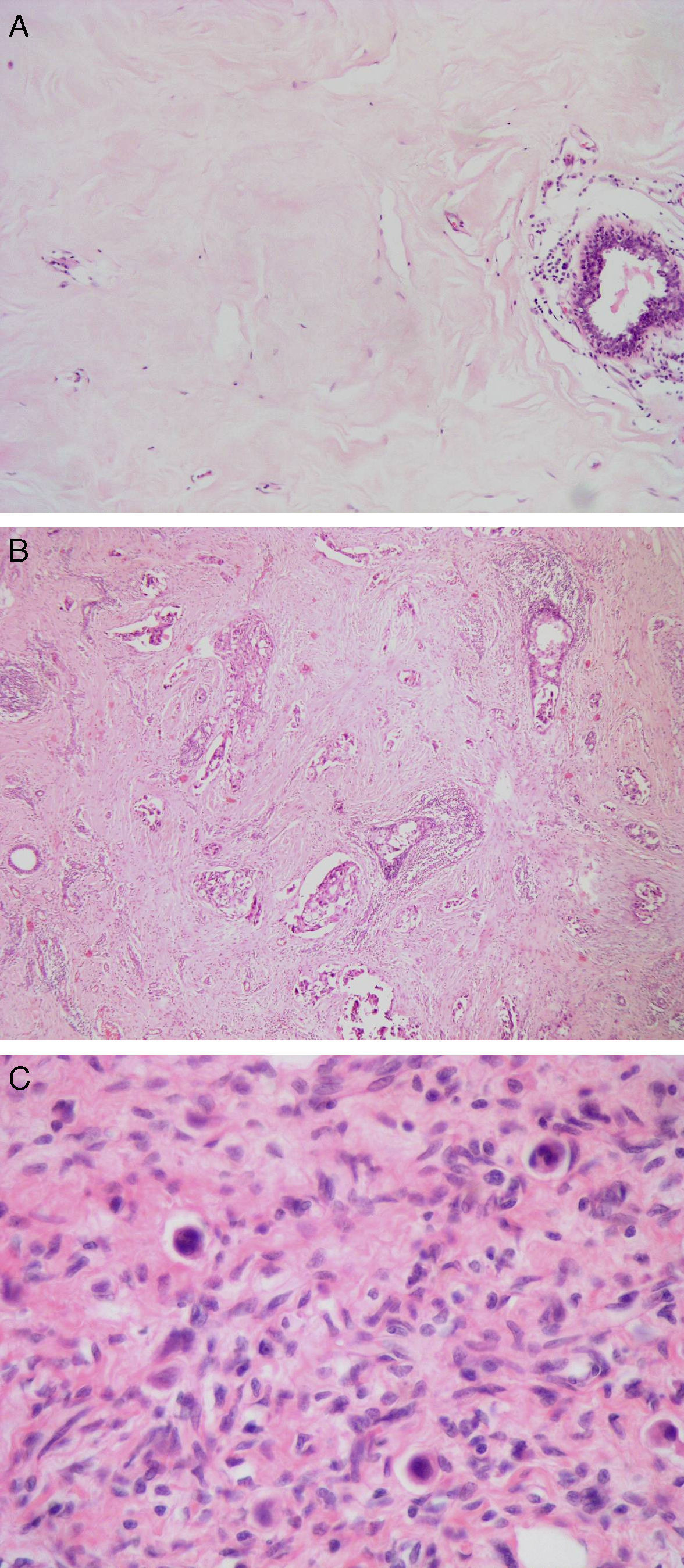
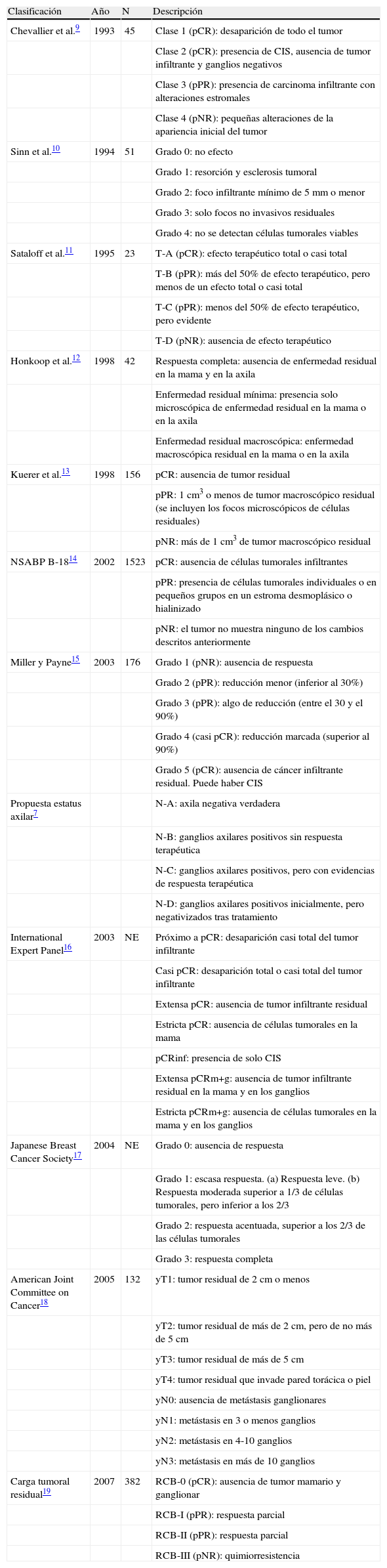
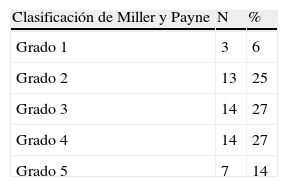
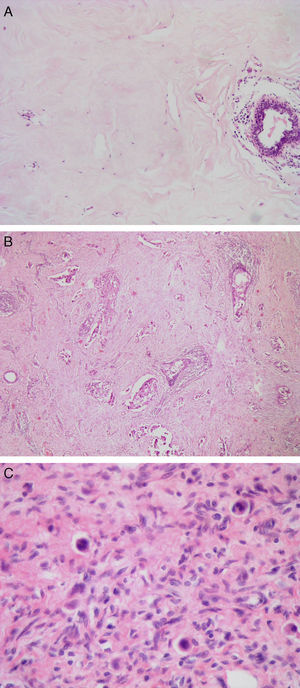
Reducción patológica: (A) completa (Miller y Payne 5, clase RCB 0). Estroma hialinizado sin celularidad tumoral. (B) Marcada (Miller y Payne 4, clase RCB I). Presencia de algunos túbulos y trabéculas de células tumorales en un estroma con fibrosis hialina. (C) Marcada (Miller y Payne 4, Clase RCB II). Presencia de escasas células tumorales aisladas de morfología histiocitoide en un estroma con marcada fibrosis.
Correlación entre Miller y Payne y la carga tumoral residual, y su representación gráfica en el análisis de correspondencias simples
| Miller y Payne | Clase RCB | ||||
| III | II | I | 0 | Total | |
| 1 | 0 | 2 | 0 | 0 | 2 |
| 2 | 6 | 6 | 0 | 0 | 12 |
| 3 | 4 | 10 | 0 | 0 | 14 |
| 4 | 0 | 8 | 6 | 0 | 14 |
| 5 | 0 | 0 | 0 | 6 | 6 |
| Total | 10 | 26 | 6 | 6 | 48 |
RCB: carga tumoral residual.
Se eliminan 3 casos con ganglio centinela positivo previos a la quimioterapia neoadyuvante.
En 4 casos con ausencia de respuesta según RCB (III) el MyP los clasificó como algo de reducción (3, entre el 30 y 90%), todos los casos mostraron metástasis ganglionares y el porcentaje de reducción celular fue de 30, 35, 40 y 60. Los casos de clase RCB II mostraron un MyP de 1 (ausencia de respuesta) en 2 ocasiones (eran grado 1 y sin metástasis ganglionares), de 2 en 6 (uno de ellos con metástasis), de 3 en 10 (8 de ellos grado 1 y 3 con metástasis ganglionares) y de 4 (reducción marcada) en 8 (5 eran grado 2 o 3 y 7 con metástasis ganglionares) (fig. 1c).
Al correlacionar la regresión con ambos sistemas con el tipo histológico y la presencia o no de carcinoma in situ no se observó relación entre las variables y el grado de regresión. Al relacionar el grado, aunque no de forma significativa, se observó una tendencia a mayor regresión con el sistema de MyP, pero no con el RCB, de las lesiones de mayor grado histológico.
DiscusiónLa QNA produce una serie de cambios histopatológicos en el tumor primario y en los ganglios linfáticos afectados, entre los que se incluyen modificaciones en el tamaño tumoral, en las características y la densidad de la celularidad, en la apariencia histológica, en el grado de diferenciación tumoral, la presencia y las características de la invasión vascular linfática y variaciones en la expresión de factores pronósticos y predictivos2,6,8,17,22,23. Muchos de estos cambios morfológicos están relacionados con la respuesta patológica de la lesión al agente quimioterápico aplicado. Para medir esta respuesta patológica existen múltiples sistemas de gradación que utilizan distintos parámetros morfológicos de evaluación9–19 con gran variabilidad entre ellos20 (tabla 1). Entre los más utilizados están el tamaño tumoral y el porcentaje de celularidad tumoral residual2,7,8, aunque los hay que también incluyen el porcentaje de lesión in situ y el estatus ganglionar9,12,15,16,18,19.
Existen controversias a la hora de definir la respuesta patológica completa, pues hay sistemas que aceptan la presencia de carcinoma in situ y/o invasión tumoral linfovascular sin evidencias de carcinoma infiltrante como respuesta patológica completa, así como la inclusión o no de la afectación ganglionar3.
Para establecer el grado de respuesta patológica completa, independientemente del método utilizado, es imprescindible seguir unos estándares a la hora de efectuar el muestreo histopatológico, determinando el tamaño del lecho tumoral y muestreándolo de forma exhaustiva para evaluar la presencia o no de tumor residual2,7,8. Se recomienda practicar cortes paralelos al eje mayor del espécimen y realizar un estudio minucioso teniendo en cuenta que la regresión tumoral puede ser en forma concéntrica en un solo foco, o en forma de panal de abejas, de modo que queden múltiples focos en el lecho tumoral7. Así mismo, es muy importante determinar el estado del margen de resección y establecer la presencia de cambios regresivos en los ganglios linfáticos regionales para detectar una posible afectación de los mismos antes del tratamiento3.
Entre los sistemas de gradación de la respuesta patológica, los más utilizados son el MyP15 y el RCB19. El sistema de MyP consta de una escala de 5 categorías que tienen en cuenta el porcentaje de reducción de celularidad tumoral. En el caso de no observar células tumorales con técnicas histológicas rutinarias es necesario recurrir a las técnicas de inmunohistoquímica para la detección de citoqueratinas. El grado 1 corresponde a la ausencia de respuesta y el grado 5 a la respuesta patológica completa, en la que puede haber carcinoma in situ (tabla 1). La distribución de los casos en cada categoría que describen los autores es similar a la que encontramos en nuestros casos, y sigue una distribución modal: grado 1 un 15%, grado 2 un 24%, grado 3 un 27%, grado 4 un 20% y grado 5 un 14%15, que es superponible al 6, 25, 27, 27 y 14%, respectivamente, para cada grado que presentan nuestros casos. El sistema elaborado en el M. D. Anderson Cancer Center que establece la carga tumoral residual19 se basa en el cálculo de una fórmula matemática que incluye el tamaño del lecho tumoral (determinado en mm es su dimensión mayor y menor), el porcentaje del área global de celularidad tumoral, el porcentaje de tumor que es in situ, el número de ganglios metastásicos y el tamaño en mm de la metástasis mayor. Con ello se obtiene un resultado numérico con 3 decimales que se extrapola a una escala cualitativa de 4 categorías, correspondiendo el 0 a la respuesta patológica completa y el iii a la ausencia de respuesta. Para este cálculo, los autores facilitan una calculadora automática, que además incluye un tutorial, para determinar las variables que se tienen en cuenta21. Aplicando este sistema, la clase RCB de nuestros casos, al igual que con la clasificación de MyP, sigue una distribución modal con una acumulación de casos en la clase ii.
Ninguno de los sistemas descritos en la literatura tiene en cuenta ni el tipo ni el grado histológico9–19. En nuestros casos, la mayoría fueron de la variedad ductal, y se observó, aunque no de forma significativa, un mayor grado de regresión con el sistema de MyP de aquellas lesiones de mayor grado histológico. La presencia o no de carcinoma in situ y el tipo histológico no se relacionaron con la regresión. Hay estudios que demuestran que ni el tipo ni grado histológico, ni el estatus ganglionar influyen en la predicción de la respuesta patológica completa5. No obstante, es conocido que el efecto de la quimioterapia produce un incremento en el grado tumoral de las lesiones residuales, pues las células tumorales se presentan de forma aislada (escasa formación de túbulos), con mayor tamaño nuclear aunque con bajo índice mitótico2,7,14, lo que está en concordancia con nuestros resultados, en los que tanto la formación de túbulos como el pleomorfismo nuclear fueron mayoritariamente grado 2 y 3, y el índice mitótico grado 1. Parece ser que en el tipo histológico lobulillar, en el grado histológico 1 y en lesiones con receptores hormonales positivos, la respuesta patológica completa no sería tan buen predictor de la supervivencia libre de enfermedad y la supervivencia global como en los otros tipos histológicos, grados 2 o 3 y estatus hormonal negativo4. Aunque clásicamente se ha descrito una menor tasa de respuesta patológica completa en la variedad lobulillar, hay estudios que demuestran que ello se debe a factores moleculares de la lesión (receptores hormonales y HER2), de forma independiente a la histología lobulillar24,25.
Tanto el sistema de MyP como el RCB se correlacionan de forma significativa con la supervivencia global y la supervivencia libre de enfermedad15,19, aunque se han descrito variaciones en función del tipo histológico y de las características moleculares del tumor4,24,25. El sistema de RCB es más objetivo y reproducible que el de MyP, el cual en su versión original no incluye el estatus ganglionar, aunque posteriormente se ha efectuado una propuesta a tal efecto7. Sin embargo, no hemos encontrado trabajos en la literatura en los que se aplique esta versión modificada del sistema de MyP, por lo que no hay correlación con la supervivencia ni la recidiva local. El sistema de MyP es quizás más impreciso, pues el grado 3 representa la respuesta patológica con una reducción entre el 30 y el 90% en la misma categoría. El sistema de RCB es más preciso, pero el hecho de considerar más variables lo hace más difícil de utilizar en la práctica.
En conclusión, atendiendo a nuestros resultados, la correlación en la respuesta completa es buena entre los 2 sistemas de gradación. Hay discrepancias a la hora de clasificar la ausencia de respuesta entre ambos sistemas, pues algunos casos según RCB son reducción menor o algo de reducción según MyP, y los casos de ausencia de respuesta según MyP fueron respuestas parciales según RCB. Estas discrepancias, según la casuística expuesta, pueden ser debidas a la inclusión del estado ganglionar en el sistema RCB.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Premio al mejor póster presentado en el XXXI Congreso de la Sociedad Española de Senología y Patología Mamaria (SESPM). Barcelona, octubre de 2012.