La radioterapia en el cáncer de mama se ha empleado desde hace más de 100 años para el control local de la enfermedad. Las mejoras tecnológicas incorporadas en los últimos 20-30 años han optimizado estos resultados de control local y han conseguido aumentar la supervivencia global (nivel de evidencia 1, en el metaanálisis de Oxford). Realizamos un breve recuerdo histórico de los avances que han cambiado la práctica clínica de la radioterapia en el cáncer de mama, desde las 2 dimensiones a las 3 dimensiones con la incorporación de la tomografía axial computarizada para la simulación virtual, los conceptos de volúmenes de tratamiento, órganos de riesgo, histogramas dosis-volumen y el objetivo de distribución homogénea de la dosis absorbida entre el 95 y el 107%. Las mejoras tecnológicas en las unidades de tratamiento, desde la cobaltoterapia a los aceleradores con multiláminas automáticos con colimación de los haces hasta 5mm en un tiempo récord, acortando los tiempos de tratamiento y la protección exquisita de los órganos de riesgo, como el pulmón y el corazón. Describiremos las generalidades de las técnicas de radioterapia en el cáncer de mama, la inmovilización en supino y en prono, la posición y volúmenes de tratamiento, la calidad de la radiación, técnica y dosis recomendadas. Mencionaremos también los nuevos fraccionamientos, que están irrumpiendo en la práctica clínica asistencial de la radioterapia del cáncer de mama, con un nivel de evidencia suficiente, con resultados en control local, supervivencia, estéticos y de toxicidad similares a los del fraccionamiento de 2Gy en 25 fracciones.
Radiation therapy in breast cancer has been used for more than a century for local disease control. Improved technology in the last 20-30 years has maximized outcomes not only in achieving local control but also in increasing overall survival (level 1 evidence in an Oxford meta-analysis). We present a brief historical review of all the technical and scientific advances that have changed clinical practice in breast cancer radiotherapy. These include the switch from 2-dimensional to 3-dimensional technology with the use of computed tomography for virtual simulation, the new concepts of treatment volumes, organs at risk and dose-volume histograms, and the objective of a homogeneous distribution of the absorbed dose of between 95% and 107%. Technological advances in treatment units, from cobalt therapy to accelerators with MLC leaves with beam collimation of up to 5mm in record time have shortened treatment times and provide exquisite protection to at-risk organs, such as the heart or lung. We describe the general features of radiation therapy techniques in breast cancer, including immobilization in supine and prone positions, the position and volumes of treatment, the quality of radiation, the technique, and recommended doses. We also mention the new dose fractions that are breaking into the clinical practice of breast cancer radiotherapy, with a considerable level of evidence showing good results in terms of local control, survival rates, and esthetic outcomes, as well as toxic effects very similar to those achieved with the standard dose of 50Gy in 25 fractions of 2Gy.
En el manejo integral del cáncer de mama, la radioterapia (RT) ha ocupado un lugar primordial durante décadas. Los avances en este ámbito van ligados estrechamente a las mejoras tecnológicas1.
La RT del cáncer de mama se remonta a más de 100 años, cuando Emil Grubbé, en 1896, en Chicago, trata con rayos X a Rose Lee, diagnosticada de un cáncer de mama izquierda localmente avanzado, obteniendo una respuesta esperanzadora. F. Baclesse, en 1965, publica una serie de 431 pacientes tratadas con rayos Roentgen exclusivamente, con resultados a 5 años. Ya describe el empleo de 6 campos de tratamiento con dosis fraccionadas y recomienda una técnica precisa y cuidadosa para no superponer las áreas de tratamiento y proteger los órganos de riesgo2.
Aunque los primeros simuladores de rayos X se introducen en los años 50, no se generaliza su uso para diseñar los tratamientos hasta los años 80. Posibilita la RT en 2 dimensiones (2D) mediante la obtención de radiografías convencionales, calculando la dosimetría en un solo plano. No solamente se profundiza en el diseño de los límites anatómicos de las regiones a tratar, como la pared costal, la región axilar o la fosa supraclavicular, sino también en índices de calidad en 2D para proteger los órganos de riesgo, como la distancia central pulmonar en los campos tangenciales (central lung distance, no mayor de 3cm) y la distancia máxima cardíaca (maximum heart distance, no mayor de 1,5cm)3.
En los años 80, la incorporación de la tomografía axial computarizada (TAC) nos permite, sobre una reconstrucción anatómica digital, realizar una simulación virtual en 3D de volúmenes de tratamiento, cálculos de distribución de dosis e histogramas dosis-volumen. Posteriormente, los aceleradores lineales multienergéticos con multiláminas automáticas permiten la conformación del haz de radiación, incluso con intensidad modulada e incorporando sistemas de control del isocentro con imagen guiada. El Grupo Español de Oncología Radioterápica de Mama publica en 2012 una encuesta sobre las técnicas de irradiación mamaria, empleadas en 2009, encontrando que en el 100% de los centros españoles participantes se emplea la 3D conformada y solo en el 1% la RT de intensidad modulada, modalidad de RT externa que permite optimizar la intensidad de los haces de radiación no uniformes con más alta precisión y mayor protección de los órganos de riesgo, o en el 5,5%, el hipofraccionamiento4.
No hay que olvidar el gran avance que supuso el consenso sobre los conceptos de planificación radioterápica en 1993 y 1999, de la International Commission on Radiation Units & Measurements, informes 50 y 62, unificando los criterios de calidad de tratamiento con fotones, haciéndolos rutinarios: el clinical target volume o volumen blanco clínico, el gross tumor volume o volumen visible tumoral, y el planning target volume (PTV, «volumen blanco de planificación»), órganos de riesgo con respecto a la delimitación de volúmenes en 3D y los de volumen tratado (isodosis del 95%), volumen irradiado y dosis máxima/mínima en relación con dosimetría clínica. Posteriormente, el margen interno y de posicionamiento o set-up, para incluir en el concepto de PTV y con referencia a que la dosis oscile en este entre un +7 y un -5% de la dosis prescrita5,6.
El objetivo primario de la RT del cáncer de mama es el de erradicar la enfermedad microscópica residual tras la cirugía para mejorar el control local y la supervivencia global.
En la actualización del metaanálisis del Early Breast Cancer Trialists’ Collaborative Group7 se evidenció que la irradiación de la mama tras cirugía conservadora disminuía, de forma global, el riesgo de la primera recidiva, ya fuese locorregional o a distancia, a 10 años, del 35 al 19,3% con una p<0,0001 y un número necesario para tratar (NNT) de 7, y el riesgo de mortalidad relacionada con el cáncer de mama a 15 años del 25,2 al 21,4%, con una p<0,0005 y un NNT de 27. En los ganglios negativos la primera recidiva a 10 años pasó del 31 al 15,6%, y el riesgo de mortalidad por cáncer de mama a 15 años del 20,5 al 17,2%, con p=0,005 y NNT de 31, y en ganglios positivos, el riesgo de recurrencia a 10 años pasó del 63,7 al 42,5%, con una p<0,0001 y un NNT de 5, y de mortalidad a 15 años, del 51,3 al 42,8%, con p<0,01, NNT 12. Nivel de evidencia 1.
En los resultados a 5 años también se demostró mejoría en el control locorregional y la supervivencia relacionada por cáncer de mama, pero se veía reducida por el incremento de mortalidad por causas no relacionadas con el cáncer, sino con la irradiación del corazón, como órgano de riesgo, con un aumento de mortalidad del 29,2 vs. al 27,1% cuando no recibían RT8. En estudios como el de Giordano et al. en 20059 se demuestra que este aumento de mortalidad disminuye con las mejoras tecnológicas introducidas en los años 80.
En la actualidad, la RT en decúbito prono o con control respiratorio disminuye la dosis en los órganos de riesgo, en corazón y/o en pulmón. Por ejemplo, el control respiratorio durante la irradiación reduce la dosis media cardíaca de 3,7 a 1,7Gy, y el volumen de pulmón ipsilateral que recibe más de 20Gy se reduce del 12,2 al 10%. Nivel de evidencia 3a10.
Procedimiento de radioterapia externa del cáncer de mamaEl proceso radioterápico se desarrolla siguiendo una serie de etapas clínicas:
- •
Evaluación clínica y la decisión de tratamiento, siendo responsabilidad del especialista en Oncología Radioterápica.
- •
Localización del tratamiento: para llevar a cabo un tratamiento con RT sobre la mama hay que realizar una TAC para la localización del volumen blanco y de los órganos de riesgo. Esta etapa la realizan los técnicos de RT.
- •
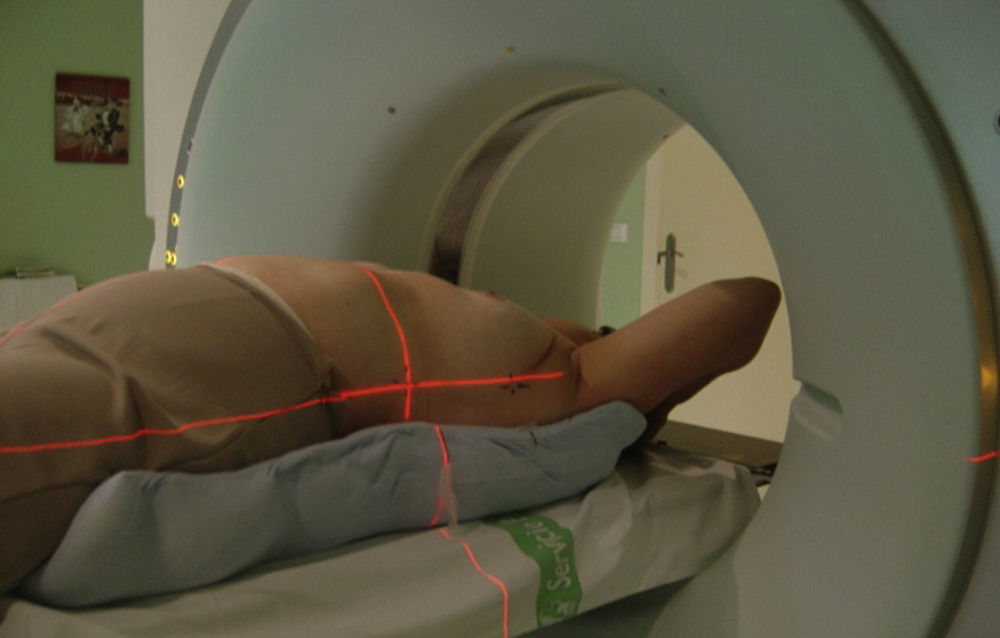
Inmovilización y posicionamiento de la paciente11,12. La posición de la paciente durante la TAC deberá ser lo más cómoda posible con el fin de asegurar su reproducibilidad durante todo el tratamiento. Comúnmente, la paciente se coloca en decúbito supino, utilizando un dispositivo de inmovilización que asegure la colocación de los brazos en abducción (90-120°), y externamente rotados por encima de la cabeza y con la cabeza girada hacia el lado contralateral; esta posición levanta la mama cranealmente, reduciendo las dosis al corazón y también proporciona simetría, por si posteriormente fuera necesaria la irradiación de la mama contralateral. En la evaluación de la posición del brazo es importante dejar los tejidos blandos del brazo situados craneales a la unión de los tangenciales y el campo supraclavicular. Además, se deben evitar en lo posible los pliegues de la piel dentro de la fosa supraclavicular (fig. 1).
La utilización de un plano inclinado con una angulación de 10-15° para apertura de TAC de 70cm o 17,5-20° para aperturas mayores de 85cm permiten aplanar la pendiente de la pared torácica en la región del esternón, lo cual puede ser útil para disminuir el volumen pulmonar incluido en el campo de irradiación. Se pueden usar sistemas de inmovilización: cuñas alfa, cuñas debajo de las rodillas, etc., los cuales permiten reproducir la posición de la paciente diariamente dentro de un margen de 5mm. No hay una forma de inmovilización completamente satisfactoria de la mama en sí misma, especialmente en mamas grandes.
Una vez posicionada la paciente, se alinea con láser en el plano longitudinal y en el transversal, y se marcan 3 puntos en el plano del isocentro transversal, uno en la línea media esternal y otros 2 a nivel de la línea media axilar bilateral. Se marcará un cuarto punto, que se localizará en la línea media esternal a nivel de la apófisis xifoides. La paciente se coloca en la mesa de la TAC sobre un plano duro y se comprueba la alineación de los puntos con las luces láser de la TAC.
• Simulación y adquisición de imágenes: el estudio TAC debe abarcar toda la zona de tratamiento, desde el ángulo de la mandíbula hasta la apófisis xifoides, lo que permite incluir la región supraclavicular en caso de tratamiento sobre las cadenas ganglionares y toda la cavidad torácica, para tener una correcta información del HDV pulmonar; en ocasiones es importante incluir el hígado para tener información de la dosis recibida por ese órgano en las afectaciones del lado derecho.
Se pueden colocar marcas radioopacas en los puntos de referencia antes señalados y se indicará con alambre radioopaco la cicatriz de tumorectomía. Es útil colocar 2 marcas radioopacas, una en la parte superior de la mama (por palpación) y otra en el surco submamario, en la proyección del pezón hacia arriba y hacia abajo. Los cortes de TAC se realizarán cada 3-5mm, y debe conseguirse que uno de ellos pase por la línea del isocentro o punto 0 de referencia.
Debe tenerse cuidado en la adquisición de datos para adaptar todos los dispositivos de apoyo al tamaño y forma de la paciente individualmente para maximizar la comodidad y así ayudar a la reproducibilidad para el posterior tratamiento.
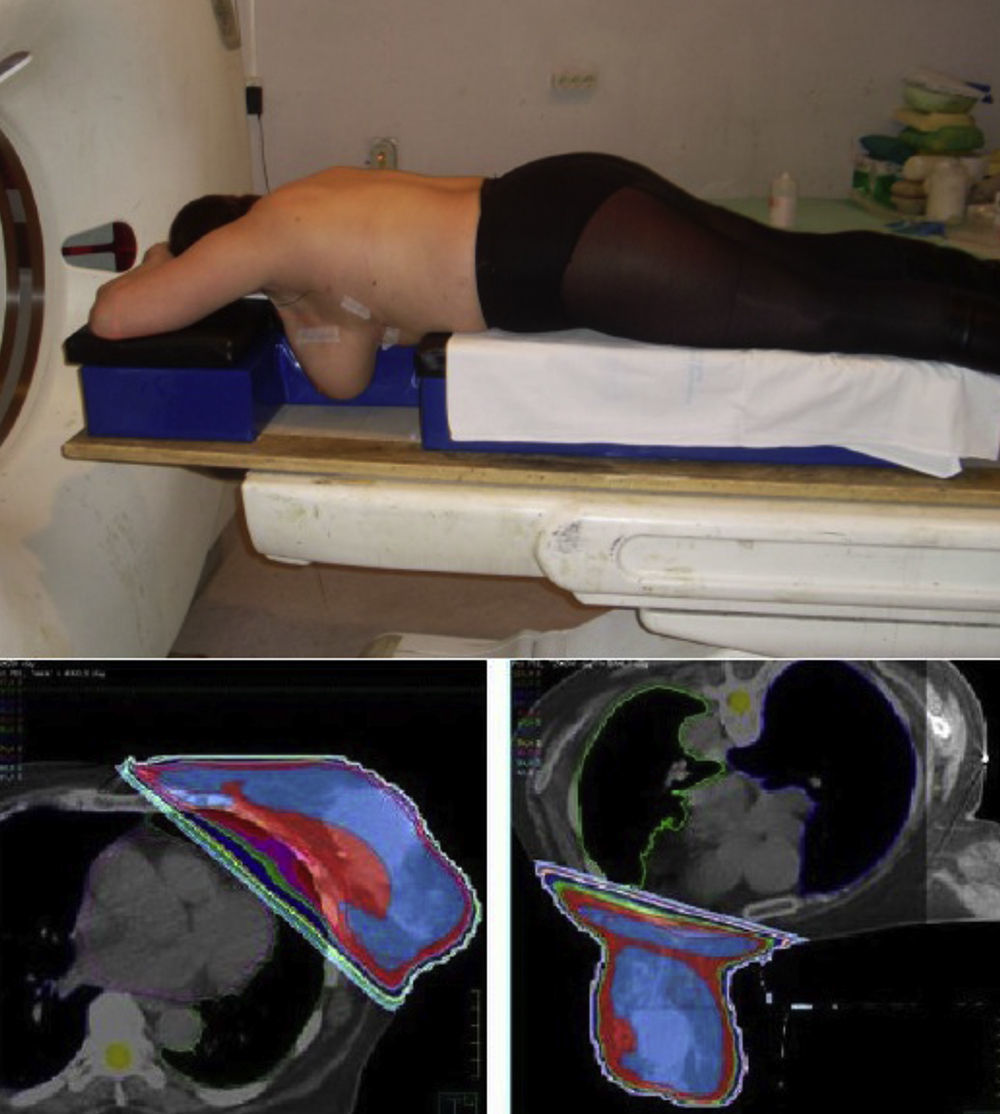
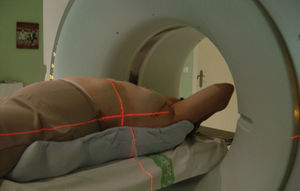
Como hemos mencionado con anterioridad, las pacientes tradicionalmente son irradiadas en posición de decúbito supino, pero el decúbito lateral y la posición de decúbito prono pueden ser especialmente útiles para pacientes con grandes mamas y mamas péndulas. La posición en decúbito prono resulta en un desplazamiento anterior del corazón, lo cual puede incrementar el volumen de este irradiado, en ocasiones. Esta posición tiene también la desventaja de reducir el cubrimiento de la pared torácica y no permite la irradiación ganglionar. A algunas pacientes no les es posible tolerar esta posición (fig. 2).
Los movimientos respiratorios de la mama en diferentes direcciones son de 2 a 6mm. El «gating respiratorio» o técnicas de control respiratorio durante la inspiración profunda pueden reducir la cantidad de corazón irradiado.
Los efectos en las variaciones en la colocación diaria y respiración normal en la distribución de la dosis acumulada dentro de la mama o en la cavidad de escisión son pequeños. Sin embargo, los movimientos respiratorios pueden resultar en un efecto sustancial en las dosis dadas a la mamaria interna.
• Plan de irradiación: se realiza de forma conjunta entre el oncólogo radioterápico, que contornea los volúmenes de tratamiento, decide la dosis total a administrar, la dosis por fracción y el número de fracciones, y los radiofísicos, que eligen la calidad de la irradiación y la técnica de tratamiento. Entre ambos se aprueba el plan de tratamiento.
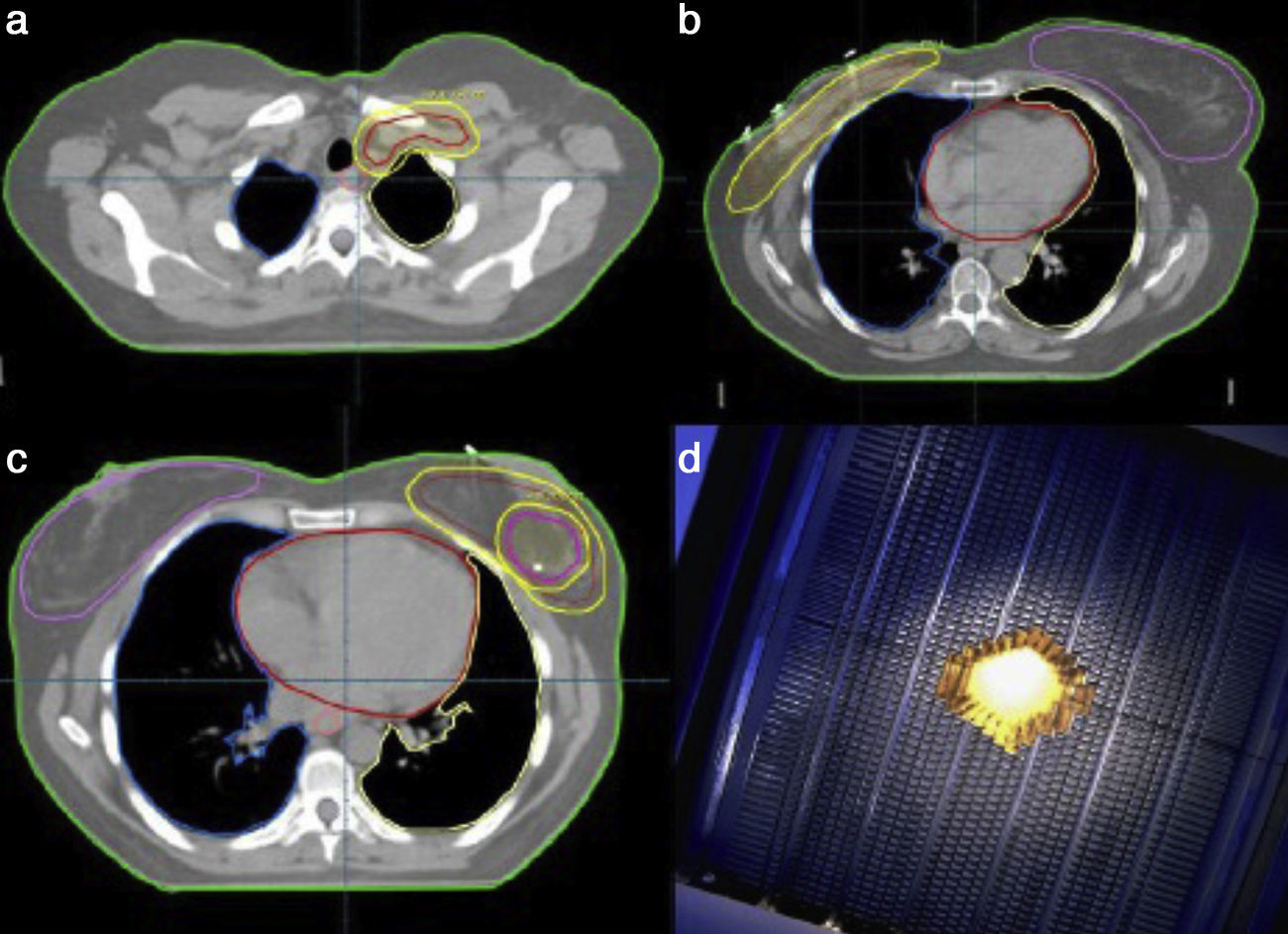
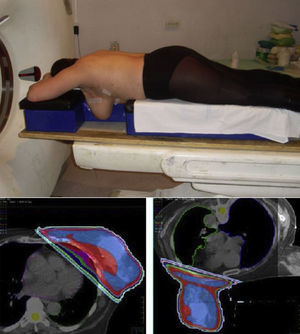
Volúmenes de tratamiento: volumen blanco clínicoMama conservada o pared costalSe define clínicamente el volumen blanco clínico, debajo de la cabeza de la clavícula, entre la línea media esternal hasta la línea media axilar, 1cm debajo del surco submamario de la mama ipsilateral o contralateral en las mastectomizadas, a 5mm debajo de la piel. Incluirá la cicatriz de tumorectomía y/o mastectomía completa (fig. 3).
3a CTV (volumen blanco clínico) y PTV (volumen blanco de planificación) de fosa supraclavicular izquierda. 3b CTV y PTV de lecho de mastectomía derecho. 3c CTV y PTV de mama conservada izquierda y del lecho de tumorectomía con clips quirúrgicos con margen de 8mm. 3d Colimación mediante multiláminas de una sobreimpresión mediante fotones.
Se definirá por la cavidad de tumorectomía (abierta) si el cirujano no realiza remodelación oncoplástica, o si es cerrada, por los clips depositados en el lecho quirúrgico, superior, interno, externo, inferior y en profundidad, o por los hallazgos de la mamografía, RMN previas o cicatriz de tumorectomía o por ecografía (fig. 3).
Fosa supraclavicularEntre el límite inferior del cartílago cricoides, superior a la cabeza clavicular, ventralmente el músculo escaleno anterior, lateral el músculo ECM y zona inferior, por la articulación costoclavicular (fig. 3).
AxilaDepende de si se ha realizado linfadenectomía o biopsia selectiva del ganglio centinela, localizándose entre los anteriores volúmenes. El nivel iii es el más frecuentemente irradiado. Los niveles i y ii quedan irradiados en ocasiones con los campos tangenciales.
Mamaria internaSe localiza adyacente a la vena y arteria mamaria interna, superiormente la pleura y lateral el esternón entre primera y cuarta costilla.
Volúmenes de tratamiento: volúmenes de planificaciónSe añadirán márgenes a cada volumen blanco clínico entre 0,5 y 1,5 cm13,14.
Calidad de la irradiaciónPodemos emplear fotones de alta energía, desde 6 hasta 15-18MV, dependiendo de las energías de las que dispongamos en los aceleradores y en función de la distribución homogénea de la dosis, evitando los puntos de sobredosis y protegiendo de forma adecuada los órganos de riesgo. Las unidades de Cobaltoterapia con una energía de 1,25MeV pueden ser adecuadas para mamas de poco volumen. Los electrones también aportan una mayor dosis a nivel de superficie en casos de pared costal muy delgada o para la sobreimpresión, cuando el lecho tumoral no es muy profundo.
Técnicas de irradiaciónLo más frecuente es el uso de haces tangenciales y opuestos para la mama o pared costal. Se pueden utilizar campos no coplanares, es decir, que no comparten el mismo eje transversal al girar la mesa de tratamiento. El empleo de los modificadores del haz, como las cuñas, la posibilidad de los colimadores multiláminas de hasta 5mm, nos permiten proteger al máximo los órganos de riesgo, sobre todo el pulmón (fig. 3).
Cuando hay indicación de irradiación ganglionar, la técnica se complica con haces anteroposteriores y posteroanteriores, con angulación del gantry o brazo del acelerador de 10-15° para evitar la médula espinal y/o oblicuos, con técnicas de multisegmentos o con hemicampos, incluso con giros de mesa para evitar el solapamiento de los haces15.
En la recientemente publicada guía de RT de intensidad modulada en el cáncer de mama16, Dayes et al. resaltan que aporta una mejor distribución de la dosis, más cóncava, que permite una mejor protección de los órganos de riesgo. En ensayos aleatorizados se describe como ventaja de esta técnica una menor descamación durante la irradiación frente a RT externa 3D conformada, 31 vs. 48% con una p=0,002. No se asocia, en cambio, con menos dolor mamario ni mejor calidad de vida17,18.
DosisEl fraccionamiento convencional en RT externa consiste en la administración de 25 fracciones a 2Gy al día durante los 5 días de la semana. Es el preferido cuando hay indicación de tratamiento en las áreas ganglionares locorregionales. La sobreimpresión se puede administrar mediante RT externa con fotones o electrones, con una dosis entre 16-20Gy, con braquiterapia intersticial con multicatéteres o de forma intraoperatoria19,20.
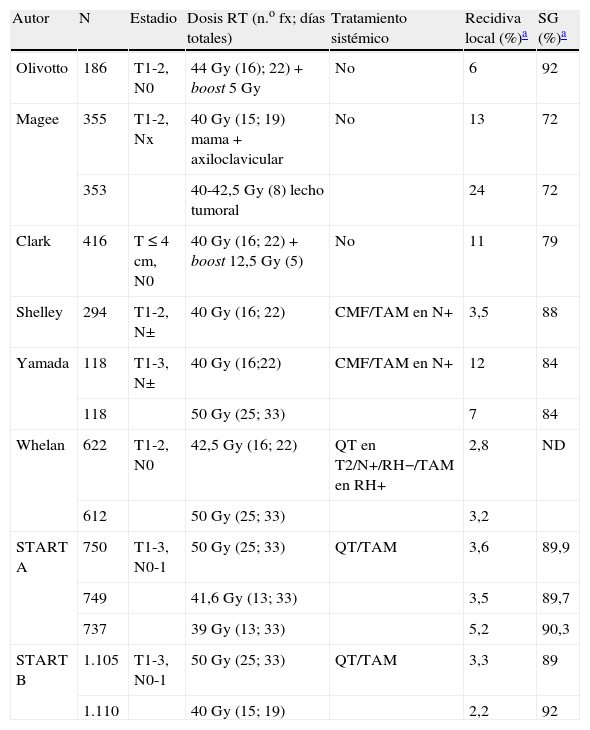
Técnicas innovadoras en radioterapia externa del cáncer de mama: hipofraccionamiento, irradiación parcial acelerada y boost concomitanteHipofraccionamientoLos resultados obtenidos con esquemas de RT tras cirugía conservadora que emplean dosis por fracción superiores a 2Gy/día se comparan muy favorablemente con los observados empleando esquemas con fraccionamiento estándar de 2Gy/día (tabla 1). Whelan et al. llevaron a cabo un estudio aleatorizado en 1.234 mujeres con tumores menores de 5cm y axila negativa que recibieron 42,5Gy en 16 fracciones o 50Gy en 25 fracciones. Un 11% de las pacientes recibieron tratamiento previo con quimioterapia si cumplían al menos 2 de los siguientes requisitos: tumores mayores de 2cm, G 3 o receptores hormonales negativos. La incidencia observada de fracaso local a 5 años fue del 2,8% en el grupo de 42,5Gy y del 3,2% en el de 50Gy. No se apreciaron diferencias entre los 2 grupos en cuanto a la aparición de toxicidad cutánea aguda o tardía, si bien el estudio excluía de inicio a aquellas mujeres con volúmenes grandes de mama (anchura máxima de la mama mayor de 25cm). El resultado estético a los 5 años de seguimiento se consideró como bueno o muy bueno en el 76,8% de las pacientes que recibieron 42,5Gy y en el 77,4% de las que fueron tratadas con 50Gy21. Recientemente, Whelan et al. han publicado los resultados a 10 años de este protocolo. La tasa de fracaso local a 10 años fue del 6,7% en las pacientes tratadas con 50Gy y del 6,2% en el grupo de tratadas con el esquema hipofraccionado hasta 42,5Gy. El resultado estético a los 5 años de seguimiento se consideró como bueno o muy bueno en el 69,8% de las pacientes que recibieron 42,5Gy y en el 71,3% de las que fueron tratadas con 50Gy. No se ha observado un aumento de la toxicidad cardíaca ni de las complicaciones tardías en el grupo de pacientes tratadas con un fraccionamiento de 2,5Gy/día frente a las que recibieron 2Gy/día22.
Resultados de estudios con respecto a recidiva local y supervivencia global que emplean fraccionamientos alternativos a 2Gy/día tras cirugía conservadora
| Autor | N | Estadio | Dosis RT (n.o fx; días totales) | Tratamiento sistémico | Recidiva local (%)a | SG (%)a |
| Olivotto | 186 | T1-2, N0 | 44Gy (16); 22)+boost 5Gy | No | 6 | 92 |
| Magee | 355 | T1-2, Nx | 40Gy (15; 19) mama+axiloclavicular | No | 13 | 72 |
| 353 | 40-42,5Gy (8) lecho tumoral | 24 | 72 | |||
| Clark | 416 | T≤4cm, N0 | 40Gy (16; 22)+boost 12,5Gy (5) | No | 11 | 79 |
| Shelley | 294 | T1-2, N± | 40Gy (16; 22) | CMF/TAM en N+ | 3,5 | 88 |
| Yamada | 118 | T1-3, N± | 40Gy (16;22) | CMF/TAM en N+ | 12 | 84 |
| 118 | 50Gy (25; 33) | 7 | 84 | |||
| Whelan | 622 | T1-2, N0 | 42,5Gy (16; 22) | QT en T2/N+/RH−/TAM en RH+ | 2,8 | ND |
| 612 | 50Gy (25; 33) | 3,2 | ||||
| START A | 750 | T1-3, N0-1 | 50Gy (25; 33) | QT/TAM | 3,6 | 89,9 |
| 749 | 41,6Gy (13; 33) | 3,5 | 89,7 | |||
| 737 | 39Gy (13; 33) | 5,2 | 90,3 | |||
| START B | 1.105 | T1-3, N0-1 | 50Gy (25; 33) | QT/TAM | 3,3 | 89 |
| 1.110 | 40Gy (15; 19) | 2,2 | 92 |
ND: no diferencias; n.o fx: número de fracciones; QT: quimioterapia; RH: receptores hormonales; RT: radioterapia; SG: supervivencia global; TAM: tamoxifeno.
En 2008 se publicaron los resultados del ensayo Standardisation of Breast Radiotherapy A y B realizado en el Reino Unido, que pretendía comprobar los beneficios de emplear fracciones diarias superiores a 2Gy en términos de control locorregional, toxicidad tardía, calidad de vida y análisis coste-efectividad. Entre 1999 y 2003 se incluyeron más de 4.500 mujeres con cáncer de mama T1-3, N0-1, M0 al diagnóstico, tratadas con cirugía conservadora, en 2 ensayos:
- A)
2.236 mujeres aleatorizadas a recibir 50Gy en 25 fracciones de 2Gy/día (N=749), 39Gy en 13 fracciones de 3Gy/día (N=750) o 41,6Gy en 13 fracciones de 3,2Gy/día (N=737).
- B)
2.215 pacientes aleatorizadas a recibir 50Gy en 25 fracciones de 2Gy/día (N=1.105) frente a 40Gy en 15 fracciones de 2,66Gy/día (N=1.110).
Con una mediana de seguimiento superior a 5 años en el ensayo A y a 6 años en el B, no se han observado diferencias en control locorregional entre los esquemas hipofraccionados frente al esquema clásico de 50Gy en 25 fracciones. Del mismo modo, tampoco existen diferencias significativas en cuanto a la toxicidad cutánea tardía analizada23,24.
En el año 2012, el grupo de la British Columbia Cancer Agency ha publicado los resultados con largo seguimiento obtenidos en pacientes con cánceres de mama grado 3 tratadas con RT con esquemas convencional o hipofraccionado. Después de 10 años de seguimiento, no hay evidencia de que el hipofraccionamiento sea inferior al fraccionamiento convencional en pacientes con cáncer de mama de grado 325.
La tabla 2 recoge los resultados observados en el análisis de la toxicidad, tanto aguda como tardía, y del resultado estético, realizado en los ensayos aleatorizados que comparaban un esquema hipofraccionado frente a fraccionamiento convencional.
Toxicidad y resultado estético de los estudios de hipofraccionamiento en cirugía conservadora
| Autor | Esquemas de tratamiento | Seguimiento (mediana) | Resultados |
| Whelan | 50Gy (25×2Gy) (n=612) | 12 años | No diferencias en toxicidad aguda, tardía ni resultado estético |
| 42,5Gy (16×2,5Gy) (n=622) | |||
| Yarnold | 50Gy (25×2Gy) (n=470) | 9,7 años | Mejor resultado estético con 39Gy vs. 50Gy (p=0,01) |
| 42,9Gy (13×3,3Gy) (n=466) | |||
| 39Gy (13×3Gy) (n=474) | |||
| Baillet | 45Gy (25×1,8Gy) (n=105) | >4 años | Mayor fibrosis con 23Gy vs. 45Gy |
| 23Gy (4×5,75Gy) (n=125) | |||
| START A | 50Gy (25×2Gy) (n=750) | 5,1 años | No diferencias en toxicidad aguda o tardía. Mejor resultado estético con 39Gy vs. 50Gy (p=0,002) |
| 41,6Gy (13×3,2Gy) (n=749) | |||
| 39Gy (13×3Gy) (n=737) | |||
| START B | 50Gy (25×2Gy) (n=1.105) | 6 años | No diferencias en toxicidad aguda o tardía. Mejor resultado estético con 40Gy vs. 50Gy (p=0,03) |
| 40Gy (15×2,67Gy) (n=1.110) | |||
| Taher | 50Gy (25×2Gy) (n=25) | 1,8 años | No diferencias en toxicidad aguda, tardía ni resultado estético |
| 42,5Gy (16×2,5Gy) (n=25) |
La evidencia existente en la actualidad apoya el empleo de esquemas hipofraccionados de RT que permitan, aumentando ligeramente la dosis por fracción y disminuyendo la dosis total, acortar el tiempo de tratamiento desde las 5 semanas de un tratamiento con fraccionamiento convencional a apenas 3 semanas. En su última revisión, el organismo británico National Institute for Health and Clinical Excellence considera los esquemas de 50Gy en 25 fracciones o de 40,05Gy en 15 fracciones estándar para la RT del cáncer de mama tras cirugía conservadora o mastectomía26.
Irradiación parcial acelerada con radioterapia externaComo es conocido que el 44-100% de las recidivas tras cirugía conservadora ocurren en la vecindad quirúrgica, se considera como volumen de tratamiento (volumen blanco clínico) el lecho de la tumorectomía exclusivamente con un margen entre 1,5-2cm (PTV). Se pueden emplear técnicas de 3D conformada, RT de intensidad modulada, tomoterapia (combina la intensidad modulada con un sistema de imagen guiada) o arcoterapia volumétrica modulada, en ensayos fase iii, junto a otras ramas que realizan la irradiación parcial con braquiterapia o RT intraoperatoria. Administran generalmente una dosis de 3,85Gy en 10 fracciones, 2 al día con intervalo de al menos 6h27. Una ventaja trascendental es la reducción del tiempo total de tratamiento radioterápico. Se indica en pacientes de bajo riesgo de recidiva: mayores de 60 años con T≤2cm, receptores hormonales positivos, ganglios negativos con margen≥2mm28.
Boost integradoEs otra técnica que disminuye el tiempo total de tratamiento. Consiste en administrar simultáneamente a la irradiación completa mamaria, en 25 fracciones, la dosis equivalente en el lecho de tumorectomía del boost, con un pequeño aumento de la dosis por fracción. Los resultados son similares en cuanto a toxicidad aguda y tardía, con excelente control local29. Es requisito que podamos localizar adecuadamente el lecho tumoral.
ConclusiónLos grandes avances tecnológicos incorporados a la RT externa del cáncer de mama nos han permitido optimizar los resultados en control local de la enfermedad y, por ende, en la supervivencia, mejorando la distribución dosimétrica de la dosis, con una mayor protección a los órganos de riesgo y menos efectos secundarios. Esto ha permitido explorar iniciativas dirigidas a acortar el tiempo total de tratamiento, como el hipofraccionamiento, la irradiación parcial o la técnica del boost integrado, con resultados similares al esquema convencional en cuanto a toxicidad aguda, tardía y de control local de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.