La prescripción conjunta de tamoxifeno y antidepresivos en pacientes con cáncer de mama puede disminuir la actividad y eficacia del primero. El objetivo fue determinar las pautas de prescripción de antidepresivos y su adecuación en estas pacientes.
Material y métodosEncuesta telefónica a 100 mujeres con cáncer de mama en tratamiento con tamoxifeno. Se determinó tiempo de tratamiento con tamoxifeno y especialidad del facultativo prescriptor, presencia o no de tratamiento concomitante con antidepresivos, tiempo de tratamiento y especialidad del facultativo prescriptor.
ResultadosSe detectó prescripción concomitante de tamoxifeno y antidepresivos en 11 pacientes (11%), con posibles interacciones potentes en 4 pacientes, 2 moderadas, 2 leves y 3 nulas. Mediana de duración del tratamiento concomitante: un año. Mediana de duración de interacciones potentes: 9 meses. Todas las prescripciones de tamoxifeno fueron realizadas por Oncología Médica, prescribiéndose los antidepresivos desde Oncología Médica, Psiquiatría o Atención Primaria.
ConclusionesExisten prescripciones que podrían generar interacciones con efecto negativo sobre la actividad del tamoxifeno, pudiendo influir en el pronóstico. Afectan aproximadamente al 10% de las pacientes que toman tamoxifeno, siendo la mitad potencialmente potentes.
Co-prescription of tamoxifen and antidepressants can cause interactions that decrease the activity and efficacy of tamoxifen. The objective of this study was to determine the prescribing patterns of antidepressants and to analyze their appropriateness.
Material and methodsA telephone questionnaire was administered to 100 breast cancer patients treated with tamoxifen to determine the length of tamoxifen treatment, the prescribing physician, concomitant treatment, the length of antidepressant treatment and the physician's field that prescribed the antidepressants.
ResultsConcomitant prescription was identified in 11 patients (11%): a potential for severe interactions was identified in 4, for moderate interactions in 2, and for mild interactions in 2. No potential for interactions was identified in 3 patients. All tamoxifen prescriptions were made by medical oncologists; antidepressants were prescribed by medical oncologists, psychiatrists and primary care physicians.
ConclusionsSome antidepressants could cause serious interactions with a negative impact on the activity of tamoxifen. These prescriptions affect approximately 10% of patients on tamoxifen, and half pose a risk of serious interactions.
El cáncer de mama es el tumor maligno más frecuentemente diagnosticado en mujeres, utilizándose en su manejo el tamoxifeno, antagonista de los receptores de estrógenos. Su uso logra disminuir la mortalidad y la recurrencia en el cáncer de mama inicial con receptores de estrógeno positivos1. Este beneficio es independiente del uso de quimioterapia, la edad, el estado del receptor de progesterona o de otras características del tumor.
El tamoxifeno es un profármaco que debe ser metabolizado por el sistema enzimático del citocromo P450 (CYP) hepático, considerándose el endoxifeno el metabolito activo más importante. La isoenzima CYP2D6 es la principal responsable del paso de tamoxifeno a endoxifeno, por lo que las sustancias que la inhiben podrían disminuir la eficacia terapéutica del tamoxifeno, en especial cuando su uso se realiza durante periodos prolongados2,3.
Por otra parte, los antidepresivos se utilizan ampliamente en el tratamiento de los síntomas menopáusicos inducidos por tamoxifeno4,5, práctica particularmente relevante debido a que los antidepresivos inhibidores selectivos de la recaptación de serotonina (ISRS) inhiben la CYP2D6 en diferentes grados3. El uso concomitante de tamoxifeno y antidepresivos con capacidad de inhibición de CYP2D6 ha sido estudiado en múltiples ocasiones, sin que exista una postura definida al respecto dado el resultado discordante de los estudios realizados6,7, y aconsejando prudencia al menos a la hora de prescribirlos conjuntamente. Considerando que en las pacientes en tratamiento con tamoxifeno por cáncer de mama el elevado valor de la prevención de la recurrencia del cáncer de mama por este sobrepasa al que pudiera tener el tratamiento con un inhibidor de CYP2D6, ciertos autores8,9 recomiendan evitarlos en pacientes tratadas con tamoxifeno.
Sin embargo, se desconoce el impacto clínico del uso concomitante de tamoxifeno y antidepresivos inhibidores de CYP2D6 sobre la posibilidad de recaída del cáncer de mama, existiendo pocos datos sobre las pautas de prescripción en condiciones asistenciales habituales en pacientes en tratamiento con tamoxifeno.
El objetivo de este trabajo fue determinar las pautas de prescripción de fármacos antidepresivos en mujeres con cáncer de mama en tratamiento con tamoxifeno analizando su adecuación en estas pacientes.
Material y métodosSe realizó, previa autorización del Comité de Ensayos y de Investigación Clínica del Hospital General Universitario Santa Lucía en Cartagena, un estudio observacional retrospectivo, de mayo de 2009 a septiembre de 2012. A partir de la base de datos de pacientes de la Sección de Oncología Médica del Hospital General Universitario Santa Lucía se generó una selección de las pacientes vivas con diagnóstico de cáncer de mama hormonosensible y en tratamiento con tamoxifeno, recogiendo los 100 primeros registros de pacientes que, por orden alfabético, respondieron a una encuesta telefónica acerca del tiempo de tratamiento con tamoxifeno y la especialidad del facultativo prescriptor de este, sobre la presencia o no de tratamiento concomitante con antidepresivos, así como sobre el tiempo de tratamiento y la especialidad del facultativo prescriptor. La realización de una encuesta telefónica, al no disponer de un medio informático de acceso a la prescripción, podría constituir un factor de sesgo que no estimara adecuadamente el uso conjunto de tamoxifeno y antidepresivos.
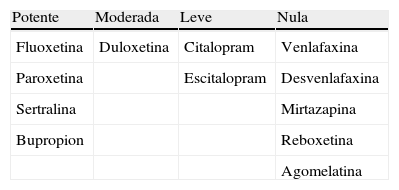
Las posibles interacciones se registraron, de acuerdo con la capacidad de inhibición de CYP2D6, como potentes, moderadas, leves o nulas siguiendo la clasificación de inhibidores «in vivo» de la FDA10. La paroxetina es un potente inhibidor de la CYP2D6, siendo el único cuya inhibición resulta irreversible. La fluoxetina y la sertralina son también inhibidores potentes. La duloxetina es un inhibidor moderado. El citalopram y su estereoisomero, escitalopram, inhiben de forma leve la CYP2D6. La venlafaxina y la desvenlafaxina, por su reducida fracción ligada a proteínas y su mínima interacción con el sistema del citocromo P450, poseen una muy leve o nula tendencia a generar interacciones con tamoxifeno(tabla 1). La interacción generada por el uso de tamoxifeno y de más de un antidepresivo podría considerarse como desconocida.
ResultadosEn 11 de las 100 pacientes consultadas (11%) se detectó la prescripción concomitante de tamoxifeno y un fármaco antidepresivo. De las 11 pacientes, una se encontraba en tratamiento con 2 fármacos antidepresivos (venlafaxina y reboxetina, ambas con interacción nula individualmente) y otra con 3 fármacos (escitalopram, agomelatina –ambas con interacción nula− y mirtazapina −con interacción leve−). Se llegaron a prescribir hasta 9 fármacos distintos: fluoxetina (en una paciente), paroxetina (en una paciente), sertralina (en 2 pacientes), duloxetina (en 2 pacientes), escitalopram (en 2 pacientes), venlafaxina (en 2 pacientes), mirtazapina (en una paciente), reboxetina (en una paciente) y agomelatina (en 2 pacientes).
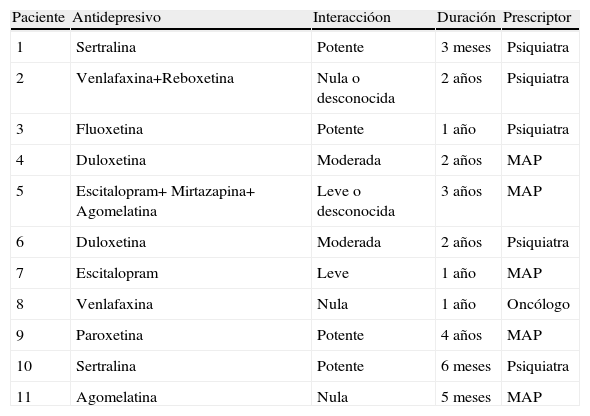
De acuerdo con la clasificación comentada previamente10 detectamos la posibilidad de interacción en 8 de los 11 casos, catalogándose la mitad de ellas (4 casos) en potentes, 2 moderadas, 2 leves y 3 nulas. La mediana de duración del tratamiento concomitante fue de un año y la de las interacciones potentes fue de 9 meses. La correspondencia entre las interacciones, las pautas de antidepresivos y la duración de las mismas se refleja en la tabla 2.
Interacción encontrada en los casos estudiados
| Paciente | Antidepresivo | Interaccióon | Duración | Prescriptor |
| 1 | Sertralina | Potente | 3 meses | Psiquiatra |
| 2 | Venlafaxina+Reboxetina | Nula o desconocida | 2 años | Psiquiatra |
| 3 | Fluoxetina | Potente | 1 año | Psiquiatra |
| 4 | Duloxetina | Moderada | 2 años | MAP |
| 5 | Escitalopram+ Mirtazapina+ Agomelatina | Leve o desconocida | 3 años | MAP |
| 6 | Duloxetina | Moderada | 2 años | Psiquiatra |
| 7 | Escitalopram | Leve | 1 año | MAP |
| 8 | Venlafaxina | Nula | 1 año | Oncólogo |
| 9 | Paroxetina | Potente | 4 años | MAP |
| 10 | Sertralina | Potente | 6 meses | Psiquiatra |
| 11 | Agomelatina | Nula | 5 meses | MAP |
MAP: médico de atención primaria.
Todas las prescripciones de tamoxifeno fueron realizadas por la Sección de Oncología Médica. En cuanto a la prescripción de los antidepresivos, desde la Sección de Oncología Médica solo se realizó una (venlafaxina; interacción nula); el Servicio de Psiquiatría realizó 5 (5%), generando 3 posibles interacciones potentes, una moderada y una nula, y el médico de atención primaria fue el prescriptor del 5% restante de los antidepresivos, generando la posibilidad de interacciones potentes (una), moderadas (una), leves (2) y nula (una) (tabla 2).
DiscusiónEn nuestro medio, el uso concomitante de tamoxifeno y antidepresivos es relativamente frecuente, aunque menos que en otras series publicadas. La publicación de Kelly et al.6 identifica hasta un 30,6% de pacientes con prescripción de antidepresivos tras haber iniciado tamoxifeno, de un total de 24.430 pacientes. Ahora bien, la metodología y el objetivo de su estudio es muy distinto al del presentado: tras excluir a las pacientes no tratadas con fármacos ISRS o tratadas con múltiples ISRS, a las que presentaban escasa adherencia a tamoxifeno y a aquellas con causa de muerte desconocida, reducen ese porcentaje a aproximadamente un 10% (2.430 mujeres), cifra más próxima al 11% encontrado en esta serie. La distribución del uso de antidepresivos no es comparable, pues en su estudio no se tiene acceso al total de fármacos que se han analizado en el presente trabajo. Analizando los fármacos comunes, el uso de fármacos que pueden generar interacciones potentes (paroxetina, fluoxetina y sertralina) constituye en este trabajo el 36,4% frente al 57% de las pacientes del trabajo norteamericano; estas diferencias podrían explicarse por el distinto acceso a los diversos fármacos antidepresivos existentes entre EE. UU. y España.
Una serie holandesa9 describe la prescripción conjunta de tamoxifeno y un inhibidor de CYP2D6 en 213 de 1.962 pacientes (10,9%), prolongándose durante más de 60 días en 150 pacientes (7,6%). De estos, 110 (5,6%), usaron inhibidores CYP2D6 potentes, principalmente fluoxetina (n=25) o paroxetina (n=82); ningún paciente utilizó duloxetina. En esta serie, 7 pacientes recibieron 2 inhibidores de CYP2D6 diferentes, siendo uno de ellos un inhibidor potente. En nuestra serie se utilizaron inhibidores potentes de CYP2D6 concomitantemente con tamoxifeno en 4 pacientes. Otros autores han encontrado una frecuencia de uso concomitante de tamoxifeno y antidepresivos similar7.
En cuanto al perfil del médico prescriptor, en nuestro medio debería hacerse hincapié en la importancia de estas interacciones, especialmente en el ámbito externo a la oncología. Esto debe considerarse por 2 aspectos principales: la interacción podría tener repercusión en el pronóstico de la enfermedad oncológica y la indicación de los antidepresivos vendrá dada, fundamentalmente, por especialistas no oncológicos, sobre todo desde la atención primaria y la psiquiatría.
Nuestro estudio presenta diversas limitaciones que pudieran contribuir a no estimar adecuadamente los resultados obtenidos, como es el no haber considerado ciertas características de la población (la edad, el estado menopáusico o el estadio del tumor), que podrían influir en la frecuencia de prescripción de estos fármacos, o a diferencia de otros estudios, el no haber podido confirmar el uso de antidepresivos con ningún registro farmacéutico,
Es especialmente importante conocer la presencia de estas interacciones y tenerlas en cuenta a la hora de elegir qué antidepresivo usamos, para tratar cuadros depresivos o sintomatología climatérica en estas pacientes, situación relativamente frecuente. Los fármacos antidepresivos recomendados por su nula o mínima interacción son la venlafaxina y la desvenlafaxina. La mirtazapina es un excelente antidepresivo que no interactúa con el sistema del CYP450, pero el aumento de peso que puede provocar representa un factor de riesgo de recidiva a evitar en esta población. Debiera evitarse el uso de inhibidores potentes de la CYP2D6, como la paroxetina (único inhibidor irreversible), la fluoxetina y la sertralina. La reboxetina y la agomelatina, si bien no son inhibidores de la CYP2D6, requieren de más estudios para una orientación definitiva en su administración en pacientes en tratamiento con tamoxifeno.
Como conclusión, los resultados de este estudio evidencian la existencia de prescripciones que podrían generar interacciones potentes con un efecto negativo sobre la actividad del tamoxifeno y que, por lo tanto, podrían influir en la eficacia de este tratamiento al aumentar el riesgo de recurrencia del cáncer de mama. Estas prescripciones afectan aproximadamente al 10% de las pacientes que toman tamoxifeno, siendo la mitad de ellas con inhibidores potentes de la CYP2D6 y, por tanto, potencialmente potentes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaTodos los autores han contribuido de forma activa y suficiente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.