Valorar la utilidad de los estudios híbridos SPECT-CT en la biopsia del ganglio centinela (BGC) post quimioterapia neoadyuvante (QNA) en pacientes cN+.
MétodoEstudio transversal de los resultados obtenidos en un grupo de 25 pacientes tratadas en la Unidad Funcional de Mama del HUGTIP desde marzo de 1918 a septiembre de 2020. La metodología específica para este estudio incluye: 1)ecografía axilar y colocación de marcador ecovisible en el ganglio afecto antes de iniciar la QNA; 2)tras QNA, colocación de marcador ferromagnético (Magseed®) en ganglio marcado previamente (GM); 3)valoración del estado axilar tras la QNA, que incluye estudio linfogammagráfico axilar con SPECT-CT; BGC y exéresis del ganglio marcado (GM) si es distinto al ganglio centinela (GC), y vaciado ganglionar axilar (VGA).
ResultadosLa valoración de los SPECT-CT permitió verificar la coincidencia entre el GM y el GC en 14 casos (56%). En 3 casos no se encontró GC y en 8 casos el marcador magnético no estaba en un GC. La biopsia selectiva de los ganglios (GC y/o GM) fue negativa en 12 pacientes (2 con VGA positivo) y positiva en 13 (4 con VGA positivo).
ConclusiónEl estudio SPECT-CT aportó información adicional sobre la localización y la concordancia del ganglio marcado y el ganglio centinela previa a la cirugía, mejorando la planificación de la misma.
To evaluate the usefulness of SPECT-CT hybrid studies in the biopsy of sentinel lymph node (SLNB) after neoadjuvant chemotherapy (NAC) in patients with axillary metastatic disease (N+).
MethodsCross-sectional study of 25 patients treated in the HUGTIP Breast Functional Unit from March 2018 to September 2020. All patients included in the study were submitted to: (1)axillary ultrasound (US) and US visible marker placement in the affected node before starting the NAC; (2)placement of a ferromagnetic marker in the previously marked lymph node (MLN) after NAC; (3)assessment of axillary status after NAC: it includes SPECT-CT lymphoscintigraphy; SLNB and excision of the MLN whether different from the sentinel lymph node (SLN); and axillary lymph node dissection (ALND).
ResultsIn 14 patients (56%) the MLN corresponded with the SLN. In 3 cases it was not possible identify the SLN and in 8 cases the MLN was not a SLN. The biopsy of MLN and SLN was negative for metastasis in 12 patients (2 of them had a positive ALND) and was positive for metastasis in 13 patients (4 of them had a positive ALND).
ConclusionThe SPECT-CT study provided additional information about the identification and the concordance of the MLN and the SLN improving the surgical planning.
Con la quimioterapia neoadyuvante (QNA), en pacientes con metástasis ganglionares axilares de inicio (cN+) por cáncer de mama se consiguen tasas de remisión completa de la enfermedad axilar cercanas al 40%1. No obstante, el vaciado ganglionar axilar (VGA) sigue siendo el tratamiento estándar. Por otro lado, existen resultados inaceptables en la aplicación de la biopsia del ganglio centinela (BGC) en estos pacientes2,3, recomendándose el empleo de marcadores para la adenopatía positiva4. En este contexto los estudios tomogammagráficos pueden mostrar su utilidad al localizar el ganglio centinela (GC) y el ganglio marcado (GM), y así planificar el mejor abordaje quirúrgico de la axila.
ObjetivoEl objetivo de este trabajo ha sido valorar la utilidad de los estudios híbridos SPECT-CT en la detección del GC en el tratamiento quirúrgico post-neoadyuvancia de pacientes con cáncer de mama que presentan metástasis ganglionares de inicio (cN+).
MétodoSe ha realizado un estudio observacional de 25 pacientes tratadas en la Unidad Funcional de Mama del HUGTP entre marzo de 2018 y septiembre de 2020. Este grupo de pacientes está incluido en el estudio multicéntrico Sentinel Node After Neoadyuvancy (SANA)5. Todas las pacientes ofrecieron su consentimiento a participar y el estudio fue aprobado por el Comité Ético de nuestro hospital (código BGC-N1/PI-17-128).
Se incluyeron pacientes de cáncer de mama con afectación ganglionar axilar de inicio (cT1-3 N1-2) tratadas con QNA y posterior localización preoperatoria del ganglio metastásico axilar mediante técnica combinada de radiotrazador y marcaje con marcador magnético.
Previo a la QNA se marcó el ganglio axilar patológico mediante la introducción de un clip en su interior y, tras finalizarla, unos días previos a la cirugía, se volvió a marcar mediante un marcador magnético (Magseed®)6.
Para la valoración del drenaje linfático axilar se realizó un estudio linfogammagráfico axilar 2h tras la administración de 4mCi/0,4ml de nanocoloide-Tc99m (Nanocoll®) mediante inyección intratumoral (10casos) o subdérmica/periareolar (15casos). En caso de no migración, a las 2h se adicionó reinyección subdérmica de 2mCi/0,2ml del mismo trazador. Se adquirieron imágenes planares (anterior y oblicua-anterior) de tórax y estudio híbrido SPECT-CT en una tomogammacámara (Symbia T2 System®). El análisis de las imágenes híbridas obtenidas permitió determinar la coincidencia entre el GC y el GM con Magseed®, así como la localización anatómica de ambos en la axila.
Durante la intervención quirúrgica de la axila se realizó la localización y la BGC usando una sonda de detección gamma portátil (Navigator® GPS). Con posterioridad, si no había coincidencia, se llevó a cabo la localización y extirpación selectiva del GM utilizando una sonda de detección magnética (Sentimag®). Finalmente, se procedió al vaciamiento ganglionar axilar (VGA).
Se realizó el estudio patológico diferido del GC y del GM marcado para determinar la coincidencia entre ambos. Así mismo, se relacionaron estos resultados con los del VGA, con el objetivo de determinar la respuesta a la QNA.
ResultadosLos hallazgos clínico-patológicos y del tratamiento se describen en la tabla 1. La edad media de las pacientes fue de 57años (rango, 41-79años). El cáncer de mama correspondió en todos los casos al tipo histológico ductal infiltrante. La clasificación en subtipos según criterios inmunohistoquímicos correspondió al subtipo tumoral LuminalB HER-2 negativo-like en 14 casos (56%), HER-2 en 5 casos (20%), LuminalB HER-2 positivo en 4 casos (16%) y Triple Negativo en 2 casos (8%). El tamaño clínico tumoral previo al inicio del tratamiento correspondió en 6 casos a T1, en 16 casos a T2 y en 3 casos a T3.
Hallazgos clínico-patológicos
| n | |
|---|---|
| N.° de pacientes | 25 |
| Edad media (rango) | 57 (41-79) |
| Tipo histológico | |
| Ductal | 25 (100%) |
| Subtipo tumoral (IHC) | |
| Luminal B HER-2 neg-like | 14 (56%) |
| Luminal B HER-2 pos-like | 4 (16%) |
| HER-2 | 5 (20%) |
| Triple negativo | 2 (8%) |
| T clínico (preQNA) | |
| T1b | 1 (4%) |
| T1c | 5 (20%) |
| T2 | 16 (64%) |
| T3 | 3 (12%) |
| Multifocalidad | |
| Unifocal | 15 (60%) |
| Multifocal | 5 (20%) |
| Multicéntrico | 5 (20%) |
| N.° de ganglios patológicos por ecografía | |
| 1 | 14 (56%) |
| 2-3 | 5 (20%) |
| ≥4 | 6 (24%) |
| Tipo de tratamiento quirúrgico | |
| Tumorectomía | 17 (68%) |
| Mastectomía | 8 (32%) |
| RCp mama | |
| Completa | 7 (28%) |
| Parcial | 13 (52%) |
| No respuesta | 5 (20%) |
| RCp axila | |
| Completa | 10 (40%) |
| Parcial | 8 (32%) |
| No respuesta | 7 (28%) |
| RCp mama y axila | 6 (24%) |
La ecografía axilar inicial, previa a la QNA, mostró la presencia de un ganglio de características ecográficas patológicas en 14 casos (56%), 2 o 3 ganglios patológicos en 5 casos (20%), y más de 3 ganglios patológicos en 6 casos (24%).
En la tabla 2 se describen los resultados de la técnica combinada radiotrazador-marcador.
Hallazgos y localización quirúrgica del ganglio centinela y del ganglio marcado
| n=25 | |
|---|---|
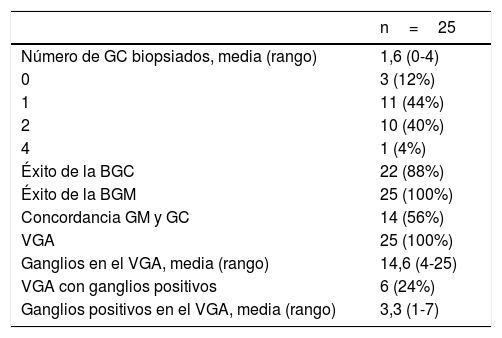
| Número de GC biopsiados, media (rango) | 1,6 (0-4) |
| 0 | 3 (12%) |
| 1 | 11 (44%) |
| 2 | 10 (40%) |
| 4 | 1 (4%) |
| Éxito de la BGC | 22 (88%) |
| Éxito de la BGM | 25 (100%) |
| Concordancia GM y GC | 14 (56%) |
| VGA | 25 (100%) |
| Ganglios en el VGA, media (rango) | 14,6 (4-25) |
| VGA con ganglios positivos | 6 (24%) |
| Ganglios positivos en el VGA, media (rango) | 3,3 (1-7) |
BGC: biopsia del ganglio centinela; BGM: biopsia del ganglio marcado; GC: ganglio centinela; GM: ganglio marcado; VGA: vaciado ganglionar axilar.
La BGC resultó en una media de 1,6 ganglios biopsiados (entre 1 y 4). No se halló GC en 3 pacientes. Respecto al GM, este fue localizado para su biopsia en todas las pacientes.
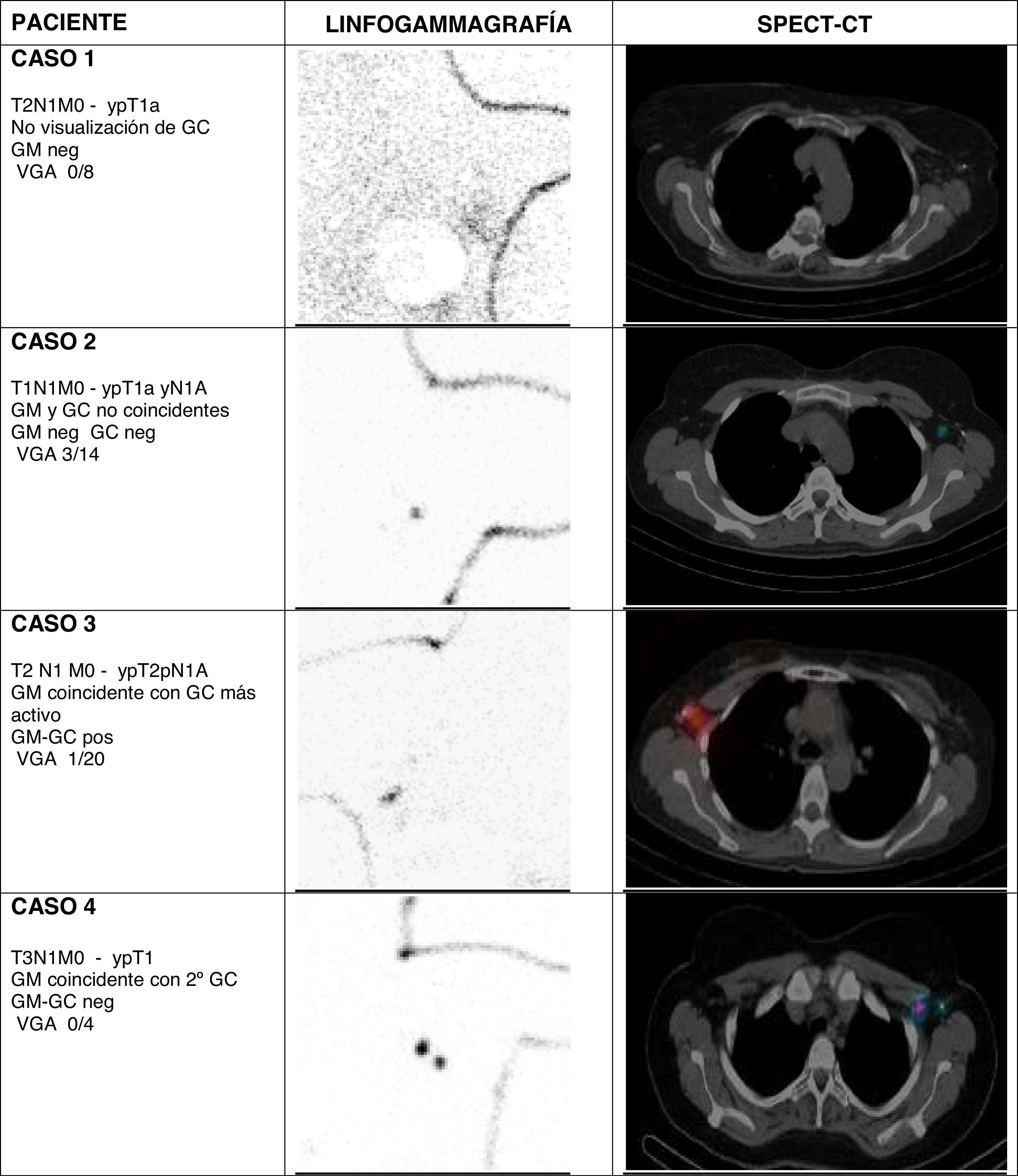
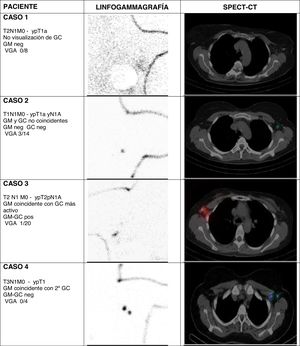
Considerando GM y GC conjuntamente, en la cirugía axilar selectiva se obtuvo una media de 1,8 ganglios por paciente (entre 1 y 4). La concordancia del GM con el GC fue del 56% (14 casos). En 3 casos no se identificó GC (fig. 1, caso 1), en 8 casos el GC no coincidió con el GM (fig. 1, caso 2), y en 14 casos el clip se situó en alguno de los GC. De estos 14, en 10 casos correspondió al primer GC del drenaje axilar, considerando su actividad y localización anatómica (fig. 1, caso 3). En los otros 4 casos el drenaje del radiofármaco identificó otros GC con mayor actividad y localizados en escalones superiores dentro de la axila (fig. 1, caso 4).
Drenaje linfático y su relación con el ganglio marcado Magseed en las imágenes linfogammagráficas (proyección oblicua anterior) y SPECT-CT (corte axial). Se describe el TNM pre y post cirugía, la coincidencia entre GM y GC, el resultado del GM y GC, y el resultado del VGA
GC: ganglio centinela; GM: ganglio marcado; VGA: vaciado ganglionar axilar.
La biopsia selectiva de los ganglios (GC y/o GM) fue negativa para metástasis en 12 pacientes (2 con VGA positivo) y positiva en 13 (4 con VGA positivo), hallándose un total de 6 pacientes con ganglios positivos adicionales (entre 1 y 7).
De los 3 pacientes en los que no se identificó GC, un caso resultó con GM y VGA positivo; en el segundo caso se halló solo positividad en el GM, y en el tercer caso todos los ganglios fueron negativos.
El total de 15 pacientes con axilas positivas correspondieron a 3 casos con células tumorales aisladas, 3 casos de micrometástasis y 9 casos de macrometástasis.
Respecto a la cirugía de la mama tras la QNA, se realizó un tratamiento conservador de la mama en 17 casos (68%), y en 8 casos se realizó mastectomía.
Se consiguió una respuesta completa patológica de la mama y axila en 6 casos (24%), mientras que la respuesta completa patológica de la axila fue del 40%.
DiscusiónEn la actualidad las pacientes con afectación ganglionar axilar por cáncer de mama siguen pautas de tratamiento sistémico neoadyuvante. El incremento del uso de la QNA en estas pacientes, junto con el porcentaje elevado de respuesta completa patológica, en especial en algunos subtipos tumorales7, hace necesario buscar técnicas mínimamente invasivas para el estadificación de la axila tras el tratamiento y poder evitar la morbilidad asociada al VGA, que se produce en el 40% de pacientes, como el linfedema y las limitaciones funcionales8.
La práctica de la técnica combinada mediante el marcaje de la adenopatía positiva y el estudio del drenaje linfogammagráfico permite disminuir la tasa de falsos negativos de que adolece la BGC en el tratamiento quirúrgico de la axila post-neoadyuvancia de cáncer de mama9,10, que no permite obtener un perfil de seguridad suficiente para recomendar la técnica a estas pacientes. Ello es así, principalmente, por la fibrosis que aparece en el tejido neoplásico de la mama y la axila, incluyendo los conductos linfáticos y los propios ganglios.
Este escenario, ya conocido tanto por cirujanos como por patólogos, se constata en las imágenes linfogammagráficas planares donde se describe una menor eficacia técnica, definida como una menor probabilidad de detección, y lo que es más preocupante, una mayor tasa de falsos negativos.
La técnica híbrida SPECT-CT aporta más información que el estudio planar, al poder localizar el marcador magnético en la adenopatía N1 y su identificación como uno de los ganglios centinela, a la vez que su relación con el resto de posibles GC y la localización de todos ellos en la cavidad axilar.
Las imágenes tomogammagráficas obtenidas en los estudios híbridos SPECT-CT permiten objetivar, además, las irregularidades en el drenaje habitual del radiotrazador, que, de manera esperable, debería situarnos el verdadero ganglio centinela coincidente con el ganglio marcado, desde un nivel más externo axilar (nivelI) hacia la región más apical axilar (nivelIII), tal como anatómicamente se ordenan los ganglios en la axila.
En nuestra serie de pacientes hemos observado esas situaciones (fig. 1). En 3 de 25 estudios no se identificó un GC. En otros 8 casos, el GM (es decir, la adenopatía positiva identificada antes de la neoadyuvancia) no correspondió a un GC. En 4 casos, el GC de mayor actividad se situaba en un 2.° a 4.° escalón de drenaje. Solo en 10 casos el ganglio centinela fue coincidente con el ganglio marcado y se situaba en un primer escalón de drenaje.
Otro resultado de interés del presente estudio es el bajo número de ganglios extirpados de manera selectiva, que incluso con la técnica combinada radiotrazador-marcador magnético fue de media 1,8. Cabe recordar que, con el fin de disminuir la tasa de falsos negativos, se requiere la exéresis de 3 o más ganglios centinela11.
El 40% de las pacientes de nuestra serie consiguieron una respuesta patológica axilar completa. El 60% restante corresponden a 13 pacientes con GM y/o GC positivo (4 de ellos con VGA positivo), y a 2 pacientes con VGA positivo pero con exéresis selectiva de GC y/o GC negativa (12 pacientes). Estos últimos corresponderían a los falsos negativos de nuestra serie.
ConclusiónLos estudios linfogammagráficos observan una pobre concordancia entre la adenopatía positiva y el GC en los estudios post-neoadyuvancia. La práctica del estudio SPECT-CT aporta información adicional sobre la localización y la concordancia del ganglio marcado y el ganglio centinela previa a la cirugía, mejorando la planificación de la misma.
La técnica combinada de marcaje de la adenopatía positiva y el estudio del drenaje linfogammagráfico permite disminuir la tasa de falsos negativos de que adolece la BGC en el tratamiento quirúrgico de la axila post-neoadyuvancia de cáncer de mama. Esta práctica se está convirtiendo actualmente en parte del enfoque estándar del manejo de la axila en el contexto del tratamiento neoadyuvante, tal y como se reflejó en el reciente informe de las guías del National Comprehensive Cancer Network.
Consideraciones éticasTodas las pacientes ofrecieron su consentimiento a participar y el estudio fue aprobado por el Comité Ético de nuestro hospital (código BGC-N1/PI-17-128).
FinanciaciónEste estudio no ha sido financiado.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.