INTRODUCCION
HER-2 es un miembro de la familia de receptores de factores de crecimiento epidérmico. Esta familia está constituida por cuatro receptores tirosin-kinasa situados en la membrana citoplasmática y están codificados por genes individuales pero muy similares. HER-2 es un importante mediador en los procesos de proliferación y diferenciación celular1 y se encuentra sobreexpresado en el 15-30 % de los carcinomas infiltrantes de mama2. Tras su descubrimiento, el gen HER-2 ha adquirido gran importancia clínica debido al reconocimiento de que su amplificación y la sobreexpresión de la proteína que codifica en tumores mamarios, condiciona un peor pronóstico en pacientes con cáncer de mama3. Estos resultados han sido confirmados en pacientes con carcinoma de mama precoz con ganglios positivos4,5. En el subgrupo de pacientes con alto riesgo de recidiva, tratadas con quimioterapia a dosis altas y autotrasplante de progenitores hematopoyéticos, la sobreexpresión de HER-2 también se ha mostrado como un factor pronóstico negativo e independiente, condicionando menores tasas de supervivencia libre de enfermedad y de supervivencia global6.
El estudio inmunohistoquímico con el anticuerpo policlonal de Dako, denominado HercepTest ha sido propuesto como un método seguro para determinar la sobreexpresión de la proteína HER-2 en tumores mamarios y su validez ha sido confirmada cuando ha sido comparado con la determinación de la amplificación génica mediante hibridación in situ fluorescente (FISH)7.
A pesar de los avances en la información pronóstica en pacientes con cáncer de mama, la mayoría de los estudios sobre el valor pronóstico de la sobreexpresión de HER-2 han sido retrospectivos. El hallazgo de HER-2 como factor predictivo de la respuesta a la quimioterapia y hormonoterapia se basa también en estudios no prospectivos. Se ha sugerido que la sobreexpresión de HER-2 condiciona resistencia a la quimioterapia adyuvante tipo CMF8,9, así como que dicha sobreexpresión incrementa la sensibilidad tumoral a la adriamicina10-13 y que estas pacientes mejoran su pronóstico cuando son tratadas con regímenes adecuados de quimioterapia adyuvante que contienen adriamicina14. Respecto a la hormonoterapia, se ha observado en algunos estudios clínicos que la sobreexpresión de HER-2 ocasiona resistencia a este tratamiento15,16.
La quimioterapia a dosis altas de consolidación con soporte de progenitores hematopoyéticos en el cáncer de mama fue considerada un tratamiento muy prometedor en la pasada década, apoyándose en los resultados de estudios pilotos y ensayos de fase I y II. Los resultados de estos estudios no controlados en los que se demostraba un beneficio en la supervivencia de las pacientes con carcinoma de mama precoz de alto riesgo, animaron a muchos investigadores a tratar de este modo a estas enfermas. Hoy disponemos de datos procedentes de siete ensayos aleatorizados y prospectivos que han incluido unas 3.000 pacientes en el contexto adyuvante, donde el tratamiento de quimioterapia a dosis altas con soporte de progenitores hematopoyéticos ha sido comparado con diferentes regímenes de quimioterapia con antraciclinas, más o menos intensos, pero sin soporte hematológico. Sólo uno de dichos estudios ha demostrado beneficio en la supervivencia para las pacientes tratadas con quimioterapia a dosis altas17-21. Mientras que los resultados definitivos están pendientes, es posible que un subgrupo de pacientes pueda beneficiarse de la quimioterapia a dosis altas. Es muy interesante identificar nuevos factores pronósticos y predictivos con objeto de aplicar con mayor seguridad los tratamientos a que es sometido este subgrupo de pacientes.
La finalidad de este estudio es identificar de manera retrospectiva el valor pronóstico y predictivo de la sobreexpresión de HER-2, medido mediante HercepTest, junto a factores pronósticos clásicos como el tamaño tumoral, estado ganglionar, receptores de estrógenos (RE) y progesterona (RP), grados histológico y nuclear y edad en las pacientes con carcinoma de mama precoz de alto riesgo tratadas por nuestro grupo con altas dosis de quimioterapia adyuvante y autotrasplante de progenitores hematopoyéticos de sangre periférica.
MATERIAL Y MÉTODOS
Han sido revisadas 62 pacientes con los siguientes requisitos: edad de 60 años o menos, diagnóstico histopatológico de carcinoma de mama obtenido mediante cirugía, estadio II o III con seis o más ganglios axilares positivos, adecuada capacidad funcional (ECOG 0-1) y funciones hematopoyética, hepática, renal, cardiaca y pulmonar normales. Se excluyeron las mujeres gestantes, con enfermedad psiquiátrica grave, con segundas neoplasias distintas al carcinoma intraepitelial de cérvix y carcinoma cutáneo. Siguiendo las normas del Comité Ético de nuestro hospital, todas las pacientes otorgaron su consentimiento por escrito antes del tratamiento y el estudio retrospectivo de HercepTest fue aprobado con garantías de anonimato de las pacientes. Las pacientes recibieron 6 ciclos de quimioterapia adyuvante FEC: ciclofosfamida 600 mg/m2, 4-epirrubicina 80 mg/m2 y 5-fluoruracilo 600 mg/m2 intravenosos (IV) cada 3 semanas y un ciclo de quimioterapia a dosis altas con ciclofosfamida 5 gr/m2 IV, etopósido 1,2 gr/m2 IV y carboplatino 1,5 gr/m2 IV. Todas recibieron radioterapia y se prescribió tamoxifeno 20 mg/día durante 5 años a las enfermas con tumores con RE/RP positivos. Las características de las pacientes se recogen en la tabla 1.
El estudio inmunohistoquímico con HercepTest (Dako®) se realizó tras obtener los bloques de parafina de los tumores primarios diagnosticados en nuestro centro y en los hospitales de referencia, a partir de los cuales se obtuvieron las secciones histológicas. Las muestras fueron analizadas por dos patólogos (M.J.P.G y J.P.R) ajenos a los resultados clínicos. Se llevó a cabo tras desparafinación de los cortes tisulares mediante el protocolo del sistema HercepTest. Se realizó recuperación antigénica mediante calor y bloqueo de la peroxidasa endógena. Los cortes se incubaron con el anticuerpo primario (anticuerpo de conejo anti-proteína HER-2 humana) durante 30 minutos, con el reactivo de visualización (EnVision) durante otros 30 minutos y finalmente con el sustrato cromógeno diaminobenzidina. Los pasos finales incluyeron la contratinción con hematoxilina de Mayer y el montaje. El control de la técnica se realizó con preparaciones histológicas de líneas celulares de cáncer de mama (MDA-231, MDA-175 y SKBR-3) que expresan diferentes intensidades de inmunotinción (0, 1+ y 3+). La evaluación se realizó mediante microscopía óptica, asignando puntuaciones del 0 al 3+. El valor de la cuantificación 0 corresponde a la ausencia de inmunotinción de membrana, el valor 1+ a una tinción de membrana débil e incompleta en más del 10 % de las células tumorales, el valor 2+ a la inmunotinción de intensidad moderada en la totalidad de la membrana celular en más del 10 % de las células y la categoría 3+ a los casos con tinción intensa y completa de membrana en más del 10 % de la población tumoral.
Los RE y RP fueron determinados por inmunohistoquímica y considerados positivos cuando más del 50 % de los núcleos presentaban tinción de intensidad 1, más del 35 % presentaban intensidad 2 o más del 20 % presentaban intensidad 3. Los grados histológico y nuclear fueron determinados según los criterios clásicos de Bloom y Richardson modificados22. El tamaño tumoral y los ganglios fueron clasificados de acuerdo con el sistema TNM23.
Las variables para el análisis estadístico fueron el status HER-2 (positivo: puntuación 3+ , repitiendo la evaluación considerando positivo la puntuación 2+ y 3+), tamaño tumoral (T1-T2 o T3-T4), número de ganglios axilares metastatizados (6-10 o > 10), grado histológico (1-2 o 3), grado nuclear (1-2 o 3), status RE/RP combinado (positivo o negativo) y edad (< 35 o > 35). Se ha analizado la asociación de las variables con la expresión de HER-2. Se ha utilizado el test de la chi cuadrado para las variables cualitativas y el test de la t-student para variables cuantitativas. La duración del seguimiento fue computada desde la fecha de la quimioterapia hasta el primer evento (recurrencia o muerte) o hasta el último contacto y fue analizado como supervivencia libre de enfermedad (SLE) o supervivencia global (SG). En el análisis de la supervivencia se ha usado el test de Kaplan-Meier24 para el cálculo del tiempo de SG y de SLE. Para estudiar la asociación entre supervivencia y ciertas variables se ha utilizado el test de Log-rank25.
RESULTADOS
La expresión de HER-2 fue 3+ en 12 casos (19 %), 2+ en 9 casos (14 %), 1+ en 10 casos (17 %) y 0 en 31 casos (50 %). Todos los casos de carcinoma lobulillar fueron HER-2 negativo con puntuación 0. En nuestra serie la positividad de HER-2 con una puntuación 3+ se asoció de forma significativa con la negatividad de RE/RP (p = 0,03) y con grado nuclear alto (p = 0,02). Sin embargo, no se observó ninguna asociación con las siguientes variables: tamaño tumoral (p = 0,39), número de ganglios positivos (p = 0,52), grado histológico (p = 0,46), y edad (p = 0,30). Cuando se realizó el mismo análisis considerando como HER-2 positivo todos los casos con puntuación 2+ y 3+ se obtuvieron resultados similares: asociación significativa con negatividad de RE/RP (p = 0,04) y con grado nuclear alto (p = 0,0001) y ausencia de asociación con tamaño tumoral (p = 0,32), número de ganglios positivos (p = 0,26), grado histológico (p = 0,17) y edad (p = 0,47).
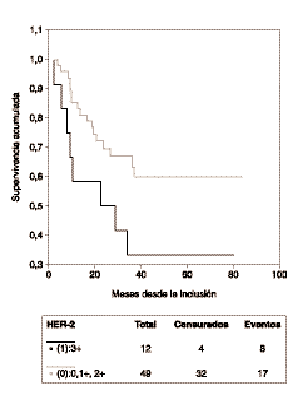
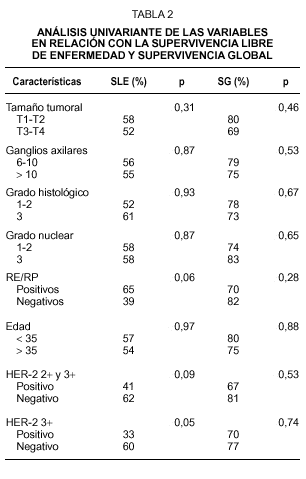
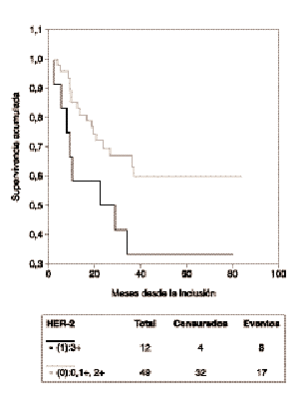
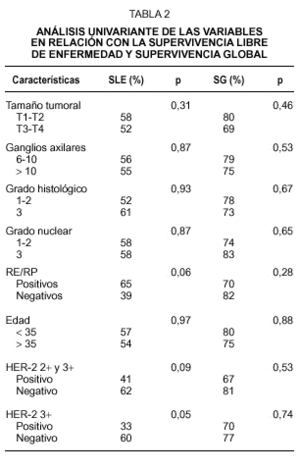
La mediana de seguimiento de las pacientes es 37 meses (rango: 5-88 meses). La SG de todo el grupo es de 75 % y la SLE es de 54 % a los 37 meses. En el análisis univariante las siguientes variables no tuvieron influencia significativa en la SG ni en la SLE: tamaño tumoral, número de ganglios, grado histológico, grado nuclear y edad. La negatividad de RE/RP está asociada a menor SLE, pero sin alcanzar significación estadística (p = 0,06) y no mostró valor predictivo de la SG (p = 0,28) (tabla 2). La sobreexpresión de HER-2 con una puntuación 3+ se asocia de forma significativa con una menor SLE (riesgo relativo [RR] = 2,24; intervalo de confianza del 95 %[IC] = 1-5,20; p = 0,05) (fig. 1), pero no presenta asociación con la SG (p = 0,74). La sobreexpresión de HER-2 con una puntuación 2+ y 3+ se asoció a una menor SLE, aunque sin alcanzar significación estadística (RR = 1,94; IC 95 % = 0,88-4,26; p = 0,09) y no demostró valor predictivo de la SG (p = 0,53) (tabla 2). Como sólo se identificó una variable significativa el análisis multivariante no fue realizado.
Fig. 1. Supervivencia libre de enfermedad de las pacientes con tumores HER-2 positivo (puntuación 3+) y negativo (puntuación 0, 1+ y 2+).
DISCUSION
Están disponibles varios métodos para determinar la sobreexpresión del gen HER-2 o de la proteína que codifica. Los más comunes son la evaluación de la amplificación génica con FISH, que es considerado un test más específico y el estudio inmunohistoquímico del tejido tumoral, que se basa en la demostración de la proteína de membrana en el tejido mediante su reacción con anticuerpos específicos. Varios estudios han demostrado que la tinción de la membrana celular en el análisis inmunohistoquímico se correlaciona bien con el contenido de HER-2 medido por otros métodos26,27, pero distintos anticuerpos han obtenido resultados diferentes, con amplia variabilidad de la sensibilidad entre los mismos27. Este hecho sugiere que el método de medida de HER-2 puede ser importante en la predicción de los resultados28, siendo fundamental en los estudios de esta área analizar si estos diferentes métodos de medida obtienen resultados comparables. A pesar de utilizar anticuerpos diferentes, los resultados de nuestro estudio coinciden con los del publicado por la Universidad de Colorado6 en la ausencia de asociación entre la sobreexpresión de HER-2 (analizado mediante el anticuerpo CB 11) y el tamaño tumoral y el número de ganglios. Hay también coincidencia en el significativo valor predictivo de la sobreexpresión de HER-2 sobre la SLE y en la ausencia de predicción de la SG en el análisis univariante. En nuestro estudio, además, se halló una asociación significativa entre sobreexpresión de HER-2, RE/RP negativos y grado nuclear alto.
Los porcentajes de positividad de HER-2 detectados en nuestra serie (33 % de casos con puntuación 2+ y 3+ y 19 % de casos con puntuación 3+) son equiparables a las tasas de 15-30 % observadas en otros estudios y están lejos del 60 % de positivos comunicados con el anticuerpo policlonal de Dako28. No parece, por tanto, plausible la explicación de que este subgrupo de pacientes con un fenotipo tumoral más agresivo (tamaño tumoral grande y elevado número de ganglios axilares metastatizados) posea una mayor prevalencia de sobreexpresión de HER-2.
El subgrupo de pacientes con expresión de HER-2 con puntuación 2+ selecciona casos donde el 75 % carece de amplificación génica29, mientras que la mayoría de los casos con una puntuación 3+ presenta amplificación del gen30. Por este motivo, hemos estudiado la asociación con la supervivencia de los casos HER-2 positivo fuerte (puntuación 3+) y de forma separada añadimos los casos HER-2 positivo débil (puntuación 2+ y 3+), con objeto de detectar si la información predictiva aumentaba proporcionalmente a la expresión de HER-2, ya que los peores resultados se obtienen en tumores con altos niveles de amplificación3. El hecho de hallar como única variable significativa a la expresión 3+ está de acuerdo con dicho planteamiento.
El carcinoma de mama es una enfermedad heterogénea en cuanto a su comportamiento clínico, pero, en general, es posible identificar factores predictivos biológicos y clínicos, como el grado histológico y nuclear, los receptores hormonales, el tamaño tumoral y el estado nodal que están bien establecidos y se correlacionan con la sobreexpresión de HER-231. El valor de los diferentes indicadores pronósticos en las pacientes con carcinoma de mama locorregional de alto riesgo tratadas con quimioterapia a dosis altas y autotrasplante de progenitores hematopoyéticos no está bien establecido. Bitran et al32 han analizado los patrones de recidiva en estas pacientes, encontrando que la sobreexpresión de HER-2 es el único factor estrechamente relacionado con el fallo del tratamiento. En el estudio de Somlo et al33 el RP negativo fue el único factor que influyó negativamente en la SLE y SG de estas pacientes, hecho que contrasta con los resultados del análisis de Nieto et al34 que hallan como factores predictivos e independientes de la SLE a la ratio nodal (número de ganglios positivos entre número de ganglios aislados), al tamaño tumoral y a los RE/RP negativos. En nuestro estudio no hemos podido detectar ningún factor predictivo de peor supervivencia, a excepción de la sobreexpresión de HER-2 con puntuación 3+. En las pacientes con carcinoma de mama metastásico tratadas con quimioterapia a dosis altas la sobreexpresión de HER-2 mediante inmunohistoquímica o FISH no estuvo asociada a peor pronóstico en el estudio publicado por Harris et al35 y sí lo estuvo en otro estudio de Nieto36.
Nuestro estudio tiene las limitaciones del escaso número de casos, el corto seguimiento y los sesgos inherentes a todos los estudios retrospectivos. Sin embargo, es el primero que evalúa el impacto pronóstico de la sobreexpresión de HER-2 analizado mediante HercepTest y encuentra que las pacientes con puntuación 3+ presentan SLE más corta. No está claro el beneficio de la quimioterapia a dosis altas adyuvante en la supervivencia de las pacientes con carcinoma de mama locorregional de alto riesgo, pero es posible, basándose en nuestros resultados, que la sobreexpresión de HER-2 sea también en este subgrupo de pacientes un factor predictivo de pobre supervivencia, obligando a los clínicos a mejorar sus opciones terapéuticas. Por supuesto que son necesarios más datos que provengan de ensayos bien diseñados antes de que el status HER-2 pueda ser empleado en estas pacientes para tomar decisiones de tratamiento.
AGRADECIMIENTOS
Agradecemos a Laboratorios Roche su generoso suministro de los reactivos del estudio inmunohistoquímico con HercepTest.
Agradecemos también a los servicios de Anatomía Patológica de los siguientes hospitales haber puesto a nuestra disposición los bloques de parafina de los tumores: Hospital Universitario de Puerto Real, Hospital de Jerez, Hospital Punta de Europa de Algeciras, Hospital Universitario Virgen del Rocío de Sevilla, Hospital Virgen de Valme de Sevilla, Hospital Juan Ramón Jiménez de Huelva, Hospital Universitario Reina Sofía de Córdoba, Hospital Ciudad de Jaén y Hospitales Militares de Sevilla y San Fernando.