La Sociedad Española de Senología y Patología Mamaria, a través de un grupo de expertos, ha redactado la vía clínica de cáncer de mama que constituye una importante herramienta de mejora continua en la atención de la paciente. Consta de 2 matrices temporales, una de diagnóstico y otra de tratamiento, en las que se describen todos los aspectos relacionados con el diagnóstico y el tratamiento del cáncer de mama desde el punto de vista de las distintas especialidades, teniendo en cuenta la distribución temporal de los mismos. Acompañan a estas matrices toda una serie de tablas y documentos explicativos de cada fase. Además, incluye un listado de indicadores para la validación de los distintos procesos.
El documento completo se publicará como una monografía de forma inminente y se distribuirá a todos los socios y a los especialistas relacionados con el manejo de la paciente con cáncer de mama.
The Spanish Society of Senology and Breast Disease, through a group of experts, has drawn up a clinical pathway for breast cancer, which constitutes an important tool for continuous quality assurance in patient care. The pathway consists of 2 temporary matrices, one for diagnosis and the other for treatment, in which all aspects related to the diagnosis and treatment of breast cancer are described from the point of view of the different specialties, taking into account their temporal distribution. These matrices are accompanied by tables and explanatory documents for each phase. The document also includes a list of indicators for the validation of the different processes.
The complete document will be published as a monograph in the near future and will be distributed to all members and specialists involved in the management of breast cancer patients.
Una vía clínica es una herramienta útil para la mejora continua de la atención a las pacientes que pretende disminuir la variabilidad clínica no justificada, facilitando su evaluación periódica y de forma que pueda disponerse de una información sobre indicadores clave, para valorar y atender correctamente a la paciente.
Desde la Sociedad Española de Senología y Patología Mamaria (SESPM), se creó un grupo de expertos para redactar una vía clínica de cáncer de mama (VCCM) dirigida a todos los especialistas relacionados con esta patología. El objetivo es describir los aspectos relacionados con el manejo de las pacientes con esta patología, el proceso de confirmación diagnóstica y el planteamiento terapéutico, con la finalidad de establecer puntos comunes y homogéneos de cuidados y sus requisitos según la evidencia clínica disponible.
Los documentos que componen la VCCM son los siguientes: una matriz temporal con todas las actividades e intervenciones que se realizan a la paciente durante el proceso de diagnóstico y de tratamiento, y un listado de indicadores de evaluación.
Exponemos a continuación la metodología seguida para la elaboración de la VCCM así como las matrices temporales de diagnóstico y tratamiento y el listado de indicadores. El documento completo irá dirigido a todos los socios de la SESPM y profesionales relacionados con el cáncer de mama, y está en fase de publicación.
Material y métodosPara la redacción de la VCCM se contó con un grupo de 38 expertos distribuidos en 6 grupos de trabajo según la especialidad: Radiodiagnóstico, Patología, Medicina Nuclear, Cirugía, Oncología Médica y Oncología Radioterápica.
Este grupo de expertos redactó la matriz temporal, el documento que recoge las recomendaciones y la evidencia que avala los pasos que describe la matriz temporal. También fue el encargado de la priorización de indicadores y la redacción de las fichas de indicador.
Se llevó a cabo una revisión bibliografía en la que se consideraron guías clínicas y documentos relacionados con la adecuación de pruebas diagnósticas y algunos relativos a la legislación sobre el tema1–3. Los documentos seleccionados fueron evaluados mediante la metodología AGREE II4,5 de forma que cumplieran con una valoración en el dominio de rigor metodológico superior al 60%.
Con esta evidencia se elaboró una matriz temporal para el proceso diagnóstico y otra para el terapéutico. En ellas se recogen en columnas las distintas especialidades que intervienen en el proceso y en las filas el personal, actividades y documentos con los que cada uno participa. Además, se contemplan los tiempos de atención de cada etapa. Estas matrices temporales se complementan con los documentos de recomendaciones, las fuentes de evidencia que las avalan y toda una serie de tablas, figuras y notas técnicas.
En el desarrollo de los indicadores de evaluación participaron todos los expertos, también divididos en los 6 grupos de trabajo incluidos en la vía clínica que tuvieron en consideración un estudio liderado por la propia SESPM6 en el que se establecieron los indicadores utilizados en las Unidades de Patología Mamaria a nivel estatal. Además, se consideraron las guías o trabajos utilizados en el estudio y otros propuestos por parte de sociedades científicas para abordar aspectos generales3,6–18.
El número de indicadores por áreas considerados fue: Patología 13, Radiodiagnóstico 8, Cirugía 22, Medicina nuclear 6, Oncología médica 18 y Oncología radioterápica 8.
A continuación, cada grupo, a través de una encuesta on-line, evaluó la relevancia de estos indicadores. La selección y priorización se llevó a cabo mediante la metodología DELPHI19,20, estableciéndose en 3 o 4 el número de indicadores a priorizar por cada grupo.
Posteriormente, se diseñó una ficha para cada indicador en la que constaba: descripción de la fórmula del indicador (definición del numerador y denominador), el estándar del indicador, los criterios de inclusión y exclusión, la fuente de información, un apartado de observaciones y bibliografía que avala la definición del indicador.
Finalmente se validaron cada uno de los indicadores en una reunión presencial, considerando que eran válidos si alcanzaban más del 75% de los votos en una puntuación de 7 o más.
ResultadosLa VCCM consta de una matriz temporal de diagnóstico (tabla 1), una matriz temporal de tratamiento (tabla 2). Cada matriz consta de referencias y citaciones a tablas y anexos explicativos de cada especialidad involucrada, que se encuentran en el documento que constituye el texto de la vía. Además se incluye un listado de indicadores por especialidad (tabla 3) con un anexo en el que mediante fichas se detallan la definición, explicaciones y estándares de cada indicador.
Matriz temporal de diagnóstico
| Matriz temporal vía clínica cáncer de mama | |||
|---|---|---|---|
| Confirmación diagnóstica ante sospecha de malignidad | |||
| Criterios entrada vía clínica (a) | Procedimiento confirmación Diagnóstica | Estudio extensión | PresentaciónCasoComité tumores |
| Tiempo síntomas-tratamiento (máximo 3 meses) | |||
| Tiempo (primera visita Unidad de Mama)-tratamiento (máximo 6 semanas) | |||
| Intervalo tiempo (decisión de realizar estudio histopatológico-resultado del mismo (máximo 14 días) | |||
| Unidad | Cirugía/Ginecología | Radiodiagnóstico | Patología | Radiodiagnóstico | |
|---|---|---|---|---|---|
| Personal implicado | CirujanoGinecólogoPlásticoAdministrativos | RadiólogosTécnicosEnfermeros (gestor de casos)Administrativos | -Patólogo-Técnico patología y citología- Patología Molecular- Administrativo | RadiólogosTécnicosEnfermerosAdministrativos | Equipo multidisciplinar- Patólogo- Cirujano-Ginecólogo- Cirujano plástico- Radiólogo- Oncólogo radioterápico- Oncólogo médico- Gestora de casos- Psicólogo |
| Evaluación Clínica | AP, AF, TTo, alergias EF cuidadosa (mama, axila y Sc) | -Mamografía /o ecografía de forma secuencial según sospecha clínica y hallazgos-RM en casos seleccionados-Biopsia percutánea BAV/ BAG de lesiones BI-RADS 4 y BI-RADS 5-Reevaluación del resultado histológico biopsia | -Sospecha diagnóstica por imagen o clínica- Información diagnóstica (hematoxilina-eosina)- Evaluación diagnóstica- Evaluación biomarcadores (IHQ, FISH)- Firma genética si procede | Después de carcinoma de mama confirmado con biopsia:-RM de estadificación-Ecografía de la axila-Colocación de marcadores si se plantea quimioterapia neoadyuvante | |
| Cuidados Enfermería | Cuidado del paciente, presencia en la EF, material en caso de citología por secreción del pezón | Soporte durante y después de procesos intervencionistas | Soporte durante y después de procesos intervencionistas | ||
| Técnicas y equipos necesarios | Material de curas básico, jeringuillas, agujas intramuscular, porta y material de fijación | MamógrafoEcógrafoSistema biopsia esterotaxiaMaterial de biopsia ecoguiadaRMSistema de biopsia por RMArpones para localizaciónClips marcadoresContraste iodadoGadolinioMaterial galactografía | BAG, BAV-Fijación-Estudio macroscópico- Estudio morfológico con (hematoxilina-eosina)- Estudio correlación radiopatológica-Estudio por congelación-Estudio de márgenes-Sección y tinción de muestras- Inmunohistoquímica (IHQ) y FISHReceptores de progesterona, estrógenos, HER2, Ki67Establecer sistema y tiempo de fijación | EcógrafoRM | Estadificación y grado de extensión de la enfermedad para la toma decision terapéuticaResultados estadificación (TNM)Diagnóstico de extensiónFactores pronósticosaEstudio predisposición genéticaGenetista / Experto en consejo genético |
| Información / Documentación | Consentimientos de BAG y BAVDocumentación de mastalgia | CI procedimientos intervencionistasEstudios previos | - Informe patológico- Informe ganglio centinela y/o linfadenectomía axilar- Informe resultados de los factores pronósticos y predictivos | CI procedimientos | |
| Actividades gestión consultas / Solicitud pruebas | Solicitud de ECO, MGF BAG o BAV según proceda | - Seguimiento BI-RADS 3 (alternativa a seguimiento clínico+radiología). Interconsulta a clínico, activación circuito rápidoSolicitud AP- Casos BI-RADS 0- Derivar a circuito o gestión de solicitud de pruebas Dx complementarias | |||
| Criterios de alta | BI-RADS 2 o menor | Si biopsia benigna concordante-Informe radiológico definitivo-Casos BI-RADS 1 o 2-Casos BI-RADS 0 | Emisión del informe definitivo incluyendo factores pronósticos y predictivos. |
AF: antecedentes familiares; AP: antecedentes personales; BAG: biopsia aguja gruesa; BAV: biopsia aspiración por vacío; BI-RADS: breast imaging reporting and data System; CI: consentimientos informados; ECO: ecografía; EF: exploración física; FISH: hibridación fluorescente in situ; IHQ: inmunohistoquímica; MGF: mamografía; RM: resonancia magnética; TTo: tratamiento.
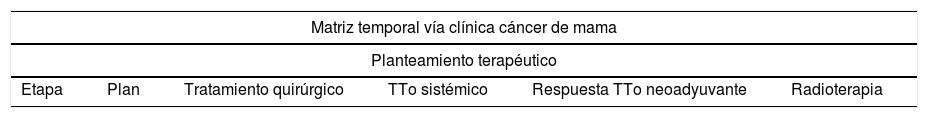
Matriz temporal del planteamiento terapéutico
| Matriz temporal vía clínica cáncer de mama | |||||
|---|---|---|---|---|---|
| Planteamiento terapéutico | |||||
| Etapa | Plan | Tratamiento quirúrgico | TTo sistémico | Respuesta TTo neoadyuvante | Radioterapia |
| Unidad | Comité tumores | Cirugía, GinecologíaCirugía Plástica | Medicina Nuclear | Patología | Oncología Médica | Patología | Oncología Radioterápica |
|---|---|---|---|---|---|---|---|
| Tiempo | Quimioterapia adyuvante (admon. 2-6 semanas poscirugía); quimioterapia neoadyuvante (realizar cirugía en las 3-4 semanas desde la finalización de la QT) | ||||||
| Personal implicado | Equipo multidisciplinar y (a) | CirujanoGinecólogoCirujano plásticoAdministrativos | Médico nuclearRadiofarmacéuticoTécnico especialistaEnfermeroAdministrativo | - Patólogo-Técnico en Anatomía Patológica y citología-Administrativo-Biólogo Molecular | Oncólogo médicoEnfermerasAdministrativos | Especialista en Anatomía Patológica-Técnico en Anatomía Patológica y citología-Administrativo-Biología Molecular | Oncólogo radioterápicoRadiofísicoTécnicosEnfermerasAdministrativas |
| Evaluación clínica | Decisión terapéuticaSegún estadificación (TNM)Factores pronósticosTras pasar por el comité de mama se le comunicará la decisión si esta es quirúrgica y las técnicas que se pueden aplicara ver columna correspondiente | -Informar de resultado de Rx y patología-Informar de decisión del comité de mama-Ofrecer alternativas en función de IHQ y sus deseos.TTo quirúrgico con sus variantes o QT-Responder dudas y explicar claramente los procedimientos quirúrgicos-Citar posteriormente si la paciente no puede tomar una decisión en ese momento-Dar fecha quirófano- Aplicación listado de verificación seguridad quirúrgica | Breve historia clínica y examen físicoProcesado de imágenesProcedimiento BSGC- Sistema de marcado ganglionar-Colaboración intraoperatoria | -BSGC: estudio patológico intraoperatorioEvaluación de la respuesta patológica | -Identificación paciente-Anamnesis y exploración física-Valoración de pruebas-Valoración del riesgo de recaída y decisión de TTo-Prescripción de tratamiento si:-Neoadyuvante- Adyuvante- Enfermedad metastásica | - Estudio respuesta. Posneoadyuvancia-Respuesta tratamiento posneoadyuvante.- Evaluación de la respuesta al tratamiento neoadyuvante (tumor primario como ganglio centinela) | -Anamnesis y exploración física-Identificación del paciente-Anamnesis y valoración de pruebas del paciente-Prescripción de tratamiento-Realización de TC-Cálculo dosimétrico-Verificación dosimétrica si precisa -Tratamiento con verificación de imágenes-Control clínico y técnico del tratamiento |
| Cuidados Enfermería | Cuidar de la pacienteSi es personal enfermería especializada citarla para atender sus dudasCuidados y consejos en el manejo de la herida quirúrgica | Cuidar y citar para atender sus dudasFormación en hábitos y estilos de vida saludables | Consejo hábitos saludables-Cuidados y consejos durante la radioterapia y en ocasiones tras la misma | ||||
| Técnicas y equipos necesarios | - Metro o regla para medición del tamaño en caso de reconstrucción para solicitar prótesis o expansores adecuadosRotulador para diseñar patrones | Equipos de diagnóstico:-Gammacámara convencional-SPECT (preferible SPECT-TC)-Sonda Intraoperatoria para ganglio centinela-PET/TC-Opcional cámara portátil intraoperatoriaRadiofármacos:-Nanocoloides de albúmina(tilmanocept si procede)-Fluordesoxiglucosa (FDG)-Difosfonatos (HDP) | -Estudio macroscópico y de correlación radiopatológica de piezas quirúrgicas-Estudio por congelación-Estudio de márgenes-Sección y tinción de muestras- Inmunohistoquímica (IHQ): Receptores de progesterona, HER2, Ki67: Establecer sistema de fijación y tiempo deFijación-Estudio ganglio centinela-- Técnicas moleculares (OSNA)- Técnicas convencionales (IHQ) (Notas 1-10) | Dispositivo de administración de QT (reservorio, PIC…) | TCSistema de delimitación de volúmenes y cálculo de dosisAcelerador linealUnidad de braquiterapia de alta tasaUnidad de radioterapia intraoperatoria | ||
| Información / Documentación | -Consentimientos de las IQ posibles-Folletos informativos de técnicas quirúrgicas-Folletos informativos de reconstrucción mamaria-Documentación de mastalgia | -Historia clínica-Consentimiento informado-Estudios previos | - Informe patológico- Informe estatus ganglionar- Informe resultados factores pronósticos y predictivosEvaluación de la respuesta patológica | Informe patológicoInforme Rx-Historia clínica-Prescripción de tratamiento-Hoja de tratamiento QT-Consentimiento informado QT-Folletos informativos de toxicidades posibles QT y consejos y cuidados | Evaluación de la respuesta patológica | -Informes Patología y Radiología-Historia clínica-Consentimiento informado-Prescripción de tratamiento-Hoja de tratamiento | |
| Actividades gestión consultas / Solicitud pruebas | Inclusión en lista de espera quirúrgicaTraslado a Oncología MédicaCoordinación con Cirugía Plástica | - Almacenamiento del material de forma segura, adecuada y fácilmente recuperable para segundas opiniones o pruebas complementarias- Consulta de casos a otros centros | -Control clínico del tratamiento-Seguimiento-Manejo efectos adversos quimioterapia-Criterios de seguimiento en función del riesgo de cáncer | Estudio de extensión, descartar M1 (ECO Abd/TAC TAP, GGO. ecocardio y analítica)Pruebas de diagnóstico por la imagen, análisis clínicos o patológicos | |||
| Seguimiento | Postoperatorio (visita a los 10 días)Retirada de puntos si procedeRevisión de las incisionesDar resultados de patologíaComprobar citas en Oncología si procedeExpansión si procedeConsentimientos de las IQ posiblesFolletos informativos de técnicas quirúrgicasFolletos informativos de reconstrucción mamaria | -Manejo efectos adversos quimioterapia-Criterios de seguimiento en función del riesgo de cáncer | |||||
| Criterios de alta | Emisión del informe definitivo incluye factores pronósticos y predictivos | No evidencia de recaída tras 5 años de seguimiento tras exéresis tumoral y finalización de tratamiento hormonal-Derivación a otro servicio para realización de mamografía anual, analítica y exploración física | En principio no se puede dar de altaReal decreto 1566/1998, de 17 de julio, | ||||
BI-RADS: breast Imaging reporting and data System; BSGC: biopsia selectiva ganglio centinela; CI: consentimientos informados; ECO: ecografía; FISH: Hibridación fluorescente in situ; HER-2: Human epidermal growth factor receptor 2; IHQ: inmunohistoquímica; IQ: intervención quirúrgica; MGF: mamografía; OSNA: One Step Nucleic Acid Amplification; QT: quimioterapia; RM: resonancia magnética; TTo: Tratamiento.
a Equipo multidisciplinar: - cirujano –ginecólogo – médico de Medicina Nuclear - cirujano plástico- patólogo- radiólogo- oncólogo radioterápico - oncólogo médico- gestora de casos- psicólogo.
Listado de indicadores por especialidades
| Indicadores de Patología |
| AP-01: Porcentaje de informes de Patología de calidad, es decir, utilización de informes siguiendo los criterios contemplados en el informe de Patología normalizado |
| AP-02: Proporción de casos con determinación de factores pronósticos y predictivos en carcinoma infiltrante |
| AP-03: Proporción de pacientes con el diagnóstico inmunohistológico antes de 9 días |
| Indicadores de Radiología |
| RX-04: Proporción de pacientes con cáncer de mama que se sometieron preoperatoriamente a pruebas de imagen de ambas mamas y axilas |
| RX-05: Proporción de pacientes intervenidas de cáncer de mama y que cuentan con BAG previa con diagnóstico de malignidad |
| RX-06: Proporción de pacientes tratadas con terapia sistémica primaria sometidas a resonancia magnética |
| Indicadores de Medicina Nuclear |
| MN-07: Proporción de pacientes con cáncer invasivo y axila negativa tanto clínicamente como por prueba de imagen, que se sometieron a una biopsia de ganglio linfático centinela |
| MN-08: Identificación adecuada del ganglio linfático centinela: Proporción de pacientes en las que se identificó al menos un ganglio centinela (tasa de detección) en los siguientes subgrupos:a) Pacientes que han recibido tratamiento neoadyuvante previob) Pacientes que no han recibido tratamiento neoadyuvante previo |
| MN-09: Proporción de pacientes a las que se les realiza técnica de BSGC mediante marcador isotópico en las que se ha realizado previamente una linfogammagrafía |
| Indicadores de cirugía |
| Cir-10: Proporción entre mastectomía y tratamiento conservador en carcinoma infiltrante estadio i o ii |
| Cir-11: Pacientes con cáncer de mama evaluadas por un comité multidisciplinar |
| Cir-12: Proporción de reintervenciones en cirugía conservadora.a) Proporción de pacientes con cirugía conservadora reintervenidas por márgenes afectosb) Porcentaje de reintervenciones por márgenes afectados en los que la pieza no muestra tumor residual |
| Cir-13: Proporción de pacientes que reciben reconstrucción inmediata al mismo tiempo de la mastectomía |
| Indicadores de Oncología Médica |
| OncoMed-14: Porcentaje de pacientes con intervalo entre la exéresis quirúrgica del tumor y la administración de quimioterapia adyuvante inferior a 8 semanas |
| OncoMed-15: Proporción de pacientes con carcinoma invasivo HER2 positivo tratadas con terapia monoclonal anti-HER2 |
| OncoMed-16 Proporción de pacientes que reciben terapia sistémica primaria (TSP) como tratamiento en los siguientes subgrupos:a) Cáncer de mama inflamatoriob) Carcinoma receptor estrogénico positivo no resecable, localmente avanzado |
| Indicadores de Oncología Radioterápica |
| Onco-Rta-17: Proporción de pacientes con cáncer de mama invasivo (M0) que recibieron radioterapia postoperatoria (RT) después de la resección quirúrgica conservadora del tumor primario y la estadificación axilar apropiada |
| Onco-Rta-18: Proporción de pacientes con afectación de los ganglios linfáticos axilares (pN2a) que recibieron radioterapia de todos los ganglios linfáticos regionales no resecados |
| Onco-Rta-19: Proporción de pacientes con afectación de hasta tres ganglios linfáticos axilares (pN1) que recibieron radioterapia, después de la cirugía, en ganglios linfáticos regionales no resecados |
La VCCM es un documento que será de gran utilidad a todos aquellos especialistas relacionados con el manejo del cáncer de mama para estandarizar procedimientos, evaluarlos y comparar resultados.
El documento ha supuesto un gran esfuerzo por parte de la SESPM en el que se han involucrado profesionales relacionados con todas las especialidades que integran el manejo multidisciplinar del cáncer de mama.
Se pretende que sea un documento activo en el que se vayan efectuando reevaluaciones y actualizaciones periódicas a medida que vayan cambiando las técnicas, los tratamientos o la actuación ante una paciente con cáncer de mama.
Se pretende difundir la VCCM a todos los profesionales de la Unidad de Mama, facilitando su uso proporcionando y su accesibilidad de manera permanente y sencilla.
Se está trabajando también en una versión en inglés de la VCCM para su difusión internacional.
Desde el Comité Científico de la VCCM esperemos que esta nueva publicación de la SESPM sea de utilidad y coloque a la Sociedad en una posición destacada por disponer de un documento de referencia en su especialidad como la vía clínica que es el primero de este tipo publicado a nivel Nacional.
Conflicto de interesesF. Tresserra es editor de la Revista de Senología y Patología Mamaria. L. Bernet es editora de la Revista de Senología y Patología Mamaria. C. Vázquez es presidente de la Sociedad Española de Senología y Patología Mamaria.
Grupo 1. Radiodiagnóstico: José Luis Raya Povedano; Hospital Reina Sofía (Córdoba). Elsa Pérez Gómez; Hospital Universitario Josep Trueta (Gerona). Joaquín Mosquera Osés; Complejo Hospitalario Juan Canalejo (La Coruña). Elena Cintora Lesón; Hospital de Basurto (Bilbao). Josefa Galobardes Monge; Hospital Infanta Cristina; Parla (Madrid). Carmen Carreira Gómez; Hospital de Fuenlabrada (Madrid). Sergi Ganau Macías; Corporació Sanitaria Parc Tauli; Sabadell (Barcelona). María Martínez Gálvez; Hospital Morales Meseguer Murcia). Rosa María Quintana de la Cruz; Hospital General Universitario de Ciudad Real (Ciudad Real).
Grupo 2. Patología: Francesc Tresserra Casas; Hospital Universitario Dexeus; Grupo Quirón Salud (Barcelona). Laia Bernet Vegué; Hospital Universitario de la Ribera; Alzira (Valencia). Begoña Vieites Pérez-Quintela; Hospital Universitario Virgen del Rocío (Sevilla). Belén Pérez Mies; Hospital Universitario Ramón y Cajal (Madrid). Maximiliano Rodrigo Gómez de la Bárcena; Hospital Universitario de Burgos (Burgos). Rafael Cano Muñoz; Hospital Universitario de la Ribera; Alzira (Valencia). Tomás García-Caballero; Complejo Hospitalario Universitario de Santiago de Compostela (Santiago de Compostela). Vicente Peg Cámara; Hospital Universitario Vall d́Hebrón (Barcelona)
Grupo 3. Cirugía: Ricardo Pardo García; Hospital Universitario Fundación Jiménez Díaz (Madrid). Mª Jesús Pla Farnos; Hospital Universitari de Bellvitge (Barcelona). Diego Alejandro Utor Fernández; Hospital Puerta del Mar (Cádiz)
Grupo 4. Medicina Nuclear: José Manuel Cordero García; Hospital Universitario La Paz (Madrid). Sergi Vidal Sicart; Hospital Clinic de Barcelona (Barcelona). Ana María García Vicente; Hospital General Universitario de Ciudad Real (Ciudad Real)
Grupo 5. Oncología Radioterápica: Manuel Algara López; Parc de Salut Mar (Barcelona). Julia Luisa Muñoz García; Hospital Universitario Infanta Cristina (Badajoz). Meritxell Arenas Prat; Hospital Universitari Sant Joan de Reus; Reus (Tarragona). María Dolores de las Peñas Cabrera; Hospital Universitario Rey Juan Carlos; Móstoles (Madrid). Ángel Montero Luis; Hospital Universitario Ramón y Cajal (Madrid). Miguel Soler Tortosa; Hospital Universitari de La Ribera; Alzira (Valencia). Xavier Sanz Latiesas; Parc de Salut Mar (Barcelona).
Grupo 6. Oncología Médica: M. Eva Pérez-López; Complejo Hospitalario Universitario de A Coruña (La Coruña). Lourdes Calvo Martínez; Complejo Hospitalario Universitario de A Coruña (La Coruña). Jesús García-Mata; Complejo Hospitalario Universitario de Ourense (Orense). M. Cristina López-Jato; Complejo Hospitalario Universitario de Pontevedra (Pontevedra). Silvia Antolín Novoa; Complejo Hospitalario Universitario de A Coruña (La Coruña). Begoña Graña Suárez; Complejo Hospitalario Universitario de A Coruña (La Coruña)